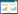2. 福建省血管衰老重点实验室(福建医科大学),福州 350001;
3. 福建医科大学第一临床医学院,福州 350001
2. Fujian Key Laboratory of Vascular Aging (Fujian Medical University), Fuzhou 350001, China;
3. First Clinical Medical College of Fujian Medical University, Fuzhou 350003, China
脓毒症是一种由宿主对感染反应失调引起的危及生命的器官功能障碍综合征,具有起病急、进展快及病死率高等特点[1]。超过一半的脓毒症病例是由细菌感染引起的。最近的全球疾病负担报告强调每年全球有近5 000万例脓毒症病例[2]。脓毒症的早期、准确识别及恰当管理,可以改善预后[1]。血流感染是影响脓毒症预后的重要因素之一,合并血流感染的脓毒症预后更差,病死率更高,早期病死率达30%~40%[3-4]。目前,血流感染诊断的金标准仍然是血液微生物培养,而影响血培养阳性率的因素众多,包括检测时间长、易受抗菌药物影响等[5],这些影响因素使得临床早期诊断困难。因此,探寻早期预测血流感染的便捷理想生物标志物具有十分重要的意义。
研究表明,中性粒细胞和淋巴细胞比值(ratio of neutrophil-lymphocyte, NLR)的升高可反映全身炎症反应情况。近年来,国内外不断有学者报道可以用NLR评估预测各种癌症、急性脑血管病、急性冠状动脉综合症、急性胰腺炎、社区获得性肺炎、尿路感染、急性阑尾炎等病情的严重程度或预后[6]。相比较单一的白细胞总数、中性粒细胞计数或者淋巴细胞计数,NLR对炎症反应具有更好的预测价值[7-8]。另外,无论是否合并糖尿病,炎症风暴均可诱发脓毒症患者出现应激性高血糖。研究表明,高血糖能引起机体防御能力受损,包括中性多形核白细胞动员能力、趋化作用和吞噬活性降低,导致感染的发生率增加,更易发生血流感染[9]。若应激性高血糖未能得到合理控制,使得原有疾病有害的病理生理反应加重,最终导致危重患者产生各种并发症,如严重感染、多器官功能衰竭[10]。本研究旨在探讨NLR联合入院时随机血糖对脓毒症患者血培养阳性的预测价值。
1 资料与方法 1.1 研究对象本研究为单中心、回顾性队列研究,以2019年1月至2021年12月福建医科大学附属协和医院连续收治的脓毒症患者为研究对象。研究符合医学伦理学标准,并经过医院伦理委员会审批(审批号:2022KY052),由于该研究为回顾性研究,因此豁免知情同意。研究项目在中国临床试验注册中心注册,注册号:ChiCTR2200060438。
纳入标准:(1)年龄≥18岁;(2)符合2016年美国危重病学会/欧洲危重病医学会脓毒症及脓毒性休克定义及诊断标准-3.0[11]:对于感染或疑似感染患者,序贯器官衰竭评分(sequential organ failure assessment, SOFA)评分≥2分[12]。排除标准:(1)年龄 < 18岁;(2)免疫系统功能缺陷(原发性免疫抑制病、获得性免疫缺陷、长期服用免疫抑制剂、长期服用糖皮质激素、器官移植术后);(3)慢性肝、肾功能疾病终末期;(4)恶性肿瘤活动期;(5)患有严重血液病(骨髓增生异常综合征、多发性骨髓瘤、白血病等);(6)入院24 h内死亡或资料不全;(7)糖尿病急症(糖尿病酮症酸中毒、糖尿病高渗性昏迷或低血糖);(8)入院24 h内未测血糖;(9)药物、急性胰腺炎、内分泌肿瘤、放疗等引起的一过性高血糖;(10)入院后未采样血培养。
血培养的采集按照全国临床检验操作规程和本院检验标本采集手册,无菌操作采取静脉血,标本采集量为成人(8~10 mL),至少同时行两套血培养检查,如果存在中心静脉导管,一套血标本从CVC的管腔采集,另一套从外周静脉采集。根据患者入院时血培养结果,将患者分为血培养阳性组及血培养阴性组,血培养阳性组再根据培养结果为革兰阳性菌/革兰阴性菌,分为革兰阳性组及革兰阴性组。NLR为中性粒细胞绝对值除以淋巴细胞绝对值得出,血小板与淋巴细胞比值(platelet-lymphocyte ratio, PLR)为血小板计数除以淋巴细胞绝对值得出。
1.2 数据收集基于医院科研大数据系统收集患者入院时的年龄、性别、感染来源、血培养结果、糖尿病史、入院时实验室检查值包括白细胞计数、中性粒细胞计数、淋巴细胞计数、总胆红素、肌酐、降钙素原(procalcitonin, PCT)、入院时随机血糖值及SOFA评分等。
1.3 统计学方法采用SPSS 25.0软件进行数据分析。采用Shapiro-Wilk法和Levene法对数据进行正态性和方差齐性检验。对于服从正态分布或接近正态分布且方差齐的计量资料,用均数±标准差(x±s)表示,采用双尾t检验进行两组间比较,采用单因素方差分析及LSD事后检验进行多组间比较。对于非正态分布或方差不齐的计量资料,采用中位数(四分位数)[M(Q1,Q3)]表示,采用Wilcoxon秩和检验进行两组间比较,Kruskal-Wallis检验及Bonferroni事后检验进行多组间比较。计数资料采用频数(构成比)表示,两组之间差异性比较采用卡方检验,如果不满足卡方检验条件,则采用Fisher确切概率法。危险因素分析采用Logistic回归分析;绘制受试者工作曲线(receiver operating characteristic, ROC)及曲线下面积(area under ROC curve, AUC)分析入院时NLR及随机血糖值对脓毒症患者血培养阳性的预测价值。以P < 0.05为差异有统计学意义。
2 结果 2.1 患者一般资料比较根据纳入排除标准,本研究共纳入265例脓毒症患者,其中男性164例,女性101例,年龄65(54,72)岁。病例筛选如图 1。血培养结果及微生物分布比较见表 1。不同组间患者的基线特征及实验室参数等见表 2及表 3。血培养阳性组的糖尿病史、白细胞计数、中性粒细胞计数、总胆红素、PCT、血糖和NLR均高于血培养阴性组,差异有统计学差异(均P < 0.001)。革兰阴性菌组的糖尿病史、NLR值、血糖及PCT高于血培养阴性组,差异有统计学意义(均P < 0.05)。
|
| 图 1 病例筛选流程图 Fig 1 Flow chart of patient selection |
|
|
| 血培养病原体 | 例数(%) |
| 肺炎克雷伯菌 | 12(4.53) |
| 大肠埃希菌 | 13(4.91) |
| 鲍曼不动杆菌 | 7(2.64) |
| 铜绿假单胞菌 | 4(1.51) |
| 其他阴性菌 | 1(0.38) |
| 金黄色葡萄球菌 | 4(1.51) |
| 其他阳性菌 | 11(4.15) |
| 真菌 | 10(3.77) |
| 指标 | 血培养阳性组(n=62) | 血培养阴性组(n=203) | z/χ2值 | P值 |
| 一般情况 | ||||
| 年龄(岁)a | 64 (54, 71) | 66 (54, 73) | 0.615 | 0.539 |
| 男性b | 38 (61.3) | 126 (62.1) | 0.012 | 0.912 |
| 糖尿病史b | 25 (40.3) | 29 (14.3) | 19.844 | < 0.001 |
| 感染来源b | 8.551 | 0.066 | ||
| 肺部 | 28 (45.2) | 119 (58.6) | ||
| 腹腔 | 10 (16.1) | 34 (16.7) | ||
| 泌尿系 | 11 (17.7) | 13 (6.4) | ||
| 皮肤软组织 | 2 (3.2) | 10 (4.9) | ||
| 其他 | 11 (17.7) | 27 (13.3) | ||
| 入院检验参数 | ||||
| 白细胞计数(×109/L)a | 17.47 (10.71, 26.17) | 12.20 (7.77, 17.55) | 3.751 | < 0.001 |
| 中性粒细胞计数a | 17.63 (10.65, 24.61) | 10.11 (6.84, 15.86) | 5.115 | < 0.001 |
| 淋巴细胞计数a | 0.65 (0.44, 0.95) | 0.83 (0.58, 1.33) | 3.436 | 0.001 |
| 血小板计数(×109/L)a | 130 (72, 212) | 147 (82, 206) | 0.700 | 0.484 |
| CRPa | 48.7 (9.0,230.8) | 93.2 (7.6,237.4) | 0.668 | 0.504 |
| NLR值a | 24.80 (16.12, 39.96) | 11.62 (7.02, 17.86) | 6.926 | < 0.001 |
| PLR值a | 190.65 (116.67, 318.52) | 160.00 (88.38, 273.68) | 1.526 | 0.127 |
| 白蛋白(g/L)a | 27.85 (23.60, 30.10) | 29.10 (24.80, 32.90) | 1.937 | 0.053 |
| 总胆红素(μmol/L)a | 24.85 (15.60, 59.80) | 19.20 (12.40, 34.20) | 2.581 | 0.010 |
| 血糖(mmol/L)a | 12.04 (8.78, 15.91) | 7.61 (6.13, 10.17) | 5.454 | < 0.001 |
| 肌酐(μmol/L)a | 112.0 (72.0, 174.0) | 103.1 (60.0, 188.0) | 0.580 | 0.562 |
| PCT(ng/mL)a | 12.13 (2.80, 93.96) | 2.61 (0.90, 20.73) | 3.741 | < 0.001 |
| SOFA评分a | 8 (5, 10) | 6 (4, 10) | 1.731 | 0.084 |
| 注:NLR为中性粒细胞与淋巴细胞比值,CRP为C反应蛋白,PCT为降钙素原,PLR为血小板与淋巴细胞比值,SOFA评分为序贯器官衰竭评分;糖尿病史为既往诊断为糖尿病正在进行降糖治疗,或者根据《中国2型糖尿病防治指南(2017版)》[13]的诊断标准。a为M(Q1,Q3),b为(例,%) | ||||
| 指标 | 革兰阳性组(n=15) | 革兰阴性组(n=37) | 血培养阴性组(n=203) | H/χ2值 | P值 |
| 一般情况 | |||||
| 年龄(岁)a | 64 (49, 69) | 66 (55, 71) | 66 (54, 73) | 0.810 | 0.667 |
| 男性b | 8 (53.33) | 24 (64.86) | 126 (62.07) | 0.607 | 0.738 |
| 糖尿病史b | 5 (33.33) | 16 (43.24) c | 29 (14.29) c | 16.779 | < 0.001 |
| 感染来源b | 14.134 | 0.049 | |||
| 肺部 | 7 (46.67) | 17 (45.95) | 119 (58.62) | ||
| 腹腔 | 3 (20.00) | 4 (10.81) | 34 (16.75) | ||
| 泌尿系 | 2 (13.33) | 9 (24.32) | 13 (6.40) | ||
| 皮肤软组织 | 1 (6.67) | 0 (0.00) | 10 (4.93) | ||
| 其他 | 2 (13.33) | 7 (18.92) | 27 (13.30) | ||
| 入院检验参数 | |||||
| 白细胞计数(×109/L)a | 20.00 (9.73, 25.38) | 15.61 (10.45, 26.49) c | 12.20 (7.77, 17.55) c, e | 10.458 | 0.005 |
| 中性粒细胞计数a | 19.50 (9.53, 25.38) c | 15.05 (10.37, 26.24) c | 10.11 (6.84, 15.86) c, e | 21.115 | 0.001 |
| 淋巴细胞计数a | 0.89 (0.69, 1.10) | 0.53 (0.30, 0.69) e | 0.83 (0.58, 1.33) e | 21.853 | < 0.001 |
| 血小板计数(×109/L)a | 184 (126, 243) | 107 (64, 173) | 147 (82, 206) | 5.012 | 0.082 |
| CRPa | 53.4 (4.8,171.7) | 68.3 (10.0,260.3) | 93.2 (7.6, 237.4) | 0.714 | 0.700 |
| NLR值a | 21.78 (10.81, 31.38) | 26.30 (23.56, 29.70) c | 11.62 (7.02, 17.86) c | 47.401 | < 0.001 |
| PLR值a | 193.68 (127.27, 283.87) | 198.39 (100.00, 414.29) | 160.00 (88.38, 273.68) | 2.599 | 0.273 |
| 白蛋白(g/L)a | 29.00 (27.30, 30.50) | 26.30 (23.56, 29.70) | 29.10 (24.80, 32.90) | 4.926 | 0.085 |
| 总胆红素(μmol/L)a | 20.60 (12.30, 27.00) | 33.40 (16.50, 61.26) c | 19.20 (12.40, 34.20) c | 7.949 | 0.019 |
| 血糖(mmol/L)a | 8.78 (6.50, 11.30) | 14.20 (10.12, 16.80) c, d | 7.61 (6.13, 10.17) c | 30.501 | < 0.001 |
| 肌酐(μmol/L)a | 90.0 (73.0, 175.0) | 114.0 (70.0, 173.0) | 103.1 (60.0, 188.0) | 0.440 | 0.803 |
| PCT(ng/mL)a | 9.37 (1.60, 76.06) | 13.25 (5.80, 100.00) c | 2.61 (0.90, 20.73) c | 15.912 | < 0.001 |
| SOFA评分a | 8 (3, 10) | 9 (5, 11) | 6 (4, 10) | 3.722 | 0.156 |
| 注:NLR为中性粒细胞与淋巴细胞比值,CRP为C反应蛋白,PCT为降钙素原,PLR为血小板与淋巴细胞比值;糖尿病史为既往诊断为糖尿病正在进行降糖治疗,或者根据《中国2型糖尿病防治指南(2017版)》[13]的诊断标准;a为M(Q1,Q3),b为(例,%);血培养阴性组与革兰阴性菌组比较,cP < 0.05;革兰阳性菌组与革兰阴性菌组比较,dP < 0.05;血培养阴性组与革兰阳性菌组比较,eP < 0.05 | |||||
单因素及多因素Logistic回归分析显示(表 4),NLR(OR=1.039,95%CI: 1.015~1.064)及血糖(OR=1.116,95%CI: 1.051~1.186)是脓毒症血培养阳性的独立危险因素(P < 0.05)。
| 变量 | 单因素分析 | 多因素分析 | |||||||||
| β值 | S.E. | Wald χ2 | P值 | OR(95%CI) | β值 | S.E. | Wald χ2 | P值 | OR(95%CI) | ||
| 糖尿病史 | -0.065 | 0.194 | 0.113 | 0.737 | 0.937(0.640~1.371) | -0.094 | 0.234 | 0.163 | 0.687 | 0.910(0.575~1.440) | |
| 白细胞计数(×109/L) | 0.071 | 0.017 | 16.549 | < 0.001 | 1.073(1.037~1.110) | 0.021 | 0.023 | 0.781 | 0.377 | 1.021(0.975~1.069) | |
| NLR值 | 0.053 | 0.011 | 23.618 | < 0.001 | 1.054(1.032~1.077) | 0.038 | 0.012 | 10.121 | 0.001 | 1.039(1.015~1.064) | |
| PLR值 | 0.001 | 0.001 | 2.414 | 0.120 | 1.001(1.000~1.002) | 0.001 | 0.001 | 1.590 | 0.207 | 1.001(0.999~1.003) | |
| 总胆红素(μmol/L) | 0.005 | 0.002 | 4.243 | 0.039 | 1.005(1.000~1.009) | 0.005 | 0.003 | 3.412 | 0.065 | 1.005(1.000~1.011) | |
| 血糖(mmol/L) | 0.115 | 0.029 | 16.174 | < 0.001 | 1.122(1.061~1.187) | 0.110 | 0.031 | 12.668 | < 0.001 | 1.116(1.051~1.186) | |
| PCT (ng/ml) | 0.011 | 0.004 | 8.416 | 0.004 | 1.011(1.004~1.018) | 0.007 | 0.005 | 2.538 | 0.111 | 1.007(0.998~1.017) | |
| 注:NLR为中性粒细胞与淋巴细胞比值,PLR为血小板与淋巴细胞比值 | |||||||||||
基于回归模型构建ROC曲线,检验NLR联合血糖值对血培养阳性(表 5、图 2A)、血培养革兰阳性菌(表 6、图 2B)及革兰阴性菌(表 7、图 2C)的预测价值,其AUC值分别为0.819(95%CI: 0.761~0.877,P < 0.001)、0.597(95%CI: 0.448~0.745,P=0.209)及0.871(95%CI: 0.813~0.928,P < 0.001),NLR联合血糖值对血培养阳性及革兰阴性菌感染具有预测价值。
| 变量 | AUC | 95%CI | S.E. | 敏感度 | 特异度 | 约登指数 | P值 |
| 血糖 | 0.729 | 0.655~0.803 | 0.038 | 0.726 | 0.695 | 0.421 | < 0.001 |
| NLR | 0.791 | 0.729~0.852 | 0.031 | 0.726 | 0.764 | 0.490 | < 0.001 |
| PCT | 0.657 | 0.581~0.732 | 0.039 | 0.742 | 0.562 | 0.304 | < 0.001 |
| PLR | 0.564 | 0.484~0.644 | 0.042 | 0.903 | 0.246 | 0.149 | 0.237 |
| NLR+血糖 | 0.819 | 0.761~0.877 | 0.030 | 0.806 | 0.719 | 0.525 | < 0.001 |
| 注:NLR为中性粒细胞与淋巴细胞比值,PCT为降钙素原,PLR为血小板与淋巴细胞比值 | |||||||
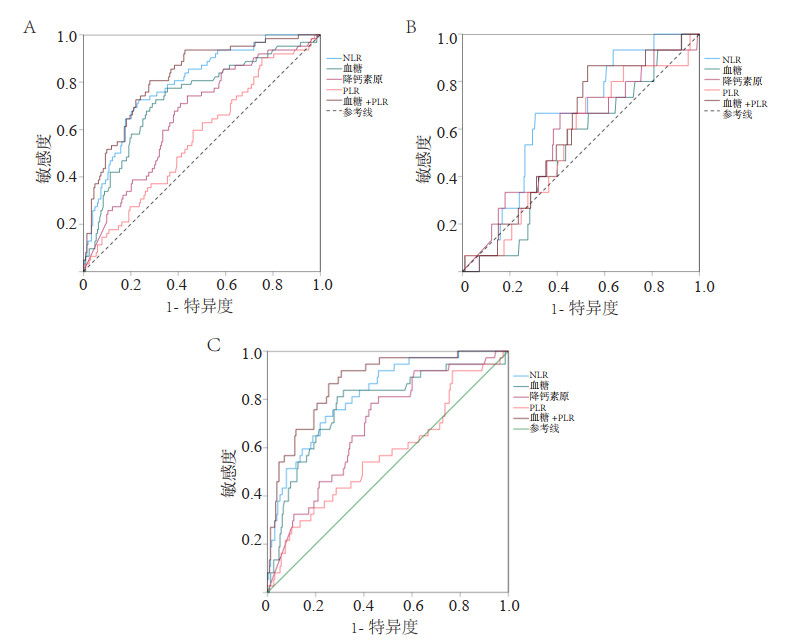
|
| A为脓毒症血培养阳性多因素Logistic回归的ROC曲线图;B为脓毒症血培养革兰阳性菌的ROC曲线图;C为脓毒症血培养革兰阳性菌的ROC曲线图 图 2 脓毒症血培养的多因素Logistic回归的ROC曲线图 Fig 2 ROC curve of multivariable logistic regression with blood culture in sepsis |
|
|
| 变量 | AUC | 95%CI | S.E. | 敏感度 | 特异度 | 约登指数 | P值 |
| 血糖 | 0.523 | 0.433~0.728 | 0.068 | 0.600 | 0.556 | 0.156 | 0.763 |
| NLR | 0.643 | 0.528~0.759 | 0.059 | 0.667 | 0.692 | 0.359 | 0.063 |
| PCT | 0.581 | 0.433~0.728 | 0.075 | 0.667 | 0.588 | 0.255 | 0.293 |
| PLR | 0.549 | 0.411~0.687 | 0.070 | 0.733 | 0.480 | 0.213 | 0.526 |
| NLR+血糖 | 0.597 | 0.448~0.745 | 0.076 | 0.733 | 0.572 | 0.305 | 0.209 |
| 注:NLR为中性粒细胞与淋巴细胞比值,PCT为降钙素原,PLR为血小板与淋巴细胞比值 | |||||||
| 变量 | AUC | 95%CI | S.E. | 敏感度 | 特异度 | 约登指数 | P值 |
| 血糖 | 0.773 | 0.685~0.860 | 0.045 | 0.811 | 0.711 | 0.522 | < 0.001 |
| NLR | 0.820 | 0.751~0.889 | 0.035 | 0.730 | 0.759 | 0.489 | < 0.001 |
| PCT | 0.689 | 0.602~0.776 | 0.044 | 0.784 | 0.570 | 0.354 | < 0.001 |
| PLR | 0.573 | 0.467~0.678 | 0.054 | 0.270 | 0.899 | 0.169 | 0.156 |
| NLR+血糖 | 0.871 | 0.813~0.928 | 0.029 | 0.892 | 0.724 | 0.616 | < 0.001 |
| 注:NLR为中性粒细胞与淋巴细胞比值,PCT为降钙素原,PLR为血小板与淋巴细胞比值 | |||||||
脓毒症是重症监护病房常见疾病,其发生率及病死率高,且是发达国家和发展中国家死亡的主要原因之一,在耗费大量医疗资源的同时病死率仍明显升高,造成巨大的医疗负担。因此,对脓毒症患者进行早期识别、病情评估、预后判断显得至关重要[14-15]。本研究发现,NLR联合入院时随机血糖对脓毒症患者的血培养阳性及革兰阴性菌血流感染具有预测价值。因此,使用该临床常用指标可加强对此类疾病的早期预测及预警。
本研究共纳入脓毒症患者265例,血培养阳性率为23.4%,与研究报告的脓毒症患者血流感染发生率为20%~30%相似[4]。本研究显示,血培养阳性组患者的中性粒细胞及淋巴细胞计数、NLR、血小板与PLR、血糖值、总胆红素以及PCT与血培养阴性组均差异有统计学意义。NLR、入院血糖值是脓毒症患者发生血流感染后血微生物培养阳性的独立危险因素。NLR联合入院时随机血糖值的ROC提示其具有良好的预测效果,有助于临床早期预测脓毒症的血流感染。中性粒细胞和淋巴细胞是免疫系统两种重要的细胞,机体发生炎症反应的初始阶段可以抵抗炎症入侵[16]。在脓毒症初期,机体为了控制剧烈的免疫反应,骨髓中储存的大量成熟中性粒细胞被迅速激活,大量中性粒细胞释放入血,其在机体血液中的数量快速增多,并释放出大量炎性因子以召集其他的炎症细胞。与此同时,凋亡的中性粒细胞数量下降,最终结果是中性粒细胞明显增加[17];另外因为细菌和内毒素的持续作用,外来抗原刺激并激活T淋巴细胞,在遇到异常活化信号或非特异性损害时可引起成熟和非成熟淋巴细胞凋亡,同时未成熟T淋巴细胞大量凋亡将导致外周淋巴组织中成熟淋巴细胞数量下降,继而直接和间接损害免疫功能,突出的表现为T淋巴细胞功能抑制,淋巴细胞凋亡明显增多,淋巴细胞数目显著降低[14, 18]。此外,因为细菌和各种毒素的持续作用,特异性地免疫活化和非特异性地损伤也会使成熟和非成熟的淋巴细胞凋亡[19],最终将导致免疫抑制,淋巴细胞数量下降,最终结果是NLR值升高。另外,脓毒症可发生应激性高血糖,其机制可能是在脓毒症病理生理急性期应激激素。例如,糖皮质激素和儿茶酚胺分泌的增加,糖皮质激素通过激活参与糖酵解的酶和降低骨骼肌中的胰岛素敏感性而导致肝脏葡萄糖释放增加导致高血糖状态,内源性儿茶酚胺和外源性儿茶酚胺诱导糖异生[20],以及脓毒症引起的全身炎症反应导致胰岛素抵抗,进一步导致血糖升高。近期有研究结果表明,NLR可以作为预测脓毒症患者发生肝损伤的早期预警指标[21]。
在本研究中,血培养阳性组感染部位来源差异无统计学意义。感染是启动脓毒症发生的重要环节,机体任何部位都有可能成为感染灶。在本研究中,脓毒症患者的感染来源主要为肺部、腹腔、泌尿道、皮肤软组织及其他(胆道、肝脏、心内膜、中枢系统等),与Cecconi等[22]的研究结果一致。然而,在对血培养阳性组进一步进行革兰阴性菌血流感染及革兰阳性菌血流感染的对比后发现,肺部来源是革兰阴性菌血流感染的更常见感染部位,差异有统计学意义,与Kim等[23]研究结果一致。在本研究中,革兰阴性菌血流感染的主要致病菌是肺炎克雷伯菌和大肠埃希菌,在革兰阳性菌感染中,可见金黄色葡萄球菌、溶血葡萄球菌、人葡萄球菌、头状葡萄球菌、屎肠球菌、表皮葡萄球菌等病原菌。其他为真菌血流感染脓毒症,这与Fitzpatrick等[24]研究的结果一致。本研究发现血流感染造成肝功能损害与非血流感染差异有统计学意义。肝脏为血流最丰富的器官之一,致病菌对肝细胞损害严重,故保肝治疗也是脓毒症初期的重点。本研究显示,NLR联合入院时随机血糖对脓毒症患者的革兰阳性菌血流感染预测价值低,考虑为阳性菌血流感染的脓毒症患者比例低所致。
本研究存在一定局限性:(1)本研究为回顾性研究,选择人群为福建医科大学附属协和医院重症医学科入院后24 h内诊断为脓毒症的患者,排除了普通病房脓毒症患者及非脓毒症患者病情恶化发展为脓毒症的患者,存在选择偏倚,无法代表所有的脓毒症患者人群的基本特征。(2)本研究为单中心回顾性研究,纳入样本量较少,收集资料时不免存在主观思维导致的选择偏差及信息偏差,研究结果还需要进行多中心、大样本的前瞻性研究以进一步探究,并且需要更客观、谨慎地设计研究方法。(3)此次纳入研究的脓毒症患者在本院留取血常规及血培养时,有部分患者曾在外院或急诊使用过抗生素,可能使得研究结果出现偏差。
综上所述,NLR及血糖是预测脓毒症发生血流感染的独立危险因素,且NLR与血糖具有便捷、高效、经济等特点,NLR与血糖值联合检测能够提高对脓毒症患者血流感染的早期预测能力,可广泛用于各级医院。本研究指标对革兰阳性菌血流感染预测能力弱于对革兰阴性菌血流感染预测能力,考虑与纳入病例数较少相关,需要进行前瞻性大样本的研究来进一步验证及评估其对革兰阳性菌的预测能力。
利益冲突 所有作者声明无利益冲突
作者贡献声明 林晓红、余广炜:研究设计;林增杰、涂福泉、郑秋英、项靖楠、魏增玉:采集数据;余广炜、林增杰:统计分析,论文撰写;林晓红、吴文伟:论文修改,指导支持
| [1] | Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021[J]. Intensive Care Med, 2021, 47(11): 1181-1247. DOI:10.1007/s00134-021-06506-y |
| [2] | Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [3] | 陈炜, 赵磊, 牛素平, 等. 不同炎症因子对细菌性血流感染所致脓毒症患者的早期诊断价值[J]. 中华危重病急救医学, 2014, 26(3): 165-170. DOI:10.3760/cma.j.issn.2095-4352.2014.03.008 |
| [4] | Gonçalves-Pereira J, Povoa PR, Lobo C, et al. Bloodstream infections as a marker of community-acquired sepsis severity. Results from the Portuguese community-acquired sepsis study (SACiUCI study)[J]. Clin Microbiol Infect, 2013, 19(3): 242-248. DOI:10.1111/j.1469-0691.2012.03776.x |
| [5] | Tabak YP, Vankeepuram L, Ye G, et al. Blood culture turnaround time in U.S. acute care hospitals and implications for laboratory process optimization[J]. J Clin Microbiol, 2018, 56(12): e00500-18. DOI:10.1128/jcm.00500-18 |
| [6] | Asik Z. The role of the NLR and PLR in urinary tract infection[J]. Clin Lab, 2021, 67(10). DOI:10.7754/Clin.Lab.2021.210133 |
| [7] | Drăgoescu AN, Pădureanu V, Stănculescu AD, et al. Neutrophil to lymphocyte ratio (NLR)-a useful tool for the prognosis of sepsis in the ICU[J]. Biomedicines, 2021, 10(1): 75. DOI:10.3390/biomedicines10010075 |
| [8] | Hou SK, Lin HA, Chen SC, et al. Monocyte distribution width, neutrophil-to-lymphocyte ratio, and platelet-to-lymphocyte ratio improves early prediction for sepsis at the emergency[J]. J Pers Med, 2021, 11(8): 732. DOI:10.3390/jpm11080732 |
| [9] | Bateman RM, Sharpe MD, Jagger JE, et al. 36th International Symposium on Intensive Care and Emergency Medicine : Brussels, Belgium. 15-18 March 2016[J]. Crit Care, 2016, 20(Suppl 2): 94. DOI:10.1186/s13054-016-1208-6 |
| [10] | Nestor D, Andersson H, Kihlberg P, et al. Early prediction of blood stream infection in a prospectively collected cohort[J]. BMC Infect Dis, 2021, 21(1): 316. DOI:10.1186/s12879-021-05990-3 |
| [11] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [12] | Vincent JL, Moreno R, Takala J, et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine[J]. Intensive Care Me, 1996, 22(7): 707-710. DOI:10.1007/BF01709751 |
| [13] | 张太阳. 中国2型糖尿病防治指南(2017年版)"糖尿病与中医药"解读[C]//江西省中西医结合学会内分泌专业委员会学术交流会暨内分泌疾病中西医结合诊疗进展学习班. 2018. |
| [14] | Fleischmann C, Scherag A, Adhikari NKJ, et al. Assessment of global incidence and mortality of hospital-treated sepsis. current estimates and limitations[J]. Am J Respir Crit Care Med, 2016, 193(3): 259-272. DOI:10.1164/rccm.201504-0781OC |
| [15] | 印明珠, 孙明, 燕宪亮. 血栓弹力图、凝血功能与平均血小板体积/血小板计数比值的联合监测对脓毒症患者预后的评估[J]. 中华急诊医学杂志, 2022, 31(10): 1347-1352. DOI:10.3760/cma.j.issn.1671-0282.2022.10.009 |
| [16] | Krinsley JS. Effect of an intensive glucose management protocol on the mortality of critically ill adult patients[J]. Mayo Clin Proc, 2004, 79(8): 992-1000. DOI:10.4065/79.8.992 |
| [17] | 潘萌萌, 宋维, 廖明喻, 等. 中性粒细胞/淋巴细胞比值在脓毒症中的研究进展[J]. 国际呼吸杂志, 2020, 40(1): 70-73. DOI:10.3760/cma.j.issn.1673-436X.2020.01.014 |
| [18] | 孙成栋, 张淑文, 董军. 脓毒症临床实验免疫指标研究进展[J]. 中国危重病急救医学, 2005, 17(12): 760-763. |
| [19] | Reinhart K, Daniels R, Kissoon N, et al. Recognizing sepsis as a global health priority - A WHO resolution[J]. N Engl J Med, 2017, 377(5): 414-417. DOI:10.1056/NEJMp1707170 |
| [20] | Aleman L, Guerrero J. Sepsis hyperglycemia in the ICU: from the mechanism to the clinic[J]. Rev Med Chil, 2018, 146(4): 502-510. DOI:10.4067/s0034-98872018000400502 |
| [21] | 高飞, 高嵩, 惠姣洁, 等. 中性粒细胞与淋巴细胞比值和中性粒细胞胞外诱捕网与脓毒症肝损伤的临床研究[J]. 中华急诊医学杂志, 2021, 30(12): 1484-1488. DOI:10.3760/cma.j.issn.1671-0282.2021.12.013 |
| [22] | Cecconi M, Evans L, Levy M, et al. Sepsis and septic shock[J]. Lancet, 2018, 392(10141): 75-87. DOI:10.1016/S0140-6736(18)30696-2 |
| [23] | Kim JS, Kim YJ, Kim WY. Characteristics and clinical outcomes of culture-negative and culture-positive septic shock: a single-center retrospective cohort study[J]. Crit Care, 2021, 25(1): 11. DOI:10.1186/s13054-020-03421-4 |
| [24] | Fitzpatrick JM, Biswas JS, Edgeworth JD, et al. Gram-negative bacteraemia; a multi-centre prospective evaluation of empiric antibiotic therapy and outcome in English acute hospitals[J]. Clin Microbiol Infect, 2016, 22(3): 244-251. DOI:10.1016/j.cmi.2015.10.034 |
 2024, Vol. 33
2024, Vol. 33