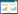2. 扬州市江都人民医院重症医学科,扬州 225200;
3. 扬州大学医学院,扬州 225001;
4. 苏北人民医院重症医学科,扬州 225001
2. Department of Intensive Care Unit, Jiangdu People's Hospital, Yangzhou 225200, China;
3. Medical College, Yangzhou University, Yangzhou 225001, China;
4. Department of Intensive Care Unit, Northern Jiangsu People's Hospital, Yangzhou 225001, China
脓毒症和脓毒症休克是导致危重患者死亡的主要疾病之一,其发病率在世界范围内呈上升趋势[1]。近年来脓毒症在诊断和治疗方法上取得了一定的进展,但脓毒症患者的死亡率仍较高[2]。明确可以判断患者疾病严重程度的临床标志物,有助于临床医生快速识别重症脓毒症患者,及时给予干预措施,有效降低病死率[3]。目前,基于年龄、生命体征、血常规、血气分析和血液生化指标的急性生理学与慢性健康状况评分Ⅱ(acute physiology and chronic health evaluation Ⅱ, APACHE Ⅱ),是临床上常用的判断危重患者病情严重程度和预后的主要指标之一[4]。本研究旨在探讨血清淀粉样蛋白A(serum amyloid A protein,SAA)和载脂蛋白A-Ⅰ(apolipoproteina-Ⅰ, ApoA-Ⅰ)水平对脓毒症及脓毒症休克患者病情严重程度和预后的预测价值,并观察两者联合判断脓毒症患者病情严重程度和预后的价值,为临床提供新的生物标志物。
1 资料与方法 1.1 研究对象本研究为前瞻性、观察性研究,选择2021年9月至2022年2月入住江苏省苏北人民医院重症医学科(intensive care unit, ICU)的脓毒症患者。该院所有病历均实行电子化管理,信息完整可靠,数据质量有保障。
纳入标准:(1)符合Sepsis-3标准诊断为脓毒症的患者,包括①感染或高度怀疑感染;②患者序贯器官衰竭评分(sequential organ failure assessment, SOFA)增加≥2分;(2)18岁≤年龄≤80岁。排除标准:(1)转入ICU之前诊断脓毒症超过6 h;(2)在入院前72 h内接受过抗生素治疗的患者;(3)妊娠;(4)慢性肝功能衰竭患者;(5)接受免疫抑制剂治疗的患者;(6)近1个月发生过脓毒症;(7)长期服用调脂药;(8)病程中用丙泊酚镇静;(9)病程中行肠外营养;(10)终末期疾病患者。
本研究经过江苏省苏北人民医院医学伦理委员会审核,伦理号:2021ky242。本项临床研究为观察性研究,在获得知情同意后纳入研究,仅采集患者临床资料,不干预患者治疗方案,不会对患者生理带来风险,研究者会尽全力保护患者提供的信息不泄露个人隐私。
1.2 研究方法患者被诊断为脓毒症时记录为0 h,之后的24 h、72 h,分别记录为24 h、72 h。用ApoA-Ⅰ ELISA试剂盒(中国,浙江伊利康生物技术有限公司)和SAA ELISA试剂盒(中国,武汉博士德生物工程有限公司)测定脓毒症患者0 h、24 h和72 h的血清ApoA-Ⅰ水平和SAA水平。计算72h ΔApoA-Ⅰ{计算公式:[(ApoA-Ⅰ72 h-ApoA-Ⅰ0 h)/ApoA-Ⅰ0 h]×100%}和72 h ΔSAA{计算公式:[(SAA0 h-SAA72 h)/SAA0 h]×100%}。记录患者性别、年龄、基础疾病、感染部位等一般资料;体温等生命体征;血白细胞、血红蛋白、白蛋白、血肌酐等主要实验室指标。评估所有患者在诊断脓毒症后24 h的APACHE Ⅱ、SOFA。
将患者分为脓毒症休克组和非脓毒症休克组,当患者符合以下2项诊断标准时,即诊断为脓毒症休克:不存在低血容量的情况下,需要使用升压药物来维持平均动脉压≥65 mmHg(1 mmHg=0.133 kPa),血清乳酸水平 > 2 mmol/L(> 18 mg/dL)。基于28 d内患者生存状态,将患者分为死亡组和存活组。
1.3 统计学方法使用SPSS统计软件(IBM Statistics for Windows version 20.0)进行统计分析。计量资料正态分布数据表示为均数±标准差(x±s),偏态分布数据用中位数和四分位数范围表示[M(Q1,Q3)];使用独立样本t检验(正态分布)或非参数检验秩和检验(Mann-Whitney U检验)(偏态分布)进行组间比较。计数资料采用例数(%)表示,两组间率的比较采用卡方检验。采用Pearson进行相关性分析。利用Logistic回归方法探索ApoA-Ⅰ和SAA回归方程,并使用受试者工作特征(receiver operating characteristic, ROC)曲线和ROC曲线下面积(area under curve, AUC)分析、比较各指标预测脓毒症患者病情严重程度、生存状态的价值。生存资料采用Kaplan-Meier生存分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 休克组与非休克组患者的临床资料比较根据脓毒症患者是否并发休克将患者分为休克组(60例)和非休克组(48例)。休克组男34例,女26例,非休克组男26例,女22例。两组体温、降钙素原、血肌酐、白蛋白、尿素氮、天门冬氨酸氨基转移酶、APACHE Ⅱ评分、SOFA评分、乳酸相比差异有统计学差异(均P < 0.05),两组年龄、性别、感染来源、基础疾病、白细胞计数、丙氨酸氨基转移酶等指标差异无统计学意义(均P > 0.05)。见表 1。
| 指标 | 非休克组(n=48) | 休克组(n=60) | 统计值 | P值 |
| 一般情况 | ||||
| 年龄(岁)a | 61.35±14.73 | 65.17±14.51 | -1.384 | 0.169 |
| 男b | 26(54.2) | 34(56.7) | 0.067 | 0.795 |
| 体温(℃)a | 38.59±4.76 | 37.07±1.12 | -2.171 | 0.035 |
| BMI(kg/m2)a | 23.80±3.67 | 22.76±4.80 | 1.239 | 0.218 |
| 感染来源b | 2.178 | 0.903 | ||
| 肺部感染 | 10(20.8) | 12(20.0) | ||
| 血液感染 | 2(4.2) | 5(8.3) | ||
| 腹部感染 | 17(35.4) | 20(33.3) | ||
| 泌尿感染 | 8(16.7) | 10(16.7) | ||
| 皮肤感染 | 4(8.3) | 7(11.7) | ||
| 中枢神经系统感染 | 1(2.1) | 2(3.3) | ||
| 其他 | 6(12.5) | 4(6.7) | ||
| 基础疾病b | 5.276 | 0.383 | ||
| 高血压病 | 13(27.1) | 18(30.0) | ||
| 糖尿病 | 13(27.1) | 9(15.0) | ||
| 冠心病 | 3(6.3) | 3(5.0) | ||
| 脑梗死 | 6(12.5) | 3(5.0) | ||
| 其他 | 1(2.1) | 16(26.7) | ||
| 临床评分a | ||||
| APACHE Ⅱ评分 | 19.13±1.72 | 19.95±1.52 | -2.606 | 0.010 |
| SOFA评分 | 16.30±0.92 | 16.80±1.33 | -2.298 | 0.024 |
| 实验室指标 | ||||
| PCT(ng/mL) c | 1.50(0.23, 7.95) | 21.00(4.58, 75.00) | -5.319 | < 0.001 |
| 白细胞(×109/L) c | 8.92(7.18, 14.63) | 9.58(4.42, 16.95) | -0.235 | 0.814 |
| 中性粒细胞百分比(%)c | 87.90(80.95, 90.80) | 88.10(80.60, 94.00) | -1.410 | 0.159 |
| 血肌酐(µmol/L)c | 83.00(50.50, 119.48) | 121.70(93.70, 173.28) | -3.630 | < 0.001 |
| 白蛋白(g/L)a | 28.46±4.91 | 23.74±6.05 | 4.370 | < 0.001 |
| 尿素氮(mmol/L)c | 7.73(5.71, 15.20) | 12.18(7.79, 17.44) | -2.653 | 0.008 |
| 丙氨酸氨基转移酶(U/L)c | 28.00(22.00, 43.75) | 33.00(22.00, 69.00) | -1.191 | 0.234 |
| 天门冬氨酸氨基转移酶(U/L)c | 34.00(27.50, 51.75) | 51.00(31.00, 135.50) | -2.867 | 0.004 |
| LAC(mmol/L)c | 1.70(1.30, 2.80) | 2.20(1.63, 4.30) | -3.085 | 0.002 |
| 注:BMI是身体质量指数,APACHE Ⅱ评分为急性生理学与慢性健康状况评分Ⅱ,SOFA评分是序贯器官衰竭评分,PCT为降钙素原,LAC为乳酸;a为x±s,b为(例,%),c为M(Q1, Q3) | ||||
根据患者28 d内的生存状态将其分为死亡组(31例)和存活组(77例)。死亡组男19例,女12例,存活组男41例,女36例,两组年龄和性别组成、感染来源、基础疾病等指标差异无统计学意义(均P > 0.05),死亡组APACHE Ⅱ评分、SOFA评分、降钙素原、乳酸均高于存活组(P < 0.05),死亡组白细胞计数低于存活组(P < 0.05)。见表 2。
| 指标 | 存活组(n=77) | 死亡组(n=31) | 统计值 | P值 |
| 一般情况 | ||||
| 年龄(岁)a | 62.78±14.87 | 65.03±14.29 | -0.720 | 0.473 |
| 男b | 41(53.2) | 19(61.3) | 0.447 | 0.447 |
| 体温(℃)a | 38.00±3.89 | 37.14±1.28 | 1.204 | 0.231 |
| BMI(kg/m2)a | 23.23±4.11 | 23.20±4.96 | -0.035 | 0.972 |
| 感染来源b | 4.318 | 0.634 | ||
| 肺部感染 | 15(19.5) | 7(22.6) | ||
| 血液感染 | 5(6.5) | 2(6.5) | ||
| 腹部感染 | 23(29.9) | 14(45.2) | ||
| 泌尿感染 | 14(18.2) | 4(12.9) | ||
| 皮肤感染 | 9(11.7) | 2(6.5) | ||
| 中枢神经系统感染 | 2(2.6) | 1(3.2) | ||
| 其他 | 9(11.7) | 1(3.2) | ||
| 基础疾病b | 6.051 | 0.301 | ||
| 高血压病 | 21(27.3) | 10(32.3) | ||
| 糖尿病 | 12(15.6) | 0(0.0) | ||
| 冠心病 | 6(7.8) | 3(9.7) | ||
| 脑梗死 | 3(3.9) | 1(3.2) | ||
| 其他 | 20(26.0) | 8(25.8) | ||
| 临床评分a | ||||
| APACHE Ⅱ评分 | 19.12±1.57 | 20.72±1.30 | 5.022 | < 0.001 |
| SOFA评分 | 16.44±1.09 | 16.98±1.16 | 2.291 | 0.024 |
| 实验室指标 | ||||
| PCT(ng/mL)c | 3.10(0.52, 15.00) | 35.00(11.00, 69.00) | -4.928 | 0.002 |
| 白细胞(×109/L)c | 9.56(6.64, 16.85) | 7.91(2.83, 11.90) | -1.970 | 0.049 |
| 中性粒细胞百分比(%)c | 87.90(80.95, 90.80) | 86.70(79.70, 93.20) | -0.435 | 0.664 |
| 血肌酐(µmol/L)c | 98.80(65.40, 165.10) | 111.70(75.00, 134.40) | -0.098 | 0.922 |
| 白蛋白(g/L)a | 27.28±5.21 | 22.26±6.51 | -4.205 | 0.055 |
| 尿素氮(mmol/L)c | 10.40(6.80, 16.30) | 11.66(7.20, 17.45) | -0.717 | 0.474 |
| 丙氨酸氨基转移酶(U/L)c | 28.00(22.00, 56.50) | 33.00(22.00, 53.00) | -0.465 | 0.642 |
| 天门冬氨酸氨基转移酶(U/L)c | 37.00(29.00, 98.50) | 51.00(31.00, 94.00) | -0.934 | 0.350 |
| LAC(mmol/L)c | 1.80(1.40, 2.80) | 2.70(1.70, 5.20) | -2.155 | 0.031 |
| 注:BMI是身体质量指数,APACHE Ⅱ评分为急性生理学与慢性健康状况评分Ⅱ,SOFA评分是序贯器官衰竭评分,PCT为降钙素原,LAC为乳酸;a为x±s,b为(例,%),c为M(Q1,Q3) | ||||
休克组0 h ApoA-Ⅰ、24 h ApoA-Ⅰ和72h ApoA-Ⅰ均低于非休克组(均P < 0.05),72 h ΔApoA-Ⅰ两组比较差异无统计学意义(P > 0.05),休克组0 h SAA、24 h SAA和72 h SAA和72 h ΔSAA均高于非休克组(均P < 0.05)。见表 3。
| 指标 | 非休克组(n=48) | 休克组(n=60) | 统计值 | P值 |
| SAA(mg/dL) a | ||||
| 0 h | 34.79±10.21 | 40.84±10.94 | 2.944 | 0.004 |
| 24 h | 30.29±8.67 | 36.35±10.54 | 3.256 | 0.002 |
| 72 h | 6.62±1.56 | 7.39±1.72 | 2.417 | 0.017 |
| 72 h ΔSAA(%)b | 81.35(79.64, 81.99) | 81.60(80.65, 82.71) | 2.176 | 0.030 |
| ApoA-Ⅰ(mg/dL) a | ||||
| 0 h | 54.00±6.00 | 51.00±9.00 | 2.477 | 0.015 |
| 24 h | 57.00±6.00 | 54.00±9.00 | 2.001 | 0.048 |
| 72 h | 66.00±7.00 | 61.00±9.00 | 3.122 | 0.002 |
| 72 h ΔSAA(%)b | 21.28(18.87, 23.73) | 20.17(16.46, 23.40) | 1.401 | 0.161 |
| 注:ApoA-Ⅰ为载脂蛋白A-Ⅰ,SAA为血清淀粉样蛋白A;a为x±s,b为M(Q1,Q3) | ||||
死亡组0 h、24 h、72 h ApoA-Ⅰ水平和72 h ΔApoA-Ⅰ均低于存活组(均P < 0.05)死亡组0 h SAA、24 h SAA、72 h SAA和72 h ΔSAA均高于存活组(均P < 0.05)。见表 4。
| 指标 | 非休克组(n=48) | 休克组(n=60) | 统计值 | P值 |
| SAA(mg/dL) a | ||||
| 0 h | 36.05±10.93 | 43.36±9.44 | 3.260 | 0.001 |
| 24 h | 31.64±9.48 | 38.52±10.37 | 3.321 | 0.001 |
| 72 h | 6.79±1.72 | 7.69±1.45 | 2.563 | 0.012 |
| 72 h ΔSAA(%)b | 81.35(79.64,81.99) | 81.60(80.65,82.71) | 2.176 | 0.030 |
| ApoA-Ⅰ(mg/dL) a | ||||
| 0 h | 54.00±8.00 | 49.00±7.00 | -2.961 | 0.004 |
| 24 h | 57.00±8.00 | 52.00±7.00 | -2.672 | 0.009 |
| 72 h | 65.00±8.00 | 58.00±7.00 | -4.173 | < 0.001 |
| 72 h ΔSAA(%)b | 21.67(18.92,24.24) | 18.64(15.91,22.64) | -2.809 | 0.005 |
| 注:ApoA-Ⅰ为载脂蛋白A-Ⅰ,SAA为血清淀粉样蛋白A;a为x±s,b为M(Q1, Q2) | ||||
0 h、24 h、72 h的SAA水平与APACHE Ⅱ评分呈正相关(均P < 0.001)。0 h、24 h、72 h ApoA-Ⅰ水平与APACHE Ⅱ评分呈负相关(均P < 0.001)。见表 5。
| 指标 | 0 h | 24 h | 72 h | |||||
| r值 | P值 | r值 | P值 | r值 | P值 | |||
| SAA和APACHE Ⅱ评分 | 0.502 | < 0.001 | 0.485 | < 0.001 | 0.501 | < 0.001 | ||
| ApoA-Ⅰ和APACHE Ⅱ评分 | -0.331 | < 0.001 | -0.327 | 0.001 | -0.349 | < 0.001 | ||
| 注:ApoA-Ⅰ为载脂蛋白A-Ⅰ,SAA为血清淀粉样蛋白A,APACHE Ⅱ评分为急性生理学与慢性健康状况评分Ⅱ | ||||||||
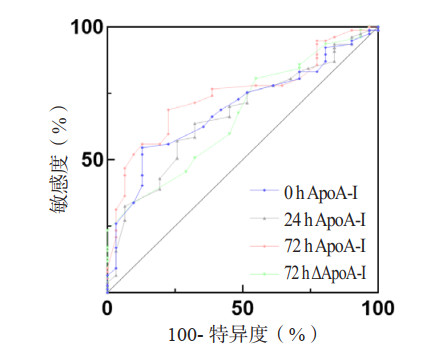
0 h、24 h、72 h ApoA-Ⅰ和72 h ΔApoA-Ⅰ预测患者28 d生存率的AUC分别为0.691、0.668、0.743和0.674(表 6,图 1)。Z检验示72 h与0 h、24 h ApoA-Ⅰ的AUC差异有统计学意义(P < 0.05),与72 h ΔApoA-Ⅰ的AUC差异无统计学意义(P > 0.05)。根据约登指数,取72 h ApoA-Ⅰ 63.00 mg/dL为截断点,预测脓毒症28 d生存率的敏感度为69.4%,特异度为77.1%。Kaplan-Meier生存曲线显示,72 h ApoA-Ⅰ≤63.00 mg/dL的脓毒症患者28 d累积生存率较72 h ApoA-Ⅰ > 63.00 mg/dL者显著降低(Log-Rank检验:χ2=16.353,P < 0.001)(图 2)。
| 指标 | AUC | 95%CI | 截断值 | 敏感度(%) | 特异度(%) | P值 |
| 0 h ApoA-Ⅰ(mg/dL) | 0.691 | 0.588~0.794 | 55.00 | 51.3 | 87.1 | 0.002 |
| 24 h ApoA-Ⅰ(mg/dL) | 0.668 | 0.561~0.776 | 56.00 | 63.9 | 68.2 | 0.006 |
| 72 h ApoA-Ⅰ(mg/dL) | 0.743 | 0.648~0.839 | 63.00 | 69.4 | 77.1 | < 0.001 |
| 72 h ΔApoA-Ⅰ(%) | 0.674 | 0.566~0.782 | 18.70 | 78.8 | 52.3 | 0.005 |
| 注:ApoA-Ⅰ为载脂蛋白A-Ⅰ | ||||||
|
| ApoA-Ⅰ为载脂蛋白A-Ⅰ 图 1 各时间点ApoA-Ⅰ和72 h ΔApoA-Ⅰ预测脓毒症患者28 d生存率的ROC曲线 Fig 1 ROC curve of ApoA-Ⅰ and 72 h ΔApoA-Ⅰ predicting 28-day survival rate of sepsis patients at different time points |
|
|
|
| ApoA-Ⅰ为载脂蛋白A-Ⅰ 图 2 不同72 h ApoA-Ⅰ水平脓毒症患者28 d的Kaplan-Meier生存曲线 Fig 2 28-day Kaplan-Meier survival curves of sepsis patients with different 72 h ApoA-Ⅰ levels |
|
|
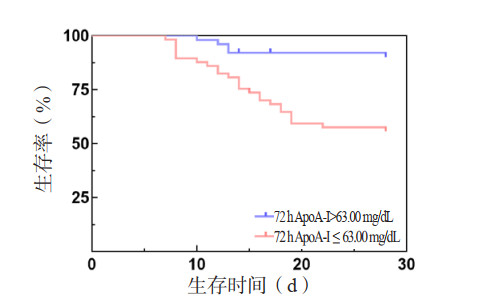
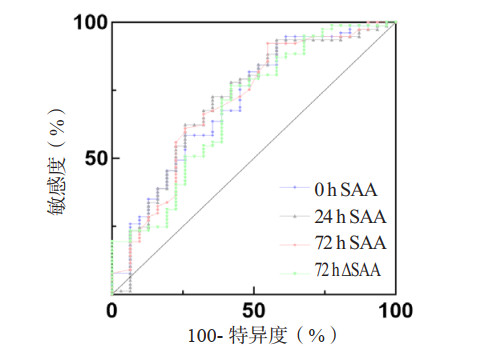
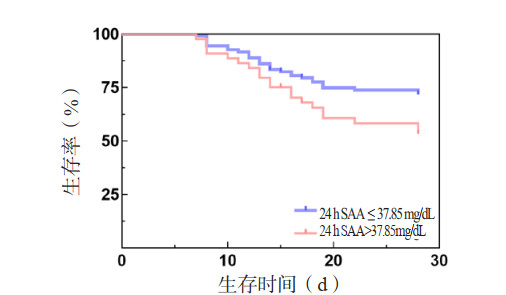
0 h、24 h、72 h SAA和72 h ΔSAA预测患者死亡风险的AUC分别为0.708、0.713、0.668和0.686(表 7,图 3)。Z检验示4个指标的AUC差异无统计学意义(P > 0.05)。根据约登指数,取24 h SAA 37.85 mg/dL为截断点,预测脓毒症28 d死亡风险的敏感度为65.3%,特异度为72.7%。Kaplan-Meier生存曲线显示,24 h SAA > 37.85 mg/dL的脓毒症患者28 d累积生存率较24 h SAA≤37.85 mg/dL者显著降低(Log-Rank检验:χ2=9.986,P=0.002)(图 4)。
| 指标 | AUC | 95%CI | 截断值 | 敏感度(%) | 特异度(%) | P值 |
| 0 h SAA(mg/dL) | 0.708 | 0.596~0.820 | 48.31 | 42.1 | 92.2 | 0.001 |
| 24 h SAA(mg/dL) | 0.713 | 0.598~0.827 | 37.85 | 65.3 | 72.7 | 0.001 |
| 72 h SAA(mg/dL) | 0.668 | 0.555~0.782 | 7.45 | 71.3 | 59.5 | 0.006 |
| 72 h ΔSAA(%) | 0.686 | 0.570~0.801 | 82.10 | 76.5 | 58.1 | 0.003 |
| 注:SAA为血清淀粉样蛋白A | ||||||
|
| SAA为血清淀粉样蛋白A 图 3 不同时间点SAA和72 h ΔSAA预测脓毒症患者28 d死亡风险ROC曲线 Fig 3 ROC curves of SAA and 72 h ΔSAA predicting 28-day risk of death in sepsis patients at different time points |
|
|
|
| SAA为血清淀粉样蛋白A 图 4 不同24 h SAA水平脓毒症患者28 d的Kaplan-Meier生存曲线 Fig 4 28-day Kaplan-Meier survival curves of sepsis patients with different 24 hSAA levels |
|
|
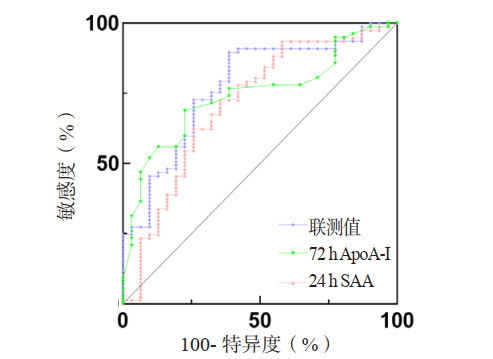
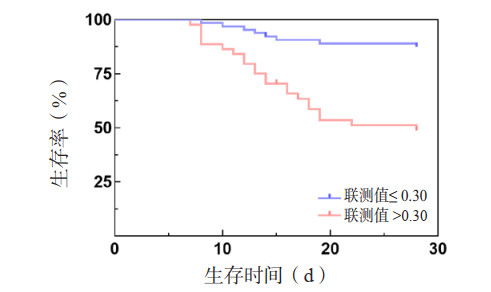
在死亡组和存活组中,利用Logistic回归方法,将ApoA-Ⅰ和SAA结合建立新的联测指标,得到死亡风险回归方程Y=1/[1+e^(2.631+0.006×24h SAA-9.050×72 h ApoA-Ⅰ)]。利用ROC曲线分析ApoA-Ⅰ、SAA及两者联测对28 d死亡风险的评估价值。24 h SAA和72 h ApoA-Ⅰ两者联测值AUC=0.758(95%CI: 0.659~0.859),较24 h SAA和72 h ApoA-I的AUC绝对值增大(图 5)。但Z检验提示,ApoA-Ⅰ、SAA联测值评估脓毒症28d死亡风险的AUC与24 h SAA、72 h ApoA-Ⅰ的AUC差异无统计学意义(P > 0.05),三者评估脓毒症患者预后的效能差异无统计学意义(P > 0.05)。取联测值0.30为截断值,其敏感度为74.2%,较单一指标敏感度有所提升,特异度为73.3%,和单一指标相比未见提升。Kaplan-Meier生存曲线显示,联测值> 0.30的脓毒症患者28 d累积生存率较联测值≤0.30者降低(Log-Rank检验:χ2=23.935,P < 0.001)(图 6)。
|
| ApoA-Ⅰ为载脂蛋白A-Ⅰ,SAA为血清淀粉样蛋白A 图 5 72 h ApoA-Ⅰ、24 h SAA及两者联测值预测脓毒症患者死亡风险的ROC曲线 Fig 5 ROC curves of 72 h ApoA-Ⅰ, 24 h SAA and their combined measurements predicting the risk of death in sepsis patients |
|
|
|
| ApoA-Ⅰ为载脂蛋白A-Ⅰ,SAA为血清淀粉样蛋白A 图 6 不同联测值水平脓毒症患者28 d的Kaplan-Meier生存曲线 Fig 6 28-day Kaplan-Meier survival curves of sepsis patients with different co-measured levels |
|
|
本研究观察到SAA在脓毒症患者中明显升高,且与APACHE Ⅱ评分呈正相关,休克组与死亡组患者的SAA水平在多个时间点均高于非休克组及存活组,提示SAA早期预测患者的病情严重程度及预后的价值。SAA是急性和慢性炎症条件下表达最丰富的肝脏蛋白和多功能载脂蛋白[5],其表达升高是所有炎症性疾病的特征[6]。SAA在急性炎症条件下可以快速升高,有研究表明脓毒症患者SAA水平比正常水平高出约1 000倍[7-8],这与本研究的结果基本一致。
在本研究中,休克组不同时间点检测的ApoA-Ⅰ均低于非休克组,死亡组不同时间点检测的ApoA-Ⅰ均低于存活组,且ApoA-Ⅰ与APACHEⅡ评分呈负相关,提示ApoA-Ⅰ水平与患者疾病严重程度及预后相关,这与之前的研究结果相似[9]。在临床上ApoA-Ⅰ的降低已被证明是全身性炎症反应综合征等多种情况下预后不良的危险因素[9],较低的ApoA-Ⅰ水平可能反映出较高的炎症水平[10]。ApoA-Ⅰ可以通过蛋白-蛋白相互作用直接灭活细菌内毒素,也可以抑制脂多糖与巨噬细胞的结合,从而抑制与脓毒症相关的炎症细胞因子的产生,对全身炎症和多器官损伤有保护作用,增加存活率[11]。
本研究中,血清SAA水平在脓毒症初期快速上升,在病程中逐渐下降,而血清ApoA-Ⅰ水平在脓毒症初期显著下降,在病程中逐渐上升。ApoA-Ⅰ是血浆HDL颗粒中含量最丰富的蛋白质组分,在HDL的抗炎功能中起着核心作用,帮助隔离和消除细菌毒素,对脓毒症具有保护作用[12]。既往研究发现脓毒症时,HDL的载脂蛋白成分发生了明显的变化,HDL中ApoA-Ⅰ被SAA部分替代,富含SAA的HDL颗粒迅速从循环中清除,使血浆中HDL浓度降低[13]。Schuchard等[14]研究表明,SAA浓度在HDL的促炎特性中起着主要作用,SAA在HDL中的积累通过激活促炎信号通路降低了其抗炎能力,使HDL功能失调,从抗炎变为促炎[15]。HDL在脓毒症条件下因为大量产生SAA而不能正常发挥作用。
为了进一步研究SAA和ApoA-Ⅰ在病程中的变异率及其与脓毒症严重程度和预后的关系,本研究计算了72 h的SAA和ApoA-Ⅰ变异率,其中非休克组72 h ΔSAA高于休克组,存活组72 h ΔSAA低于死亡组,提示72 h SAA的变异率可预测病情严重程度和预后,确诊脓毒症后的72 h时SAA水平上升速度越快,患者病情越重、预后越差。存活组72 h ΔApoA-Ⅰ均高于死亡组,提示72 h ApoA-Ⅰ变异率可预测脓毒症病情预后,ApoA-Ⅰ水平速度下降越快,患者预后越差。
本研究使用ROC曲线分析ApoA-Ⅰ、SAA、ΔApoA-Ⅰ和ΔSAA预测脓毒症患者生存状态的价值。各时间点ApoA-Ⅰ和SAA的AUC均大于0.6,但不同时间点ApoA-Ⅰ之间、不同时间点SAA之间AUC差异并无统计学意义,故ApoA-Ⅰ和SAA均是脓毒症不良预后的独立预测因子,但预测效能有限。在既往的研究中,研究者多针对某一固定时间点的ApoA-Ⅰ和SAA进行检测,讨论病程中ApoA-Ⅰ和SAA水平与炎症反应的关系。本研究在验证ApoA-Ⅰ、SAA水平与脓毒症患者病情严重程度、预后关系的基础上,试图寻找一个预测价值最高的检测时间点以指导临床治疗、改善患者预后。在目前的研究结果中,未能在确诊脓毒症的72 h内明确一个预测价值显著提升的检测时间点,于是尝试联合SAA和ApoA-Ⅰ。
目前鲜有关于SAA、ApoA-Ⅰ与脓毒症患者的研究报道,尚未见SAA联合ApoA-Ⅰ判断脓毒症患者病情的研究报道。本研究利用Logistic回归模型进行联合试验,对变量进行检验,并比较AUC大小。由于SAA和ApoA-Ⅰ不同时间点的AUC差异无统计学意义,故选择AUC绝对值最大的24 h SAA和72 h ApoA-Ⅰ进行联合,结果发现联合后评估脓毒症患者预后的效能同单一指标相比并无显著提升。脓毒症时SAA替代ApoA-Ⅰ成为血浆HDL颗粒中含量最丰富的蛋白质组分,血清SAA水平在脓毒症病程中先升后降,ApoA-Ⅰ水平先降后升,二者的变异率趋于一致,这可能是SAA联合ApoA-Ⅰ后未能提高脓毒症预后价值的原因之一。
本研究存在一定局限性,纳入研究的病例数相对较少,且并未测定患者基础的血脂水平,可能对研究结果产生影响,在后期的研究中会继续完善研究方案。
综上所述,血清SAA、ApoA-Ⅰ水平及其动态变化对预测脓毒症患者的病情严重程度及预后有一定的价值,其中72 h ApoA-Ⅰ和24 h SAA水平的预后预测效能最好。但相较于单一指标,尚不能证明SAA联合ApoA-Ⅰ可提高对脓毒症患者的预后评估能力。
利益冲突 所有作者声明无利益冲突
作者贡献声明 谭睿、於江泉:酝酿和设计实验,实施研究,分析数据,起草文章;王晶:采集数据;杨鹏磊:统计分析;缪红军、郑瑞强:对文章的知识性内容作批评性审阅,获取研究经费,行政、技术和材料支持
| [1] | Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [2] | Besen BAMP, Romano TG, Nassar AP, et al. Sepsis-3 definitions predict ICU mortality in a low–middle-income country[J]. Ann Intensive Care, 2016, 6(1): 107. DOI:10.1186/s13613-016-0204-y |
| [3] | Angus DC, Bindman AB. Achieving diagnostic excellence for sepsis[J]. JAMA, 2022, 327(2): 117-118. DOI:10.1001/jama.2021.23916 |
| [4] | Wang JY, Chen YX, Guo SB, et al. Predictive performance of quick Sepsis-related Organ Failure Assessment for mortality and ICU admission in patients with infection at the ED[J]. Am J Emerg Med, 2016, 34(9): 1788-1793. DOI:10.1016/j.ajem.2016.06.015 |
| [5] | 孙宝妮, 李萍, 裴红红, 等. 血清淀粉样蛋白A在急重症感染患者中的意义[J]. 中华急诊医学杂志, 2023, 32(9): 1278-1283. DOI:10.3760/cma.j.issn.1671-0282.2023.09.026 |
| [6] | Gabay C, Kushner I. Acute-phase proteins and other systemic responses to inflammation[J]. N Engl J Med, 1999, 340(6): 448-454. DOI:10.1056/NEJM199902113400607 |
| [7] | Tsunoda F, Lamon-Fava S, Horvath KV, et al. Comparing fluorescence-based cell-free assays for the assessment of antioxidative capacity of high-density lipoproteins[J]. Lipids Health Dis, 2016, 15(1): 163. DOI:10.1186/s12944-016-0336-y |
| [8] | De Buck M, Gouwy M, Wang JM, et al. The cytokine-serum amyloid A-chemokine network[J]. Cytokine Growth Factor Rev, 2016, 30: 55-69. DOI:10.1016/j.cytogfr.2015.12.010 |
| [9] | 徐炎松, 宋凯, 尹冉, 等. 急性胰腺炎患者血清Apo B/A1、MAP1-LC3和ICAM-1水平在早期病情评估中的价值[J]. 中华急诊医学杂志, 2022, 31(4): 551-556. DOI:10.3760/cma.j.issn.1671-0282.2022.04.022 |
| [10] | Morin EE, Guo L, Schwendeman A, et al. HDL in sepsis - risk factor and therapeutic approach[J]. Front Pharmacol, 2015, 6: 244. DOI:10.3389/fphar.2015.00244 |
| [11] | Marik PE, Taeb AM. SIRS, qSOFA and new sepsis definition[J]. J Thorac Dis, 2017, 9(4): 943-945. DOI:10.21037/jtd.2017.03.125 |
| [12] | Curcic S, Holzer M, Frei R, et al. Neutrophil effector responses are suppressed by secretory phospholipase A2 modified HDL[J]. Biochim Biophys Acta, 2015, 1851(2): 184-193. DOI:10.1016/j.bbalip.2014.11.010 |
| [13] | Ye RD, Sun L. Emerging functions of serum amyloid A in inflammation[J]. J Leukoc Biol, 2015, 98(6): 923-929. DOI:10.1189/jlb.3VMR0315-080R |
| [14] | Schuchardt M, Prüfer N, Tu YX, et al. Dysfunctional high-density lipoprotein activates toll-like receptors via serum amyloid A in vascular smooth muscle cells[J]. Sci Rep, 2019, 9(1): 3421. DOI:10.1038/s41598-019-39846-3 |
| [15] | Tölle M, Huang T, Schuchardt M, et al. High-density lipoprotein loses its anti-inflammatory capacity by accumulation of pro-inflammatory-serum amyloid A[J]. Cardiovasc Res, 2012, 94(1): 154-162. DOI:10.1093/cvr/cvs089 |
 2024, Vol. 33
2024, Vol. 33