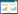2. 宁波市北仑区人民医院重症医学科,宁波 315800;
3. 义乌市中心医院急诊医学科,义乌 322000;
4. 宁波市第一医院急诊医学科,宁波 315000;
5. 宁海县第一医院重症医学科,宁海 315600;
6. 绍兴第二医院急诊医学科,绍兴 312000;
7. 杭州市急救中心,杭州 310021
2. Department of Intensive Care Medicine, People's Hospital of Beilun District of Ningbo, Ningbo 315800, China;
3. Department of Emergency Medicine, Yiwu Central Hospital, Yiwu 322000, China;
4. Department of Emergency Medicine, Ningbo First Hospital, Ningbo 315000, China;
5. Department of Intensive Care Medicine, the First Hospital of Ninghai, Ninghai 315600, China;
6. Department of Emergency Medicine, Shaoxing Second Hosptial, Shaoxing 312000, China;
7. Hangzhou Emergency Medical Center, Hangzhou 310021, China
心脏骤停复苏是一个系统性缺血-再灌注的过程,将导致复苏后心、脑、肺、肾、肠等多个器官损伤,后者成为患者临床预后不佳的关键因素[1-2]。其中,肠缺血-再灌注将启动氧化应激、炎症反应、凋亡等病理损伤途径,造成肠黏膜损伤及屏障功能障碍,进而促进肠内细菌与毒素入血,激活全身免疫系统及加剧炎症反应,最终导致系统性炎症反应综合征和多器官功能障碍[3-5]。研究表明,核因子E2相关因子2(nuclear factor erythroid 2-related factor-2, Nrf2)是调控抗氧化基因表达的关键因子,能在各种损伤刺激下启动血红素加氧酶1(heme oxygenase 1, HO-1)等抗氧化基因表达,进而增强抗氧化损伤能力[6]。研究发现,萝卜硫素(sulforaphane, SFN)能通过特异性激活Nrf2介导的抗氧化途径而减轻杜氏肌营养不良、非甾体抗炎药、过氧化氢等多种诱因所致的肠源性疾病[7-9]。本研究拟建立猪心肺复苏(cardiopulmonary resuscitation, CPR)模型,探讨SFN对复苏后肠黏膜损伤的治疗效果及作用机制,为其在复苏领域中的应用提供依据。
1 材料与方法 1.1 动物来源与分组研究使用24头国产健康雄性大白猪,由上海甲干生物科技有限公司提供,生产合格证号为SCXK(沪)2020-0006。动物应用随机数字表法,分为假手术(Sham)组、CPR组、SFN组,其中Sham组6头、另两组各9头。Sham组仅进行麻醉监护、机械通气、血管内置管等准备工作;CPR组完成上述准备工作后,利用10 min心脏骤停与6 min CPR的造模参数建立猪CPR模型;SFN组同上完成动物准备与模型建立,并在复苏后5 min时经股静脉泵入2 mg/kg SFN,整个时长为10 min。该研究获得浙江大学医学院附属第二医院动物伦理委员会审批(批准号为2022-024)。
1.2 主要仪器与试剂主要仪器:SV350呼吸机和BeneVision N15心电监护仪(深圳迈瑞公司),M Series除颤监护仪(美国ZOLL公司),ePAQ Pro手持式复苏循环监护仪和PalmCPR胸腔按压反馈仪(苏州尚领公司),压力监测导管(美国Edwards公司),电刺激装置(美国Weil危重病研究所),165-8001电泳仪和iMARK型酶标仪(美国Bio-Rad公司),CX31型光学显微镜和CX43型激光共聚焦显微镜(日本Olympus公司)。
主要试剂:萝卜硫素冻干粉(美国LKT Laboratories公司),替来他明/唑拉西泮粉剂(法国Virbac公司),噻拉嗪注射液(吉林华牧公司),丙泊酚注射液(西安力邦制药),肠型脂肪酸结合蛋白(intestinal fatty acid binding protein, IFABP)、二胺氧化酶(diamine oxidase, DAO)和过氧化物4-羟基壬烯醛(4-hydroxy-2-nonenal, 4-HNE)检测试剂盒(上海美轩生物),超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、还原型谷胱甘肽(glutathione, GSH)和丙二醛(malondialdehyde, MDA)检测试剂盒(南京建成生物),活性氧物质(reactive oxygen species, ROS)检测试剂盒(北京索莱宝科技),TUNEL检测试剂盒(武汉博士德生物),黏连蛋白-1(zonula occluden-1, ZO-1)、闭合蛋白(occludin)、Nrf2和HO-1一抗工作液(美国Proteintech公司)。
1.3 实验动物准备实验前夜,动物禁食不禁水。实验当日,应用替来他明/唑拉西泮5 mg/kg和噻拉嗪1 mg/kg肌肉注射诱导麻醉,再应用丙泊酚2 mg/kg静脉推注全身麻醉,继以丙泊酚4 mg/(kg·h)静脉泵入维持麻醉状态。经体表电极动态监测心电图。经口气管插管,连接手持式复苏循环监护仪和呼吸机,用于呼气末二氧化碳分压监测与机械通气,通气参数为V-C模式、潮气量10 mL/kg、通气频率12次/min、氧浓度21%。消毒右腹股沟区和右颈部皮肤,充分暴露右侧股动脉、股静脉和右侧颈外静脉,分别切开并置入2根压力监测导管和1根室颤诱导电极,前二者连接心电监护仪以监测胸主动脉血压和右心房压,后者连接电刺激装置以诱导室颤。
1.4 模型制备参照笔者团队[10]的方法建立猪CPR模型。应用电刺激装置释放1 mA交流电,经室颤诱导电极传递至右心室,待确认室颤诱导成功后,无干预观察10 min。然后,参照心肺复苏指南实施CPR术,即人工胸外按压和球囊辅助通气,比例30∶2,并应用胸腔按压反馈仪监测以保证按压深度5~6 cm、频率100~120次/min的标准按压。在CPR 2 min时,经股静脉推注负荷量肾上腺素20 μg/kg,此后每3 min重复1次。在CPR 6 min时,应用150 J双向波电除颤1次,随即判断是否复苏成功,其标准为室上性自主心律恢复和平均动脉压≥50 mmHg(1 mmHg=0.133 kPa)以上、持续≥5 min。若初次复苏失败,立即重启CPR流程,即人工胸外按压和球囊辅助通气2 min后电除颤1次,重复该流程直至复苏成功或5个循环后宣告失败。复苏成功后,继续麻醉监护4 h,再送回猪圈观察20 h。最后,同前肌注诱导麻醉,再静脉推注负荷量丙泊酚3 mg/kg和10%氯化钾10 mL处死动物。
1.5 观察指标造模前,各组监测血流动力学、血气分析等基本指标的情况。造模期间,各组记录复苏结局和24h存活情况。在造模前及复苏后1 h、2 h、4 h和24 h等时间点,各组经股静脉采集静脉血样2 mL,离心取上清液,置于-80 ℃冰箱冻存,择期应用ELISA法检测肠黏膜损伤标志物IFABP和DAO的血清水平。
在复苏后24 h时,各组随机选6只动物处死后,迅速解剖获取回肠末端组织标本,部分进行多聚甲醛溶液固定、石蜡包埋、切片等病理样本制作,择期应用TUNEL法检测细胞凋亡情况,即每张切片染色后置于200倍镜下拍照,随机取5个视野的照片,计数棕黄色阳性细胞与总细胞的数量及比例,以5个视野计算结果的平均值为细胞凋亡指数。
在复苏后24 h时,用同上方法获取回肠末端组织标本,先后应用液氮快速冷冻与-80 ℃冰箱长期冻存,择期取样本进行匀浆,应用生化法检测SOD和CAT活性、GSH和MDA含量,以及ELISA法检测4-HNE含量。另外,择期取部分样本,制作冰冻切片,应用ROS试剂盒检测ROS荧光强度。此外,择期应用Western blot法检测ZO-1、Occludin、Nrf2和HO-1的蛋白表达情况,即取少许冻存组织样本,应用RIPA液裂解,然后低温超速离心获取上清液,再经SDS-PAGE蛋白电泳、PVDF转膜、5%脱脂牛奶封闭等步骤后,加入上述4个蛋白的一抗工作液(稀释比例均为1∶1 000)后低温孵育过夜,再加入二抗室温孵育,最后应用ECL液显影拍照,在Image J软件中测量蛋白灰度值,以目的蛋白与磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase, GAPDH)的灰度比值表示其相对表达水平。
1.6 统计学方法应用SPSS 20.0统计软件(美国IBM公司)进行数据统计分析。符合正态分布的计量资料以均数±标准差(x±s)表示,三组间比较采用单因素方差分析,进一步两两比较采用Bonferroni事后检验。计数资料以百分率表示,两组间比较采用Fisher精确检验法。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组动物的基本指标、复苏和存活情况研究使用实验猪共计24头。造模前,各组动物的心率、平均动脉压、pH、氧分压、二氧化碳反应、乳酸等指标,组间比较均差异无统计学意义(均P > 0.05)。造模期间,CPR组和SFN组分别使用肾上腺素(2.46±1.07)mg、(2.06±0.97)mg,组间比较差异无统计学意义(P > 0.05)。另外,CPR组和SFN组分别复苏成功6头、7头,两组复苏成功比例分别为6/9、7/9,组间比较差异无统计学意义(P > 0.05)。造模后24 h时,CPR组和SFN组分别存活6头、7头,两组24 h存活比例分别为6/9、7/9,组间比较差异无统计学意义(P > 0.05)。
2.2 各组动物的肠黏膜损伤标志物变化复苏后观察期间,CPR组和SFN组肠黏膜损伤标志物IFABP和DAO的血清水平升高,且在复苏后1 h、2 h、4 h和24 h等时间点均高于Sham组,组间比较差异均有统计学意义(均P < 0.05)。然而,SFN组IFABP在2 h、4 h和24 h等时间点、DAO在1 h、2 h、4 h和24 h等时间点均低于CPR组,组间比较差异均有统计学意义(均P < 0.05)。见图 1。
|
| IFABP为肠型脂肪酸结合蛋白,DAO为二胺氧化酶,BL为基线;与Sham组比较,aP < 0.05;与CPR组比较,bP < 0.05 图 1 各组动物的肠黏膜损伤标志物变化 Fig 1 The changes of biomarkers of intestinal mucosal injury in each group |
|
|
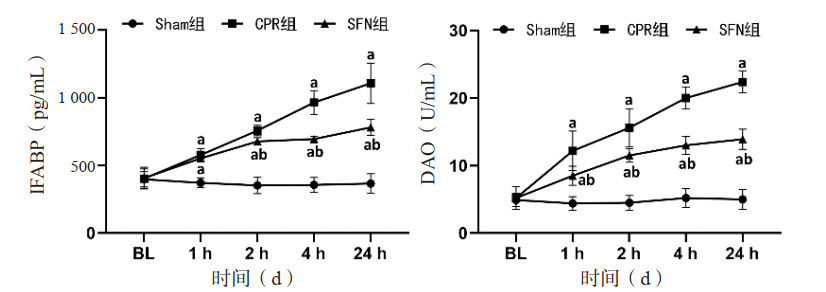
复苏后24 h时,CPR组和SFN组肠黏膜紧密连接蛋白出现表达异常,其标志蛋白ZO-1和Occludin的表达水平低于Sham组,组间比较差异均有统计学意义(均P < 0.05)。然而,SFN组ZO-1和Occludin的蛋白表达水平高于CPR组,组间比较差异均有统计学意义(均P < 0.05)。见图 2。
|
| ZO-1为黏连蛋白-1,Occludin为闭合蛋白;与Sham组比较,aP < 0.05;与CPR组比较,bP < 0.05 图 2 各组动物的肠黏膜紧密连接蛋白表达情况 Fig 2 The expression levels of intestinal mucosal tight junction proteins in each group |
|
|
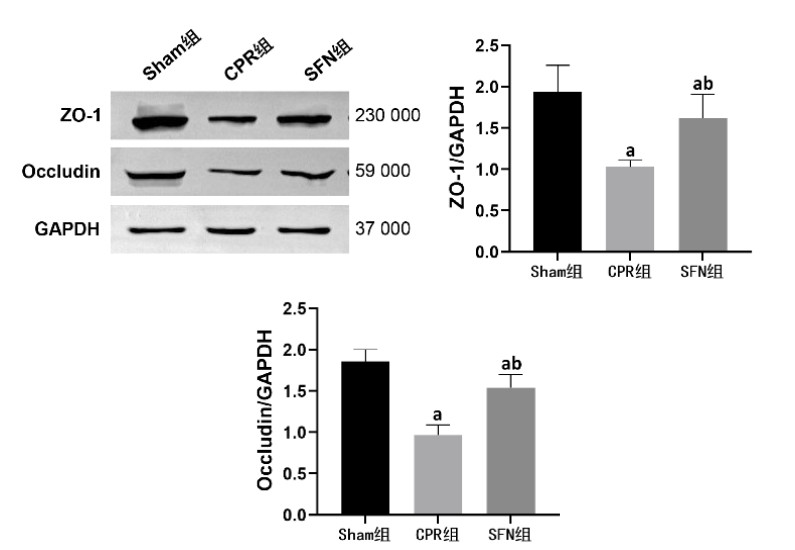
复苏后24 h时,CPR组和SFN组肠黏膜组织均出现细胞凋亡现象,且细胞凋亡指数高于Sham组,组间比较差异均有统计学意义(均P < 0.05)。然而,SFN组肠黏膜组织的细胞凋亡指数低于CPR组,组间比较差异有统计学意义(P < 0.05)。见图 3。
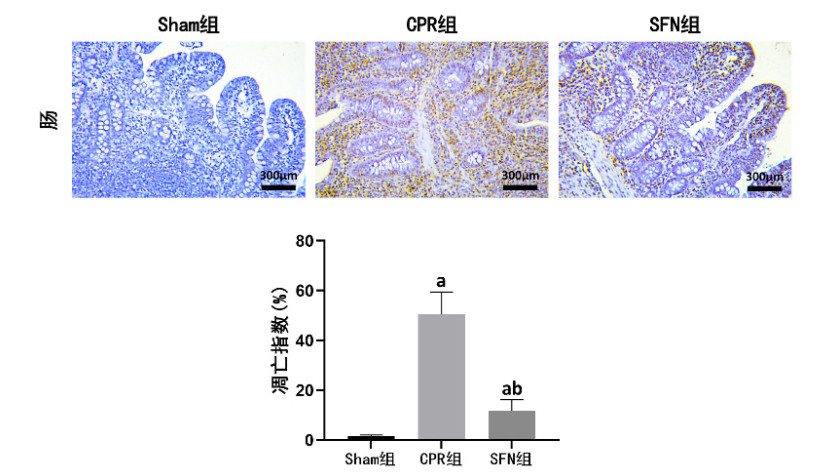
|
| 与Sham组比较,aP < 0.05;与CPR组比较,bP < 0.05 图 3 各组动物的肠黏膜组织细胞凋亡情况(TUNEL染色,×200) Fig 3 Cell apoptosis in intestinal mucosal tissue in each group (TUNEL staining, ×200) |
|
|
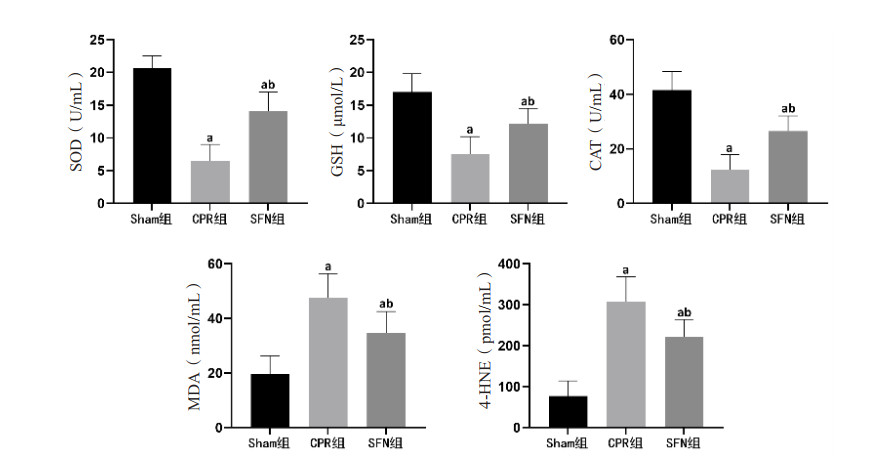
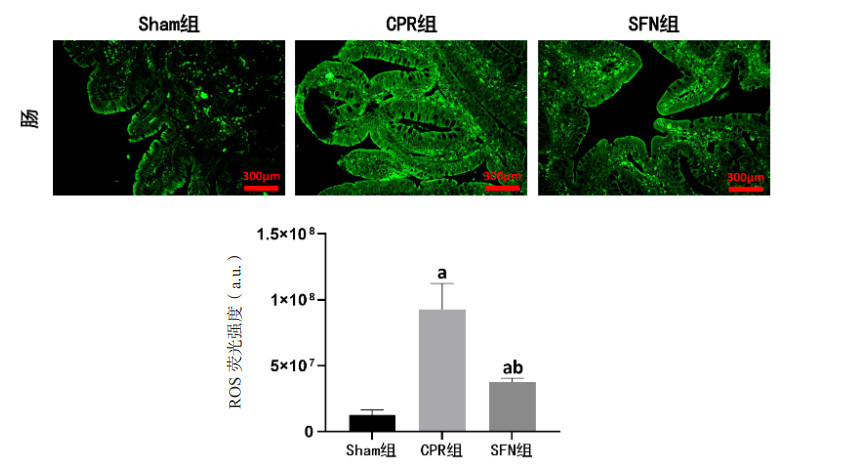
复苏后24 h时,CPR组和SFN组肠黏膜组织出现氧化损伤情况,表现为抗氧化物SOD和CAT活性、GSH含量均低于Sham组,氧化相关产物MDA和4-HNE含量、ROS荧光强度均高于Sham组,组间比较差异均有统计学意义(均P < 0.05)。然而,SFN组肠黏膜组织中抗氧化物SOD和CAT活性、GSH含量均高于CPR组,氧化相关产物MDA和4-HNE含量、ROS荧光强度均低于CPR组,组间比较差异均有统计学意义(均P < 0.05)。见图 4、5。
|
| SOD为超氧化物歧化酶,GSH为还原型谷胱甘肽,CAT为过氧化氢酶,MDA为丙二醛,4-HNE为4-羟基壬烯醛;与Sham组比较,aP < 0.05;与CPR组比较,bP < 0.05 图 4 各组动物肠黏膜组织中抗氧化与氧化物质的变化 Fig 4 The changes of antioxidants and oxidants in intestinal mucosal tissue in each group |
|
|
|
| ROS为活性氧物质;与Sham组比较,aP < 0.05;与CPR组比较,bP < 0.05 图 5 各组动物肠黏膜组织中活性氧物质的变化(免疫荧光,×200) Fig 5 The changes of reactive oxygen species in intestinal mucosal tissue in each group (Immunofluorescence, ×200) |
|
|
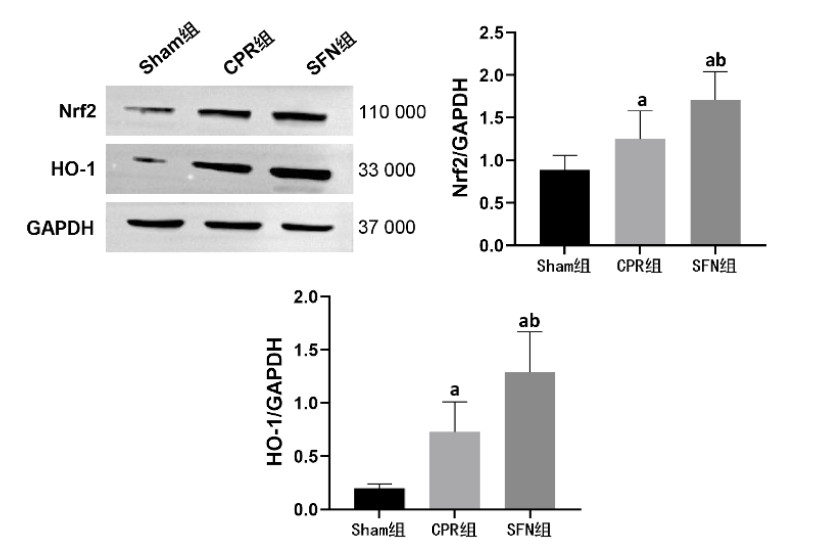
复苏后24 h时,CPR组和SFN组肠黏膜组织中Nrf2/HO-1通路出现异常,表现为Nrf2和HO-1的蛋白表达水平高于Sham组,组间比较差异均有统计学意义(均P < 0.05)。此外,SFN组肠黏膜组织中Nrf2和HO-1的蛋白表达水平高于CPR组,组间比较差异均有统计学意义(均P < 0.05)。见图 6。
|
| Nrf2为核因子E2相关因子2,HO-1为血红素加氧酶-1;与Sham组比较,aP < 0.05;与CPR组比较,bP < 0.05 图 6 各组动物的肠黏膜组织Nrf2/HO-1通路变化 Fig 6 The changes of Nrf2/HO-1 pathway in intestinal mucosal tissue in each group |
|
|
本研究利用猪CPR模型探讨了SFN对复苏后肠黏膜损伤的治疗作用。研究显示,猪复苏后出现肠黏膜损伤标志物的血清水平升高,同时可见肠黏膜屏障破坏、肠组织氧化应激损伤与细胞凋亡等现象;应用SFN能降低猪复苏后肠黏膜损伤的血清标志物水平及各类肠黏膜组织损伤的程度。因而提示,SFN具有减轻复苏后肠黏膜损伤的保护作用,将为其在复苏领域的应用提供依据。
研究表明,SFN来自甘蓝菜、西兰花、花椰菜等十字花科蔬菜,属于异硫氰酸酯类的活性物质,主要通过激活Nrf2/HO-1信号通路而产生系列抗氧化的保护效应[11]。部分研究表明,在杜氏肌营养不良、非甾体抗炎药、过氧化氢等诱因所致的肠源性疾病中,SFN具有减轻这些因素所致肠道疾病的积极治疗作用。Swiderski等[7]建立杜氏肌营养不良小鼠模型,研究发现SFN具有改善肌肉组织收缩功能及遏制其纤维化病程的胃肠道保护能力。Yanaka等[8]利用非甾体抗炎药-阿司匹林诱导建立小肠损伤的体内外实验模型,研究发现SFN能保护小肠免受上述药源性损伤,其保护机制可能与激活Nrf2-Keap1信号通路介导的抗氧化系统、以及抑制肠道厌氧菌的侵袭性移位等有关。易国栋和谭静[9]利用过氧化氢诱导建立人结肠上皮细胞的体外氧化应激损伤模型,研究发现SFN通过激活Nrf2/ARE信号通路后启动GCLC、NQO1、HO-1等系列抗氧化蛋白的表达,进而增强抗氧化物SOD活性及降低过氧化物MDA含量,从而促进人结肠上皮细胞存活。
目前,尚无研究探讨SFN对局部或系统性缺血-再灌注所致肠黏膜损伤的治疗作用,但部分研究已显示Nrf2信号蛋白是肠黏膜缺血-再灌注损伤的保护性干预靶标。Zhang等[12]建立肠缺血-再灌注小鼠模型,研究发现色氨酸代谢物-吲哚-3-乳酸能通过启动Nrf2信号途径而减轻肠上皮损伤程度,进而改善肠黏膜屏障功能状态。Liu等[13]同样建立肠缺血-再灌注小鼠模型,研究发现苔藓抑素1能通过靶向激活Nrf2/HO-1信号通路而产生抗氧化应激与抗炎症反应的治疗作用,进而改善缺血-再灌注后肠黏膜渗透性和肠道细菌移位比例,由此产生积极的肠保护效果。基于上述文献证据,当前有必要探索SFN对复苏后肠黏膜损伤的治疗效果。
首先,研究选择大动物猪作为实验对象,以及选择心脏骤停10 min与CPR 6 min的建模参数,预期获得更为贴合临床实际的实验结果[14]。其次,根据现有文献资料报道的SFN在缺血-再灌注事件中的合适使用剂量[15-16],以及结合不同种属间的药物剂量转化方法[17],同时参照CPR救治中最佳的给药时机[10],综合考虑决定在复苏后5 min时经静脉泵入2 mg/kg的SFN。本实验结果显示,与Sham组相比,CPR组和SFN组动物经历心脏骤停复苏所致的全身性损伤应激后,可见肠黏膜损伤标志物IFABP和DAO的血清水平显著升高,其中IFABP分别较Sham组增长3.0倍、2.1倍,DAO分别较Sham组增长4.5倍、2.8倍;另外,可见肠黏膜紧密连接蛋白的表达水平下调。然而,SFN组IFABP和DAO的血清水平显著低于CPR组,且肠黏膜紧密连接蛋白的表达水平高于CPR组,提示SFN具有减轻复苏后肠黏膜损伤的治疗作用。
研究表明,氧化应激和细胞凋亡是各种缺血-再灌注事件发生后器官损伤的重要形式,亦成为各种抗缺血-再灌注损伤的保护性干预靶标[18-19]。同样地,在肠缺血-再灌注损伤研究中,多种药物已被发现通过抑制氧化应激和细胞凋亡途径而产生肠保护的作用。Li等[20]建立大鼠肠缺血-再灌注损伤模型,研究发现柯里拉京能通过激活AMPK/Sirt1通路介导的自噬途径后抑制肠黏膜组织的氧化应激与细胞凋亡过程,从而改善肠功能障碍。Fan等[21]建立小鼠肠缺血-再灌注损伤模型,研究发现榈酸乙酯通过调控基质金属蛋白酶9功能而抑制肠黏膜组织氧化应激、炎症及凋亡等多种病理损伤途径,从而减轻肠黏膜组织的多种病理损害。本研究结果显示,与Sham组相比,CPR组和SFN组复苏后24 h时的肠黏膜组织抗氧化物SOD和CAT活性下降、GSH含量降低,过氧化物MDA和4-HNE含量上升、ROS产物增加,以及细胞凋亡指数升高,提示两组造模的动物复苏后出现肠黏膜组织氧化应激损伤与细胞凋亡。然而,SFN组动物肠黏膜组织的上述抗氧化物的活性或含量显著高于CPR组,同时过氧化物含量和细胞凋亡指数显著低于CPR组,因而提示SFN具有减轻复苏后肠黏膜组织氧化应激与细胞凋亡程度的保护作用。另外,与Sham组相比,CPR组和SFN组动物复苏后肠黏膜组织中的Nrf2和HO-1蛋白表达水平上调,且二者在SFN组的表达水平高于CPR组,因而提示SFN可能通过进一步激活Nrf2/HO-1途径而加强机体抗氧化与抗凋亡的保护效果。
本研究存在如下局限性。第一,研究仅使用大动物模型初步观察单一剂量SFN对复苏后肠黏膜损伤的治疗作用,以致SFN用于复苏后肠保护的药效学、药动学与毒理学等资料仍需研究确认。第二,由于大动物模型复杂且代价大,以致研究样本量偏少、且研究周期偏短,仍需加大样本量及延长观察时长以获得更加殷实的研究证据。第三,研究虽然发现SFN激活Nrf2/HO-1通路后能发挥抗氧化与抗凋亡的肠保护作用,但其调控氧化应激与细胞凋亡途径的分子机制仍需探讨。
综上所述,SFN具有减轻猪复苏后肠黏膜损伤的保护作用,其机制可能与激活Nrf2/HO-1通路后抑制组织氧化应激与细胞凋亡等有关。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张俊锋:实验操作、数据收集及整理、统计学分析、论文撰写;张茂:研究设计、论文指导与修改;葛风、朱锦江、王旭光、陈启江、曹光立、周梅亚、徐杰丰:实验操作
| [1] | Roberts BW, Kilgannon JH, Chansky ME, et al. Multiple organ dysfunction after return of spontaneous circulation in postcardiac arrest syndrome[J]. Crit Care Med, 2013, 41(6): 1492-1501. DOI:10.1097/CCM.0b013e31828a39e9 |
| [2] | Cunningham CA, Coppler PJ, Skolnik AB. The immunology of the post-cardiac arrest syndrome[J]. Resuscitation, 2022, 179: 116-123. DOI:10.1016/j.resuscitation.2022.08.013 |
| [3] | Yu H, Kirkpatrick IDC. An update on acute mesenteric ischemia[J]. Can Assoc Radiol J, 2023, 74(1): 160-171. DOI:10.1177/08465371221094280 |
| [4] | Chalkias A, Scheetz MH, Gulati A, et al. Periarrest intestinal bacterial translocation and resuscitation outcome[J]. J Crit Care, 2016, 31(1): 217-220. DOI:10.1016/j.jcrc.2015.09.015 |
| [5] | Korth U, Krieter H, Denz C, et al. Intestinal ischaemia during cardiac arrest and resuscitation: comparative analysis of extracellular metabolites by microdialysis[J]. Resuscitation, 2003, 58(2): 209-217. DOI:10.1016/s0300-9572(03)00119-9 |
| [6] | Thiruvengadam R, Venkidasamy B, Samynathan R, et al. Association of nanoparticles and Nrf2 with various oxidative stress-mediated diseases[J]. Chem Biol Interact, 2023, 380: 110535. DOI:10.1016/j.cbi.2023.110535 |
| [7] | Swiderski K, Read SJ, Chan AS, et al. Investigating the potential for sulforaphane to attenuate gastrointestinal dysfunction in mdx dystrophic mice[J]. Nutrients, 2021, 13(12): 4559. DOI:10.3390/nu13124559 |
| [8] | Yanaka A, Sato J, Ohmori S. Sulforaphane protects small intestinal mucosa from aspirin/NSAID-induced injury by enhancing host defense systems against oxidative stress and by inhibiting mucosal invasion of anaerobic enterobacteria[J]. Curr Pharm Des, 2013, 19(1): 157-162. DOI:10.2174/13816128130120 |
| [9] | 易国栋, 谭静. 萝卜硫素通过Nrf2/ARE通路对人结肠上皮细胞氧化应激损伤的调控作用[J]. 西部中医药, 2019, 32(11): 40-43. |
| [10] | Xu JF, Zhao X, Jiang XK, et al. Tubastatin A improves post-resuscitation myocardial dysfunction by inhibiting NLRP3-mediated pyroptosis through enhancing transcription factor EB signaling[J]. J Am Heart Assoc, 2022, 11(7): e024205. DOI:10.1161/JAHA.121.024205 |
| [11] | Ruhee RT, Suzuki K. The integrative role of sulforaphane in preventing inflammation, oxidative stress and fatigue: a review of a potential protective phytochemical[J]. Antioxidants, 2020, 9(6): 521. DOI:10.3390/antiox9060521 |
| [12] | Zhang FL, Chen XW, Wang YF, et al. Microbiota-derived tryptophan metabolites indole-3-lactic acid is associated with intestinal ischemia/reperfusion injury via positive regulation of YAP and Nrf2[J]. J Transl Med, 2023, 21(1): 264. DOI:10.1186/s12967-023-04109-3 |
| [13] | Liu ML, Wen HX, Zuo LG, et al. Bryostatin-1 attenuates intestinal ischemia/reperfusion-induced intestinal barrier dysfunction, inflammation, and oxidative stress via activation of Nrf2/HO-1 signaling[J]. FASEB J, 2023, 37(6): e22948. DOI:10.1096/fj.202201540R |
| [14] | Vognsen M, Fabian-Jessing BK, Secher N, et al. Contemporary animal models of cardiac arrest: a systematic review[J]. Resuscitation, 2017, 113: 115-123. DOI:10.1016/j.resuscitation.2017.01.024 |
| [15] | Guan ZH, Zhou LM, Zhang Y, et al. Sulforaphane ameliorates the liver injury of traumatic hemorrhagic shock rats[J]. J Surg Res, 2021, 267: 293-301. DOI:10.1016/j.jss.2021.05.004 |
| [16] | Goodfellow MJ, Borcar A, Proctor JL, et al. Transcriptional activation of antioxidant gene expression by Nrf2 protects against mitochondrial dysfunction and neuronal death associated with acute and chronic neurodegeneration[J]. Exp Neurol, 2020, 328: 113247. DOI:10.1016/j.expneurol.2020.113247 |
| [17] | Nair AB, Jacob S. A simple practice guide for dose conversion between animals and human[J]. J Basic Clin Pharm, 2016, 7(2): 27-31. DOI:10.4103/0976-0105.177703 |
| [18] | Bi ML, Li DY, Zhang J. Role of curcumin in ischemia and reperfusion injury[J]. Front Pharmacol, 2023, 14: 1057144. DOI:10.3389/fphar.2023.1057144 |
| [19] | Osorio-Llanes E, Villamizar-Villamizar W, Ospino Guerra MC, et al. Effects of metformin on ischemia/reperfusion injury: new evidence and mechanisms[J]. Pharmaceuticals, 2023, 16(8): 1121. DOI:10.3390/ph16081121 |
| [20] | Li B, Li WL, Zheng ML, et al. Corilagin alleviates intestinal ischemia/reperfusion injury by relieving oxidative stress and apoptosis via AMPK/Sirt1-autophagy pathway[J]. Exp Biol Med, 2023, 248(4): 317-326. DOI:10.1177/15353702221147560 |
| [21] | Fan SY, Feng XY, Li K, et al. Protective mechanism of ethyl gallate against intestinal ischemia-reperfusion injury in mice by in vivo and in vitro studies based on transcriptomics[J]. Chem Biodivers, 2023, 20(1): e202200643. DOI:10.1002/cbdv.202200643 |
 2024, Vol. 33
2024, Vol. 33