2. 首都医科大学附属北京朝阳医院急诊医学中心,心肺脑复苏北京市重点实验室,北京 100020
2. Emergency Medicine Center, Beijing ChaoYang Hospital, Capital Medical University, Beijing Key Laboratory of Cardiopulmonary Cerebral Resuscitation, Beijing 100020, China
国际上通常把60岁以上人口占总人口的比例达到10%或65岁以上人口占比达7%作为一个国家或地区进入老龄化社会的标准,据此我国2005年已全面进入老龄化社会[1]。如何使老年人功能发挥最大化,是实现健康老龄化的关键,也是整个社会面临的严峻挑战[2]。衰弱是老年临床综合征的核心之一,全球老年人衰弱患病率约为13.6%,与不良健康结局密切相关[3]。早期识别衰弱并予以干预,可能延缓甚至逆转其进程。衰弱的发病机制尚未明确,目前慢性炎症与衰老相关机制是研究的热点[4]。研究发现,Sirtuins是一类依赖NAD的蛋白去乙酰酶抑制剂,在高级真核生物中可能作为代谢、基因组沉默和衰老的枢纽。有7种同源Sirtuins,命名为沉默信息调节因子(silent information regulator, SIRT)-1~SIRT-7,其中,SIRT-1可能与细胞增殖、分化、衰老和衰弱相关[3, 5-7]。因此,笔者在急诊科进行该项研究,旨在明确血清白细胞介素(interleukin, IL)-6、SIRT-1是否能够作为衰弱的早期预警生物标志物,以期未来实施干预并改善老年患者预后。
1 资料与方法 1.1 研究对象本研究为单中心横断面研究,连续纳入2022年1月至12月于北京博爱医院急诊科就诊的患者。纳入标准:(1)接受急诊治疗;(2)年龄≥60岁。排除标准:(1)不能配合完成评估;(2)需行急诊手术;(3)住院时间 < 24 h;(4)临床资料不全;(5)主动退出研究。
本研究符合医学伦理学标准,经中国康复研究中心医学伦理委员会审批通过(批号:2021-093-1),所有受试者自愿参加,签署临床研究知情同意书。
1.2 研究方法 1.2.1 临床资料收集收集入选患者的人口统计学,包括性别、年龄、受教育程度、身体质量指数(body mass index, BMI)。收集临床资料:(1)急诊就诊的主要诊断,包括肺炎、慢性阻塞性肺疾病急性加重、慢性心力衰竭急性发作、急性脑卒中、急性冠脉综合征、脓毒症、其他;(2)慢性基础疾病,包括高血压、糖尿病、冠状动脉粥样硬化性心脏病、慢性心力衰竭、慢性肾脏病、慢性阻塞性肺疾病、脑卒中,其他(慢性肝脏疾病、肿瘤、免疫系统疾病等)。
1.2.2 实验室检查所有患者入院后24 h内采集空腹静脉血6 mL,检测血常规、生化指标、IL-6。同时,采集静脉血2 mL离心后血清放置-80 ℃储存,样本收集结束后统一应用酶联免疫吸附测定法检测血清SIRT-1水平。血常规应用迈瑞BC-5390全自动血液细胞分析仪,血生化指标应用奥林巴斯AU-680全自动生化分析仪,IL-6应用罗氏cobas e 602全自动电化学发光免疫分析仪,SIRT-1应用雷杜Rayto RT-6100酶标仪进行测定。
1.2.3 量表评定所有入选患者入院后72 h内采用营养风险筛查2002量表[8]进行营养风险评估,采用Barthel指数行日常生活能力评定;同时使用握力计测量握力(优势侧,测量2次,记录最高值),并完成Fried衰弱表型(frailty phenotype, FP)[9]评分,根据得分是否 > 2分,分为衰弱组和无衰弱组。
1.3 统计学方法采用SPSS 27.0, MedCalc 15.2, GraphPad Prism 9.4统计软件包进行数据分析及画图。采用Kolmogorov-Smirnov法对定量资料进行正态性检验,符合正态分布的以均数±标准差(x±s)表示,组间比较采用独立样本t检验;非正态分布的连续性变量、等级资料用中位数(四分位数)[M(Q1,Q3)]表示,采用Mann-Whitney U检验。无序分类资料以频数(%)表示,采用χ2检验。采用多因素Logistic回归方程分析衰弱的影响因素;采用基于似然比检验的逐步向前法筛选自变量,相对危险度用优势比(odds ratio, OR)和95% 置信区间(confidence interval, CI)表示。描绘受试者工作特征(receiver operating characteristic, ROC)曲线,并计算和比较ROC曲线下面积(area under the curve, AUC),以评价血清IL-6、SIRT-1对衰弱的预测能力。以P < 0.05为差异有统计学意义。
2 结果本研究筛选了北京博爱医院急诊科年龄≥60岁患者共420例,依据排除标准排除104例,最终入选研究对象316例。依据Fried FP标准,分为衰弱组156例,无衰弱组160例,衰弱患病率49.4%。患者急诊就诊的主要急性病构成比为:肺炎141例(44.6%)、慢性阻塞性肺疾病急性发作42例(13.3%)、心衰急性发作46例(14.6%)、急性脑卒中45例(14.2%)、急性冠脉综合征22例(7.0%)、脓毒症22例(7.0%)、其他疾病18例(5.7%),部分患者可能同时存在2种或以上急性病。
2.1 衰弱患者临床资料的单因素分析本研究首先对入选患者的一般资料、基础疾病、营养风险、Barthel指数和握力进行分析发现,与无衰弱组相比,衰弱组患者女性比例、年龄、冠状动脉粥样硬化性心脏病、慢性心力衰竭、慢性阻塞性肺疾病、慢性病≥3个占比及有营养风险比例更高(均P < 0.05);受教育水平、BMI、Barthel指数及握力更低(均P < 0.05),见表 1。
| 变量 | 总人数(n=316) | 衰弱组(n=156) | 无衰弱组(n=160) | 统计值 | P值 |
| 男性a | 164 (51.9) | 65 (41.7) | 99 (61.9) | 12.921 | < 0.001 |
| 年龄(岁) b | 80.0 (71.0, 85.0) | 84.0 (78.0, 87.0) | 77.0 (68.0, 83.0) | 4.836 | < 0.001 |
| 受教育水平b | 小学(小学, 高中) | 小学(文盲, 初中) | 初中(小学, 高中) | 4.065 | < 0.001 |
| BMI (kg/m2) c | 23.32±4.68 | 22.58±5.12 | 24.03±4.10 | 2.773 | 0.006 |
| 高血压a | 202 (63.9) | 99 (63.5) | 103 (64.4) | 0.029 | 0.866 |
| 糖尿病a | 122 (38.6) | 62 (39.7) | 60 (37.5) | 0.168 | 0.682 |
| CHDa | 123 (41.0) | 72(48.0) | 51 (34.0) | 6.077 | 0.014 |
| CHFa | 38 (12.0) | 26 (16.7) | 12 (7.5) | 6.274 | 0.012 |
| CKDa | 30 (9.5) | 19 (12.2) | 11 (6.9) | 2.587 | 0.108 |
| COPDa | 63 (19.9) | 39 (25.0) | 24 (15.0) | 4.948 | 0.026 |
| 脑卒中a | 67 (21.2) | 34 (21.8) | 33 (20.6) | 0.065 | 0.799 |
| 并存病≥3个a | 136 (43.0) | 76 (48.7) | 60 (37.5) | 4.055 | 0.044 |
| 营养风险a | 210 (66.5) | 122 (78.2) | 88 (55.0) | 19.080 | < 0.001 |
| Barthel指数b | 75.0 (40.0, 90.0) | 50.0 (25.0, 75.0) | 85.0 (70.0, 95.0) | 9.436 | < 0.001 |
| 握力(kg)b | 14.25 (8.40, 19.30) | 8.60 (6.80, 14.75) | 17.85 (11.10, 23.40) | 8.080 | < 0.001 |
| 注:BMI为身体质量指数,CHD为冠状动脉粥样硬化性心脏病,CHF为慢性心力衰竭,CKD为慢性肾脏病,COPD为慢性阻塞性肺疾病;a为例(%),b为M(Q1,Q3),c为x±s | |||||
本研究进一步对入选患者的实验室指标进行分析发现,与无衰弱组相比,衰弱组患者血红蛋白、白蛋白、前白蛋白水平更低(均P < 0.05);血清hs-CRP、IL-6、SIRT-1水平更高(均P < 0.05),见表 2。
| 变量 | 总人数(n=316) | 衰弱组(n=156) | 无衰弱组(n=160) | 统计值 | P值 |
| WBC (×109/L) a | 8.59 (6.09, 11.49) | 8.32 (6.30, 11.45) | 8.72 (5.89, 11.54) | 0.369 | 0.712 |
| HGB (g/L) b | 124.0±19.7 | 121.0±21.3 | 127.0±17.5 | 2.985 | 0.003 |
| PLT (×109/L) a | 177 (141, 226) | 176 (136, 239) | 178 (144, 223) | 0.111 | 0.912 |
| ALT (U/L) a | 14.9 (10.5, 22.2) | 14.6 (9.9, 21.0) | 15.0 (10.7, 22.6) | 0.502 | 0.615 |
| AST (U/L) a | 18.2 (12.9, 27.3) | 19.5 (13.5, 28.3) | 16.9 (12.6, 25.90) | 1.142 | 0.254 |
| ALB (g/L) b | 35.2±5.19 | 34.2±5.30 | 36.1±4.92 | 3.166 | 0.002 |
| PA (mg/L) a | 156 (104, 210) | 138 (94, 186) | 188 (112, 227) | 4.584 | < 0.001 |
| BUN (mmol/L) a | 7.50 (5.44, 10.75) | 7.98 (5.51, 12.47) | 7.10 (5.27, 8.93) | 1.765 | 0.077 |
| FBG (mmol/L) a | 6.51 (5.44, 8.46) | 6.67 (5.56, 8.56) | 6.28 (5.32, 8.35) | 1.277 | 0.201 |
| Scr (μmmol/L) a | 84.0 (68.4, 123.9) | 87.2 (66.6, 133.0) | 81.9 (69.1, 122.6) | 0.515 | 0.607 |
| UA (μmol/L) a | 327 (256, 429) | 331 (251, 453) | 325 (259, 426) | 0.356 | 0.722 |
| TG (mmol/L) a | 1.01 (0.77, 1.42) | 0.98 (0.78, 1.40) | 1.07 (0.76, 1.46) | 0.840 | 0.401 |
| TCH (mmol/L) a | 3.70 (3.02, 4.48) | 3.66 (2.98, 4.33) | 3.75 (3.07, 4.57) | 0.342 | 0.732 |
| HDL-c (mmol/L) a | 1.10 (0.91, 1.33) | 1.15 (0.91, 1.37) | 1.08 (0.90, 1.28) | 1.087 | 0.277 |
| LDL-c (mmol/L) a | 2.11 (1.62, 2.72) | 2.11 (1.62, 2.56) | 2.11 (1.62, 2.83) | 0.466 | 0.641 |
| HCY (μmol/L) a | 13.7 (10.3, 18.3) | 14.0 (10.1, 20.4) | 12.8 (10.4, 17.8) | 0.566 | 0.572 |
| hs-CRP (mg/dl) a | 2.23 (0.42, 8.72) | 3.57 (0.80, 9.13) | 0.85 (0.22, 7.75) | 3.021 | 0.003 |
| IL-6 (ng/L) a | 26.0 (11.4, 51.8) | 33.3 (13.0, 69.2) | 20.0 (9.2, 41.3) | 3.202 | 0.001 |
| SIRT-1 (μg/L) b | 9.48±1.54 | 9.98±1.23 | 8.98±1.65 | 6.163 | < 0.001 |
| 注:WBC为白细胞,HGB为血红蛋白,PLT为血小板,ALT为丙氨酸氨基转氨酶,AST为天门冬氨酸氨基转移酶,ALB为白蛋白,PA为前白蛋白,BUN为血尿素氮,FBG为空腹血糖,Scr为血肌酐,UA为尿酸,TG为甘油三酯,TCH为总胆固醇,HDL-c为高密度脂蛋白胆固醇,LDL-c为低密度脂蛋白胆固醇,HCY为同型半胱氨酸;hs-CRP为超敏C反应蛋白,DDIM为D-二聚体,IL-6为白细胞介素-6,SIRT-1为沉默信息调节因子-1;a为M(Q1,Q3),b为x±s | |||||
以Fried FP评定的衰弱为因变量,单因素分析差异有统计学意义的变量纳入多因素Logistic回归方程。调整性别、年龄、BMI、Barthel指数及握力后,血清IL-6(OR=1.006,95% CI: 1.001~1.011,P=0.036)、SIRT-1(OR=1.838,95% CI: 1.475~2.290,P < 0.001)水平较高均是衰弱的独立危险因素,见表 3。
| 影响因素 | B | SE. | Wald | P值 | OR | 95%CI |
| 女性 | 0.502 | 0.319 | 2.482 | 0.115 | 1.652 | 0.885~3.084 |
| 年龄(岁) | 0.023 | 0.018 | 1.764 | 0.184 | 1.024 | 0.989~1.060 |
| BMI (kg/m2) | -0.005 | 0.033 | 0.024 | 0.878 | 0.995 | 0.932~1.062 |
| Barthel指数 | -0.037 | 0.006 | 33.924 | < 0.001 | 0.964 | 0.952~0.976 |
| 握力(kg) | -0.110 | 0.023 | 22.820 | < 0.001 | 0.896 | 0.857~0.937 |
| IL-6 (ng/L) | 0.006 | 0.003 | 4.382 | 0.036 | 1.006 | 1.001~1.011 |
| SIRT-1 (μg/L) | 0.609 | 0.112 | 29.363 | < 0.001 | 1.838 | 1.475~2.290 |
| 常数 | -4.651 | 2.031 | 5.243 | 0.022 | 0.010 | |
| 注:BMI为身体质量指数,IL-6为白细胞介素-6,SIRT-1为沉默信息调节因子 | ||||||
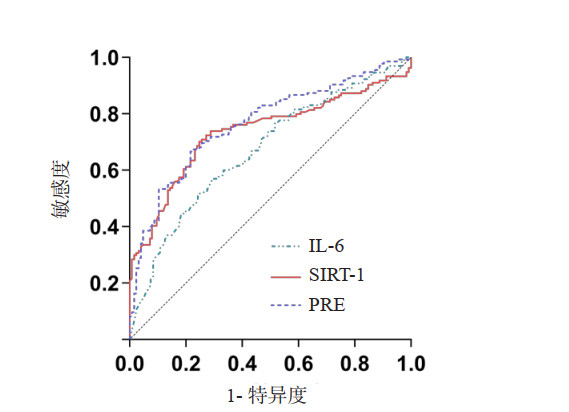
以Fried FP评定的衰弱为状态变量,血清IL-6、SIRT-1及二者联合应用Logistic回归方程得到的联合变量模型的预测值(predicted value, PRE)为检测变量,得到回归方程并绘制ROC曲线:Logit (P)=e﹣(0.006×IL-6+0.450×SIRT-1-4.552),见图 1。
|
| IL-6为白细胞介素-6,SIRT-1为沉默信息调节因子-1,PRE为IL-6和SIRT-1联合变量产生的预测值 图 1 血清IL-6、SIRT-1、联合变量预测衰弱的ROC曲线 Fig 1 ROC curves of serum IL-6, SIRT-1 and their combination predicting frailty |
|
|
笔者使用AUC评价血清IL-6、SIRT-1与二者联合变量模型对衰弱的预测效能,并以约登指数最大的点为界,计算最佳截断值、敏感度与特异度。AUC两两比较结果示,血清SIRT-1与IL-6对衰弱的预测能力差异无统计学意义(Z=1.303,P=0.192);联合变量模型的预测效能高于IL-6(Z=2.119,P=0.034)。见表 4。
| 变量 | AUC(95%CI) | 截断值 | 约登指数 | 敏感度 | 特异度 | Z值 | P值 |
| IL-6 (ng/L) | 0.671(0.604~0.738) | 33.8 | 0.277 | 0.708 | 0.569 | 5.025 | < 0.001 |
| SIRT-1 (μg/L) | 0.736(0.674~0.799) | 9.13 | 0.454 | 0.752 | 0.702 | 7.419 | < 0.001 |
| PRE | 0.765(0.707~0.823) | 0.44 | 0.502 | 0.776 | 0.726 | 9.645 | < 0.001 |
| 注:IL-6为白细胞介素-6,SIRT-1为沉默信息调节因子,PRE为联合变量预测值 | |||||||
衰弱是一种增龄相关的临床综合征,表现为机体生理储备和应激水平下降,对内源性或外源性打击的易损性升高,并导致跌倒、失能、死亡等不良结局风险增加[4, 10-14]。有关衰弱的研究主要集中于老年医学领域,现有的研究人群主要为社区和住院患者。随着人口老龄化进程加速,急诊科老年患者比例日益增加,老年急危重症将成为急诊医学一个新的重要领域[1]。美国国立卫生院老年研究所衰弱工作组在2017年召开的“将衰弱整合到临床实践”专题讨论会提出衰弱用于急诊、危重症患者等临床实践中[11]。本团队的前期前瞻性队列研究发现,衰弱与急诊老年患者预后(包括失能、机械通气、ICU再入院、死亡)呈独立相关[14-16]。衰弱在老年个体中存在明显的异质性[17],关注并早期识别老年衰弱,是急诊科医生面临的新挑战。
衰弱的生物学机制尚不清楚,免疫衰老、慢性炎症、线粒体功能障碍、氧化应激损伤、微生物群的变化及代谢功能紊乱等均参与了其过程[11],为其早期诊断及治疗决策带来了挑战[3, 12, 18]。确定特异敏感的生物学标志物,多维度早期识别衰弱并进行及时有效的干预,对改善不良健康结局至关重要[3, 11]。慢性炎症是衰弱发展的重要机制[4, 12],IL-6与衰弱的相关性已被多个研究报告[19-21]。SIRT-1是衰老相关代谢变化的关键调节因子,它通过调控下游靶点如PGC1α、FOXO、p53和NF-κB,在衰老和对热量限制的反应中发挥关键作用[7, 22-23]。动物模型中,由遗传或药物干预产生的SIRT-1活性的增加与衰老和代谢障碍的延迟发生有关。既往研究对SIRT-1在衰弱中的作用有不一致的报道。有学者认为,SIRT-1浓度随年龄增长而下降,在衰弱个体中下降更明显[23-24]。但CHAMP研究发现[6],SIRT-1水平低的老年男性更不易发生衰弱,随后的研究也表明,衰弱的老年男性血清SIRT-1诱导表达水平并不低[25]。Ma等[7]的研究发现,中国老年衰弱人群的血清SIRT-1水平明显高于健康人。这与既往动物模型中的结果以及对于Sirtuins生物功能的预期相矛盾。研究还发现,外周血SIRT-1水平与年龄呈正相关,与胰岛素和某些脂肪因子(如瘦素)水平呈正相关,与步行速度呈负相关;但与炎症指数评分、C-反应蛋白无相关性,这表明胰岛素和脂肪因子可能参与了衰弱的过程,而SIRT-1通过代谢调控对衰弱发挥作用。关于不同研究之间结果不一致性的解释,可能与不同的衰弱判定标准有关,SIRT-1的不同下游靶点也可能是原因之一,其病理生理学机制仍需进一步探索。本研究采用Fried FP标准在急诊科老年患者中评定衰弱,单因素及多因素分析结果均证实了高水平血清IL-6、SIRT-1与衰弱独立相关。同时发现,血清SIRT-1与IL-6对衰弱的预测能力相当。
本研究存在一定局限性。横断面研究的设计并不能解释循环IL-6、SIRT-1水平与衰弱之间的因果关系,且未进行连续监测分析其在衰弱患者中的变化趋势及与预后的关系,需要基于纵向数据的进一步研究。此外,病例来源于单中心,存在一定选择偏倚,样本量偏小,结果仍需后续研究重复验证。即使基于HL统计量的拟合优度检验提示本文Logistic回归方程较好拟合了原始数据(P > 0.2),但衰弱的影响因素众多,尚有许多因素未被纳入研究。
综上所述,血清IL-6、SIRT-1可作为衰弱的生物标志物,二者联合可以提高预测的准确性。繁忙的急诊科缺乏老年医学专家,在危重患者中开展衰弱筛查的难度较大,检测血清IL-6、SIRT-1可帮助临床医生早期发现和预防老年人衰弱,指导医疗决策制定,优化医疗资源配置,以期减少衰弱相关的不良结局,提高老年人生活质量,促进健康老龄化。
利益冲突 所有作者声明无利益冲突
作者贡献声明 刘慧珍:获取研究经费、实施研究、文章撰写;王娜:研究设计、行政支持;商娜:数据分析;李俊玉、刘小蒙:数据收集及整理;郭树彬:实验指导、支持性贡献;腾飞:对文章内容做批评性审阅、统计学分析、文章修改
| [1] | 温伟, 张新超, 王旭涛. 老年急危重症- 急诊医学一个新的重要领域[J]. 中华急诊医学杂志, 2021, 30(4): 383-386. DOI:10.3760/cma.j.issn.1671-0282.2021.04.001 |
| [2] | 周雅茹, 马丽娜. 《健康老龄化的十年∶基线报告》解读[J]. 中华老年医学杂志, 2022, 41(12): 1405-1409. DOI:10.3760/cma.j.issn.0254-9026.2022.12.001 |
| [3] | Pan YM, Ji T, Li Y, et al. Omics biomarkers for frailty in older adults[J]. Clin Chim Acta, 2020, 510: 363-372. DOI:10.1016/j.cca.2020.07.057 |
| [4] | 苏琳, 郝秋奎, 杨颖, 等. 老年人衰弱与血清炎性因子和衰老因子的相关性[J]. 中华老年医学杂志, 2018, 37(5): 579-583. DOI:10.3760/cma.j.issn.0254-9026.2018.05.024 |
| [5] | Imai S, Armstrong CM, Kaeberlein M, et al. Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase[J]. Nature, 2000, 403(6771): 795-800. DOI:10.1038/35001622 |
| [6] | Le Couteur DG, Benson VL, McMahon AC, et al. Determinants of serum-induced SIRT1 expression in older men: the CHAMP study[J]. J Gerontol A Biol Sci Med Sci, 2011, 66(1): 3-8. DOI:10.1093/gerona/glq158 |
| [7] | Ma L, Niu H, Sha G, et al. Serum SIRT1 is associated with frailty and adipokines in older adults[J]. J Nutr Health Aging, 2019, 23(3): 246-250. DOI:10.1007/s12603-018-1149-7 |
| [8] | Kondrup J, Rasmussen HH, Hamberg O, et al. Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials[J]. Clin Nutr, 2003, 22(3): 321-336. DOI:10.1016/s0261-5614(02)00214-5 |
| [9] | Fried LP, Tangen CM, Walston J, et al. Frailty in older adults: evidence for a phenotype[J]. J Gerontol A Biol Sci Med Sci, 2001, 56(3): M146-M156. DOI:10.1093/gerona/56.3.m146 |
| [10] | 中华医学会老年医学分会, 《中华老年医学杂志》编辑委员会. 老年人衰弱预防中国专家共识(2022)[J]. 中华老年医学杂志, 2022, 41(5): 503-511. DOI:10.3760/cma.j.issn.0254-9026.2022.05.001 |
| [11] | 马丽娜, 陈彪. 老年人衰弱综合征的研究现状及发展趋势[J]. 中华老年医学杂志, 2020, 39(4): 369-372. DOI:10.3760/cma.j.issn.0254-9026.2020.04.001 |
| [12] | 潘一鸣, 李耘, 马丽娜. 代谢相关生物学标志物在老年人衰弱中的研究进展[J]. 基础医学与临床, 2021, 41(3): 428-432. DOI:10.16352/j.issn.1001-6325.2021.03.022 |
| [13] | 马丽娜. 老年衰弱综合征的发病机制[J]. 中华老年医学杂志, 2021, 40(3): 379-382. DOI:10.3760/cma.j.issn.0254-9026.2021.03.023 |
| [14] | 刘慧珍, 郭树彬, 商娜, 等. 衰弱、血清C-末端聚集蛋白与老年急性冠脉综合征患者预后的相关性研究[J]. 中华老年医学杂志, 2024, 43(2): 192-197. DOI:10.3760/cma.j.issn.0254-9026.2024.02.008 |
| [15] | Liu H, Shang N, Chhetri JK, et al. A frailty screening questionnaire (FSQ) to rapidly predict negative health outcomes of older adults in emergency care settings[J]. J Nutr Health Aging, 2020, 24(6): 627-633. DOI:10.1007/s12603-020-1374-8 |
| [16] | Shang N, Liu HZ, Wang N, et al. Comparison of three frailty screening instruments for prediction of adverse outcomes among older adults in the emergency department[J]. Geriatr Gerontol Int, 2022, 22(10): 851-856. DOI:10.1111/ggi.14469 |
| [17] | 郭雁飞, 阮晔, 孙双圆, 等. 中国50岁及以上人群衰弱轨迹的研究[J]. 中华流行病学杂志, 2022, 43(11): 1711-1716. DOI:10.3760/cma.j.cn112338-20220528-00477 |
| [18] | Niebla-Cárdenas A, Bareke H, Juanes-Velasco P, et al. Translational research into frailty from bench to bedside: Salivary biomarkers for inflammaging[J]. Exp Gerontol, 2023, 171: 112040. DOI:10.1016/j.exger.2022.112040 |
| [19] | 渠吉皊, 沈易静, 侯苹, 等. 白细胞介素-6与衰弱的相关性meta分析[J]. 国际医药卫生导报, 2021, 27(6): 802-806. DOI:10.3760/cma.j.issn.1007-1245.2021.06.004 |
| [20] | 施红, 孟丽, 石婧, 等. 老年人衰弱与血液生物指标的关系研究[J]. 中华老年医学杂志, 2018, 37(12): 1383-1386. DOI:10.3760/cma.j.issn.0254-9026.2018.12.022 |
| [21] | Gómez-Rubio P, Trapero I, Cauli O, et al. Salivary IL-6 concentration is associated with frailty syndrome in older individuals[J]. Diagnostics, 2022, 12(1): 117. DOI:10.3390/diagnostics12010117 |
| [22] | Sinclair DA, Guarente L. Small-molecule allosteric activators of sirtuins[J]. Annu Rev Pharmacol Toxicol, 2014, 54: 363-380. DOI:10.1146/annurev-pharmtox-010611-134657 |
| [23] | Baur JA, Ungvari Z, Minor RK, et al. Are sirtuins viable targets for improving healthspan and lifespan?[J]. Nat Rev Drug Discov, 2012, 11(6): 443-461. DOI:10.1038/nrd3738 |
| [24] | Zhong Y, Chen AF, Zhao J, et al. Serum levels of cathepsin D, sirtuin1, and endothelial nitric oxide synthase are correlatively reduced in elderly healthy people[J]. Aging Clin Exp Res, 2016, 28(4): 641-645. DOI:10.1007/s40520-015-0472-7 |
| [25] | Razi S, Cogger VC, Kennerson M, et al. SIRT1 polymorphisms and serum-induced SIRT1 protein expression in aging and frailty: the CHAMP study[J]. J Gerontol A Biol Sci Med Sci, 2017, 72(7): 870-876. DOI:10.1093/gerona/glx018 |
 2024, Vol. 33
2024, Vol. 33