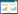2. 南方医科大学第十附属医院(东莞市人民医院)重症医学科,东莞 523000
免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)作为抗肿瘤药物在国内应用日趋增多,免疫相关不良反应(immunerelated adverse events, irAEs)报道逐年攀升[1-2]。本文报道1例非小细胞肺癌患者,接受ICIs治疗后出现心肌炎、心源性休克、肌炎,合并噬血细胞综合征。经成人体外心肺复苏(extracorporeal cardiopulmonary resuscitation, ECPR)、糖皮质激素、血浆置换等治疗,救治成功。ICIs临床应用可能诱发多系统免疫相关不良反应,早期诊断、规范诊治,降低病死率。
1 病例资料患者女,51岁。因“肺癌综合治疗3年余,气促、乏力1周”于2021年12月16日入院。2018年9月19日外院行肺癌切除术,术后病理示低分化鳞状细胞癌。2021年10月外院PET-CT示肺癌复发,11月25日在外院行第2周期纳武利尤单抗(200 mg静滴),完善心肌损伤标志物未见异常,超声心动图示射血分数(ejection fractions, EF)73 %,未见室壁运动异常。用药后14 d出现呼吸急促、疲乏,血压降至92/43 mmHg(1 mmHg=0.133 kPa),复查肌酸激酶(creatine kinase, CK)811.6 U/L(参考值< 200 U/L),肌酸激酶同工酶(creatine kinase-MB, CK-MB)27 U/L(参考值< 25 U/L),肌红蛋白(myoglobin, Myo)211.67 ng/mL(参考值< 65.8 ng/mL),高敏肌钙蛋白Ⅰ(high-sensitivity cardiac troponin Ⅰ, hsTnI)3 510 pg/mL(参考值< 17.5 pg/mL)偏高。心电图示窦性心动过速,心脏超声示心肌收缩明显减弱,并出现心脏骤停,考虑ICIs相关心肌炎、心源性休克,经ECPR治疗后患者恢复自主循环,转至本院重症监护室治疗。既往否认心脏病、高血压、糖尿病、自身免疫性疾病史,否认近期感冒病史。
体格检查:体温36.5 ℃,心率122次/min,呼吸20次/min,血压130/101 mmHg,双下肺可闻及湿性啰音,心律齐,各瓣膜听诊区无杂音。四肢肌力Ⅰ级。实验室检查:hsTnI 6 567.2 pg/mL,CK-MB 61.4 U/L,CK 5 491 U/L,Myo > 3 769 ng/mL,B型利钠肽(B-type natriuretic peptide, BNP) > 5 009 pg/mL(参考值< 100 pg/mL),自身免疫抗体示:抗核糖核蛋白抗体、抗干燥综合征A型抗体阳性;抗Sm(Smith)抗体、抗环瓜氨酸肽抗体、抗干燥综合征B型抗体、抗中性粒细胞胞浆抗体、抗拓扑异构酶-1抗体、抗多发性肌炎/硬皮病复合物抗体、抗组氨酰tRNA合成酶抗体阴性。超声心动图示左心室壁运动明显减弱,EF 21%。心电图:窦性心律,未见特异性ST-T改变。胸片示双肺多发渗出病变。诊断ICIs相关心肌炎、肌炎,考虑患者病情危重,未行心脏MRI、心内膜心肌活检,行腓肠肌活检(图 1)。入院予以静脉-动脉体外膜氧合(venous-arterial extracorporeal membrane oxygenation, V-A ECMO)支持(转速3 500 r/min,流量2.80 L/min)、静脉注射甲泼尼龙(0.5 g/d,持续3 d)、免疫球蛋白(10 g/d,持续3 d)、血浆置换(持续3 d)、阿巴西普(250 mg,1次)、抗感染、维持内环境稳定等治疗,3 d后复查CK、CK-MB、hsTnI明显下降,激素调整为0.25 g/d(持续5 d)。ECMO支持110 h患者循环稳定,心功能逐渐恢复,顺利撤离ECMO。第6天起患者反复发热,热峰39.0℃,降钙素原0.91 ng/mL、白介素-6 1.30 pg/mL,胸片示两肺病变较前减轻,静脉导管和外周血培养阴性,血红蛋白67 g/L,血小板15×109/L,纤维蛋白原0.94 g/L,甘油三酯4.19 mmol/L,铁蛋白1 405 μg/L(参考值< 306.8 μg/L),NK细胞活性低,可溶性白细胞介素-2受体sCD25 1 028 U/mL,抗人球蛋白试验(Coomb' s)试验阴性,骨髓穿刺活检见噬血现象(图 2),考虑ICIs相关噬血细胞综合征,给予激素(0.12 g/d,连用3 d)、免疫球蛋白(5 g/d,连用3 d)及血浆置换(连用3 d)、输注成分血治疗,患者体温下降至正常范围,复查血红蛋白、血小板恢复正常。后续患者病情好转出院。
|
| 肌组织见散在坏死(图A中三角形区域)、钙化(图B中三角形区域)、空泡变性(图C中三角形区域), 部分肌纤维萎缩(图A中三角形区域)。局灶间质见中性粒细胞及淋巴细胞浸润(图C及图D中红色箭头区域) 图 1 腓肠肌肌组织病理(苏木精-伊红染色, ×200) |
|
|
|
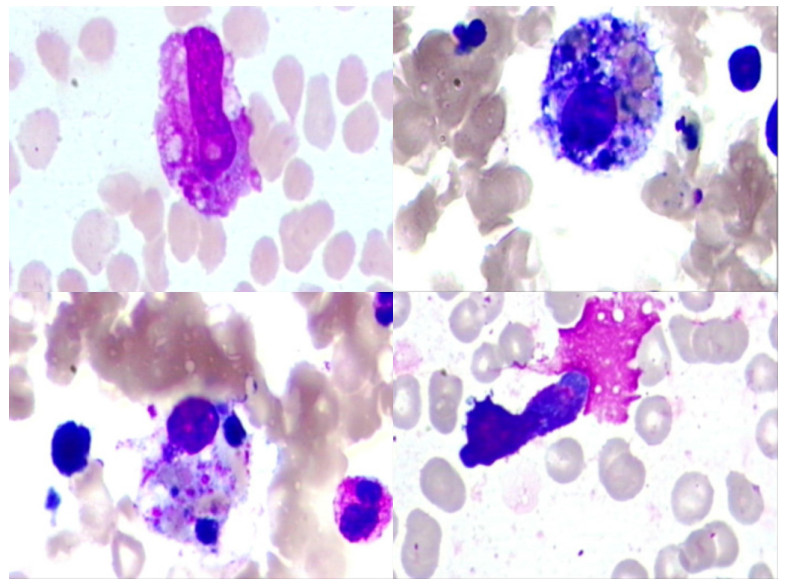
| 可见噬血细胞,偶见异型淋巴细胞 图 2 骨髓细胞形态学检查(瑞氏染色, ×1 000) |
|
|
ICIs包括程序性死亡受体1(PD-1)/程序性死亡受体配体1(PD-L1)抑制剂,细胞毒性T淋巴细胞相关抗原4(CTLA-4)抑制剂,通过阻断T淋巴细胞表达的抑制剂受体及相关配体的相互作用,重新激活机体抗肿瘤细胞的免疫应答,发挥抗肿瘤作用,有助于改善肿瘤生存者的长期预后。ICIs导致的irAEs可引起机体多器官功能障碍[3],常见累及皮肤、胃肠道、内分泌系统。而罕见的irAEs如心肌炎、肌炎、血液毒性反应等,发病率低[4]。2018年一项评估ICIs与心脏毒性之间的研究显示,免疫不良事件包括心肌炎、心包炎、心律失常以及心力衰竭等,其中心肌炎致死率50%[5]。
ICIs相关心肌炎[6]发病机制复杂,可导致如心律失常、暴发性心肌炎、心源性休克等,诊断金标准是心内膜心肌活检,典型表现为淋巴细胞和巨噬细胞浸润以及心肌纤维化,但可以结合心肌损伤标志物、心脏影像学、临床症状协助诊断。
值得注意的是,美国临床肿瘤学会(ASCO)/NCCN指南[2, 7]指出,ICIs相关的毒性分级为:G1为1级毒性(轻度),建议继续接受ICIs治疗;G2为2级毒性(中度),暂停ICIs治疗,给予小剂量的糖皮质激素治疗,在症状和(或)实验室检测指标恢复至1级或1级以下时建议维持ICIs治疗;G3为3级毒性(重度),G4为4级毒性(危及生命),对于3级甚至4级毒性,建议永久停用ICIs治疗,尽快给予大剂量糖皮质激素治疗,必要时可以联合其他免疫抑制剂,包括英夫利单抗、吗替麦考酚酯或抗胸腺细胞免疫球蛋白等,以及早期的心脏移植,减少心血管相关免疫不良事件发生。
此外,ICIs相关性心肌炎容易合并其他系统irAE[8-9],如神经系统、肌肉骨骼系统等。Allenbach等[9]发现ICIs相关性肌炎发生率 < 1%,相比非心肌炎患者,合并重症心肌炎的免疫性肌炎患者病死率 > 50%。一项纳入9 088例接受了至少一次ICIs治疗的肿瘤患者单中心回顾性研究[10],临床数据显示36例(0.4%)患者发生了免疫检查点抑制剂相关肌炎,中位发生时间为接受ICIs治疗后的27(7, 161)d。相关文献报道,ICIs相关性心肌炎合并肌炎治疗方案[11-12]以糖皮质激素为核心,推荐联合其他免疫抑制剂如阿巴西普、免疫球蛋白或血浆置换等。本例患者使用第2次ICIs后14 d出现呼吸急促、疲乏,并出现心脏骤停,hsTnI、CK-MB、CK、Myo、BNP骤升,炎症指标不高,超声心动图未见节段性室壁运动异常,行腓肠肌活检(图 1),血培养阴性。排除脓毒症心肌病、心肌梗死,诊断ICIs相关心肌炎、心源性休克、肌炎。患者通过ECPR、糖皮质激素、免疫球蛋白、阿巴西普、血浆置换等治疗,复查心肌损伤标志物明显下降,循环稳定。
既往文献报道ICIs相关血液毒性事件[13]发生率为0.5%~3.6%,较为罕见,包括自身免疫性溶血性贫血、免疫性血小板减少症、再生障碍性贫血以及噬血细胞综合征等,其临床表现缺乏特异性,发病机制复杂,病因仍未完全阐明。
噬血细胞综合征又称噬血细胞性淋巴组织细胞增生症(hemophagocytic lymphohistiocytosis, HLH),是一种免疫过度激活介导的严重炎症反应综合征[14]。一项来源于VigiBase数据库的临床回顾性分析显示,168例ICIs血液毒性事件的发病时间40(3, 405)d,其中HLH(26例)发生较早,接受ICIs治疗后中位时间26 d,病死率高达23%[15]。
参考HLH-2004诊断标准[16],本例患者病程中反复发热,血细胞减少、高甘油三酯血症、低纤维蛋白原血症、骨髓穿刺活检见噬血现象、NK细胞活性低、铁蛋白水平升高。感染性病因可能性低,考虑HLH与免疫检查点抑制剂相关。患者通过糖皮质激素、免疫球蛋白、血浆置换等治疗,体温逐渐下降至正常范围,血细胞(血红蛋白、血小板)升至正常范围。
综上所述,ICIs诱发的免疫相关心肌炎、肌炎和噬血细胞综合征发生率低,早期诊断困难,病情进展快,病死率高,临床医师需及时识别及处理。
利益冲突 所有作者声明无利益冲突
| [1] | Hargadon KM, Johnson CE, Williams CJ. Immune checkpoint blockade therapy for cancer: an overview of FDA-approved immune checkpoint inhibitors[J]. Int Immunopharmacol, 2018, 62: 29-39. DOI:10.1016/j.intimp.2018.06.001 |
| [2] | Brahmer JR, Lacchetti C, Schneider BJ, et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: American society of clinical oncology clinical practice guideline[J]. J Clin Oncol, 2018, 36(17): 1714-1768. DOI:10.1200/JCO.2017.77.6385 |
| [3] | Ramos-Casals M, Brahmer JR, Callahan MK, et al. Immune-related adverse events of checkpoint inhibitors[J]. Nat Rev Dis Primers, 2020, 6(1): 38. DOI:10.1038/s41572-020-0160-6 |
| [4] | Wang DY, Salem JE, Cohen JV, et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis[J]. JAMA Oncol, 2018, 4(12): 1721-1728. DOI:10.1001/jamaoncol.2018.3923 |
| [5] | Salem JE, Manouchehri A, Moey M, et al. Cardiovascular toxicities associated with immune checkpoint inhibitors: an observational, retrospective, pharmacovigilance study[J]. Lancet Oncol, 2018, 19(12): 1579-1589. DOI:10.1016/S1470-2045(18)30608-9 |
| [6] | Lehmann LH, Cautela J, Palaskas N, et al. Clinical strategy for the diagnosis and treatment of immune checkpoint inhibitor-associated myocarditis: a narrative review[J]. JAMA Cardiol, 2021, 6(11): 1329-1337. DOI:10.1001/jamacardio.2021.2241 |
| [7] | Schneider BJ, Naidoo J, Santomasso BD, et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: ASCO guideline update[J]. J Clin Oncol, 2021, 39(36): 4073-4126. DOI:10.1200/JCO.21.01440 |
| [8] | Pathak R, Katel A, Massarelli E, et al. Immune checkpoint inhibitor-induced myocarditis with Myositis/myasthenia gravis overlap syndrome: a systematic review of cases[J]. Oncologist, 2021, 26(12): 1052-1061. DOI:10.1002/onco.13931 |
| [9] | Allenbach Y, Anquetil C, Manouchehri A, et al. Immune checkpoint inhibitor-induced myositis, the earliest and most lethal complication among rheumatic and musculoskeletal toxicities[J]. Autoimmun Rev, 2020, 19(8): 102586. DOI:10.1016/j.autrev.2020.102586 |
| [10] | Aldrich J, Pundole X, Tummala S, et al. Inflammatory Myositis in cancer patients receiving immune checkpoint inhibitors[J]. Arthritis Rheumatol, 2021, 73(5): 866-874. DOI:10.1002/art.41604 |
| [11] | Curigliano G, Lenihan D, Fradley M, et al. Management of cardiac disease in cancer patients throughout oncological treatment: ESMO consensus recommendations[J]. Ann Oncol, 2020, 31(2): 171-190. DOI:10.1016/j.annonc.2019.10.023 |
| [12] | Salem JE, Allenbach Y, Vozy A, et al. Abatacept for severe immune checkpoint inhibitor-associated myocarditis[J]. N Engl J Med, 2019, 380(24): 2377-2379. DOI:10.1056/NEJMc1901677 |
| [13] | Michot JM, Lazarovici J, Tieu A, et al. Haematological immune-related adverse events with immune checkpoint inhibitors, how to manage?[J]. Eur J Cancer, 2019, 122: 72-90. DOI:10.1016/j.ejca.2019.07.014 |
| [14] | 中国医师协会血液科医师分会, 中华医学会儿科学分会血液学组, 噬血细胞综合征中国专家联盟. 中国噬血细胞综合征诊断与治疗指南(2022年版)[J]. 中华医学杂志, 2022, 102(20): 1492-1499. DOI:10.3760/cma.j.cn112137-20220310-00488 |
| [15] | Davis EJ, Salem JE, Young A, et al. Hematologic complications of immune checkpoint inhibitors[J]. Oncologist, 2019, 24(5): 584-588. DOI:10.1634/theoncologist.2018-0574 |
| [16] | La Rosée P, Horne A, Hines M, et al. Recommendations for the management of hemophagocytic lymphohistiocytosis in adults[J]. Blood, 2019, 133(23): 2465-2477. DOI:10.1182/blood.2018894618 |
 2024, Vol. 33
2024, Vol. 33