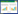新生儿急性呼吸窘迫综合征(neonatal acute respiratory distress syndrome, NARDS)作为新生儿科常见的危重症, 具有较高的病死率和致残率,该病的病理生理过程涉及较多复杂的炎性反应, 且后期常伴多种合并症, 治疗效果不理想[1]。NARDS生物学和临床证据均证实, 围生期继发性严重肺损伤与ARDS存在相同点, 但由于新生儿在肺部发育、免疫功能等方面的特殊性可能导致NARDS在病因、临床表现、治疗及预后方面均不同于儿童和成年人时期的ARDS患者[2]。该起因复杂,发病的病理生理机制也各不相同,常伴有急性炎症性肺损伤,且无论肺内或肺外因素均可以触发。微小RNA(microRNAs, miRNAs)是一类长度约为18~24个核苷酸的短小的非编码单链RNA, 通过负性调控基因表达在各种细胞的生理过程中起主要作用[3]。有研究数据显示,miRNA在肺器官的正常发育中发挥着重要作用,由于其靶向的性质,其中某些miRNA甚至可以起到限制损伤和促进修复的双重作用,因为它们除了调节肺部修复活性外还具有抗炎特性,可减少继发感染所造成的损害[4],这引起了大家对miRNA在肺部疾病中的广泛关注。既往研究发现通过检测NARDS患儿血清中miR-34a呈高表达,并且随病情程度的加重而增高[5]。
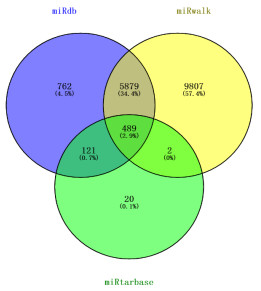
为了进一步探寻miR-34a在NARDS中的调控机制,通过大量的查阅文献,同时采用生物信息学分析,对miR-34a潜在的作用靶点进行预测,通过miRdb、miRwalk、miRTarBase三种在线软件预测miR-34a的靶基因,利用venny2.0在线软件取交集得到489个基因,最终确定miR-34a的靶基因集合范围(见图 1)。利用在线数据库String 11.5查询获得所预测靶基因集合编码蛋白质之间的关系并将所得数据导入Cytoscape 3.9.0软件,对结果进行可视性分析得到蛋白质互作网络图(见图 2)。发现TNF-ɑ的编码蛋白质在整个蛋白质互作网络中具有较强的互作性,说明miR-34a对TNF-ɑ可能存在一定的调控作用。
|
| 图 1 miR-34a的预测靶基因 Fig 1 Predicted target genes of miR-34a |
|
|
|
| 图 2 miR-34a的蛋白质互作网络图 Fig 2 Protein interaction network diagram of miR-34a |
|
|
本研究通过检测不同时间段NARDS新生大鼠肺组织中miRNA-34a的表达变化情况,期望发现miR-34a与TNF-α的相关性,拟探讨miR-34a、TNF-α在NARDS发病机制中的作用,为临床上NARDS的诊断和治疗提供新的提供新的参考依据和策略。
1 材料与方法 1.1 主要试剂LPS溶液(上海生物科技有限公司),10%水合氯醛(四川佰春科技有限责任公司),4%多聚甲醛(上海钰博生物科技有限公司)、二甲苯(武汉九逸化工有限公司)、梯度酒精(武汉九逸化工有限公司)、中性树胶(武汉卡诺斯科技有限公司)、mRNA反转录试剂盒(杭州爱津生物技术有限公司)、mRNA荧光定量PCR试剂盒(上海康朗生物科技有限公司)、无水乙醇、BCA蛋白浓度测定试剂盒(武汉伊莱瑞特生物科技股份有限公司)、大鼠TNF-αELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司)等。
1.2 实验动物分组Sprague-Dawley (SD)孕鼠30只,自由饮食及饮水, 本实验经内蒙古医科大学伦理委员会批准,动物处置方法符合动物伦理学。建模前12 h禁食,孕鼠生产后选取新生7日龄SD大鼠80只,雌雄各半,按随机数字法分为实验组和对照组,每组10只,设立3 h、6 h、12 h、24 h四个时相组。每只大鼠采用腹腔内注射10%水合氯醛进行麻醉,剂量为(4 mg/kg)。给予实验组腹腔内注射LPS溶液4 mL/g(LPS 0.004 mg溶于2 mL等渗Nacl溶液中),给予对照组腹腔内注射等渗Nacl溶液。观察其一般情况、记录呼吸频率。实验组即对照组建立完场后,分别于上述时间点采集肺组织标本,右肺的膈叶和副叶测定肺湿/干重(W/D) 值, 右肺组织的尖叶和心叶放置于在-80℃冰箱中保存备用。4%多聚甲醛固定左肺2 d后进行HE染色,光学显微镜下观察肺组织的病理变化并作肺损伤病理评分。
1.3 肺组织大体观察及病理损伤评分取出双侧肺脏,行肺组织大体观察(包括表面色泽、体积、表面及切面有无充血渗出等病理改变),取左肺组织,经固定、脱水、包埋、切片、HE染色后,光镜进行肺组织病理学观察并依据标准作肺损伤病理评分。
1.4 测定肺湿干比重取右肺的膈叶和副叶测定称湿重,置恒温箱(温度条件为60°),1 d后再称干重,通过计算W/D比值。进一步评判肺组织水肿程度。
1.5 MicroRNA的提取、逆转录及qRT-PCR利用TRIzol方法从准备好的冻存组织中提取RNA,反转录,确定具体引物序列并配制相应的qRT-PCR反应体系后进行miR-34a表达水平的检测,最后结果采用公式2-ΔΔCt计算。
1.6 ELISA检测TNF-αLISA检测肺组织匀浆上清液中TNF-α浓度, 操作步骤应严格遵守试剂盒说明书。
1.7 统计学方法文章中的图形制作使用Graph Pad Prism 7软件进行,使用SPSS 22.0软件进行实验数据统计学分析,经检验,所有计量资料均符合正态分布,故计量资料均采用均数±标准差(x±s)的方式表示,两组间样本均数比较采用成组t检验, 多组间均数比较采用单因素方差分析。计数资料以构成比(%)表示,采用χ2检验进行比较。检验水准为α=0.05,以P < 0.05为差异有统计学意义,分析实验数据的相关性时采用Pearson相关分析。
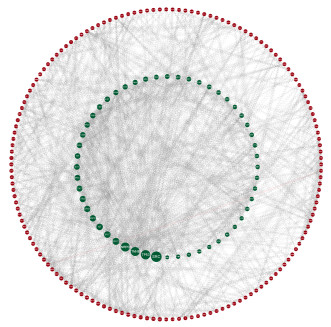
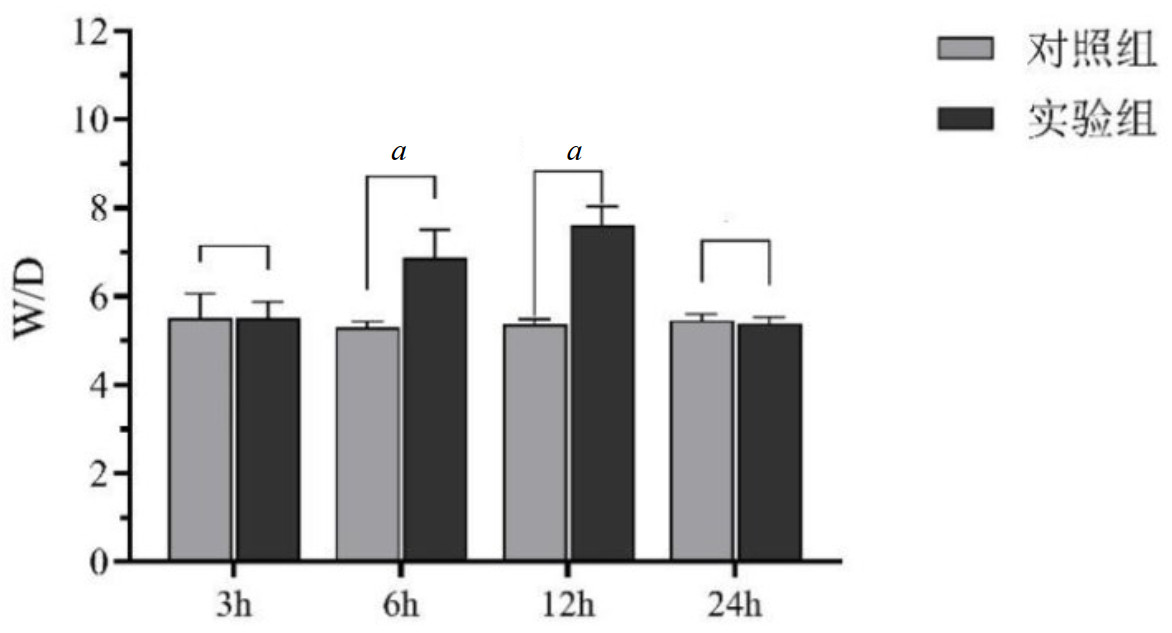
2 结果 2.1 肺W/D值实验组及对照组肺W/D值在实验进行6 h、12 h的大鼠肺W/D值较对照组明显升高, 各组比较差异有统计学意义。而3 h与24 h时肺组织W/D值差异无统计学意义(P>0.05)。提示给药后ARDS所致得肺水肿在最初3 h不明显,6 h、12 h肺组织水肿明显,而24 h后肺水肿程度减轻,见图 3。
|
| 图 3 a为P < 0.05不同时间点对照组与实验组大鼠肺W/D比值比较 Fig 3 Comparison of lung W/D ratio between control group and experimental group at different time points |
|
|
肺组织石蜡切片HE染色显示, 对照组大鼠肺泡结构完整, 肺泡腔清晰,肺泡壁无充血,未见渗出。实验组呈弥漫性改变, 肺泡膨胀不全、肺泡出现融合或塌陷,肺泡腔内可见渗出液,肺间质红白细胞浸润及出血,且随时间增加而加重。见图 4。
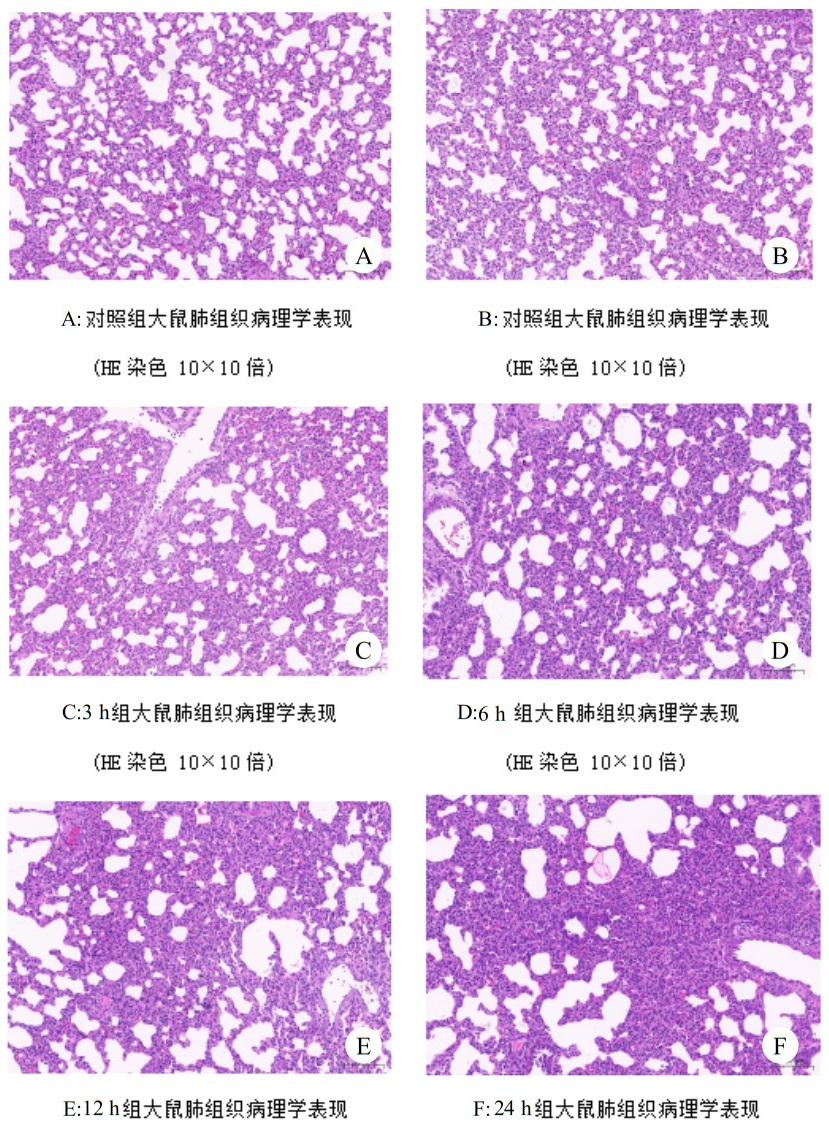
|
| 图 4 显微镜下肺组织病理切片 Fig 4 Pathological section of lung tissue under microscope |
|
|
实验组各时相组肺病理损伤评分如下。LPS-3 h组(1.35±0.59);LPS-6 h组(2.00±0.73);LPS-12 h组(3.10±0.72);LPS-3 h组(5.20±0.89),差异有统计学意义(P<0.05),且实验组的各时相组进行组间比较,差异有统计学意义(P<0.05)。可见,随着时间的延长,实验组各时相组新生大鼠肺组织的肺损伤病理评分逐渐增加,肺损伤的程度不断加重,呈正相关,见图 5。
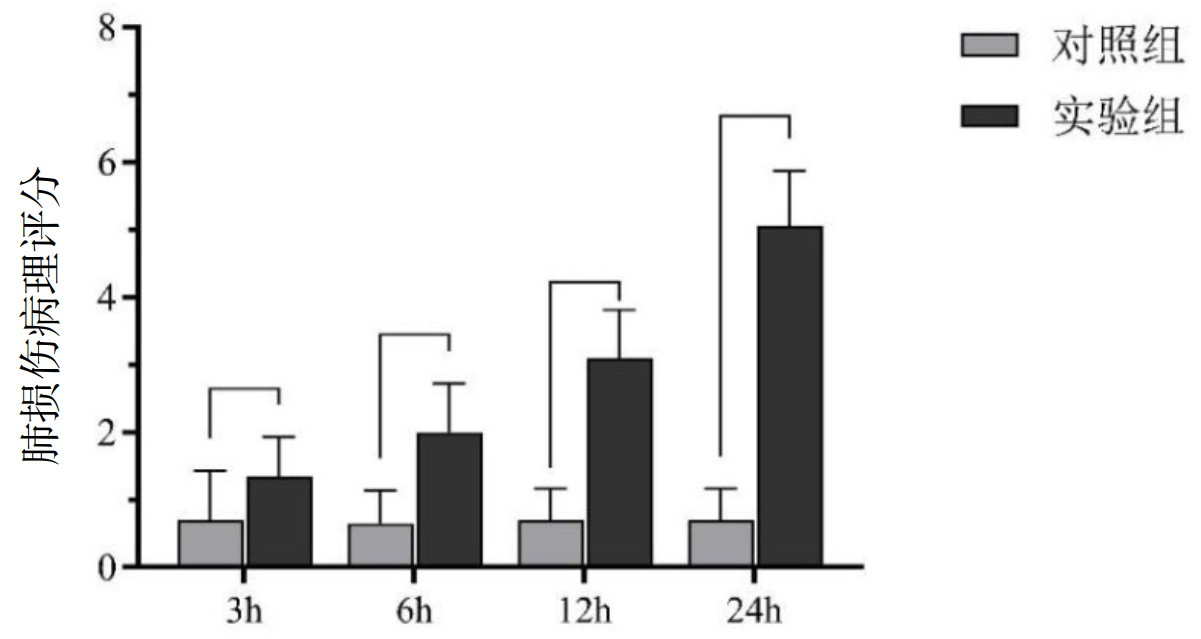
|
| 图 5 不同时间点两组大鼠肺损伤病理评分 Fig 5 Pathological scores of lung injury in two groups at different time points |
|
|
与对照组相比,结果显示,实验组四个时间点鼠肺组织miR-34a表达水平呈递增趋势[(2.01±0.17),(2.85±0.27),(4.20±0.17),(5.84±0.13)]。各组比较, 差异有统计学意义(F=787.652, P<0.05),大鼠肺组织miR-34a表达随LPS处理时间的延长而表达增加, 其中致伤后的24 h组表达最高。见图 6。
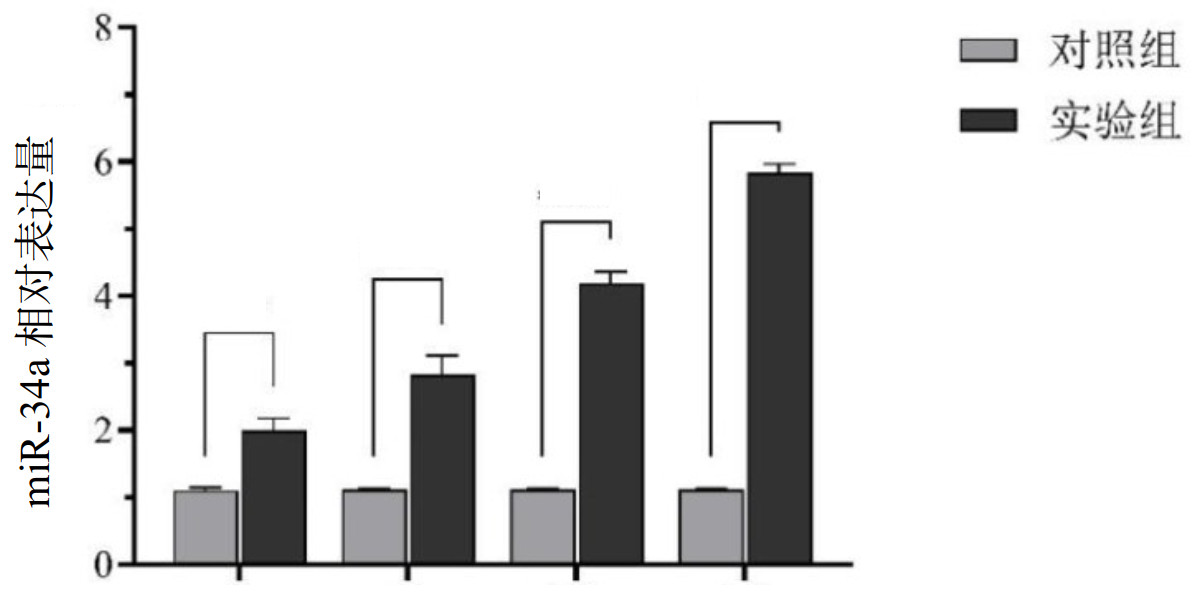
|
| 图 6 不同时间点对照组与实验组大鼠肺组织miR-34a的表达比较 Fig 6 Comparison of miR-34a expression in the lung tissues of the control group and the experimental group at different time points |
|
|
与对照组相比实验组的3 h、6 h、12 h、24 h的肺组织中的TNF-α浓度均升高(21.59±0.81,85.68±2.04,167.85±2.36,102.42±1.40),各组比较差异有统计学意义(F=1171.6, P<0.05), 其中在12 h达到表达高峰。见图 7。
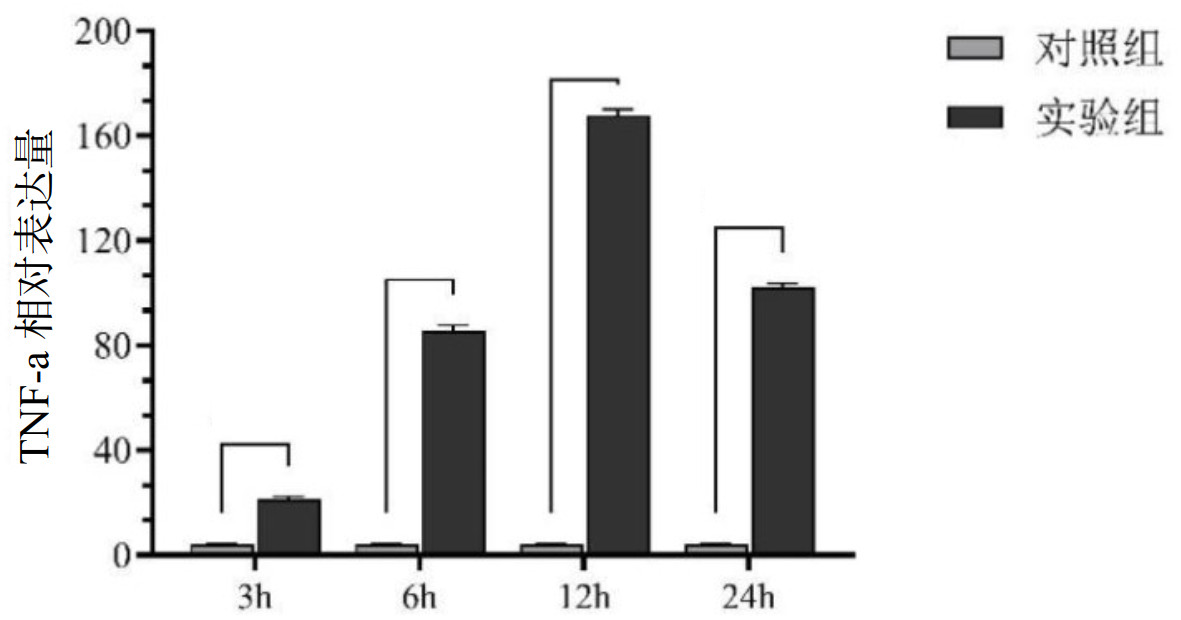
|
| 图 7 不同时间点对照组与实验组大鼠肺组织TNF-ɑ的表达比较 Fig 7 Comparison of TNF-ɑ expression in the lung tissues of the control group and the experimental group at different time points |
|
|
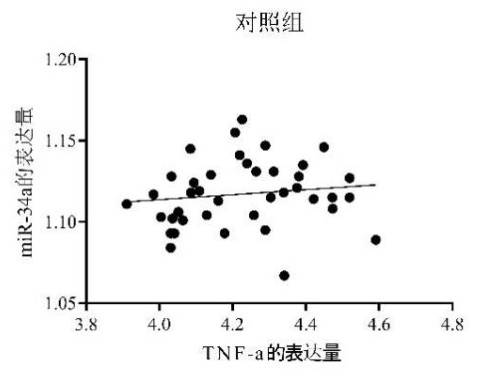
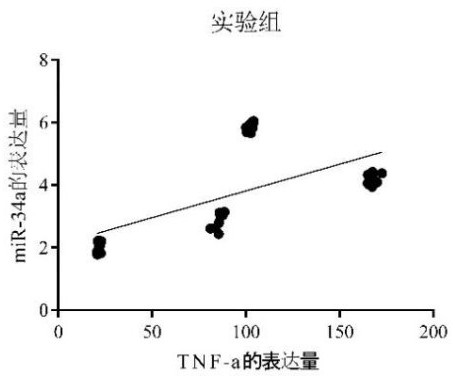
根据pearson相关性分析显示,实验组新生大鼠肺组织miR-34a与TNF-α的表达水平呈正向线性相关关系(r=0.607,P<0.05);对照组新生大鼠肺组织miR-34a与TNF-α的表达水平未见明显的线性相关关系(r=0.131,P>0.05)。见图 8、9。
|
| 图 8 对照组miR-34a与TNF-α表达的相关性 Fig 8 Correlation between miR-34a and TNF-α expression in the control group |
|
|
|
| 图 9 实验组miR-34a与TNF-α表达的相关性 Fig 9 Correlation between miR-34a and TNF-α expression in experimental group |
|
|
数十年间,新生儿ARDS经历了从成人ARDS到儿童ARDS,再到新生儿ARDS巨大演变。期间国内外学者也分别对不同年龄层次的ARDS患者进行了相应的定义[6]。正如大家所熟知的,新生儿是一个特殊时期。从胎儿向新生儿时期的转变导致其心肺功能和血流动力学也发生相应的改变,加之肺部发育尚不成熟的原因,该阶段的免疫功能和全身对炎症性反应的调控能力相对不足[7]。目前,NARDS仍然是新生儿科常见的呼吸系统急危重症之一, 病死率为9.6%~15.2%,具有较高的病死率和致残率[8]。与其他年龄段ARDS患者不同,该病的病理生理过程涉及较多复杂的炎性反应,加之不可避免的与围产期新生儿其他疾病及母亲妊娠期合并症相叠加,NARDS患儿的临床表现相对较严重,病程时间相对较长,后期常伴多种合并症,往往需要更多的PS使用、更高级的呼吸支持以及多器官综合支持,但治疗效果仍然不理想[9-10]。目前,针对NARDS患儿的临床诊断常采用动脉血气结合影像学检查的方法(主要包括肺部超声检查与X线检查), 但不同检查方法的操作和作用原理均可导致诊断结果出现一定差异[11]。NARDS患儿临床表现缺乏特异性,虽然可以依靠动脉血气分析及相关影像学检查,介于新生儿年龄段特点,自身血管发育条件不佳,采集动脉血难度较大,易与静脉血相混,需反复进行有创操作送检,与此同时,相应的影像学检查因执行者的认知及技术水平等主观差异较大,且NARDS疾病早期肺部改变并没有很典型影像学表现,易出现漏诊、误诊,不能达到快速且准确诊断,从而导致患儿错失最佳救治机会。故临床上迫切需要一种易于操作,表达稳定,客观且定量的生物学标志物。近年来,众多研究者[12-13]通过miRNA芯片杂交技术,筛选出318种在NARDS患儿和正常新生儿血清中差异表达的miRNA,证实部分miRNA的血清表达水平与NARDS发病之间的相关性,从分子水平出发,探讨miRNA在NARDS发病机制中发挥的作用,以期为NARDS的诊疗提供帮助。研究[14]显示,NARDS患儿的血清中miR-34a的表达水平与非NARDS组比较具有统计学意义。故本研究提出miR-34a可能参与NARDS的发病过程的猜想,但其参与NARDS发病过程的具体机制以及其表达浓度是否可作为NARDS发病的生物学预测指标的临床参考价值均存在一定争议。
近年来,国内外学者对NARDS发病机制的研究从未停止,但其临床治疗效果不佳。成人肺发育期分为五个阶段:胚胎期,假腺期,小管期,囊状期和肺泡期,而新生儿的肺发育包含胚胎期、胎儿期及出生后期[15-16],迄今为止大部分的动物模型都是基于成人ARDS来进行的,不能完全还原新生儿肺发育的过程,因此,建立稳定、可靠的NARDS肺损伤临床前模型是明确其发病机制、发掘潜在治疗靶点。
本团队之前的预实验中按照4 mg/kg的剂量经腹腔内注射LPS溶液所建立的大鼠模型最稳定,因此在本实验中按照同样的给药剂量和给药方式构建NARDS动物模型。发现实验组随着致伤时间的推移,出现口唇及四肢末端发绀,呼吸费力,呼吸频率增快,时而伴点头呼吸及呼吸暂停,对外界刺激反应淡漠,活动量明显降低,进食明显减少、部分拒食,全身温度减低等现象,部分大鼠死亡。肺水肿是引起肺组织换气障碍,导致机体进行性呼吸困难、低氧血症甚至呼吸衰竭的的重要原因。通过肺组织W/ D值提示肺水肿程度与LPS致伤时间存在时序性,在LPS致伤后3 h、6 h、12 h、24 h四个时相采集标本进行分析的结果均显示相比于对照组,LPS组大鼠的肺组织的W/D明显增大,差异有统计学意义(P<0.05)。HE染色后在光镜下观察结果显示,随致伤时间的延长,肺病理组织变化明显加重,LPS组小鼠的肺脏组织逐渐出现肺泡萎缩,肺泡壁局灶性增厚,肺泡结构完整性破坏,肺泡间隔明显变宽,部分肺泡破裂融合成肺大泡,肺组织内可见充血以及大量红细胞渗出、炎症细胞浸润。肺组织病理损伤评分稳点性高,操作简便,可以做到客观准确的反应肺组织病变损伤程度,经过肺组织病理损伤评分评估计算后[17],显示上述四个时相组大鼠的肺组织均发生了弥漫性肺病理损伤,与对照组相比其损伤评分逐渐升高,差异有统计学意义(P<0.05)。实验组的各时相组进行组间比较,差异有统计学意义(P<0.05)。
LPS是革兰阴性菌细胞壁的主要成分,是ARDS的一种致病因素,可引起Ⅰ型肺泡上皮细胞释放TNF-a、IL -1B等多种炎性细胞因子[18]。TNF-α是ARDS早期活化的巨噬细胞分泌的生物学效应最强、最早期的细胞因子,可引起多种促炎性趋化因子的释放,在一定程度上可反应病情的严重程度[19]。本实验通过ELISA检测TNF–a表达水平的演变过程,发现,TNF-a表达水平明显升高,至12 h达高峰,随后开始下降但仍高于对照组,提示TNF-a是NARDS升高较早的炎症因子。国内一项目研究发现[20],ARDS患者血清和支气管肺泡灌洗液中的TNF-a表达升高,与预后较差及病死率有关,因此TNF-a浓度可以反映ARDS的肺损伤程度。miR-34家族(miR-34s)是一类种属保守的非编码miRNA家族,人源miR-34s由miR-34a、miR-34b及miR-34c组成。随着对miR-34s研究的深入,越来越多的研究表明[21-22],miR-34s在NARDS和BPD等多种呼吸系统疾病的发生发展中扮演重要角色。近年来有学者研究发现[23],miR-34a在多种肺部疾病中介导肺损伤,在呼吸系统疾病中,miR-34a在多种炎性状态下表达上调,可见miR-34a广泛参与调节机体抗炎免疫反应。本实验通过qRT-PCR检测大鼠肺组织中的miR-34a表达,结果显示,与对照组比较,miR-34a在LPS致伤的3、6、12、24 h四个时间点表达升高,表达量随时间递增,呈正向线性相关,姜等学者也证实,LPS刺激后可引起miR-34a表达上调。
此前笔者利用靶基因预测网站发现TNF-ɑ为miR-34a的靶基因。通过查阅文献发现,miR-34a可通过调节TNF-ɑ的表达进而影响肺组织损伤的的发生和发展。其中龙春艺等[24]学者通过构造ARDS模型实验发现,miR-34a和基质金属蛋白酶(MMP2)水平表达呈正相关,miR-34a可通过NF-κB通路靶向调控MMP2来参与ARDS的发生。MMP2已经被认定为生物标志物之一,与肺损伤程度相关,作为NF-κB通路的下游产物,TNF-α同时可诱导NF-κB激活,促进更多炎性因子表达,形成炎性环路,促进炎症爆发,最终导致NARDS的发生。而且当TNF-α分泌增高时,TNF-α可激活A549肺上皮细胞中NF-κB信号通路, 刺激MMP2的产生[25-27]。另外,Meng等[28]一项关于结肠癌的研究显示,miR-34a可通过上调TNF-α的表达来促进免疫微环境中的肿瘤生长。因此有理由推测miR-34a介导着下游靶基因TNF-α的表达。本实验通过采用腹腔内注射LPS的方法成功构建了新生大鼠ARDS模型,分别于不同时间点检测其肺组织中miR-34a、TNF-α的表达量,结果显示实验组肺组织中miR-34a及TNF-α表达显著增高,且具有时间相关性,推测miR-34a可能通过正向调控TNF-α的表达,从而参与NARDS的发生。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王秀: 研究设计、数据整理、论文撰写;张杰: 数据整理、论文修改;王晓丽、霍梦月、新春: 数据分析、统计学分析;梅花: 技术指导、论文修改、经费支持
| [1] | Chen L, Li J, Shi Y, et al. Clinical characteristics and outcomes in neonates with perinatal acute respiratory distress syndrome in China: a national, multicentre, cross-sectional study[J]. EClinicalMedicine, 2022, 55: 101739. DOI:10.1016/j.eclinm.2022.101739 |
| [2] | De Luca D, Tingay DG, van Kaam AH, et al. Epidemiology of neonatal acute respiratory distress syndrome: prospective, multicenter, international cohort study[J]. Pediatr Crit Care Med, 2022, 23(7): 524-534. DOI:10.1097/PCC.0000000000002961 |
| [3] | Ho PTB, Clark IM, Le LTT. MicroRNA-based diagnosis and therapy[J]. Int J Mol Sci, 2022, 23(13): 7167. DOI:10.3390/ijms23137167 |
| [4] | Ferruelo A, Peñuelas Ó, Lorente JA. MicroRNAs as biomarkers of acute lung injury[J]. Ann Transl Med, 2018, 6(2): 34. DOI:10.21037/atm.2018.01.10 |
| [5] | Martucci G, Arcadipane A, Tuzzolino F, et al. Identification of a circulating miRNA signature to stratify acute respiratory distress syndrome patients[J]. J Pers Med, 2020, 11(1): 15. DOI:10.3390/jpm11010015 |
| [6] | 郭静雨. 基于蒙特勒标准的新生儿急性呼吸窘迫综合征的单中心回顾性研究[D]. 重庆: 重庆医科大学, 2022. |
| [7] | Wu JF, Wang YL, Zhao AL, et al. Lung ultrasound for the diagnosis of neonatal respiratory distress syndrome: a meta-analysis[J]. Ultrasound Q, 2020, 36(2): 102-110. DOI:10.1097/RUQ.0000000000000490 |
| [8] | Rong ZH, Mo LX, Pan R, et al. Bovine surfactant in the treatment of pneumonia-induced-neonatal acute respiratory distress syndrome (NARDS) in neonates beyond 34 weeks of gestation: a multicentre, randomized, assessor-blinded, placebo-controlled trial[J]. Eur J Pediatr, 2021, 180(4): 1107-1115. DOI:10.1007/s00431-020-03821-2 |
| [9] | Chioma R, Amabili L, Ciarmoli E, et al. Lung UltraSound targeted recruitment (LUSTR): a novel protocol to optimize open lung ventilation in critically ill neonates[J]. Children, 2022, 9(7): 1035. DOI:10.3390/children9071035 |
| [10] | 金宝, 杨波, 雷红林, 等. LISA技术联合咖啡因治疗早产儿呼吸逢泊综合征的临床研究[J]. 中华急诊医学杂志, 2022, 31(6): 761-766. DOI:10.3760/cma.j.issn.1671-0282.2022.06.011 |
| [11] | Huang TP, Chen DY, Ye W, et al. Effect and mechanism of apelin on lipopolysaccharide induced acute pulmonary vascular endothelial barrier dysfunction[J]. Sci Rep, 2023, 13(1): 1560. DOI:10.1038/s41598-023-27889-6 |
| [12] | Zhou H, Chanda B, Chen YF, et al. Microarray and bioinformatics analysis of circular RNA differential expression in newborns with acute respiratory distress syndrome[J]. Front Pediatr, 2021, 9: 728462. DOI:10.3389/fped.2021.728462 |
| [13] | 陈怡, 周发春. MicroRNA-34a在脂多糖诱导急性呼吸窘迫综合征中的表达及作用机制[J]. 重庆医科大学学报, 2019, 44(6): 752-758. DOI:10.13406/j.cnki.cyxb.002212 |
| [14] | 陈小冰, 张雪梅, 陈求凝, 等. 血清miR-34a及miR-155在新生儿急性呼吸窘迫综合征中的表达及临床意义[J]. 中国急救医学, 2020, 40(4): 334-338. DOI:10.3969/j.issn.1002-1949.2020.04.014 |
| [15] | Chen IL, Chen HL. New developments in neonatal respiratory management[J]. Pediatr Neonatol, 2022, 63(4): 341-347. DOI:10.1016/j.pedneo.2022.02.002 |
| [16] | Liu ZQ, Feng J, Shi LL, et al. Influences of miR-155/NF-κB signaling pathway on inflammatory factors in ARDS in neonatal pigs[J]. Eur Rev Med Pharmacol Sci, 2019, 23(16): 7042-7048. DOI:10.26355/eurrev_201908_18746 |
| [17] | Matute-Bello G, Downey G, Moore BB, et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals[J]. Am J Respir Cell Mol Biol, 2011, 44(5): 725-738. DOI:10.1165/rcmb.2009-0210ST |
| [18] | Wang XM, Wang YL, Huang DM, et al. Astragaloside Ⅳ regulates the ferroptosis signaling pathway via the Nrf2/SLC7A11/GPX4 axis to inhibit PM2.5-mediated lung injury in mice[J]. Int Immunopharmacol, 2022, 112: 109186. DOI:10.1016/j.intimp.2022.109186 |
| [19] | Ding JR, Jiang HB, Su B, et al. DNMT1/miR-130a/ZEB1 regulatory pathway affects the inflammatory response in lipopolysaccharide-induced sepsis[J]. DNA Cell Biol, 2022, 41(5): 479-486. DOI:10.1089/dna.2021.1060 |
| [20] | 宋婷阁, 张鹏举, 耿彪, 等. 新生儿急性呼吸窘迫综合征患者血清miR-183-5p的表达及与IL-1β, IL-6和TNF-α水平的相关性[J]. 现代检验医学杂志, 2021, 36(5) 55-57, 68. DOI:10.3969/j.issn.1671-7414.2021.05.012 |
| [21] | Maeda H, Yao HW, Go H, et al. Involvement of miRNA-34a regulated Krüppel-like factor 4 expression in hyperoxia-induced senescence in lung epithelial cells[J]. Respir Res, 2022, 23(1): 340. DOI:10.1186/s12931-022-02263-8 |
| [22] | Kuropatkina TA, Pankova NV, Medvedeva NA, et al. Ubiquinol ameliorates endothelial dysfunction and increases expression of miRNA-34a in a rat model of pulmonary hypertension[J]. Res Results Pharmacol, 2021, 7(3): 23-31. DOI:10.3897/rrpharmacology.7.67291 |
| [23] | Khan MJ, Singh P, Dohare R, et al. Inhibition of miRNA-34a promotes M2 macrophage polarization and improves LPS-induced lung injury by targeting Klf4[J]. Genes, 2020, 11(9): 966. DOI:10.3390/genes11090966 |
| [24] | 龙春艺. MiR-34a-5p及其靶基因MMP2在ARDS患者外周血中的表达及其临床意义的研究[D]. 右江: 右江民族医学院, 2019. |
| [25] | Wang GJ, Liu GH, Ye YW, et al. Upregulation of miR-34a by diallyl disulfide suppresses invasion and induces apoptosis in SGC-7901 cells through inhibition of the PI3K/Akt signaling pathway[J]. Oncol Lett, 2016, 11(4): 2661-2667. DOI:10.3892/ol.2016.4266 |
| [26] | 黄莹. RAGE对TNF-α诱导A549细胞MMPs/TIMPs表达的调控作用[D]. 右江: 右江民族医学院, 2019. |
| [27] | Costanzo L, Soto B, Meier R, et al. The biology and function of tissue inhibitor of metalloproteinase 2 in the lungs[J]. Pulm Med, 2022, 2022: 3632764. DOI:10.1155/2022/3632764 |
| [28] | Meng F, Yang M, Chen Y, et al. miR-34a induces immunosuppression in colorectal carcinoma through modulating a SIRT1/NF-κB/B7-H3/TNF-α axis[J]. Cancer Immunol Immunother, 2021, 70(8): 2247-2259. DOI:10.1007/s00262-021-02862-2 |
 2024, Vol. 33
2024, Vol. 33