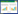脓毒症是机体对感染的反应失衡,而导致危及生命的器官功能障碍,为重症监护病房(intensive care unit,ICU)的常见病症[1-2]。全球疾病负担研究显示每年约有4 890万例脓毒症患者,死亡病例约为1 100万,占全球总死亡数的19.7%[3]。脓毒症常合并多个器官障碍,大脑是最常累及的器官之一,约有一半的脓毒症患者在入ICU时会出现脑功能障碍[4]。从临床上看,脓毒症引起的脑功能障碍在病程上可分为急性期与慢性期,而谵妄为急性期主要的临床表现[5],其发生与中枢神经系统功能紊乱密切相关。相对于非脓毒症患者,脓毒症患者谵妄等脑功能障碍的发生率更高[5]。《精神障碍诊断和统计手册》第5版(Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition,DSM-5)将谵妄定义为一种以起病急、病情反复波动为特征的,表现为意识障碍、注意力不集中、漫无边际、不相关或不连贯的思维模式的一组急性脑综合征,不能用先前存在的神经系统疾病来解释[6]。脓毒症患者一旦出现谵妄,将导致患者医源性肺炎、反流误吸等并发症增加,不良住院事件的风险增加、病死率及住院成本增加、住院时间延长,甚至遗留长期的认知功能损害[7-8]。谵妄的病理生理学机制尚未完全了解,可能与内皮细胞和血脑屏障受损、脑血流改变、大脑信号传递紊乱、神经炎症及小胶质细胞激活、线粒体功能障碍等相关[9-10]。目前尚未找到有效的方法来治疗谵妄,因此更加重要的是预防谵妄的发生。谵妄的发生通常是由多种因素共同作用导致的,找出脓毒症患者谵妄发生的独立危险因素,最大程度地识别出谵妄高危人群,并及时采取干预措施,对减少谵妄的发生及改善患者预后有着重要意义。
1 资料与方法 1.1 研究对象采用回顾性研究方法,纳入苏州大学附属第二医院ICU在2020年9月至2022年8月期间收治的脓毒症患者作为研究对象。本研究已通过苏州大学附属第二医院伦理委员会审查批准(伦理审查决定号:JD-HG-2022-17)。入选标准:(1)年龄≥18岁。(2)入ICU时符合脓毒症sepsis 3.0诊断标准:在怀疑或确定感染情况下,序贯器官衰竭(the sequential organ failure assessment, SOFA)评分≥2分[11]。排除标准:(1)心脏骤停、急性脑卒中、颅脑外伤、合并血液系统疾病、恶性肿瘤放化疗期间、临床终末期、严重精神障碍、既往认知障碍患者。(2)入ICU前出现谵妄。(3)视力或听力严重障碍影响交流及后续随访。(4)ICU住院时间<24 h。(5)ICU住院期间持续昏迷无法评估谵妄。
1.2 谵妄评估本研究中谵妄的评估由两位评估人员完成,包括一位护士及一位医师,在护士评估完成后由医生确认是否存在谵妄,如双方存在争议,则交由第三位评估人员(主治医师或主管护师及以上职称医务人员)评估。所有评估人员均提前接受ICU谵妄评估培训,并采取意识模糊评估法(The Confusion Assessment Method for the Intensive Care Unit, CAM-ICU)评估患者有无出现谵妄[12]。对于符合纳入标准的患者,评估人员每日于8~9点,16~17点及22~23点常规进行3次评估,若患者在其余时间内出现意识形态的改变,则随时评估和记录谵妄情况。若患者在ICU住院期间评估谵妄均为阴性,则归为非谵妄组。若出现至少一次谵妄阳性,则归为谵妄组。
1.3 观察指标参考相关文献[6,13-15]选取纳入研究的谵妄危险因素,使用住院电子病历系统及重症护理系统收集脓毒症患者入住ICU第1个24 h一般资料及临床资料。(1)一般资料:性别、年龄、既往病史(高血压、糖尿病、冠心病、房颤、肾功能不全、脑血管疾病)、个人史(吸烟史、酗酒史);(2)临床资料:患者入ICU第1个24小时内临床数据:①实验室指标:血常规、生化、凝血功能、感染指标(C-反应蛋白,降钙素原)、血气分析、神经元特异性烯醇化酶。所有实验室指标取入ICU 24 h内最差值。②药物及治疗措施:镇静镇痛药物(咪达唑仑等)使用情况,血管活性药物使用情况;机械通气时间;是否行急诊手术、肾脏替代治疗、输血。③评分:急性生理与慢性健康评分Ⅱ(acute physiology and chronic health evaluation Ⅱ, APACHE Ⅱ)评分,SOFA评分。
1.4 统计学方法采用SPSS 25.0,R语言4.0.1, GraphPad Prism 8.0.2进行统计学分析,计量资料组间比较,如果服从正态分布采用成组t检验,不服从正态分布采用Wilcoxon秩和检验;计数资料组间比较,采用χ2检验,以P<0.05为差异有统计学意义。采取向后逐步回归法筛选预测变量,将筛选出的预测变量纳入多因素Logistic回归分析,建立谵妄风险预测模型。采用ROC曲线评估模型的区分能力,并计算曲线下面积,以P<0.05为差异有统计学意义。AUC>0.7表示模型对谵妄预测的区分能力能够接受,AUC越接近1提示区分能力越强。采用Hosmer-Lemeshow(H-L)拟合优度检验评估模型的拟合程度,计算Brier评分曲线评价预测模型的区分度及校准度(一般认为Brier评分<0.25,则预测能力较好)。绘制预测模型临床决策曲线及影响曲线以评价模型临床适用度。
2 结果 2.1 两组一般资料比较本研究纳入ICU脓毒症患者381例,其中114例患者出现谵妄。谵妄组谵妄持续中位数时间为1 d,谵妄持续时间≤3 d的患者占总谵妄人群的88.6%,55.3%的患者在入ICU 3 d内出现谵妄,77.2%的患者在ICU住院期间只出现1次谵妄。两组患者在性别、体重指数、高血压病史、糖尿病病史、房颤病史、冠心病病史、慢性阻塞性肺疾病病史、肾功能不全病史、吸烟及酗酒史方面差异无统计学意义(P>0.05),而两组在年龄上差异有统计学意义(P<0.05)。见表 1。
| 参数 | 谵妄组(n=114) | 非谵妄组(n=267) | χ2/Z值 | P值 |
| 年龄a(n,%) | ||||
| ≥65岁 | 97(85.1) | 160(59.9) | 23.041 | < 0.001 |
| <65岁 | 17(14.9) | 107(40.1) | ||
| 性别(n,%) | ||||
| 男 | 81(71.1) | 172(64.4) | 1.576 | 0.209 |
| 女 | 33(28.9) | 95(35.6) | ||
| BMI(kg/m2) | 22.2(20.3~25.2) | 22.8(20.1~25.6) | -0.582 | 0.561 |
| 既往病史(n,%) | ||||
| 高血压 | 70(61.4) | 150(56.2) | 0.893 | 0.345 |
| 糖尿病 | 29(25.4) | 89(33.3) | 2.329 | 0.127 |
| 冠心病 | 8(7.0) | 13(4.9) | 0.708 | 0.400 |
| 房颤 | 7(6.1) | 10(3.7) | 1.075 | 0.300 |
| 肾功能不全 | 8(7.0) | 13(4.9) | 0.708 | 0.400 |
| 慢性阻塞性肺疾病 | 4(3.5) | 2(0.7) | 2.347 | 0.126 |
| 脑血管病 | 16(14.0) | 45(16.9) | 0.472 | 0.492 |
| 个人史(n,%) | ||||
| 吸烟史 | 37(32.5) | 62(23.2) | 3.543 | 0.060 |
| 酗酒史 | 13(11.4) | 25(9.4) | 0.370 | 0.543 |
| 注:aP<0.05; n:患者例数,BMI:体重指数 | ||||
两组的临床资料对比显示,脓毒症休克、急诊入院、低钾血症、高钾血症、低钠血症、高钠血症、低钙血症,氧合指数、白细胞、血红蛋白、白蛋白、总胆红素、谷草转氨酶、谷丙转氨酶、C反应蛋白、降钙素原、神经元特异性烯醇化酶、是否有创机械通气、急诊手术、肾脏替代治疗、使用阿片类镇痛药物、使用糖皮质激素等22个因素在两组间差异无统计学意义(P>0.05),而两组在代谢性酸中毒、尿素>7.1 mmol/L、凝血功能障碍、乳酸、血小板指标、是否输血、使用咪达唑仑、使用去甲肾上腺素,咪达唑仑使用时间、有创机械通气时间、SOFA评分、APACHE Ⅱ评分方面差异有统计学意义(P<0.05)。见表 2。
| 指标 | 谵妄组(n=114) | 非谵妄组(n=267) | t/χ2/Z值 | P值 |
| 代谢性酸中毒(n,%)a | 34(29.8) | 34(12.7) | 15.915 | < 0.001 |
| 合并凝血功能障碍(n,%)a | 84(73.7) | 121(45.3) | 25.862 | < 0.001 |
| 脓毒症休克(n,%) | 25(21.9) | 48(18.0) | 0.806 | 0.369 |
| ALT(U/L) | 34(21~70) | 34(19~65) | -0.586 | 0.558 |
| AST(U/L) | 46(26~82) | 39(24~74) | -1.091 | 0.275 |
| 尿素(n,%)a | ||||
| >7.1 mmol/L | 104(91.2) | 181(67.8) | 23.284 | < 0.001 |
| ≤7.1 mmol/L | 10(8.8) | 86(32.2) | ||
| 低钠血症(n,%) | 38(33.3) | 97(36.3) | 0.436 | 0.509 |
| 高钠血症(n,%) | 27(23.7) | 44(16.5) | 2.735 | 0.098 |
| 低钾血症(n,%) | 36(31.6) | 94(35.2) | 0.468 | 0.494 |
| 高钾血症(n,%) | 7(6.1) | 8(3.0) | 1.340 | 0.247 |
| 低钙血症(n,%) | 63(55.3) | 142(53.2) | 0.139 | 0.709 |
| CRP(mg/L) | 139(62~217) | 160(79~249) | -1.858 | 0.063 |
| PCT(ng/mL) | 6.0(0.8~30.9) | 4.4(0.5~25.2) | -1.096 | 0.273 |
| Lac(mmol/L)a | 1.9(1.4~3.6) | 1.5(1.1~2.4) | -2.643 | 0.008 |
| PaO2/FiO2(mmHg) | 205(170~290) | 246(193~323) | -1.949 | 0.051 |
| WBC(109/L) | 14.6(10.3~20.2) | 13.2(9.6~18.8) | -1.247 | 0.212 |
| PLT(109/L)a | 138(85~189) | 163(107~225) | -2.713 | 0.007 |
| Hb(g/L) | 104±26 | 105±24 | 1.191 | 0.234 |
| NE(109/L) | 13.1(9.2~18.6) | 11.8(8.4~17.3) | -1.382 | 0.167 |
| Alb(g/L) | 27.8±4.7 | 28.3±4.7 | 1.318 | 0.188 |
| TBil(μmol/L) | 21.5(12.5~35.6) | 17.5(10.4~28.8) | -1.075 | 0.282 |
| NSE(ng/mL) | 13.6(10.3~20.4) | 12.6(9.2~18.5) | -1.471 | 0.141 |
| 有创机械通气(n,%) | ||||
| 是 | 34(29.8) | 56(21.0) | 3.469 | 0.063 |
| 否 | 80(70.2) | 211(79.0) | ||
| 有创机械通气时间(n,%)a | ||||
| >72 h | 28(24.6) | 35(13.1) | 7.593 | 0.006 |
| ≤72 h | 86(75.4) | 232(86.9) | ||
| 急诊手术(n,%) | ||||
| 是 | 11(9.6) | 18(6.7) | 0.960 | 0.327 |
| 否 | 103(90.4) | 249(93.3) | ||
| 输血(n,%)a | ||||
| 是 | 25(21.9) | 32(12.0) | 6.210 | 0.013 |
| 否 | 89(78.1) | 235(88.0) | ||
| 肾脏替代治疗(n,%) | ||||
| 是 | 19(16.7) | 28(10.5) | 2.821 | 0.093 |
| 否 | 95(83.3) | 239(89.5) | ||
| 使用咪达唑仑(n,%)a | ||||
| 是 | 24(21.1) | 17(6.4) | 17.942 | < 0.001 |
| 否 | 90(78.9) | 250(93.6) | ||
| 咪达唑仑使用时间(n,%)a | ||||
| >72 h | 10(8.8) | 10(3.7) | 4.058 | 0.044 |
| ≤72 h | 104(91.2) | 257(96.3) | ||
| 使用阿片类镇痛药物(n,%) | ||||
| 是 | 42(36.8) | 72(27.0) | 3.716 | 0.054 |
| 否 | 72(63.2) | 195(73.0) | ||
| 使用去甲肾上腺素(n,%)a | ||||
| 是 | 45(39.5) | 76(28.5) | 4.468 | 0.035 |
| 否 | 69(60.5) | 191(71.5) | ||
| 使用糖皮质激素(n,%) | ||||
| 是 | 22(19.3) | 58(21.7) | 0.283 | 0.595 |
| 否 | 92(80.7) | 209(78.3) | ||
| APACHE Ⅱ评分(n,%)a | ||||
| >15 | 86(75.4) | 144(53.9) | 15.444 | < 0.001 |
| ≤15 | 28(24.6) | 123(46.1) | ||
| SOFA评分(n,%)a | ||||
| >4 | 94(82.5) | 160(59.9) | 18.250 | < 0.001 |
| ≤4 | 20(17.5) | 107(40.1) | ||
| 注:aP<0.05;ALT:谷丙转氨酶;AST谷草转氨酶;CRP:C反应蛋白;PCT:降钙素原;Lac:乳酸;PaO2/FiO2:氧合指数;WBC:白细胞;PLT:血小板;Hb:血红蛋白;NE:中性粒细胞;Alb:白蛋白;TBil:胆红素;NSE:神经元特异性烯醇化酶 | ||||
根据单因素分析结果,以是否发生谵妄为因变量,将年龄≥65岁、APACHEⅡ评分>15、SOFA评分>4、输血、使用咪达唑仑、使用血管活性药物、代谢性酸中毒、尿素>7.1 mmol/L、凝血功能障碍、Lac、PLT共11项自变量,采用二元Logistic-向后-LR条件法进行回归分析,结果显示年龄≥65岁(OR=3.574, 95%CI=1.858~7.280)、APACHEⅡ评分>15(OR=1.891, 95%CI=1.057~3.449)、使用咪达唑仑(OR=4.380, 95%CI=1.932~10.383)、合并凝血功能障碍(OR=3.138, 95%CI=1.826~5.529)、尿素>7.1 mmol/L (OR=3.656, 95%CI=1.735~8.428)、代谢性酸中毒(OR=4.904, 95%CI=2.497~9.947) 6个因素在脓毒症患者谵妄组与非谵妄组之间差异有统计学意义(P<0.05)。见表 3,图 1。
| 参数 | β | SE | P值 | OR | 95%CI |
| 年龄≥65岁 | 1.274 | 0.347 | < 0.001 | 3.574 | 1.858~7.280 |
| APACHE Ⅱ>15 | 0.637 | 0.300 | 0.034 | 1.891 | 1.057~3.449 |
| 使用咪达唑仑 | 1.477 | 0.426 | 0.001 | 4.380 | 1.932~10.383 |
| 合并凝血功能障碍 | 1.144 | 0.282 | < 0.001 | 3.138 | 1.826~5.529 |
| 尿素>7.1 mmol/L | 1.296 | 0.400 | 0.001 | 3.656 | 1.735~8.428 |
| 代谢性酸中毒 | 1.590 | 0.351 | < 0.001 | 4.904 | 2.497~9.947 |
| 注:β值:回归系数;SE:标准误;OR:优势比;CI:置信区间 | |||||
|
| 图 1 多因素logistic回归分析森林图 Fig 1 Forest plot of multivariable logistic regression analysis |
|
|
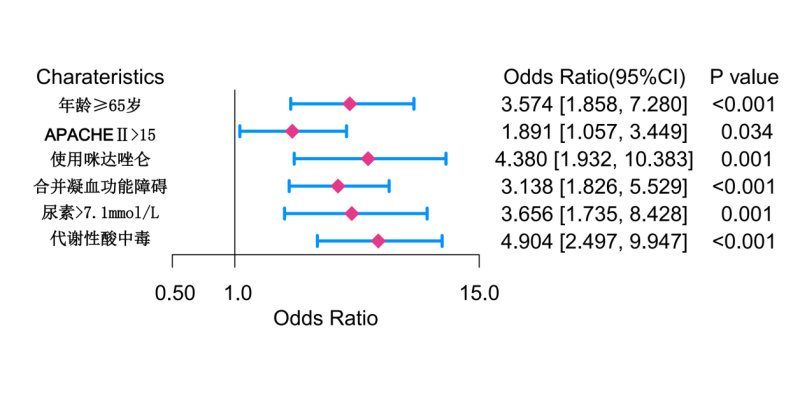
Logistic模型的一般形式logit (p) =β0+β1x1+β2x2+…+βnxn[16]。根据多因素Logistic回归分析结果,将多因素logistic回归分析的结果代入模型表达式中,令X1=年龄≥65岁,X2=APACHE Ⅱ>15,X3=使用咪达唑仑,X4=合并凝血功能障碍,X5=尿素>7.1 mmol/L,X6=代谢性酸中毒;β0为常数项,β为各项的回归系数。得到logistic回归模型如下所示:P(Y) = 1/1 + e^-[-4.458+1.274×年龄≥65岁(=0或1)+0.637×APACHEⅡ>15(=0或1)+1.477×使用咪达唑仑(=0或1)+1.144×凝血功能障碍(=0或1)+1.296×尿素>7.1 mmo/L(=0或1)+1.590×代谢性酸中毒(=0或1)],见图 2。
|
| 图 2 ICU脓毒症患者谵妄发生预测概率-诺莫图 Fig 2 Nomogram for predicting delirium incidence in ICU sepsis patients |
|
|
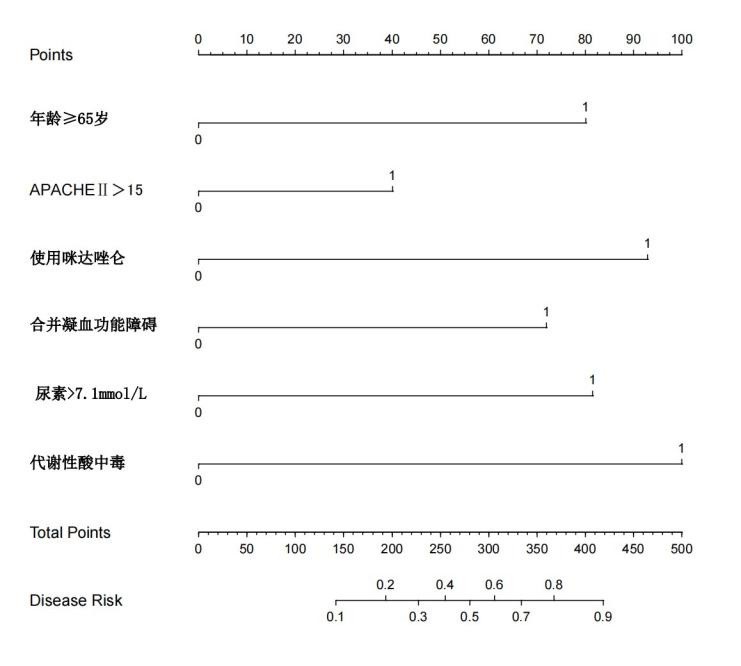
2.5.1预测模型区分度评价采用R软件“pROC”包绘制受试者操作特性曲线(receiver operating characteristic curve, ROC)(图 3)评价模型的区分度,ROC曲线下面积(area under the receiver operating characteristic curve, AUROC)为0.813,95% 置信区间(95% confidence interval,95%CI)为0.767~0.859,P<0.001。预测模型的约登指数最大值为0.321,识别谵妄的敏感度76.3%,特异度73.0%。
|
| 图 3 ROC曲线 Fig 3 ROC curve |
|
|
采用R软件“rms”包绘制Calibration校准曲线(图 4),“ResourceSelection”包进行HL(Hosmer-Lemeshow)拟合优度检验评价模型校准度。结果显示,校准曲线原始C指数为0.813(95%CI =0.767~0.859),矫正C指数为0.812;HL拟合优度检验χ2 =2.596, P=0.957>0.05,模型的拟合程度较好。
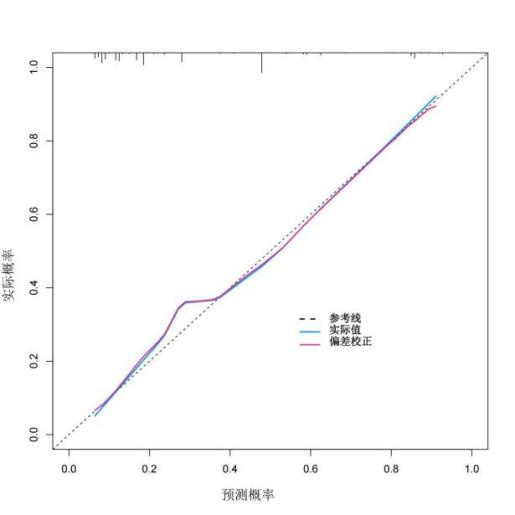
|
| 图 4 校准曲线 Fig 4 Calibration curve |
|
|
采用R软件“rms”包计算Brier评分评价模型的总体表现,结果显示,预测模型的Brier评分为0.149(<0.25),表明模型预测能力较好。
2.5.4 预测模型临床适用度评价采用R软件“rmda”包绘制风险预测模型的临床决策曲线及临床影响曲线(图 5,6),以评价模型的临床适用度。结果表明,在阈概率0.07~0.85时,依照风险预测模型干预的净收益比默认方法(全干预和不干预)干预的净收益高,预测模型具有较好的临床适用度。
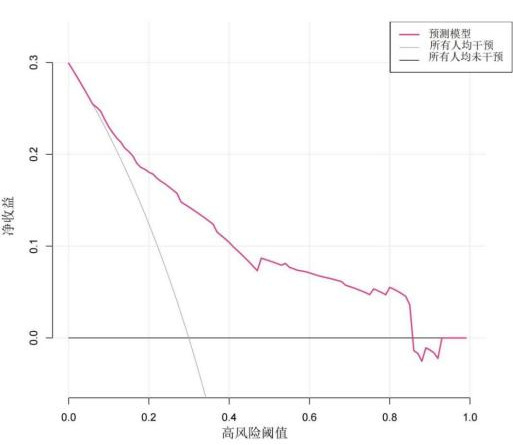
|
| 图 5 临床决策曲线 Fig 5 Clinical decision curve |
|
|
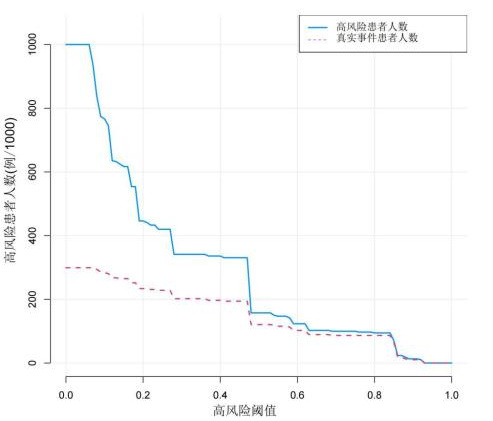
|
| 图 6 临床影响曲线 Fig 6 Clinical impact curve |
|
|
脓毒症是机体对感染的反应失调,进而诱发多器官功能障碍,在ICU中有着较高的病死率。脓毒症患者由于全身炎症反应、血流动力学异常、血脑屏障(blood brain barrier,BBB)通透性改变和神经传递紊乱等因素,更易出现谵妄等脑功能障碍。既往文献中报道的脓毒症患者ICU住院期间谵妄发生率从不到10%至超过70%不等[17-19]。目前谵妄无特别有效的治疗方法,故谵妄的预防就显得尤为重要,而谵妄的预防关键在于对谵妄危险因素的发现及处理。
本研究通过对脓毒症ICU住院早期谵妄危险因素的收集及分析,得出年龄≥65岁、APACHE Ⅱ评分>15、使用咪达唑仑、合并凝血功能障碍、尿素>7.1 mmol/L、代谢性酸中毒6个因素为脓毒症患者ICU住院期间谵妄发生的独立危险因素;并在此基础上构建临床预测模型。因本研究纳入总体病例数偏少,故只将纳入的脓毒症患者作为建模序列,模型的评价采取内部验证结果,结果显示模型具有较好的区分度、校准度及临床适用度,模型稳定性较好。
本研究发现在ICU住院期间老年组脓毒症患者相对于非老年患者谵妄发生风险更高,且两组间差异有统计学意义,与其他研究结果相一致[20-22]。这可能与高龄患者合并基础疾病,神经细胞凋亡增多,脑萎缩及功能退行性改变,脑血流改变及胆碱能功能障碍等有关[23]。APACHE Ⅱ评分由急性生理评分、年龄评分及慢性健康评分构成[24],临床上作为评估疾病严重程度的评分之一,分值越高,表示病情越重,预后越差,病死率越高。本研究以APACHE Ⅱ评分15分为界限将脓毒症患者分为两组,多因素分析结果发现APACHE Ⅱ评分>15为脓毒症患者谵妄发生的独立危险因素。APACHE Ⅱ评分多用于反映疾病的严重程度,疾病越重患者越容易出现神经内分泌功能及内环境紊乱,导致谵妄等急性脑功能障碍的出现。本研究中多因素分析发现使用镇静药物咪达唑仑是脓毒症患者ICU住院期间谵妄发生的独立危险因素,这与临床上目前普遍认为的苯二氮卓类药物增加谵妄发生风险一致[25]。目前咪达唑仑诱导谵妄发生的机制尚不明确,可能与镇静后影响患者内外环境刺激的感受性,药物本身的不良反应,药物撤药反应及剂量变化等有关[13]。合理选用镇静目标及对深镇静患者实施每日镇静中断,不仅可以减少镇静药物用量,也可避免患者出现过度镇静,有益于减少谵妄的发生[26]。在脓毒症患者中,全身炎症反应可通过引起凝血功能障碍使脑血管反应性受损、血栓形成造成脑血流减少,致使谵妄的发生[27-28]。在术后患者中,同样也发现凝血功能与谵妄的发生有关[29]。本研究根据脓毒症诱导凝血病诊断标准[30-31]定义凝血功能障碍,即分别从国际标准化比值(international normalisation ratio, INR)、血小板计数(Platelet count)、SOFA评分三个方面进行评估;以上3项评分相加大于等于4且PT-INR和血小板计数两项评分之和大于2诊断成立;多因素分析结果显示凝血功能障碍为ICU脓毒症患者谵妄发生的独立危险因素。本研究根据尿素7.1 mmol/L为界限将患者分为尿素>7.1 mmol/L和尿素≤7.1 mmol/L两组,多因素分析结果发现两组之间差异有统计学意义,这与Boogaard等[32]、Wassenaa等[33]的研究结果一致。尿素作为反映肾功能指标之一,为蛋白质代谢产物,尿素的升高一定程度上说明肾脏功能受损,从而导致毒素在体内蓄积及炎症介质清除率降低,多项研究也表明急性肾损伤为谵妄的易感因素[34-35]。本研究中多因素分析结果另发现代谢性酸中毒为脓毒症患者谵妄发生的独立危险因素,这可能与脓毒症患者低氧低灌注,内环境失调等因素相关,但具体机制尚不明确。
Boogaard等[32]构建的PRE-DELIRIC模型及Wassenaar等[33]构建的E-PRE-DELIRIC模型为目前认可度较高的两种谵妄预测模型,两种模型共有19个预测因子,其中“年龄、急诊入科和入院分组”3个因素重合,PRE-DELIRIC模型主要在患者入ICU 24 h后评估谵妄风险,而E-PRE-DELIRIC模型则是在患者入ICU时评估。本研究基于脓毒症群体构建ICU谵妄预测模型,同样发现高龄、APACHE Ⅱ评分、使用镇静药、尿素、代谢性酸中毒为ICU谵妄发生的独立风险因素,但也存在一些区别,如本研究发现凝血功能障碍为谵妄发生的危险因素,并未发现急诊入院、入院疾病分组、酗酒史、平均动脉压、使用糖皮质激素和呼吸衰竭等与谵妄之间的相关性,原因可能为:①本研究将急诊入院定义为经由急诊室收治入ICU,并未包括普通病房患者病情恶化转入ICU这一部分,而定义不同可能会导致研究结果不同。②本研究根据手术与否,分为内科组及外科组,并未分为内科组、外科组、神经组及多发伤组四组,而研究分组不同可能导致研究结果不同。③酗酒患者进入ICU后,容易产生焦虑、抑郁、幻觉等酒精戒断综合征及出现低镁、低钾等电解质紊乱,进而引起谵妄出现。但本研究并未发现酗酒与谵妄之间存在联系,可能是由于酗酒在各个研究中酒精含量定义不同。④本研究未发现平均动脉压、使用糖皮质激素和呼吸衰竭与谵妄发生有关,这可能是因为本研究以患者入ICU 24 h内的数据评估谵妄发生风险,而并不是如E-PRE-DELIRIC模型在患者入ICU时评估有关。⑤本研究发现在脓毒症患者中,凝血功能障碍为谵妄发生的独立危险因素,但各个研究对于凝血功能障碍的定义并不相同,本研究由于研究样本为脓毒症患者,故采取脓毒症诱导的凝血病诊断标准。目前凝血功能障碍与谵妄发生的关系尚不清楚,可能与脑自主调节受损有关。
本研究同时存在一些不足之处:首先本研究为单中心研究,样本量偏少,且并未进行外部验证,构建的临床预测模型是否能合适应用于其他ICU病房甚至其他医院尚未可知,需进一步在其他中心验证;其次本研究未纳入如睡眠、ICU环境等危险因素,且未针对谵妄进行分型,后期将展开对谵妄分型及严重程度方面的研究,并针对不同谵妄风险进行分层,以采取不同干预措施;最后本研究未对治愈出院患者进行长期随访,对于患者的预后缺乏足够的临床观测,后期将针对存活患者进行定期随访。
利益冲突 所有作者声明无利益冲突
作者贡献声明 杨思敏:研究设计、数据收集及分析、论文撰写;卞兴航、邓开基:数据收集;孙海伟、王少雄、朱建军:病例筛选及质控、论文修改;周保纯:技术指导、论文修改
| [1] | 崔业惠, 李燕, 王芸飞, 等. 全身免疫炎症指数预测脓毒症病死率: 一项回顾性研究[J]. 中华急诊医学杂志, 2024, 33(2): 200-203. DOI:10.3760/cma.j.issn.1671-0282.2024.02.010 |
| [2] | Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock 2021[J]. Intensive Care Med, 2021, 47(11): 1181-1247. DOI:10.1007/s00134-021-06506-y |
| [3] | Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [4] | Manabe T, Heneka MT. Cerebral dysfunctions caused by sepsis during ageing[J]. Nat Rev Immunol, 2022, 22(7): 444-458. DOI:10.1038/s41577-021-00643-7 |
| [5] | Chung HY, Wickel J, Brunkhorst FM, et al. Sepsis-associated encephalopathy: from delirium to dementia?[J]. J Clin Med, 2020, 9(3): 703. DOI:10.3390/jcm9030703 |
| [6] | Wilson JE, Mart MF, Cunningham C, et al. Delirium[J]. Nat Rev Dis Primers, 2020, 6: 90. DOI:10.1038/s41572-020-00223-4 |
| [7] | Girard TD, Jackson JC, Pandharipande PP, et al. Delirium as a predictor of long-term cognitive impairment in survivors of critical illness[J]. Crit Care Med, 2010, 38(7): 1513-1520. DOI:10.1097/CCM.0b013e3181e47be1 |
| [8] | Sanchez D, Brennan K, Al Sayfe M, et al. Frailty, delirium and hospital mortality of older adults admitted to intensive care: the Delirium (Deli) in ICU study[J]. Crit Care, 2020, 24(1): 609. DOI:10.1186/s13054-020-03318-2 |
| [9] | Stubbs DJ, Yamamoto AK, Menon DK. Imaging in sepsis-associated encephalopathy: insights and opportunities[J]. Nat Rev Neurol, 2013, 9(10): 551-561. DOI:10.1038/nrneurol.2013.177 |
| [10] | Sonneville R, de Montmollin E, Poujade J, et al. Potentially modifiable factors contributing to sepsis-associated encephalopathy[J]. Intensive Care Med, 2017, 43(8): 1075-1084. DOI:10.1007/s00134-017-4807-z |
| [11] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [12] | Ely EW, Inouye SK, Bernard GR, et al. Delirium in mechanically ventilated patients: validity and reliability of the confusion assessment method for the intensive care unit (CAM-ICU)[J]. JAMA, 2001, 286(21): 2703-2710. DOI:10.1001/jama.286.21.2703 |
| [13] | 汤铂, 王小亭, 陈文劲, 等. 重症患者谵妄管理专家共识[J]. 中华内科杂志, 2019, 58(2): 108-118. DOI:10.3760/cma.j.issn.0578-1426.2019.02.007 |
| [14] | Zaal IJ, Devlin JW, Peelen LM, et al. A systematic review of risk factors for delirium in the ICU[J]. Crit Care Med, 2015, 43(1): 40-47. DOI:10.1097/CCM.0000000000000625 |
| [15] | Ouimet S, Kavanagh BP, Gottfried SB, et al. Incidence, risk factors and consequences of ICU delirium[J]. Intensive Care Med, 2007, 33(1): 66-73. DOI:10.1007/s00134-006-0399-8 |
| [16] | 孙振球, 徐勇勇. 医学统计学[M]. 4版. 北京: 人民卫生出版社, 2014. |
| [17] | Girard TD, Thompson JL, Pandharipande PP, et al. Clinical phenotypes of delirium during critical illness and severity of subsequent long-term cognitive impairment: a prospective cohort study[J]. Lancet Respir Med, 2018, 6(3): 213-222. DOI:10.1016/S2213-2600(18)30062-6 |
| [18] | Tauber SC, Djukic M, Gossner J, et al. Sepsis-associated encephalopathy and septic encephalitis: an update[J]. Expert Rev Anti Infect Ther, 2021, 19(2): 215-231. DOI:10.1080/14787210.2020.1812384 |
| [19] | Mazeraud A, Righy C, Bouchereau E, et al. Septic-associated encephalopathy: a comprehensive review[J]. Neurotherapeutics, 2020, 17(2): 392-403. DOI:10.1007/s13311-020-00862-1 |
| [20] | Gao W, Zhang YP, Jin JF. Poor outcomes of delirium in the intensive care units are amplified by increasing age: a retrospective cohort study[J]. World J Emerg Med, 2021, 12(2): 117-123. DOI:10.5847/wjem.j.1920-8642.2021.02.006 |
| [21] | Bramley P, McArthur K, Blayney A, et al. Risk factors for postoperative delirium: an umbrella review of systematic reviews[J]. Int J Surg, 2021, 93: 106063. DOI:10.1016/j.ijsu.2021.106063 |
| [22] | Marcantonio ER. Delirium in hospitalized older adults[J]. N Engl J Med, 2017, 377(15): 1456-1466. DOI:10.1056/NEJMcp1605501 |
| [23] | Cerejeira J, Batista P, Nogueira V, et al. Low preoperative plasma cholinesterase activity as a risk marker of postoperative delirium in elderly patients[J]. Age Ageing, 2011, 40(5): 621-626. DOI:10.1093/ageing/afr053 |
| [24] | Giamarellos-Bourboulis EJ, Norrby-Teglund A, Mylona V, et al. Risk assessment in sepsis: a new prognostication rule by APACHE Ⅱ score and serum soluble urokinase plasminogen activator receptor[J]. Crit Care, 2012, 16(4): R149. DOI:10.1186/cc11463 |
| [25] | Zaal IJ, Devlin JW, Hazelbag M, et al. Benzodiazepine-associated delirium in critically ill adults[J]. Intensive Care Med, 2015, 41(12): 2130-2137. DOI:10.1007/s00134-015-4063-z |
| [26] | 王桥生, 罗琼, 蒋志华, 等. 以eCASH理念为基础的镇静策略对ICU患者的效果[J]. 中华急诊医学杂志, 2021, 30(2): 226-230. DOI:10.3760/cma.j.issn.1671-0282.2021.02.017 |
| [27] | Pfister D, Siegemund M, Dell-Kuster S, et al. Cerebral perfusion in sepsis-associated delirium[J]. Crit Care, 2008, 12(3): R63. DOI:10.1186/cc6891 |
| [28] | Girard TD, Ware LB, Bernard GR, et al. Associations of markers of inflammation and coagulation with delirium during critical illness[J]. Intensive Care Med, 2012, 38(12): 1965-1973. DOI:10.1007/s00134-012-2678-x |
| [29] | 张迎新, 王维, 李冠华, 等. 外科Apgar评分预测开腹大手术后谵妄的回顾性病例对照研究[J]. 临床与病理杂志, 2021, 41(4): 824-831. DOI:10.3978/j.issn.2095-6959.2021.04.015 |
| [30] | Iba T, Levy JH, Warkentin TE, et al. Diagnosis and management of sepsis-induced coagulopathy and disseminated intravascular coagulation[J]. J Thromb Haemost, 2019, 17(11): 1989-1994. DOI:10.1111/jth.14578 |
| [31] | 赵会鑫, 宋振举, 邵勉. 脓毒症凝血病诊断标准的研究进展[J]. 中华急诊医学杂志, 2022, 31(7): 991-996. DOI:10.3760/cma.j.issn.1671-0282.2022.07.032 |
| [32] | van den Boogaard M, Pickkers P, Slooter AJ, et al. Development and validation of PRE-DELIRIC (PREdiction of DELIRium in ICu patients) delirium prediction model for intensive care patients: observational multicentre study[J]. BMJ, 2012, 344: e420. DOI:10.1136/bmj.e420 |
| [33] | Wassenaar A, van den Boogaard M, van Achterberg T, et al. Multinational development and validation of an early prediction model for delirium in ICU patients[J]. Intensive Care Med, 2015, 41(6): 1048-1056. DOI:10.1007/s00134-015-3777-2 |
| [34] | Monard C, Meersch-Dini M, Joannidis M. When the kidneys hurt, the other organs suffer[J]. Intensive Care Med, 2023, 49(2): 233-236. DOI:10.1007/s00134-022-06925-5 |
| [35] | Siew ED, Fissell WH, Tripp CM, et al. Acute kidney injury as a risk factor for delirium and Coma during critical illness[J]. Am J Respir Crit Care Med, 2017, 195(12): 1597-1607. DOI:10.1164/rccm.201603-0476OC |
 2024, Vol. 33
2024, Vol. 33