近三分之一因流感住院的成年人存在肺炎,并与ICU住院和死亡相关。老年患者和有某些基础疾病的患者更为显著[1]。在流感病毒和新型冠状病毒感染患者中,2型糖尿病尤其是老年患者,发生严重感染与不良结局的风险增加[2-3]。但是,糖尿病患者发生严重呼吸道感染的风险存在明显的异质性,在年龄较大、男性、非白人种族和贫困程度较高的人群的风险更高[4],一些可改变的危险因素,如身体质量指数偏大、基础血糖偏高和血糖变异性较大等,也会导致重症感染的风险增加[5]。在一项调查研究中表明,血糖控制不佳的糖尿病患者,特别是未发现的糖尿病患者,与罹患COVID-19并需要住院治疗具有明显的关联,且糖化血红蛋白(glycated haemoglobin A1c, HbA1c) 水平升高是COVID-19的危险因素[6]。然而,HbA1c作为糖尿病的一项辅助诊断指标,以及血糖控制状态的一个评价指标,它是否可作为判断流感肺炎患者预后的指标,尚未得到充分研究。本研究旨在探讨HbA1c水平与流感肺炎患者死亡风险的相关性。
1 资料与方法 1.1 研究对象本研究为单中心回顾性研究,收集2017年至2019年首都医科大学附属北京朝阳医院急诊留观或住院部的流感肺炎患者。
流感肺炎诊断标准:①流感流行季节,以发热和(或)急性呼吸道症状起病;②甲型或乙型流感病毒核酸阳性或抗原阳性;③胸片或胸CT显示支气管周围渗出影,或肺组织片状浸润影、叶/节段实变影、磨玻璃影,或肺间质改变。纳入标准:①年龄≥ 18周岁;②诊断为流感肺炎;③住院或急诊留观。排除标准:①年龄 < 18周岁;②妊娠;③流感或肺炎诊断依据不足者;④临床重要研究数据缺失。
本研究经北京朝阳医院机构审查委员会和医学伦理委员会批准(伦理批准号:2023-科-6)。由于研究设计和数据分析匿名进行,因此本研究豁免知情同意。
1.2 研究方法临床资料:收集研究周期内诊断为流感肺炎患者的人口统计学信息(性别、年龄)、基础疾病,和就诊时的流感病毒核酸或抗原结果、胸片或胸CT报告、血常规结果、生化指标、HbA1c水平、降钙素原(procalcitonin, PCT) 水平,以及临床转归。
分组方法:本研究依据28 d死亡分为生存组和死亡组,对于28 d内出院患者进行电话随访,以确定临床结局。
1.3 统计学方法本研究采用Shapiro-Wilk法对定量资料进行正态性检验,符合正态分布的数据使用均数±标准差(x±s) 描述,使用Student's t检验比较组间差异;不符合正态分布的数据使用中位数(下四分位数,上四分位数)[M (Q1, Q3)] 描述,使用Mann-Whitney U检验比较组间差异。二分类资料使用频数(%) 描述,使用χ2检验或Fisher精确概率检验比较组间差异。采用Cox回归分析28 d死亡的危险因素,采用基于似然比检验的逐步向前法筛选自变量,相对危险度用风险比(hazard ratio, HR) 和95 % 置信区间(confidence interval, CI) 表示。描绘Kaplan-Meier生存曲线对影响28 d死亡的危险因素进行生存分析。采用SPSS 23.0 (IBM SPSS Statistics for Windows, version 21.0; Armonk, NY, USA) 统计软件进行数据分析及画图,以P < 0.05为差异有统计学意义。
2 结果本研究筛选了首都医科大学附属北京朝阳医院急诊留观和住院流感肺炎患者196例,根据排除标准排除74例,最终纳入研究对象122例,依据28 d临床结局分为生存组94 (77.0 %) 例和死亡组28 (23.0 %) 例。
2.1 流感肺炎患者28 d死亡组与生存组的临床资料的比较本研究首先对入选患者的性别、年龄、基础疾病、血常规、随机血糖、HbA1c和PCT进行了单因素分析,发现与生存组相比,死亡患者淋巴细胞计数降低,HbA1c和PCT升高(均P < 0.05),见表 1。
| 变量 | 总人数(n=122) | 生存组(n=94) | 死亡组(n=28) | Z/χ2/t值 | P值 |
| 性别[男,n (%)] | 86 (70.5) | 68 (72.3) | 18 (64.3) | 0.673 | 0.412 |
| 年龄(岁) | 60.0 (47.8, 70.3) | 59.0 (47.0, 68.3) | 61.0 (51.5, 77.3) | 1.206 | 0.228 |
| 基础疾病[n (%)] | |||||
| 器官移植 | 5 (4.1) | 2 (2.1) | 3 (10.7) | 2.157 | 0.142 |
| 自身免疫性疾病口服激素 | 3 (2.5) | 2 (2.1) | 1 (3.6) | 0.546 | |
| 恶性肿瘤 | 2 (1.6) | 2 (2.1) | 0 (0.0) | 0.999 | |
| 慢性呼吸道疾病 | 15 (12.3) | 12 (12.8) | 3 (10.7) | 0.001 | 0.999 |
| 慢性心衰 | 2 (1.6) | 2 (2.1) | 0 (0.0) | 0.999 | |
| 慢性肾病 | 6 (4.9) | 3 (3.2) | 3 (10.7) | 1.250 | 0.264 |
| 糖尿病 | 36 (29.5) | 27 (28.7) | 9 (32.1) | 0.121 | 0.728 |
| 高血压 | 57 (46.7) | 43 (45.7) | 14 (50.0) | 0.157 | 0.692 |
| 冠心病 | 23 (18.9) | 17 (18.1) | 6 (21.4) | 0.158 | 0.691 |
| 实验室检查 | |||||
| WBC (×109/L) | 6.78 (4.18, 10.49) | 7.03 (4.42, 9.96) | 6.02 (3.75, 12.77) | - 0.280 | 0.779 |
| NE (×109/L) | 5.10 (3.26, 8.28) | 5.12 (3.48, 7.80) | 4.82 (3.23, 10.86) | 0.240 | 0.810 |
| LY (×109/L) | 0.68 (0.44, 1.10) | 0.77 (0.49, 1.23) | 0.49 (0.33, 0.73) | - 3.008 | 0.003 |
| HGB (g/L) | 134 ± 22 | 135 ± 21 | 132 ± 26 | 0.740 | 0.461 |
| HCT (%) | 38.8 ± 6.2 | 39.2 ± 6.0 | 37.5 ± 6.9 | 1.251 | 0.213 |
| PLT (×109/L) | 152 (110, 205) | 155 (109, 210) | 140 (111, 187) | - 1.020 | 0.308 |
| GLU (mmol/L) | 8.1 (6.3, 9.7) | 7.5 (6.0, 9.6) | 9.1 (7.0, 10.1) | 1.877 | 0.061 |
| HbA1c (%) | 6.2 (5.8, 6.9) | 6.1 (5.7, 6.8) | 6.5 (6.1, 7.1) | 2.203 | 0.028 |
| PCT (μg/L) | 0.24 (0.06, 1.11) | 0.16 (0.05, 0.87) | 0.64 (0.20, 6.43) | 2.594 | 0.009 |
| 注:连续变量表示为 x±s或M (Q1, Q3);WBC:白细胞计数,NE:中性粒细胞计数,LY:淋巴细胞计数,HGB:血红蛋白,HCT:红细胞压积,PLT:血小板计数,GLU:入院时随机血糖,HbA1c,糖化血红蛋白,PCT,降钙素原 | |||||
本研究以28 d死亡为因变量,进一步把年龄、淋巴细胞计数、HbA1c和PCT纳入Cox多因素回归方程,校正年龄后,发现淋巴细胞计数和HbA1c是28 d死亡的独立危险因素,见表 2。
| 危险因素 | B | SE. | Wald | df | P值 | HR | 95% CI for HR | |
| Lower | Upper | |||||||
| 年龄(岁) | 0.015 | 0.014 | 1.288 | 1 | 0.256 | 1.016 | 0.989 | 1.043 |
| LY (×109/L) | -1.348 | 0.556 | 5.870 | 1 | 0.015 | 0.260 | 0.087 | 0.773 |
| HbA1c (%) | 0.259 | 0.129 | 4.045 | 1 | 0.044 | 1.295 | 1.007 | 1.666 |
| 注:LY:淋巴细胞计数,HbA1c:糖化血红蛋白 | ||||||||
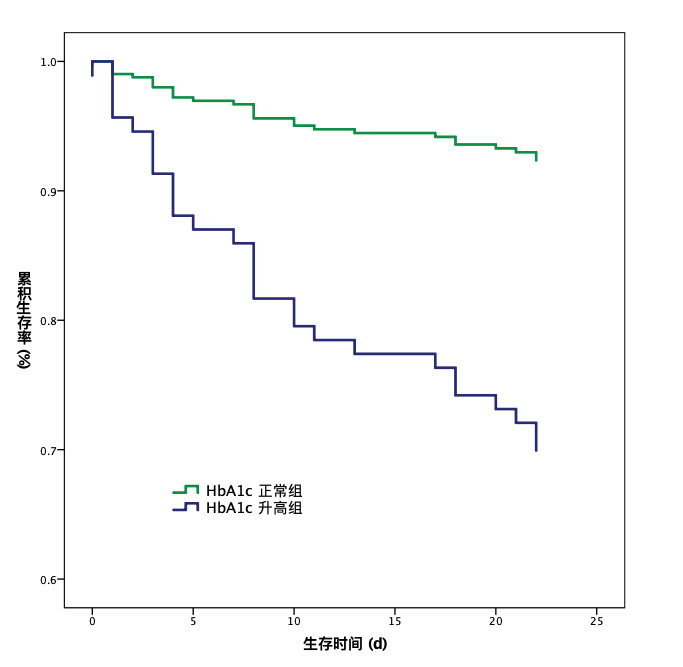
最后,笔者以HbA1c预测28 d死亡风险的约登指数最大点为界,计算截断值为HbA1c > 5.9 %,敏感度为89.3 %,特异度为39.4 %,并以HbA1c > 5.9 % 把入选研究对象分为HbA1c升高组和HbA1c正常组。在HbA1c升高组,28 d死亡25例,病死率30.5 %,在HbA1c正常组,28 d死亡3例,病死率7.5 %。HbA1c升高组的28 d病死率显著高于HbA1c正常组,χ2 =8.034,P =0.005。Cox生存分析得出HR=4.497, 95% CI: 1.355~14.930, P=0.014,描绘Kaplan-Meier生存曲线分析HbA1c对流感肺炎患者28 d死亡的影响,见图 1。
|
| 图 1 糖化血红蛋白(HbA1c)升高与正常的流感肺炎患者的生存曲线(随访至28 d) Fig 1 Survival curves for influenza pneumonia patients with and without elevated HbA1c (follow-up to 28 days) |
|
|
本研究针对在流感流行季节,甲型或乙型流感相关的肺炎患者,发现校正年龄因素后,淋巴细胞计数降低和HbA1c水平升高是28 d死亡的独立危险因素。流感病毒感染后,在严重的病例中,宿主免疫内环境平衡紊乱,先后出现过度炎症期和免疫抑制期,统称为病毒性脓毒症[7]。淋巴细胞减少是严重流感病毒感染的典型特征,本研究结果也证实淋巴细胞计数降低与死亡独立相关。在笔者的既往对流感患者T细胞亚群的研究中,也证实了CD8+T细胞计数是死亡的预测指标[8]。淋巴细胞减少并不是流感病毒感染所特有的,其他呼吸道病毒感染的重症患者,包括SARS-CoV-2,也可能出现外周血淋巴细胞计数减少[9-10]。但淋巴细胞减少的分子机制尚不清楚,病毒直接感染淋巴细胞和细胞因子诱导的细胞死亡的作用仍有待探讨[11]。
既往研究证实,PCT可作为脓毒症患者危险分层的有效标志物,反映细菌感染引起的系统性炎症水平[12]。笔者先前使用PCT评价流感患者的预后,其意义在于PCT水平升高提示流感合并细菌感染带来的额外死亡风险[13]。本研究结果显示,PCT水平在死亡组显著高于生存组,但在Cox多因素回归模型中,PCT并未被筛选为死亡独立相关因素。关于其对流感肺炎患者死亡风险的预测价值,仍需扩大样本量进一步研究验证,但其升高需引起临床医生的对细菌合并感染及预后不良的警惕。
血糖异常患者免疫功能受损,对病毒或细菌的易感性增加,且死于感染的可能性是一般人群的2倍[14]。然而,通过表 1可以看出,病史中提供糖尿病信息或入院时随机血糖,在死亡组与生存组中差异无统计学意义,这提示糖尿病史与随机血糖测定并不能对预后判断产生充足的依据。究其原因,笔者认为与一些患者处于糖尿病前期甚至糖尿病状态而没有发现,以及一些糖尿病患者血糖控制不佳有关。在丹麦一项对SARS-CoV-2、流感病毒或细菌引起的社区获得性肺炎患者中,发现15.2% 患有已知糖尿病,6.1%患有未确诊的糖尿病,51.3 % 为糖尿病前期,81%有高血糖[15]。这项研究数据证实了笔者的推测,提示了未确诊的糖尿病、糖尿病前期以及血糖控制不佳的患者可能存在着较高的隐匿的死亡风险。在危及生命的急性感染患者,难以实施详细而充分的糖代谢状态评估,HbA1c检测不失为一项简洁有效的措施。有学者认为,与肺炎或流感相比,COVID-19与可改变风险因素如身体质量指数、较高的HbA1c相关性更强[16]。而新近一项以糖尿病患者为对象的队列研究表明,血糖控制不良和严重肥胖始终与COVID-19、流感和肺炎住院风险增加和严重结局一致相关,尤其是在70岁以下的人群中,HbA1c和身体质量指数相关的相对风险最高[17]。类似的,一项瑞典的研究对2型糖尿病患者HbA1c水平进行分层,发现HbA1c水平与脓毒症的发生风险呈U型相关,而发生脓毒症时,全因病死率增加4倍[18]。在本研究中,HbA1c升高的流感肺炎患者死亡风险是HbA1c正常者的4.497 (95% CI: 1.355~14.930) 倍。本研究结论与这些发现相一致,进一步证实了未诊断的糖尿病与血糖控制不佳相对于血糖控制良好的流感肺炎患者,带来的额外的死亡风险。
本研究根据约登指数最大点计算出以HbA1c > 5.9 % 为预测流感肺炎患者28 d死亡风险增加的界值,美国糖尿病协会2023年发布的《病诊断和管理实验室分析的指南和建议》[19],以HbA1c ≥ 6.5 % 为诊断糖尿病的界值。HbA1c用于预测流感肺炎患者预后的截断值低于用于诊断糖尿病的截断值,初步提示流感肺炎患者可能需要更加严格的血糖控制以改善预后,后续仍然需要扩大样本量进一步研究阐明。本研究还发现,以HbA1c > 5.9 % 为预测流感肺炎患者28 d死亡风险有较高的敏感度89.3 %,也进一步印证了HbA1c水平升高是独立的危险因素,且具有较高的风险比;预测的特异度较低,为39.4 %,提示HbA1c正常的患者,也不一定是死亡的低风险人群,说明影响流感肺炎患者死亡的危险因素众多,尚有很多因素未被纳入本研究,有待于后续研究。
本研究存在一定局限性。第一,本研究病例来源于单中心,存在一定选择偏倚,样本量偏小,结果仍需多中心、大样本研究重复验证,增强研究结论的外部推广性和临床实用性。第二,HbA1c在一定程度上可反应糖尿病患者血糖的控制程度,也可筛查出一部分未确诊的糖尿病患者,但由于是回顾性研究,根据诊疗规范,临床医生通过临床评价对糖尿病患者、随机血糖异常患者以及有糖尿病潜在风险的患者开具了HbA1c检查,未能形成HbA1c筛查的标准化方案,因此,需要进一步设计前瞻性队列研究以校正HbA1c的最佳截点值。第三,本研究未能获取研究人群流感病毒感染前血糖基线值,以及对血糖连续监测值得出的血糖变异性,未能获取到血糖的全面监测数据加以充分分析。
综上所述,HbA1c水平在一定程度上反映了急性感染患者近期血糖控制情况,可作为预测流感肺炎患者28 d死亡的标志物,有助于提示临床医生在治疗流感肺炎的过程中,关注并强化控制血糖,降低血糖控制不佳对流感肺炎患者带来的额外死亡负担。同时,建议在流感流行季节,加强监测并控制血糖,防止流感病毒感染增加严重感染的风险。
利益冲突 所有作者声明无利益冲突
作者贡献声明 腾飞研究设计与实施、数据分析、文章撰写;李子怡、赵海洋、李道荣研究实施、数据收集与整理;何新华研究指导、支持性贡献以及对文章内容做批评性审阅与修改
| [1] | Garg S, Jain S, Dawood FS, et al. Pneumonia among adults hospitalized with laboratory-confirmed seasonal influenza virus infection-United States, 2005-2008[J]. BMC Infect Dis, 2015, 15: 369. DOI:10.1186/s12879-015-1004-y |
| [2] | Roncon L, Zuin M, Rigatelli G, et al. Diabetic patients with COVID-19 infection are at higher risk of ICU admission and poor short-term outcome[J]. J Clin Virol, 2020, 127: 104354. DOI:10.1016/j.jcv.2020.104354 |
| [3] | Owusu D, Rolfes MA, Arriola CS, et al. Rates of severe influenza-associated outcomes among older adults living with diabetes-influenza hospitalization surveillance network (FluSurv-NET), 2012-2017[J]. Open Forum Infect Dis, 2022, 9(5): ofac131. DOI:10.1093/ofid/ofac131 |
| [4] | Mc Gurnaghan SJ, Weir A, Bishop J, et al. Risks of and risk factors for COVID-19 disease in people with diabetes: a cohort study of the total population of Scotland[J]. Lancet Diabetes Endocrinol, 2021, 9(2): 82-93. DOI:10.1016/S2213-8587(20)30405-8 |
| [5] | Zhu LH, She ZG, Cheng X, et al. Association of blood glucose control and outcomes in patients with COVID-19 and pre-existing type 2 diabetes[J]. Cell Metab, 2020, 31(6): 1068-1077.e3. DOI:10.1016/j.cmet.2020.04.021 |
| [6] | Hamer M, Gale CR, Batty GD. Diabetes, glycaemic control, and risk of COVID-19 hospitalisation: population-based, prospective cohort study[J]. Metabolism, 2020, 112: 154344. DOI:10.1016/j.metabol.2020.154344 |
| [7] | Xu JY, Yu JP, Yang LN, et al. Influenza virus in community-acquired pneumonia: current understanding and knowledge gaps[J]. Semin Respir Crit Care Med, 2020, 41(4): 555-567. DOI:10.1055/s-0040-1710584 |
| [8] | 腾飞, 梅雪, 郭树彬. 氧合指数联合T细胞亚群计数判断流感相关脓毒症患者预后的临床价值[J]. 中国急救医学, 2019, 39(5): 452-456. DOI:10.3969/j.issn.1002-1949.2019.05.011 |
| [9] | Huang CL, Wang YM, Li XW, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497-506. DOI:10.1016/S0140-6736(20)30183-5 |
| [10] | Wang ZD, Song CY, Yang DG, et al. Comparison of clinical and immunological profiles in coronavirus disease 2019 and influenza patients: a case control study[J]. World J Emerg Med, 2022, 13(4): 309-312. DOI:10.5847/wjem.j.1920-8642.2022.042 |
| [11] | Méndez R, Menéndez R, Amara-Elori I, et al. Lymphopenic community-acquired pneumonia is associated with a dysregulated immune response and increased severity and mortality[J]. J Infect, 2019, 78(6): 423-431. DOI:10.1016/j.jinf.2019.04.006 |
| [12] | Ren EF, Xiao HL, Wang GX, et al. Value of procalcitonin and presepsin in the diagnosis and severity stratification of sepsis and septic shock[J]. World J Emerg Med, 2024, 15(2): 135-138. DOI:10.5847/wjem.j.1920-8642.2024.028 |
| [13] | Teng F, Wan TT, Guo SB, et al. Outcome prediction using the Mortality in Emergency Department Sepsis score combined with procalcitonin for influenza patients[J]. Med Clin, 2019, 153(11): 411-417. DOI:10.1016/j.medcli.2019.03.021 |
| [14] | Carey IM, Critchley JA, DeWilde S, et al. Risk of infection in type 1 and type 2 diabetes compared with the general population: a matched cohort study[J]. Diabetes Care, 2018, 41(3): 513-521. DOI:10.2337/dc17-2131 |
| [15] | Ryrsø CK, Dungu AM, Hegelund MH, et al. Body composition, physical capacity, and immuno-metabolic profile in community-acquired pneumonia caused by COVID-19, influenza, and bacteria: a prospective cohort study[J]. Int J Obes, 2022, 46(4): 817-824. DOI:10.1038/s41366-021-01057-0 |
| [16] | Ho FK, Celis-Morales CA, Gray SR, et al. Modifiable and non-modifiable risk factors for COVID-19, and comparison to risk factors for influenza and pneumonia: results from a UK Biobank prospective cohort study[J]. BMJ Open, 2020, 10(11): e040402. DOI:10.1136/bmjopen-2020-040402 |
| [17] | Hopkins R, Young KG, Thomas NJ, et al. Risk factor associations for severe COVID-19, influenza and pneumonia in people with diabetes to inform future pandemic preparations: UK population-based cohort study[J]. BMJ Open, 2024, 14(1): e078135. DOI:10.1136/bmjopen-2023-078135 |
| [18] | Balintescu A, Lind M, Franko MA, et al. Glycemic control and risk of sepsis and subsequent mortality in type 2 diabetes[J]. Diabetes Care, 2022, 45(1): 127-133. DOI:10.2337/dc21-1050 |
| [19] | Sacks DB, Arnold M, Bakris GL, et al. Guidelines and recommendations for laboratory analysis in the diagnosis and management of diabetes mellitus[J]. Diabetes Care, 2023, 46(10): e151-e199. DOI:10.2337/dci23-0036 |
 2024, Vol. 33
2024, Vol. 33