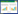一氧化氮(nitric oxide, NO)是一种无色、无刺激性气味的气体,具有脂溶性,广泛分布于人体各组织,可以快速透过细胞膜扩散,参与调控细胞的生理活动,是细胞间重要的信号传导分子。外源性吸入时,NO是一种选择性肺血管扩张剂,为肺动脉高压、新生儿低氧性呼吸衰竭的有效治疗手段,临床应用长达二十余年,其安全性和有效性已得到验证,并且应用范围逐渐拓展至急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、重症肺炎、高原肺水肿(high altitude pulmonary edema, HAPE)、急性肺栓塞(acute pulmonary embolism, APE)、心力衰竭和手术后严重低氧血症等急危重症并取得良好效果。
吸入一氧化氮(inhaled nitric oxide, iNO)疗法在临床使用时通常使用百万分之一单位表示气体浓度(×10-6),常见设备采用ppm(parts per million)来表示计量单位,与国际标准单位质量-体积浓度(即mg/m3)之间的简化换算公式为:Y=30/22.4·X,式中Y为NO以mg/m3表示的浓度值,X为NO以ppm表示的浓度值[1]。
建议选择医用NO气体用于临床治疗。目前临床使用的iNO设备根据气体来源可分为传统高压气瓶类和即时发生类:高压气瓶类iNO设备传统上称之为“NO气体流量控制仪”,使用含氮气/NO混合气的高压气瓶作为NO气体的来源,国内已有钢瓶存储的医用NO气体作为吸入制剂获批,但适应证仅限于新生儿;即时发生类是将NO即时生成、NO输送和监测模块整合的iNO医疗设备,全球范围内共有四氧化二氮裂解法、电化学催化还原法和高压电弧放电法三种技术路线,其中后两种方法学国内已有相应设备获批用于临床。
国际上iNO疗法相关的临床研究和实践经验丰富,多次制定和更新iNO在小儿和成人中的应用指南和专家共识。但我国iNO的应用起步较晚,随着国内医疗级NO气体治疗设备投入临床使用,将面临适用患者人群、用法用量、以及安全性监测和撤机等问题。因此,本共识专家组制定了《吸入一氧化氮治疗在急危重症中的临床应用专家共识》,以期为临床合理应用iNO治疗急危重症儿童和成人患者提供参考。
本共识通过国际实践指南注册与透明化平台(Practice Guideline Registration for Transparency, PREPARE)进行注册,注册号PREPARE-2024CN152。共识由专家组围绕iNO在急危重症中的临床应用这一关键问题,检索数据库包括Pubmed、Web of Science、Embase、Cochrance Library、万方数据知识服务平台、中国知网、维普数据库等;检索时限为建库至2024年3月31日。结合国内外相关研究进展、指南、专家共识等,通过四次会议讨论、修改,最终定稿。本共识结合风险利弊、结论可推广性、适宜性以及资源利用等方面,借鉴GRADE(Grading of Recommendations Assessment, Development and Evaluations)指南意见,形成证据等级和推荐等级意见(表 1)。将推荐等级分为“强推荐、弱推荐”两个等级。当明确显示干预措施利大于弊或弊大于利时,视为强推荐;当利弊不确定或无论质量高低的证据均显示利弊相当时,则视为弱推荐。
| 等级 | 说明 |
| 证据等级 | |
| Ⅰ(高等级) | 高质量的随机对照临床研究(RCT)、权威指南以及高质量系统综述和Meta分析 |
| Ⅱ(中等级) | 有一定研究局限性的RCT研究(如无隐藏分组、未设盲、未报告失访)、队列研究、病例系列研究以及病例对照研究等 |
| Ⅲ(低等级) | 专家共识/声明、专家意见、病例报道、高质量动物实验等 |
| 推荐等级 | |
| 强推荐 | 明确显示干预措施利大于弊或弊大于利 |
| 弱推荐 | 利弊不确定或无论质量高低的证据均显示利弊相当 |
NO的半衰期仅3~5 s,吸入后经被动扩散迅速到达通气肺区域的肺血管平滑肌细胞,通过环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)途径降低细胞内游离钙离子的浓度,从而舒张肺小动脉平滑肌,降低肺动脉压力(pulmonary artery pressure,PAP)以及肺血管阻力(pulmonary vascular resistance,PVR);降低右心后负荷从而改善右心功能,并且对体循环血流动力学无明显影响[2-3]。另外,NO只作用于通气功能良好的肺区域,不会在萎陷的肺组织中造成血管扩张,通过减少肺内分流从而改善通气/血流比值,改善动脉血氧合状况[4]。NO还可减少缺血再灌注损伤(ischemia-reperfusion injury,IRI),起到器官保护的作用。研究发现,IRI情况下外源性补充NO可以增加其生物利用度,抑制氧化应激、中性粒细胞、白细胞与内皮细胞黏附、细胞炎症因子释放和细胞凋亡等多种保护机制[5]。
吸入的NO扩散至血液后迅速与血红蛋白结合而失活,通过亚硝基化反应被代谢转化为硝酸盐、亚硝酸盐主要由肾脏排出体外。因而连续长时间的吸入治疗不会导致NO在体内的蓄积,并且不易被胎盘代谢[6],在妊娠合并肺动脉高压、顽固性低氧血症以及羊水栓塞的孕产妇中也有应用。iNO最早用于治疗新生儿持续性肺动脉高压以及低氧性呼吸衰竭,安全性良好且不影响远期神经系统发育[7]。
推荐意见1:iNO治疗可用于降低肺动脉高压和右心后负荷,改善动脉氧合,减少缺血再灌注损伤,保护器官功能(强推荐,高等级质量证据)。
2 iNO在急危重症中的应用 2.1 ARDSARDS的主要特征是肺通气-灌注不匹配和分流增加,从而导致严重低氧血症。NO可选择性调节肺血流,改善肺通气-灌注匹配,降低PAP[8]。国外流行病学调查发现iNO在ARDS患者中的使用率高达24.9%~65.8%,并且呈上升趋势[9]。大多临床研究显示iNO可改善ARDS患者的氧合[3],NO浓度集中在5~20 ppm,最高达40 ppm,治疗时间最长达30 d。iNO联合俯卧位通气对氧合的改善更为显著[10-11]。此外,5 ppm iNO对患者长期肺功能有改善作用[12]。5~10 ppm iNO在儿童ARDS中还缩短了机械通气时间和住院时间,提高无体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)生存率[13-14],以及长期预后[15]。
早期RCT研究显示iNO并未降低短期及中长期死亡风险[3, 16],甚至长时间iNO治疗可能会增加肾损伤的发生风险[3, 17-18]。但有指南和综述指出[19-22],iNO未能改善病死率的最主要原因是ARDS的主要死因可能是多器官功能障碍,而非低氧,并且早期研究并未采用肺保护性通气策略;iNO在ARDS中急性肾损伤的不利结果也可能受合并用药、病情严重程度等混杂因素影响,需通过检测NO代谢产物和肾脏生物标志物等明确这一结论的合理性。
基于目前的证据,共识组认为,5~20 ppm iNO有利于改善ARDS患者氧合,联合俯卧位和保护性通气策略可能有更好的临床获益。
推荐意见2:对于常规治疗无效的ARDS患者,可以考虑加用iNO,常用的浓度范围5~20 ppm(强推荐,高等级质量证据)。
推荐意见3:iNO可考虑联合俯卧位通气改善氧合(强推荐,中等级质量证据)。
2.2 重症肺炎早期临床研究显示,社区获得性单侧细菌性肺炎合并呼吸衰竭患者接受5 ppm iNO短期治疗后肺内分流和动脉氧合即可获得明显改善[23]。在严重急性呼吸综合征(severe acute respiratory syndrome, SARS)流行期间,一项临床对照试验对6例重症SARS患者给予高达30 ppm iNO治疗至少3 d,可显著改善动脉氧合,降低呼吸支持条件,并减少肺浸润扩散[24]。中东呼吸综合征和甲型流感病毒H1N1大流行期间的流行病学调查研究显示,重症患者使用iNO改善氧合的需求分别为20%和36%[25-26]。
此外体外和动物实验证实了高浓度NO(160~300 ppm)具有抗病毒和抗菌效应[27],并在健康人体中验证了高浓度iNO 160 ppm,每次持续30 min,每天5次,连续5 d给药方案的可行性和安全性[28]。在COVID-19流行期间,iNO不仅改善COVID-19患者的短期氧合,还可减少ECMO的使用,中位持续时间长达2.8~11.0 d[29-31]。80 ppm连续给药与160 ppm以上浓度间歇性给药还可以使COVID-19患者的病毒载量下降更快,甚至适用于孕产妇,且无毒性和不良事件报道,提示高浓度iNO抗病毒的可能性[32-36]。
还有一些小样本研究采用间歇性高浓度iNO给药方案治疗多重耐药细菌或真菌感染的囊性纤维化患者以及难治性非结核分枝杆菌肺部感染患者,均可显著降低这些患者的肺内微生物负荷,但未能实现微生物根除[27]。
基于目前的证据,iNO在重症肺炎中存在临床可用性,主要用于改善严重低氧血症的氧合状态,高浓度可能降低病原微生物载量。
推荐意见4:iNO常规浓度改善重症肺炎相关低氧血症患者短期氧合(强推荐,高等级质量证据)。
推荐意见5:高浓度(≥80 ppm)iNO可能降低肺部感染患者病原微生物载量(弱推荐,中等级质量证据)。
2.3 HAPEHAPE的发生机制仍不十分明确,目前认为过度低氧性肺血管收缩导致的肺动脉高压为主要的病理生理学改变之一[37]。早期临床研究模拟了低氧条件,即吸入氧气浓度百分比(fraction of inspired oxygen,FiO2)为12%时,6 min内平均肺动脉压(mean pulmonary artery pressure,mPAP)明显升高,随即吸入40 ppm NO,mPAP恢复至常氧状态时的水平,可迅速逆转低氧所致的PAP升高而不引起全身血管扩张[38]。1996年首个HAPE人体研究中iNO浓度为40 ppm,15 min后观察到平均肺动脉收缩压降低,通过肺灌注扫描显示iNO更易进入非水肿的肺泡,引起肺小动脉舒张,促使肺部血流由水肿区域向非水肿区域转移,减轻水肿区域的过度灌注[39]。另一项临床对照试验采用iNO 15 ppm联合50% O2单次30 min较单独iNO对肺血流动力学和气体交换的改善更显著[40]。国内临床采用的iNO治疗方案多为10~20 ppm,每次30 min~2 h,一天治疗1~2次,治疗天数视病程而定,通常1~5 d,结果均提示HAPE患者的血氧饱和度得到明显改善,肺部X线阴影消失时间和病程日数显著缩短[41-43]。尚待开展大样本量、RCT确证。
推荐意见6:iNO可降低HAPE患者肺动脉高压,改善气体交换和氧合,缩短病程。建议iNO浓度为10~20 ppm,治疗时长每次30 min~2 h,一天治疗1~2次(强推荐,中等级质量证据)。
2.4 APE机械性梗阻及缺氧导致的一系列神经体液因素和血小板活化等因素导致的肺动脉收缩共同构成了APE患者PVR剧增的病理生理基础。患者表现为不同程度的急性右室功能不全、低氧血症和心源性休克(cardiogenic shock, CS)[44]。iNO通过快速扩张肺动脉、降低肺循环阻力,达到降低右心室后负荷、改善血流动力学状态以及氧合目的[45-46]。该治疗手段已被列为儿童高危APE的支持治疗手段之一[46]。iNO 25 ppm联合吸氧治疗持续2 h用于成人严重次大面积APE的Ⅰ期临床试验显示,能够显著改善APE患者的Borg评分、动脉血氧饱和度以及血流动力学状态[47]。一项针对中高危APE合并右心功能障碍的RCT的Ⅱ期临床研究显示:在抗凝等常规治疗基础上接受iNO 50 ppm联合吸氧治疗24 h,可以改善右心室扩张,增强右心室运动能力,尽管该研究并未达到肌钙蛋白和超声心动图恢复正常比例的临床观察终点[48]。
推荐意见7:对于中高危和高危APE患者,常规治疗效果不佳的情况下,推荐iNO不超过50 ppm联合吸氧,以最大程度地降低肺循环阻力,改善右心室功能和血流动力学状态(弱推荐,中等级质量证据)。
2.5 肺动脉高压肺动脉高压发病机制复杂,因血管内皮功能障碍,内皮细胞型一氧化氮合酶诱导生成的内源性NO减少而内皮素分泌增加导致血管收缩,是肺动脉高压发生的驱动因素之一,由此增加的右心后负荷可能导致最终发展为右心衰竭(right ventricular failure, RVF)[49]。iNO选择性扩张肺血管,降低PAP、PVR以及右心后负荷,改善肺内分流和氧合,而不影响体循环,在五大类肺动脉高压的诊疗和肺动脉高压危象的防治中均有应用[2, 4, 50]。
iNO是肺动脉高压急性血管反应试验(acute vasoreactivity testing,AVT)的主要药物选择,通常使用浓度10~20 ppm,吸入5~10 min[51]。AVT中吸入NO除了用于指导肺动脉高压药物的选择,还常用于成人和儿童肺动脉高压患者手术指征和治疗预后的评估[52-53]。
国际指南推荐,iNO是预防和治疗成人或儿童急危重症患者肺动脉高压危象(pulmonary hypertension crisis,PHC)的首要选择[50, 54-55],根据国外儿科的应用经验,发生PHC者均使用iNO进行急救,最大浓度通常20~80 ppm[56]。
此外,iNO 40 ppm降低慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)所致慢性肺心病急性发作期患者的肺动脉压力,改善急性血流动力学[57],在COPD中重度患者中iNO 10~40 ppm短时间内可快速降低PAP和PVR,改善通气-灌注匹配并缓解患者临床症状,防止运动引起动脉血氧分压(partial pressure of arterial oxygen,PaO2)降低的发生[58-59]。临床报道显示,对于伴肺动脉高压风险的间质性肺病所致低氧性呼吸衰竭患者,iNO治疗10 min即改善通气-灌注匹配,30 min改善氧合状态,以10~20 ppm浓度共治疗2 d,最终避免ECMO的有创使用[60]。在有肺动脉高压风险的纤维化间质性肺病患者中,长期接受iNO也观察到运动能力的改善[61]。对于慢性血栓栓塞性肺动脉高压患者,在球囊肺血管生成术或肺动脉内膜剥脱术的术中或术后接受iNO 20 ppm可降低PVR,改善氧合,且不影响全身血流动力学[50, 62-63]。iNO还可降低慢性肾脏病相关肺动脉高压和肿瘤血栓性微血管病患者的PAP和PVR[64-65]。
推荐意见8:iNO是AVT的主要药物选择,通常使用浓度10~20 ppm,吸入5~10 min(强推荐,高等级质量证据)。
推荐意见9:iNO是预防和治疗PHC的首要选择,推荐使用iNO常规浓度(强推荐,高等级质量证据)。
推荐意见10:iNO改善血流动力学,是肺动脉高压患者在原发病治疗的基础上可考虑的治疗选择,浓度通常不超过40 ppm(弱推荐,高等级质量证据)。
2.6 心力衰竭iNO在RVF患者中的临床应用已受到国际广泛认可,数篇国际指南共识以及综述推荐iNO作为右心功能障碍或衰竭患者的有效治疗手段之一[2, 4, 55, 66-67]。急性右心功能障碍患者接受iNO 10~40 ppm治疗1~7 d可改善血流动力学和右心功能[68-70]。一项双盲RCT在成人急性ST段抬高型心肌梗死成人患者中,经皮冠状动脉介入术后,面罩吸入O2和NO 80 ppm 4 h安全性良好,并且在前4 h心肌再灌注过程中显著增加cGMP血浆水平,保护心脏功能,虽然在48~72 h内没有减少梗死面积,但4个月和1年内显著降低死亡、复发性缺血、中风或再入院的的发生率[71]。然而,有研究报道iNO治疗严重充血性心力衰竭时可能引起急性肺水肿,可能是由于肺血管扩张引起的左心房充盈压突然增加,而不是iNO的直接负性肌力作用所致[72]。iNO在失代偿性左心室功能衰竭患者中的临床获益尚不确定。
推荐意见11:iNO是右心功能障碍或衰竭患者的有效治疗手段之一,建议iNO浓度不超过80 ppm(强推荐,高等级质量证据)。
推荐意见12:对于左心衰竭,临床经验丰富的单位可考虑将iNO作为一种补救措施,使用时应密切关注患者病情变化(弱推荐,低等级质量证据)。
2.7 心脏骤停2021年首次在成人院内心脏骤停患者接受iNO治疗的可行性研究中,与年龄匹配对照的常规治疗相比,心肺复苏后给予iNO 40 ppm 24 h显著提高出院生存率[73]。高质量动物实验在心脏骤停的鼠和猪模型中发现心肺复苏期间给予iNO 20~40 ppm直至自主循环恢复后5 h,可减少心脏损伤,改善血流动力学,生存率和神经系统结局[74-75]。有必要在心脏骤停患者中开展大规模RCT,进一步探究标准治疗基础上增加iNO的临床获益。
推荐意见13:对于心脏骤停患者心肺复苏术后给予20~40 ppm iNO可能提高临床生存获益(弱推荐,低等级质量证据)。
2.8 围手术期iNO在心脏手术以及心、肺和肝移植手术围手术期中的临床获益已较为明确。
iNO通过增强通气-灌注匹配,减少肺内分流从而改善氧合。国内学者的研究显示,冠状动脉搭桥术,心脏瓣膜,升主动脉和全弓置换术等心脏直视手术后难治性低氧血症患者接受iNO 5~10 ppm治疗可即刻改善氧合指数[76]。我国多项临床研究发现,iNO 5 ppm 30 min通过降低肺内分流显著改善急性A型主动脉夹层术后严重低氧血症患者的PaO2/FiO2[77],在常规治疗的基础上接受iNO 5~10 ppm平均治疗3 d,可缩短这类患者的有创机械通气时间,以及ICU和住院时间[78-80]。iNO 5~20 ppm联合常规治疗在心肺移植以及肝移植术后逆转成人和儿童严重低氧血症的临床效果也已在一些小样本临床试验以及病例报道中得到验证[81-83]。
iNO降低PAP,改善右心功能。研究表明,心脏手术围手术期PVR升高的成人和儿童分别对20~40 ppm,10~20 ppm iNO反应良好[84-85],术后早期给予iNO可预防PHC,降低术后RVF的发生风险[86-88]。iNO是心脏瓣膜手术和左心辅助装置植入术等心脏手术围手术期肺动脉高压和RVF管理中的一种重要治疗方式[50]。成人和儿童的小样本临床研究显示,对于合并肺动脉高压的心脏移植受者,围手术期给予iNO 20 ppm可降低术后右心功能障碍的发生风险并提高生存率[89-90]。
iNO具有修复内皮细胞功能以及抗炎和免疫调节作用,减少移植过程中的IRI,降低原发性移植物功能障碍(primary graft dysfunction,PGD)的发生风险。一些历史对照或RCT表明在移植肺再灌注时或肺移植术后在常规治疗的基础上接受20 ppm iNO中位治疗时间4 d,可降低术后PGD及急性排斥反应的发生率[81, 91-93]。两项RCT还显示出iNO的肺外效应,肝移植术围手术期接受iNO 80 ppm可减轻IRI,加速肝功能恢复,降低肝胆并发症的发生风险[94-95]。
推荐意见14:对于心脏手术患者以及器官移植术受者,iNO 5~20 ppm可改善术后难治性低氧血症;成人iNO 20~40 ppm,儿童iNO 10~20 ppm可改善围手术期肺动脉高压以及右心功能障碍;在肺移植和肝移植手术围手术期分别给予20 ppm和80 ppm的iNO对减少IRI可能有益(强推荐,高等级质量证据)。
2.9 羊水栓塞孕妇用药同时需考虑对胎儿可能的致畸及毒副作用。iNO因起效快、不影响体循环以及不被胎盘代谢的特点,可以逆转妊娠期低氧血症,解除肺动脉高压以及RVF,尤其适用于羊水栓塞等急危重病情[6, 96-97]。目前已有一些个案病例报告报道了常规浓度iNO救治PHC、羊水栓塞、肺栓塞、艾森曼格综合征以及心脏骤停孕产妇的案例[54, 98-102]。参考国内外羊水栓塞指南和专家共识的意见,推荐iNO 5~40 ppm以降低肺循环后负荷。
推荐意见15:iNO可快速改善孕产妇肺动脉高压、RVF,纠正低氧血症,推荐iNO 5~40 ppm用于羊水栓塞患者解除肺动脉高压(强推荐,中等级质量证据)。
3 一氧化氮与呼吸/生命支持类设备联合使用iNO设备通过与空气源/氧源、呼吸支持类设备以及生命支持类设备连接,输送NO进入体内,以实现治疗目的。iNO设备与临床常用呼吸/生命支持类设备的连接操作示意图见图 1。

|
| A. 与有创呼吸机连接(麻醉机可参考该连接方式);B. 与无创呼吸机连接;C. 与经鼻高流量氧疗设备连接;D. 与鼻导管吸氧设备连接(普通面罩吸氧可参考该连接方式);E. 与ECMO/CPB系统连接;流量传感器线缆用于将气体混合时通过流量传感器获取的流量数据传输至iNO设备,iNO设备基于该数据实时配置注入管路的NO流量,从而达到使用者预先设置的NO浓度 图 1 iNO设备与临床常用呼吸/生命支持类设备的连接操作示意图 |
|
|
iNO设备与呼吸支持设备的连接方式,一般取决于iNO设备种类和呼吸支持设备的呼吸回路类型,大多数iNO设备都可以连接有创或无创呼吸机,某些iNO设备也可与高流量氧疗设备相连接[68, 103],在临床应用中具有良好的安全性,可改善急性血流动力学和氧合状态,可作为有创机械通气的替代策略[68, 104]。iNO设备接入麻醉机管路亦可实现NO浓度的准确输送,达到临床预期结局[105-106]。iNO设备与呼吸机联用时,NO气体输送模式一般分为恒定流量输送(也称连续式NO输送)和恒定浓度输送(也称间歇式NO输送)两种:前者无需考虑NO气体同呼吸周期同步的问题(即“不同步”),技术实现简单,但也造成了NO的浪费甚至过度排放影响治疗环境;后者只在吸气相输送NO,根据呼吸机送气流量实时配置输注NO流量,以达到与患者吸气“同步”的目的,实现浓度稳定的目标[107],提高病患和医务人员的安全性,被国际指南推荐使用[19]。
iNO设备还可与生命支持类设备,如体外循环(cardiopulmonary bypass,CPB)和ECMO相连使用。心脏手术中使用CPB易产生IRI及全身炎症反应,影响器官功能,增加围手术期并发症的风险。CPB期间及术后使用NO可减少IRI损伤,具有心肺保护和肾保护作用,降低心肌损伤和肾损伤的发生风险,缩短机械通气时间[108-115],使用NO浓度通常20~80 ppm,疗程视手术时长和患者病情而定。一项试点研究在30名儿童中验证了在ECMO循环回路中同时给予NO 20 ppm的安全性,较历史对照组iNO潜在减轻IRI及终末器官功能障碍,改善临床结局[116]。CS需静脉-动脉方式ECMO联合介入式人工心脏Impella支持的顽固性右心功能不全患者,iNO作为桥接手段通过改善右心功能辅助ECMO撤机[69-70]。
综上所述,考虑临床实际和各类设备的连接,四种iNO设备类型(见表 2)中,其中“即时发生同步”类设备一方面相对高压气瓶类具有体积小巧、易于使用、安全、便携、不依赖NO气体供应链等优点,除了常规床旁诊疗场景,亦能满足急救转运的需求[117-119],另一方面,“同步”功能的实现令输出浓度稳定,更适用于临床[19]。
| 气体来源 | 输送模式 | ||
| 恒定流量输送(连续式、不同步) | 恒定浓度输送(间歇式,同步) | ||
| 高压气瓶 | Ⅰ.气瓶不同步 | Ⅱ.气瓶同步 | |
| 即时发生 | Ⅲ.即时发生不同步 | Ⅳ.即时发生同步 | |
推荐意见16:使用iNO设备时应根据患者病情及设备类型选择合适的连接方式,与各类呼吸/生命支持类设备联合使用可能实现更优的临床结局,而能实现NO气体的吸入与患者吸气“同步”的即时发生iNO设备便携、输出浓度稳定,对患者和医务人员更安全,更适用于临床(强推荐,高等级质量证据)。
4 吸入一氧化氮治疗的安全性问题与监测iNO Ⅰ期临床研究已在健康人体中验证了高浓度160 ppm给药方案的可行性和安全性[28],目前NO临床值得关注的不良反应和安全风险,以及监测指标和注意事项主要在以下两个方面。
4.1 气体与杂质监测NO暴露于O2形成的NO2对人体有危害,应为首要监测指标。按照职业安全与健康行业标准,环境保护要求工业排出NO2气体的浓度应 < 5 ppm,但应尽可能降低到达人体内特别是肺组织的NO2浓度[120],美国新生儿临床指南建议NO2报警设限为2 ppm[121]。目前国内临床使用时,建议实时监测患者吸入端NO2低于3 ppm。诸多研究表明,在严格的监测条件下,吸入高浓度(> 80 ppm)NO时NO2的浓度也在安全范围内[32-36]。
由于NO2的潜在毒性作用,且浓度与治疗中的NO浓度,O2浓度以及两者的相互作用时间正相关[4, 122],应以NO最低有效浓度为治疗原则[19, 120],在连续治疗的过程中逐渐降低NO浓度,以最低有效浓度维持治疗效果。因此,应精确监测NO浓度[19],NO浓度的调节范围和监测范围最小值应低于1 ppm,监测误差应尽可能在±10%以内[1]。与呼吸支持设备联用时,关注NO浓度调节的同时,iNO设备应实时、精确监测呼吸回路混合气体中NO、NO2以及O2的浓度[1, 19, 121],并设置合理的报警阈值,以最大限度地减少暴露。目前主流iNO设备的气体注入端靠近呼吸支持设备的出气口,以保障有足够空间混合NO和呼吸支持设备输出的气体。气体采样端则应置于送气回路近患者端,一般距离气管插管或无创面罩连接处不超过15 cm,以保证采样的正确性[1, 121]。
此外,高压电弧放电法iNO设备还应关注金属颗粒物,多种氮氧化物以及臭氧等副产物的过滤质量和效率,相关杂质固体和气体应满足相关国家标准[123],如1 h内O3的平均暴露浓度应不大于160 μg/m3,以减少对人体的危害。
推荐意见17:iNO治疗过程中,应关注NO浓度的稳定性和设备精准度,实时、精确监测近患者端NO、NO2和O2的浓度,设置临床可接受的、合理的报警阈值(强推荐,高等级质量证据)。
4.2 临床指标监测先天性或获得性的高铁蛋白血症或高铁血红蛋白还原酶缺陷者为iNO治疗的禁忌证,这类人群不建议接受iNO治疗。美国新生儿临床指南建议iNO治疗期间监测高铁蛋白水平,当高铁血红蛋白水平达到5%以上,NO需减量或停止使用[121]。临床研究报道显示,健康成人iNO 160 ppm高铁血红蛋白始终保持在5%以下且治疗停止后可逆,无累积效应[28];肝移植手术期间iNO 80 ppm,高铁血红蛋白水平最高约2%[94-95]。iNO长期治疗达1~2年的患者高铁血红蛋白水平也未超过3%[124-125]。因此,常规浓度iNO治疗一般不会造成有临床意义的高铁血红蛋白血症。
NO具有抑制血小板聚集、黏附和凝血的作用。目前临床尚未见使用iNO增加颅内出血或任何其他出血相关疾病的发生率的报道[121],但有研究显示NO影响血小板的聚集和黏附,可能增加出血风险[126]。根据目前临床研究可知,iNO高浓度80 ppm仍无显著的血小板功能不良反应发生[94-95]。因此,iNO常规浓度治疗期间凝血功能障碍的临床风险几乎可以忽略不计[113],建议具出血风险患者iNO治疗期间密切监测,血小板、凝血时间等实验室检查可纳入常规检查。
肺血管扩张可以使PAP下降,肺静脉回流增加,通过肺循环的血容量增加,使左室的充盈压增加[72]。对于左心功能障碍者可能具有恶化病情的风险,这类患者在iNO之前应尽可能纠正心力衰竭,使用期间应注意密切监测患者病情。
ARDS的早期RCT研究显示iNO可能增加患者肾损伤的发生风险[3, 17-18],其它类型患者尚未有相关报道,目前机制尚不明确。建议慢性肾病及肾功能不全者在治疗期间注意监测肾功能。
此外,iNO治疗前和期间应注意监测患者的动脉血气和呼吸支持设备的相关参数,合并肺动脉高压以及心功能异常者,有必要行右心导管检查或心脏超声检查,以通过观察氧合指数、肺动脉压力以及心功能的改善情况,及时调整iNO有效浓度以及撤离方案[19, 120, 121, 127]。
推荐意见18:高铁血红蛋白血症或高铁血红蛋白还原酶缺陷者禁用iNO(强推荐,高等级质量证据)。
推荐意见19:出血风险患者iNO治疗期间日常监测血小板及凝血指标(弱推荐,高等级质量证据)。
推荐意见20:左心功能障碍者iNO治疗前应纠正心力衰竭,治疗期间密切关注患者病情变化(弱推荐,低等级质量证据)。
推荐意见21:肾功能不全患者治疗期间应注意监测肾功能(弱推荐,低等级质量证据)。
推荐意见22:iNO治疗期间应监测动脉血气、呼吸支持参数、肺动脉压力和心功能等指标的改善情况以评估治疗效果,及时调整iNO治疗方案(强推荐,高等级质量证据)。
5 吸入一氧化氮治疗的撤离时机和撤离方案临床可根据患者的病情及临床使用经验,在常规治疗无效时应用iNO,对于病情危急者也可考虑和常规治疗联合应用。iNO治疗的方案和流程可参考iNO在低氧血症中的使用流程建议(见图 2)。
当NO浓度≥10 ppm,突然撤离时可能会出现缺氧现象,这种快速降低的氧合作用与肺动脉高压的反弹有关,也叫NO撤离低氧性反跳现象。NO在停药前将浓度逐渐降至1 ppm或更低,可减少这种反跳现象的发生,在最终撤离前提高FiO2或口服磷酸二酯酶制剂(西地那非)可改善这种低氧反跳现象[121]。因此,建议在NO撤离前将其浓度逐渐下降至1 ppm或更低,并在完全撤离前提高FiO2[120-121]。
目前成人尚无固定的NO撤离模式。对于持续iNO治疗的患者建议氧合改善并稳定时考虑撤离,可根据情况参考国外iNO在成人ARDS患者中的两种撤离方案[33, 127],一种方案是PaO2/FiO2 > 300 mmHg持续至少24 h,考虑开始撤离。将iNO浓度每4 h逐步从40 ppm降低到20、10 ppm、5 ppm、3 ppm、2 ppm和1 ppm,至停止使用。在撤离过程中若出现低氧血症(脉搏血氧饱和度 < 92%)或急性全身性低血压(收缩压 < 90 mmHg),应增加iNO浓度直至稳定。另一种方案是当PaO2/FiO2 > 150 mmHg且FiO2 < 0.8,iNO浓度从20 ppm降低到5 ppm时,每次减少5~10 ppm(20-10-5):每8~12 h减少1次,从5 ppm降低到1 ppm,每次减少2 ppm(5-3-1):每6~8 h减少1次,在1 ppm至少维持30 min,持续监测血氧饱和度及凝血指标直至iNO完全撤离。
推荐意见23:iNO治疗患者氧合改善并稳定时考虑撤机,NO撤离应逐渐降低浓度至1 ppm或更低(强推荐,中等级质量证据)。
6 未来研究的方向和展望综上所述,iNO在急危重症中有重要的治疗价值(表 3),但仍有部分问题需进一步研究解决,如急性肺栓塞、心力衰竭、心脏骤停等疾病中应用的大样本临床证据,iNO的最佳治疗方案和远期疗效,以及急诊转运中的应用标准等。此外,近期试验深入研究了传统应用之外的条件下使用iNO,如脓毒症相关ARDS的辅助治疗,以及缺血性脑卒中的神经保护等[128],因此,iNO可能在重塑不同医疗领域的治疗方法方面发挥关键作用,为改善患者预后和创新治疗模式提供新途径。未来仍需更多、更全面的研究以期为iNO在急危重症中的临床应用提供更好的指导和帮助。
| 疾病类型 | 治疗方案 |
| 急性呼吸窘迫综合征 | 常规治疗无效者,可以考虑加用iNO,常用的浓度范围5~20 ppm,建议使用NO最低有效浓度维持动脉氧合,疗程视患者临床反应而定,最长可达30 d;可考虑联合俯卧位通气改善氧合 |
| 重症肺炎 | 浓度80 ppm以内的iNO可改善重症肺炎相关低氧血症患者短期氧合,高浓度(≥80 ppm)iNO可能降低病原微生物载量;iNO的疗程一般在3~11 d |
| 高原肺水肿 | 建议iNO浓度为10~20 ppm,治疗时长每次30 min~2 h,一天治疗1~2次,治疗天数视病程而定,通常1~5 d |
| 急性肺栓塞 | 对于中高危和高危患者,常规治疗效果不佳时,iNO不超过50 ppm联合吸氧治疗24 h |
| 肺动脉高压 | iNO用于急性血管反应试验推荐浓度10~20 ppm,吸入5~10 min;iNO用于肺动脉高压危象最大浓度通常为20~80 ppm,至患者病情稳定;iNO治疗肺部疾病相关肺动脉高压时浓度通常不超过40 ppm,可短期治疗也可长期治疗,在慢性血栓栓塞性肺动脉高压术中或术后使用浓度一般不超过20 ppm |
| 心力衰竭 | 右心功能障碍或衰竭患者通常iNO浓度10~40 ppm治疗1~7 d,80 ppm时通常治疗时间较短;对于左心衰竭患者,临床经验丰富的单位可考虑将iNO作为一种补救措施,使用时应密切关注患者病情变化 |
| 心脏骤停 | 心脏骤停患者心肺复苏术后给予20~40 ppm iNO短期治疗可能提高临床生存获益 |
| 围手术期 | 对于心脏手术患者以及器官移植术受者,iNO 5~20 ppm用于改善术后难治性低氧血症;成人iNO 20~40 ppm,儿童iNO 10~20 ppm用于改善围手术期肺动脉高压以及右心功能障碍;在肺移植术中/后给予20 ppm iNO,肝移植术中给予80 ppm iNO对减少缺血再灌注损伤可能有益;NO与体外循环联用时的浓度一般为20~80 ppm |
| 羊水栓塞 | 推荐iNO 5~40 ppm用于羊水栓塞患者解除肺动脉高压 |
| 注:iNO为吸入一氧化氮,NO为一氧化氮 | |
本专家共识推荐意见汇总见表 4。
| iNO应用 | 推荐意见 |
| 1. 一氧化氮的生理学特性 | 推荐意见1:iNO治疗可用于降低肺动脉高压和右心后负荷,改善动脉氧合,减少缺血再灌注损伤,保护器官功能(强推荐,高等级质量证据)。 |
| 2. 吸入一氧化氮治疗在急危重症中的应用 | |
| 急性呼吸窘迫综合征(ARDS) | 推荐意见2:对于常规治疗无效的ARDS患者,可以考虑加用iNO,常用的浓度范围5~20ppm(强推荐,高等级质量证据)。 推荐意见3:iNO可考虑联合俯卧位通气改善氧合(强推荐,中等级质量证据)。 |
| 重症肺炎 | 推荐意见4:iNO常规浓度改善重症肺炎相关低氧血症患者短期氧合(强推荐,高等级质量证据)。 推荐意见5:高浓度(≥80 ppm)iNO可能降低肺部感染患者病原微生物载量(弱推荐,中等级质量证据)。 |
| 高原肺水肿(HAPE) | 推荐意见6:iNO可降低HAPE患者肺动脉高压,改善气体交换和氧合,缩短病程。建议iNO浓度为10~20 ppm,治疗时长每次30 min~2 h,一天治疗1~2次(强推荐,中等级质量证据)。 |
| 急性肺栓塞(APE) | 推荐意见7:对于中高危和高危APE患者,常规治疗效果不佳的情况下,推荐iNO不超过50 ppm联合吸氧,以最大程度地降低肺循环阻力,改善右心室功能和血流动力学状态(弱推荐,中等级质量证据)。 |
| 肺动脉高压 | 推荐意见8:iNO是AVT的主要药物选择,通常使用浓度10~20 ppm,吸入5~10 min(强推荐,高等级质量证据)。 推荐意见9:iNO是预防和治疗PHC的首要选择,推荐使用iNO常规浓度(强推荐,高等级质量证据)。 推荐意见10:iNO改善血流动力学,是肺动脉高压患者在原发病治疗的基础上可考虑的治疗选择,浓度通常不超过40 ppm(弱推荐,高等级质量证据)。 |
| 心力衰竭 | 推荐意见11:iNO是右心功能障碍或衰竭患者的有效治疗手段之一,建议iNO浓度不超过80 ppm(强推荐,高等级质量证据)。 推荐意见12:对于左心衰竭,临床经验丰富的单位可考虑将iNO作为一种补救措施,使用时应密切关注患者病情变化(弱推荐,低等级质量证据)。 |
| 心脏骤停 | 推荐意见13:对于心脏骤停患者心肺复苏术后给予20~40 ppm iNO可能提高临床生存获益(弱推荐,低等级质量证据)。 |
| 围手术期 | 推荐意见14:对于心脏手术患者以及器官移植术受者,iNO 5~20 ppm可改善术后难治性低氧血症;成人iNO 20~40 ppm,儿童iNO 10~20 ppm可改善围手术期肺动脉高压以及右心功能障碍;在肺移植和肝移植手术围手术期分别给予20 ppm和80 ppm的iNO对减少IRI可能有益(强推荐,高等级质量证据)。 |
| 羊水栓塞 | 推荐意见15:iNO可快速改善孕产妇肺动脉高压、RVF,纠正低氧血症,推荐iNO 5~40 ppm用于羊水栓塞患者解除肺动脉高压(强推荐,中等级质量证据)。 |
| 3. 一氧化氮与呼吸/生命支持类设备联合使用 | 推荐意见16:使用iNO设备时应根据患者病情及设备类型选择合适的连接方式,与各类呼吸/生命支持类设备联合使用可能实现更优的临床结局,而能实现NO气体的吸入与患者吸气“同步”的即时发生iNO设备便携、输出浓度稳定,对患者和医务人员更安全,更适用于临床(强推荐,高等级质量证据)。 |
| 4. 吸入一氧化氮治疗的安全性问题与监测 | |
| 气体与杂质监测 | 推荐意见17:iNO治疗过程中,应关注NO浓度的稳定性和设备精准度,实时、精确监测近患者端NO、NO2和O2的浓度,设置临床可接受的、合理的报警阈值(强推荐,高等级质量证据)。 |
| 临床指标监测 | 推荐意见18:高铁血红蛋白血症或高铁血红蛋白还原酶缺陷者禁用iNO(强推荐,高等级质量证据)。 推荐意见19:出血风险患者iNO治疗期间日常监测血小板及凝血指标(弱推荐,高等级质量证据)。 推荐意见20:左心功能障碍者iNO治疗前应纠正心力衰竭,治疗期间密切关注患者病情变化(弱推荐,低等级质量证据)。 推荐意见21:肾功能不全患者治疗期间应注意监测肾功能(弱推荐,低等级质量证据)。 推荐意见22:iNO治疗期间应监测动脉血气、呼吸支持参数、肺动脉压力和心功能等指标的改善情况以评估治疗效果,及时调整iNO治疗方案(强推荐,高等级质量证据)。 |
| 5. 吸入一氧化氮治疗的撤离时机和撤离方案 | 推荐意见23:iNO治疗患者氧合改善并稳定时考虑撤机,NO撤离应逐渐降低浓度至1 ppm或更低(强推荐,中等级质量证据)。 |
| 注:iNO为吸入一氧化氮,AVT为急性血管反应试验,PHC为肺动脉高压危象,IRI为缺血再灌注损伤,RVF为右心衰竭,NO为一氧化氮,NO2为二氧化氮 | |
执笔:吴彩军、曾举浩、吴晨曦
参与共识制定专家(按姓名汉语拼音为序):曹钰(四川大学华西医院)、柴艳芬(天津医科大学总医院)、陈旭锋(江苏省人民医院)、陈玉国(山东大学齐鲁医院)、邓颖(哈尔滨医科大学附属第二医院)、杜娟(中国医学科学院阜外医院)、郭琳瑛(首都儿科研究所附属儿童医院)、郭伟(首都医科大学附属北京中医医院)、何小军(《中华急诊医学杂志》编辑部)、胡军利(河北医科大学第二医院)、李铁刚(中国医科大学附属盛京医院)、李燕(山西医科大学第二医院)、梁朝阳(中日友好医院)、凌云鹏(北京大学第三医院)、刘保社(山西省中医院)、马青变(北京大学第三医院)、马岳峰(浙江大学医学院附属第二医院)、毛雯(江苏省药学会药物临床评价研究专业委员会)、米玉红(首都医科大学附属北京安贞医院)、潘龙飞(西安交通大学第二附属医院)、潘曙明(上海市普陀区中心医院)、裴红红(西安交通大学第二附属医院)、孙传政(中南大学湘雅三医院)、田英平(河北医科大学第二医院)、童朝阳(复旦大学附属中山医院)、吴彩军(北京中医药大学东直门医院)、吴利东(南昌大学第二附属医院)、伍绍文(首都医科大学附属北京妇产医院)、谢苗荣(首都医科大学附属北京友谊医院)、邢吉红(吉林大学白求恩第一医院)、闫炀(西安交通大学第一附属医院)、曾红科(广东省人民医院)、曾举浩(广东省人民医院)、张国强(中日友好医院)、朱继红(北京大学人民医院)、朱建军(苏州大学附属第二医院)
指南共识注册编号:PREPARE-2024CN152
利益冲突 所有作者声明无利益冲突
| [1] | 国家药品监督管理局医疗器械技术审评中心. 一氧化氮治疗仪注册审查指导原则(2024年第8号)[OL]. (2024-02-06)[2024-04-28]. https://www.cmde.org.cn//xwdt/shpgzgg/gztg/20240206155349189.html. |
| [2] | Griffiths MJ, Evans TW. Inhaled nitric oxide therapy in adults[J]. N Engl J Med, 2005, 353(25): 2683-2695. DOI:10.1056/NEJMra051884 |
| [3] | Gebistorf F, Karam O, Wetterslev J, et al. Inhaled nitric oxide for acute respiratory distress syndrome (ARDS) in children and adults[J]. Cochrane Database Syst Rev, 2016, 2016(6): CD002787. DOI:10.1002/14651858.CD002787.pub3 |
| [4] | Ichinose F, Roberts JD Jr, Zapol WM. Inhaled nitric oxide: a selective pulmonary vasodilator: current uses and therapeutic potential[J]. Circulation, 2004, 109(25): 3106-3111. DOI:10.1161/01.CIR.0000134595.80170.62 |
| [5] | Jiang SQ, Dandu CT, Geng XK. Clinical application of nitric oxide in ischemia and reperfusion injury: a literature review[J]. Brain Circ, 2020, 6(4): 248-253. DOI:10.4103/bc.bc_69_20 |
| [6] | Society for Maternal-Fetal Medicine. Management Considerations for Pregnant Patients With COVID-19. Developed with guidance from Torre Halscott, MD, MS; Jason Vaught, MD; and the SMFM COVID-19 Task Force[OL]. (2021-02-02)[2024-04-28]. https://assets.noviams.com/novi-file-uploads/smfm/Clinical_Guidance/COVID_Resources/SMFM_COVID_Management_of_COVID_pos_preg_patients_2-2-21__final_.pdf. |
| [7] | Barrington KJ, Finer N, Pennaforte T. Inhaled nitric oxide for respiratory failure in preterm infants[J]. Cochrane Database Syst Rev, 2017, 1(1): CD000509. DOI:10.1002/14651858.CD000509.pub5 |
| [8] | Ferguson ND, Guérin C. Adjunct and rescue therapies for refractory hypoxemia: prone position, inhaled nitric oxide, high frequency oscillation, extra corporeal life support[J]. Intensive Care Med, 2018, 44(9): 1528-1531. DOI:10.1007/s00134-017-5040-5 |
| [9] | Tatham KC, Ferguson ND, Zhou Q, et al. Evolution of practice patterns in the management of acute respiratory distress syndrome: a secondary analysis of two successive randomized controlled trials[J]. J Crit Care, 2021, 65: 274-281. DOI:10.1016/j.jcrc.2021.06.017 |
| [10] | 於江泉, 郑瑞强, 林华, 等. 俯卧位通气联合一氧化氮吸入对急性呼吸窘迫综合征患者氧合的影响[J]. 中华急诊医学杂志, 2012, 21(12): 1374-1377. DOI:10.3760/cma.j.issn.1671-0282.2012.12.019 |
| [11] | Rialp G, Betbesé AJ, Pérez-Márquez M, et al. Short-term effects of inhaled nitric oxide and prone position in pulmonary and extrapulmonary acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2001, 164(2): 243-249. DOI:10.1164/ajrccm.164.2.2002087 |
| [12] | Dellinger RP, Trzeciak SW, Criner GJ, et al. Association between inhaled nitric oxide treatment and long-term pulmonary function in survivors of acute respiratory distress syndrome[J]. Crit Care, 2012, 16(2): R36. DOI:10.1186/cc11215 |
| [13] | Bronicki RA, Fortenberry J, Schreiber M, et al. Multicenter randomized controlled trial of inhaled nitric oxide for pediatric acute respiratory distress syndrome[J]. J Pediatr, 2015, 166(2): 365-369. DOI:10.1016/j.jpeds.2014.10.011 |
| [14] | Berger JT, Maddux AB, Reeder RW, et al. Inhaled nitric oxide use in pediatric hypoxemic respiratory failure[J]. Pediatr Crit Care Med, 2020, 21(8): 708-719. DOI:10.1097/PCC.0000000000002310 |
| [15] | Göthberg S, Edberg KE, Tang SF, et al. Residual pulmonary hypertension in children after treatment with inhaled nitric oxide: a follow-up study regarding cardiopulmonary and neurological symptoms[J]. Acta Paediatr, 2000, 89(12): 1414-1419. DOI:10.1080/080352500456561 |
| [16] | Albert M, Corsilli D, Williamson DR, et al. Comparison of inhaled milrinone, nitric oxide and prostacyclin in acute respiratory distress syndrome[J]. World J Crit Care Med, 2017, 6(1): 74-78. DOI:10.5492/wjccm.v6.i1.74 |
| [17] | Ruan SY, Huang TM, Wu HY, et al. Inhaled nitric oxide therapy and risk of renal dysfunction: a systematic review and meta-analysis of randomized trials[J]. Crit Care, 2015, 19(1): 137. DOI:10.1186/s13054-015-0880-2 |
| [18] | Ruan SY, Wu HY, Lin HH, et al. Inhaled nitric oxide and the risk of renal dysfunction in patients with acute respiratory distress syndrome: a propensity-matched cohort study[J]. Crit Care, 2016, 20(1): 389. DOI:10.1186/s13054-016-1566-0 |
| [19] | Papazian L, Aubron C, Brochard L, et al. Formal guidelines: management of acute respiratory distress syndrome[J]. Ann Intensive Care, 2019, 9(1): 69. DOI:10.1186/s13613-019-0540-9 |
| [20] | Puri N, Dellinger RP. Inhaled nitric oxide and inhaled prostacyclin in acute respiratory distress syndrome: what is the evidence?[J]. Crit Care Clin, 2011, 27(3): 561-587. DOI:10.1016/j.ccc.2011.05.001 |
| [21] | Bhatraju P, Crawford J, Hall M, et al. Inhaled nitric oxide: Current clinical concepts[J]. Nitric Oxide, 2015, 50: 114-128. DOI:10.1016/j.niox.2015.08.007 |
| [22] | Munshi L, Adhikari NK. Inhaled nitric oxide and acute kidney injury: new insights from observational data[J]. Crit Care, 2017, 21(1): 83. DOI:10.1186/s13054-017-1651-z |
| [23] | Gómez FP, Amado VM, Roca J, et al. Effect of nitric oxide inhalation on gas exchange in acute severe pneumonia[J]. Respir Physiol Neurobiol, 2013, 187(2): 157-163. DOI:10.1016/j.resp.2013.03.006 |
| [24] | Chen L, Liu P, Gao H, et al. Inhalation of nitric oxide in the treatment of severe acute respiratory syndrome: a rescue trial in Beijing[J]. Clin Infect Dis, 2004, 39(10): 1531-1535. DOI:10.1086/425357 |
| [25] | Alraddadi BM, Qushmaq I, Al-Hameed FM, et al. Noninvasive ventilation in critically ill patients with the Middle East respiratory syndrome[J]. Influenza Other Respir Viruses, 2019, 13(4): 382-390. DOI:10.1111/irv.12635 |
| [26] | Boots RJ, Lipman J, Lassig-Smith M, et al. Experience with high frequency oscillation ventilation during the 2009 H1N1 influenza pandemic in Australia and New Zealand[J]. Anaesth Intensive Care, 2011, 39(5): 837-846. DOI:10.1177/0310057X1103900507 |
| [27] | Sorbo LD, Michaelsen VS, Ali A, et al. High doses of inhaled nitric oxide as an innovative antimicrobial strategy for lung infections[J]. Biomedicines, 2022, 10(7): 1525. DOI:10.3390/biomedicines10071525 |
| [28] | Miller C, Miller M, McMullin B, et al. A phase I clinical study of inhaled nitric oxide in healthy adults[J]. J Cyst Fibros, 2012, 11(4): 324-331. DOI:10.1016/j.jcf.2012.01.003 |
| [29] | Mekontso Dessap A, Papazian L, Schaller M, et al. Inhaled nitric oxide in patients with acute respiratory distress syndrome caused by COVID-19: treatment modalities, clinical response, and outcomes[J]. Ann Intensive Care, 2023, 13(1): 57. DOI:10.1186/s13613-023-01150-9 |
| [30] | Abman SH, Fox NR, Malik MI, et al. Real-world use of inhaled nitric oxide therapy in patients with COVID-19 and mild-to-moderate acute respiratory distress syndrome[J]. Drugs Context, 2022, 11: 2022-1. DOI:10.7573/dic.2022-1-4 |
| [31] | Ziehr DR, Alladina J, Wolf ME, et al. Respiratory physiology of prone positioning with and without inhaled nitric oxide across the coronavirus disease 2019 acute respiratory distress syndrome severity spectrum[J]. Crit Care Explor, 2021, 3(6): e0471. DOI:10.1097/CCE.0000000000000471 |
| [32] | Safaee Fakhr B, Di Fenza R, Gianni S, et al. Inhaled high dose nitric oxide is a safe and effective respiratory treatment in spontaneous breathing hospitalized patients with COVID-19 pneumonia[J]. Nitric Oxide, 2021, 116: 7-13. DOI:10.1016/j.niox.2021.08.003 |
| [33] | Di Fenza R, Shetty NS, Gianni S, et al. High-dose inhaled nitric oxide in acute hypoxemic respiratory failure due to COVID-19: a multicenter phase Ⅱ trial[J]. Am J Respir Crit Care Med, 2023, 208(12): 1293-1304. DOI:10.1164/rccm.202304-0637OC |
| [34] | Strickland B, Albala L, Coffey EC, et al. Safety and practicality of high dose inhaled nitric oxide in emergency department COVID-19 patients[J]. Am J Emerg Med, 2022, 58: 5-8. DOI:10.1016/j.ajem.2022.04.052 |
| [35] | Safaee Fakhr B, Wiegand SB, Pinciroli R, et al. High concentrations of nitric oxide inhalation therapy in pregnant patients with severe coronavirus disease 2019 (COVID-19)[J]. Obstet Gynecol, 2020, 136(6): 1109-1113. DOI:10.1097/AOG.0000000000004128 |
| [36] | Valsecchi C, Winterton D, Safaee Fakhr B, et al. High-dose inhaled nitric oxide for the treatment of spontaneously breathing pregnant patients with severe coronavirus disease 2019 (COVID-19) pneumonia[J]. Obstet Gynecol, 2022, 140(2): 195-203. DOI:10.1097/AOG.0000000000004847 |
| [37] | Li YH, Zhang YJ, Zhang Y. Research advances in pathogenesis and prophylactic measures of acute high altitude illness[J]. Respir Med, 2018, 145: 145-152. DOI:10.1016/j.rmed.2018.11.004 |
| [38] | Frostell CG, Blomqvist H, Hedenstierna G, et al. Inhaled nitric oxide selectively reverses human hypoxic pulmonary vasoconstriction without causing systemic vasodilation[J]. Anesthesiology, 1993, 78(3): 427-435. DOI:10.1097/00000542-199303000-00005 |
| [39] | Scherrer U, Vollenweider L, Delabays A, et al. Inhaled nitric oxide for high-altitude pulmonary edema[J]. N Engl J Med, 1996, 334(10): 624-629. DOI:10.1056/NEJM199603073341003 |
| [40] | Anand IS, Prasad BA, Chugh SS, et al. Effects of inhaled nitric oxide and oxygen in high-altitude pulmonary edema[J]. Circulation, 1998, 98(22): 2441-2445. DOI:10.1161/01.cir.98.22.2441 |
| [41] | 孙泽平, 郑建保. 一氧化氮在治疗高原肺水肿中作用[J]. 西藏科技, 2003(1): 43-44. DOI:10.3969/j.issn.1004-3403.2003.01.016 |
| [42] | 王伟, 张西洲, 马勇, 等. 吸入一氧化氮治疗高原肺水肿疗效对比观察[J]. 广东医学, 2002, 23(12): 1232-1233. DOI:10.3969/j.issn.1001-9448.2002.12.004 |
| [43] | 郑必海, 李素芝, 何祎, 等. 吸入外源性一氧化氮对急性高原病患者内皮源性血管舒缩因子的影响[J]. 中华结核和呼吸杂志, 2007, 30(2): 127-129. DOI:10.3760/j.issn.1001-0939.2007.02.014 |
| [44] | Fernandes CJ, Luppino Assad AP, Alves-Jr JL, et al. Pulmonary embolism and gas exchange[J]. Respiration, 2019, 98(3): 253-262. DOI:10.1159/000501342 |
| [45] | Bhat T, Neuman A, Tantary M, et al. Inhaled nitric oxide in acute pulmonary embolism: a systematic review[J]. Rev Cardiovasc Med, 2015, 16(1): 1-8. DOI:10.3909/ricm0718 |
| [46] | Ross C, Kumar R, Pelland-Marcotte MC, et al. Acute management of high-risk and intermediate-risk pulmonary embolism in children: a review[J]. Chest, 2022, 161(3): 791-802. DOI:10.1016/j.chest.2021.09.019 |
| [47] | Kline JA, Hernandez J, Garrett JS, et al. Pilot study of a protocol to administer inhaled nitric oxide to treat severe acute submassive pulmonary embolism[J]. Emerg Med J, 2014, 31(6): 459-462. DOI:10.1136/emermed-2013-202426 |
| [48] | Kline JA, Puskarich MA, Jones AE, et al. Inhaled nitric oxide to treat intermediate risk pulmonary embolism: a multicenter randomized controlled trial[J]. Nitric Oxide, 2019, 84: 60-68. DOI:10.1016/j.niox.2019.01.006 |
| [49] | Hagan G, Pepke-Zaba J. Pulmonary hypertension, nitric oxide and nitric oxide-releasing compounds[J]. Expert Rev Respir Med, 2011, 5(2): 163-171. DOI:10.1586/ers.11.5 |
| [50] | McGlothlin DP, Granton J, Klepetko W, et al. ISHLT consensus statement: Perioperative management of patients with pulmonary hypertension and right heart failure undergoing surgery[J]. J Heart Lung Transplant, 2022, 41(9): 1135-1194. DOI:10.1016/j.healun.2022.06.013 |
| [51] | Humbert M, Kovacs G, Hoeper MM, et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension[J]. Eur Heart J, 2022, 43(38): 3618-3731. DOI:10.1093/eurheartj/ehac237 |
| [52] | 中华医学会小儿外科分会心脏学组, 国家儿童医学中心心血管专科联盟. 儿童先天性心脏病相关性肺高压诊断与治疗指南[J]. 中华小儿外科杂志, 2022, 43(11): 966-980. DOI:10.3760/cma.j.cn421158-20211220-00624 |
| [53] | Satoh T, Yaoita N, Nochioka K, et al. Inhaled nitric oxide testing in predicting prognosis in pulmonary hypertension due to left-sided heart diseases[J]. ESC Heart Fail, 2023, 10(6): 3592-3603. DOI:10.1002/ehf2.14515 |
| [54] | Decoene C, Bourzoufi K, Moreau D, et al. Use of inhaled nitric oxide for emergency Cesarean section in a woman with unexpected primary pulmonary hypertension[J]. Can J Anaesth, 2001, 48(6): 584-587. DOI:10.1007/BF03016836 |
| [55] | Topjian AA, Raymond TT, Atkins D, et al. Part 4: Pediatric basic and advanced life support: 2020 American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care[J]. Circulation, 2020, 142(16_suppl_2): S469-S523. DOI:10.1161/CIR.0000000000000901 |
| [56] | Bernier ML, Romer LH, Bembea MM. Spectrum of current management of pediatric pulmonary hypertensive crisis[J]. Crit Care Explor, 2019, 1(8): e0037. DOI:10.1097/CCE.0000000000000037 |
| [57] | 张洪玉, 杨媛华, 翁心植, 等. 吸入一氧化氮对慢性肺心病急性发作期血流动力学影响[J]. 中华内科杂志, 1996, 35(6): 400-401. |
| [58] | Ashutosh K, Phadke K, Jackson JF, et al. Use of nitric oxide inhalation in chronic obstructive pulmonary disease[J]. Thorax, 2000, 55(2): 109-113. DOI:10.1136/thorax.55.2.109 |
| [59] | Roger N, Barberà JA, Roca J, et al. Nitric oxide inhalation during exercise in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 1997, 156(3 Pt 1)): 800-806. DOI:10.1164/ajrccm.156.3.9611051 |
| [60] | Wu X, Zheng R, Zhao Z. Case report: Inhaled nitric oxide rescued a hypoxemia patient caused by dermatomyositis complicated with interstitial pneumonia[J]. Front Med (Lausanne), 2024, 11: 1371183. DOI:10.3389/fmed.2024.1371183 |
| [61] | Nathan SD, Flaherty KR, Glassberg MK, et al. A randomized, double-blind, placebo-controlled study of pulsed, inhaled nitric oxide in subjects at risk of pulmonary hypertension associated with pulmonary fibrosis[J]. Chest, 2020, 158(2): 637-645. DOI:10.1016/j.chest.2020.02.016 |
| [62] | Abe S, Ishida K, Masuda M, et al. A prospective, randomized study of inhaled prostacyclin versus nitric oxide in patients with residual pulmonary hypertension after pulmonary endarterectomy[J]. Gen Thorac Cardiovasc Surg, 2017, 65(3): 153-159. DOI:10.1007/s11748-016-0724-2 |
| [63] | Saito S, Ikeda N, Iijima R, et al. Evaluation of the effect of nitric oxide inhalation in the patients with chronic thromboembolic pulmonary hypertension or pulmonary disease during balloon pulmonary angioplasty[J]. Pulm Circ, 2022, 12(1): e12032. DOI:10.1002/pul2.12032 |
| [64] | Tran H, Kamangar N. Improvement of breast cancer-associated pulmonary tumor thrombotic microangiopathy with carboplatin and gemcitabine[J]. Cureus, 2023, 15(5): e38600. DOI:10.7759/cureus.38600 |
| [65] | Del Valle KT, Krowka MJ, Schinstock CA, et al. Hemodynamic response to inhaled nitric oxide in patients with pulmonary hypertension and chronic kidney disease: a retrospective cohort study[J]. Pulm Circ, 2024, 14(1): e12341. DOI:10.1002/pul2.12341 |
| [66] | Konstam MA, Kiernan MS, Bernstein D, et al. Evaluation and Management of Right-Sided Heart Failure: A Scientific Statement From the American Heart Association[J]. Circulation, 2018(20): e578-e622. DOI:10.1161/CIR.0000000000000560 |
| [67] | Houston BA, Brittain EL, Tedford RJ. Right Ventricular Failure[J]. N Engl J Med, 2023, 388(12): 1111-1125. DOI:10.1056/NEJMra2207410 |
| [68] | Tremblay JA, Couture ÉJ, Albert M, et al. Noninvasive administration of inhaled nitric oxide and its hemodynamic effects in patients with acute right ventricular dysfunction[J]. J Cardiothorac Vasc Anesth, 2019, 33(3): 642-647. DOI:10.1053/j.jvca.2018.08.004 |
| [69] | Oki T, Ikeda Y, Ishii S, et al. Inhaled nitric oxide for ECPELLA management in fulminant myocarditis complicated with severe right ventricular dysfunction: a case report[J]. J Cardiol Cases, 2022, 26(2): 104-107. DOI:10.1016/j.jccase.2022.03.013 |
| [70] | Fujita K, Ueno M, Yasuda M, et al. Haemodynamic effects of inhaled nitric oxide in acute myocardial infarction complicated by right heart failure under ECPELLA support: case report[J]. Eur Heart J Case Rep, 2023, 7(8): ytad369. DOI:10.1093/ehjcr/ytad369 |
| [71] | Janssens SP, Bogaert J, Zalewski J, et al. Nitric oxide for inhalation in ST-elevation myocardial infarction (NOMI): a multicentre, double-blind, randomized controlled trial[J]. Eur Heart J, 2018, 39(29): 2717-2725. DOI:10.1093/eurheartj/ehy232 |
| [72] | Bocchi EA, Bacal F, Auler Júnior JO, et al. Inhaled nitric oxide leading to pulmonary edema in stable severe heart failure[J]. Am J Cardiol, 1994, 74(1): 70-72. DOI:10.1016/0002-9149(94)90496-0 |
| [73] | Patel JK, Schoenfeld E, Hou W, et al. Inhaled nitric oxide in adults with in-hospital cardiac arrest: A feasibility study[J]. Nitric Oxide, 2021, 115: 30-33. DOI:10.1016/j.niox.2021.07.001 |
| [74] | Brücken A, Derwall M, Bleilevens C, et al. Brief inhalation of nitric oxide increases resuscitation success and improves 7-day-survival after cardiac arrest in rats: a randomized controlled animal study[J]. Crit Care, 2015, 19: 408. DOI:10.1186/s13054-015-1128-x |
| [75] | Derwall M, Ebeling A, Nolte KW, et al. Inhaled nitric oxide improves transpulmonary blood flow and clinical outcomes after prolonged cardiac arrest: a large animal study[J]. Crit Care, 2015, 19(1): 328. DOI:10.1186/s13054-015-1050-2 |
| [76] | 虞敏, 毛建强, 樊永亮, 等. 吸入一氧化氮治疗心脏直视手术后难治性低氧血症的疗效分析[J]. 上海交通大学学报(医学版), 2014, 34(3) 343-346, 351. DOI:10.3969/j.issn.1674-8115.2014.03.017 |
| [77] | Hao GW, Tu GW, Yu SJ, et al. Inhaled nitric oxide reduces the intrapulmonary shunt to ameliorate severe hypoxemia after acute type A aortic dissection surgery[J]. Nitric Oxide, 2021, 109-110: 26-32. DOI:10.1016/j.niox.2021.03.001 |
| [78] | Ma GG, Hao GW, Lai H, et al. Initial clinical impact of inhaled nitric oxide therapy for refractory hypoxemia following type A acute aortic dissection surgery[J]. J Thorac Dis, 2019, 11(2): 495-504. DOI:10.21037/jtd.2019.01.42 |
| [79] | Zhang H, Liu Y, Meng X, et al. Effects of inhaled nitric oxide for postoperative hypoxemia in acute type A aortic dissection: a retrospective observational study[J]. J Cardiothorac Surg, 2020, 15(1): 25. DOI:10.1186/s13019-020-1069-6 |
| [80] | Zheng P, Jiang D, Liu C, et al. Nitric oxide inhalation therapy attenuates postoperative hypoxemia in obese patients with acute type A aortic dissection[J]. Comput Math Methods Med, 2022, 2022: 9612548. DOI:10.1155/2022/9612548 |
| [81] | Yoshiyasu N, Sato M, Nakajima D, et al. Current status of inhaled nitric oxide therapy for lung transplantation in Japan: a nationwide survey[J]. Gen Thorac Cardiovasc Surg, 2021, 69(10): 1421-1431. DOI:10.1007/s11748-021-01648-8 |
| [82] | Nayyar D, Man HS, Granton J, et al. Proposed management algorithm for severe hypoxemia after liver transplantation in the hepatopulmonary syndrome[J]. Am J Transplant, 2015, 15(4): 903-913. DOI:10.1111/ajt.13177 |
| [83] | Raghunathan V, Mohan N, Dhaliwal M, et al. Pediatric liver transplantation in severe hepatopulmonary syndrome and use of inhaled nitric oxide for post-transplant hypoxemia-a single center experience[J]. Pediatr Transplant, 2020, 24(7): e13792. DOI:10.1111/petr.13792 |
| [84] | Nakane T, Esaki J, Ueda R, et al. Inhaled nitric oxide improves pulmonary hypertension and organ functions after adult heart valve surgeries[J]. Gen Thorac Cardiovasc Surg, 2021, 69(12): 1519-1526. DOI:10.1007/s11748-021-01651-z |
| [85] | Matsugi E, Takashima S, Doteguchi S, et al. Real-world safety and effectiveness of inhaled nitric oxide therapy for pulmonary hypertension during the perioperative period of cardiac surgery: a post-marketing study of 2817 patients in Japan[J]. Gen Thorac Cardiovasc Surg, 2024, 72(5): 311-323. DOI:10.1007/s11748-023-01971-2 |
| [86] | Miller OI, Tang SF, Keech A, et al. Inhaled nitric oxide and prevention of pulmonary hypertension after congenital heart surgery: a randomised double-blind study[J]. Lancet, 2000, 356(9240): 1464-9. DOI:10.1016/S0140-6736(00)02869-5 |
| [87] | Kolcz J, Karnas E, Madeja Z, et al. The cardioprotective and anti-inflammatory effect of inhaled nitric oxide during Fontan surgery in patients with single ventricle congenital heart defects: a prospective randomized study[J]. J Intensive Care, 2022, 10(1): 48. DOI:10.1186/s40560-022-00639-y |
| [88] | 张明杰, 柳立平, 李春香, 等. 先天性心脏病术后早期一氧化氮吸入治疗的有效性和安全性评价[J]. 中华心脏与心律电子杂志, 2023, 11(4): 210-215. DOI:10.3877/cma.j.issn.2095-6568.2023.04.004 |
| [89] | Ardehali A, Hughes K, Sadeghi A, et al. Inhaled nitric oxide for pulmonary hypertension after heart transplantation[J]. Transplantation, 2001, 72(4): 638-641. DOI:10.1097/00007890-200108270-00013 |
| [90] | Ofori-Amanfo G, Hsu D, Lamour JM, et al. Heart transplantation in children with markedly elevated pulmonary vascular resistance: impact of right ventricular failure on outcome[J]. J Heart Lung Transplant, 2011, 30(6): 659-666. DOI:10.1016/j.healun.2010.12.007 |
| [91] | Ghadimi K, Cappiello J, Cooter-Wright M, et al. Inhaled pulmonary vasodilator therapy in adult lung transplant: a randomized clinical trial[J]. JAMA Surg, 2022, 157(1): e215856. DOI:10.1001/jamasurg.2021.5856 |
| [92] | Moreno I, Vicente R, Mir A, et al. Effects of inhaled nitric oxide on primary graft dysfunction in lung transplantation[J]. Transplant Proc, 2009, 41(6): 2210-2212. DOI:10.1016/j.transproceed.2009.05.019 |
| [93] | Cornfield DN, Milla CE, Haddad IY, et al. Safety of inhaled nitric oxide after lung transplantation[J]. J Heart Lung Transplant, 2003, 22(8): 903-907. DOI:10.1016/s1053-2498(02)00809-4 |
| [94] | Lang JD Jr, Smith AB, Brandon A, et al. A randomized clinical trial testing the anti-inflammatory effects of preemptive inhaled nitric oxide in human liver transplantation[J]. PLoS One, 2014, 9(2): e86053. DOI:10.1371/journal.pone.0086053 |
| [95] | Lang JD Jr, Teng XJ, Chumley P, et al. Inhaled NO accelerates restoration of liver function in adults following orthotopic liver transplantation[J]. J Clin Invest, 2007, 117(9): 2583-2591. DOI:10.1172/JCI31892 |
| [96] | Society for Maternal-Fetal Medicine (SMFM), Pacheco LD, Saade G, et al. Amniotic fluid embolism: diagnosis and management[J]. Am J Obstet Gynecol, 2016, 215(2): B16-b24. DOI:10.1016/j.ajog.2016.03.012 |
| [97] | 中华医学会妇产科学分会产科学组. 羊水栓塞临床诊断与处理专家共识(2018)[J]. 中华妇产科杂志, 2018, 53(12): 831-835. DOI:10.3760/cma.j.issn.0529-567x.2018.12.006 |
| [98] | Bredmose PP, Buskop C, Lømo AB. Inhaled nitric oxide might be a contributing tool for successful resuscitation of cardiac arrest related to pulmonary hypertension[J]. Scand J Trauma Resusc Emerg Med, 2019, 27(1): 22. DOI:10.1186/s13049-019-0602-x |
| [99] | Juul N. Inhaled nitric oxide in a pregnant woman with pulmonary hypertension and critical aortic and mitral stenosis[J]. Chest, 2014, 145(3): 509A. DOI:10.1378/chest.1835892 |
| [100] | Lam GK, Stafford RE, Thorp J, et al. Inhaled nitric oxide for primary pulmonary hypertension in pregnancy[J]. Obstet Gynecol, 2001, 98(5 Pt 2): 895-898. DOI:10.1016/s0029-7844(01)01549-6 |
| [101] | Goodwin TM, Gherman RB, Hameed A, et al. Favorable response of Eisenmenger syndrome to inhaled nitric oxide during pregnancy[J]. Am J Obstet Gynecol, 1999, 180(1 Pt 1): 64-67. DOI:10.1016/s0002-9378(99)70151-1 |
| [102] | Crerar-Gilbert A, Boots R. Use of inhaled nitric oxide in pulmonary embolism[J]. Anaesth Intensive Care, 1999, 27(4): 412-414. DOI:10.1177/0310057X9902700415 |
| [103] | Chandel A, Patolia S, Ahmad K, et al. Inhaled Nitric Oxide via High-Flow Nasal Cannula in Patients with Acute Respiratory Failure Related to COVID-19[J]. Clin Med Insights Circ Respir Pulm Med, 2021, 15: 11795484211047065. DOI:10.1177/11795484211047065 |
| [104] | Shekar K, Varkey S, Cornmell G, et al. Feasibility of non-invasive nitric oxide gas inhalation to prevent endotracheal intubation in patients with acute hypoxemic respiratory failure: a single-centre experience[J]. Nitric Oxide, 2021, 116: 35-37. DOI:10.1016/j.niox.2021.08.005 |
| [105] | Ceccarelli P, Bigatello LM, Hess D, et al. Inhaled nitric oxide delivery by anesthesia machines[J]. Anesth Analg, 2000, 90(2): 482-488. DOI:10.1097/00000539-200002000-00045 |
| [106] | Eljezi V, Rochette L, Dualé C, et al. Inhaled nitric oxide before induction of anesthesia in patients with pulmonary hypertension[J]. Ann Card Anaesth, 2021, 24(4): 452-457. DOI:10.4103/aca.ACA_82_20 |
| [107] | 孙珵琭, 胡兆燕, 陈正龙, 等. 一氧化氮治疗仪及其应用进展[J]. 北京生物医学工程, 2015, 34(6): 649-656. DOI:10.3969/j.issn.1002-3208.2015.06.20 |
| [108] | Lei C, Berra L, Rezoagli E, et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery[J]. Am J Respir Crit Care Med, 2018, 198(10): 1279-1287. DOI:10.1164/rccm.201710-2150OC |
| [109] | Pichugin VV, Seyfetdinov IR, Ryazanov MV, et al. New technology for the use of inhaled nitric oxide to protect the heart and lungs during operations with cardiopulmonary bypass[J]. Sovrem Tekhnologii Med, 2021, 12(5): 28-34. DOI:10.17691/stm2020.12.5.03 |
| [110] | Hu J, Spina S, Zadek F, et al. Effect of nitric oxide on postoperative acute kidney injury in patients who underwent cardiopulmonary bypass: a systematic review and meta-analysis with trial sequential analysis[J]. Ann Intensive Care, 2019, 9(1): 129. DOI:10.1186/s13613-019-0605-9 |
| [111] | Yan Y, Kamenshchikov N, Zheng ZY, et al. Inhaled nitric oxide and postoperative outcomes in cardiac surgery with cardiopulmonary bypass: a systematic review and meta-analysis[J]. Nitric Oxide, 2024, 146: 64-74. DOI:10.1016/j.niox.2024.03.004 |
| [112] | Abouzid M, Roshdy Y, Daniel JM, et al. The beneficial use of nitric oxide during cardiopulmonary bypass on postoperative outcomes in children and adult patients: a systematic review and meta-analysis of 2897 patients[J]. Eur J Clin Pharmacol, 2023, 79(11): 1425-1442. DOI:10.1007/s00228-023-03554-9 |
| [113] | James C, Millar J, Horton S, et al. Nitric oxide administration during paediatric cardiopulmonary bypass: a randomised controlled trial[J]. Intensive Care Med, 2016, 42(11): 1744-1752. DOI:10.1007/s00134-016-4420-6 |
| [114] | Checchia PA, Bronicki RA, Muenzer JT, et al. Nitric oxide delivery during cardiopulmonary bypass reduces postoperative morbidity in children--a randomized trial[J]. J Thorac Cardiovasc Surg, 2013, 146(3): 530-536. DOI:10.1016/j.jtcvs.2012.09.100 |
| [115] | Kamenshchikov NO, Mandel IA, Podoksenov YK, et al. Nitric oxide provides myocardial protection when added to the cardiopulmonary bypass circuit during cardiac surgery: Randomized trial[J]. J Thorac Cardiovasc Surg, 2019, 157(6): 2328-2336. DOI:10.1016/j.jtcvs.2018.08.117 |
| [116] | Chiletti R, Horton S, Bednarz A, et al. Safety of nitric oxide added to the ECMO circuit: a pilot study in children[J]. Perfusion, 2018, 33(1): 74-76. DOI:10.1177/0267659117720495 |
| [117] | Liu YW, Zhu YF, Jiang CY, et al. An electrochemical nitric oxide generator for in-home inhalation therapy in pulmonary artery hypertension[J]. BMC Med, 2022, 20(1): 481. DOI:10.1186/s12916-022-02686-6 |
| [118] | 封志纯, 李秋平. 我国危重新生儿专业的成就与展望[J]. 中华围产医学杂志, 2023, 26(11): 898-902. DOI:10.3760/cma.j.cn113903-20231019-00270 |
| [119] | 赵强, 钱盟, 卫永禛. 一氧化氮医疗器械的创新发展之路[J]. 国际生物医学工程杂志, 2024, 47(1): 1-5. DOI:10.3760/cma.j.cn121382-20240201-00101 |
| [120] | 中国医师协会新生儿科医师分会. 一氧化氮吸入治疗在新生儿重症监护病房的应用指南(2019版)[J]. 发育医学电子杂志, 2019, 7(4): 241-248. DOI:10.3969/j.issn.2095-5340.2019.04.001 |
| [121] | DiBlasi RM, Myers TR, Hess DR. Evidence-based clinical practice guideline: inhaled nitric oxide for neonates with acute hypoxic respiratory failure[J]. Respir Care, 2010, 55(12): 1717-1745. |
| [122] | Lovich MA, Fine DH, Denton RJ, et al. Generation of purified nitric oxide from liquid N2O4 for the treatment of pulmonary hypertension in hypoxemic swine[J]. Nitric Oxide, 2014, 37: 66-72. DOI:10.1016/j.niox.2014.02.001 |
| [123] | 国家市场监督管理总局, 国家标准化管理委员会. GB/T 18883-2022室内空气质量标准[S]. (2022-07-11)[2023-12-28]. https://openstd.samr.gov.cn/bzgk/gb/newGbInfo?hcno=6188E23AE55E8F557043401FC2EDC436. |
| [124] | Pérez-Peñate GM, Juliá-Serdà G, Ojeda-Betancort N, et al. Long-term inhaled nitric oxide plus phosphodiesterase 5 inhibitors for severe pulmonary hypertension[J]. J Heart Lung Transplant, 2008, 27(12): 1326-1332. DOI:10.1016/j.healun.2008.08.007 |
| [125] | Ivy DD, Parker D, Doran A, et al. Acute hemodynamic effects and home therapy using a novel pulsed nasal nitric oxide delivery system in children and young adults with pulmonary hypertension[J]. Am J Cardiol, 2003, 92(7): 886-890. DOI:10.1016/s0002-9149(03)00910-x |
| [126] | Beghetti M, Sparling C, Cox PN, et al. Inhaled NO inhibits platelet aggregation and elevates plasma but not intraplatelet cGMP in healthy human volunteers[J]. Am J Physiol Heart Circ Physiol, 2003, 285(2): H637-H642. DOI:10.1152/ajpheart.00622.2002 |
| [127] | Monsalve-Naharro JÁ, Domingo-Chiva E, García Castillo S, et al. Inhaled nitric oxide in adult patients with acute respiratory distress syndrome[J]. Farm Hosp, 2017, 41(2): 292-312. DOI:10.7399/fh.2017.41.2.10533 |
| [128] | Kaplish D, Vagha JD, Meshram RJ, et al. A comprehensive review of inhaled nitric oxide therapy: current trends, challenges, and future directions[J]. Cureus, 2024, 16(2): e53558. DOI:10.7759/cureus.53558 |
| [129] | Matthay MA, Arabi Y, Arroliga AC, et al. A new global definition of acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2024, 209(1): 37-47. DOI:10.1164/rccm.202303-0558WS |
 2024, Vol. 33
2024, Vol. 33