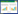近年来,心肺复苏(cardiopulmonary resuscitation, CPR)和体外生命支持技术的不断进步和完善,极大地提升了心脏骤停(cardiac arrest, CA)患者自主循环恢复(return of spontaneous circulation, ROSC)的成功率[1]。体外心肺复苏(extracorporeal CPR, ECPR)通过对已接受常规心肺复苏(conventional CPR, CCPR)不能恢复自主循环或反复CA患者快速给予静动脉体外膜肺氧合(extracorporeal membrane oxygenation, ECMO),以提供暂时的循环和呼吸支持,直到完成病因筛查和针对性治疗[2]。然而,ECPR患者仍可能进展为不可逆性脑损伤。因此,准确可靠的预测指标对ECPR患者神经功能预后评估和治疗策略的选择具有重要的临床价值。
CA后全身缺血再灌注损伤的病理生理机制包括全身炎症反应综合征和凝血系统激活等[3]。缺血再灌注损伤可引起凝血/纤溶级联反应,导致凝血功能异常。凝血/纤溶改变在CA后综合征发生发展过程中发挥重要作用,主要由内皮细胞、血小板和凝血/纤溶物质等参与。CA后全身炎症反应引起血管内皮损伤活化,组织因子诱导凝血酶产生,凝血系统激活,血小板活化聚集;继而抗凝活性受损,纤溶系统受抑制,导致凝血功能障碍。如病情进一步发展,持续高凝状态可引起凝血物质耗竭,凝血/纤溶失衡,最终发生弥散性血管内凝血(disseminated intravascular coagulation, DIC)[4]。凝血/纤溶系统功能紊乱对判断CA后患者病情严重程度及预后具有重要价值,本研究旨在探讨凝血/纤溶改变对成人ECPR患者神经功能预后的预测价值。
1 资料与方法 1.1 研究对象本研究为单中心、回顾性观察性研究,连续纳入2018年1月至2023年4月于南京医科大学第一附属医院急诊科接受ECPR治疗的CA患者。排除标准为:年龄 < 18岁,ROSC后格拉斯哥昏迷评分(Glasgow coma scale, GCS) > 8分,ECMO转机时间 < 24 h,存在创伤、恶性肿瘤、神经功能缺损性疾病、重大手术(心脏手术、胰腺炎、烧伤等)、严重肝硬化(Child > B级)及其他影响凝血功能的血液系统疾病、既往服用抗凝药物等。本研究符合医学伦理学标准,经医院伦理委员会批准(伦审号:2020-SR-226),并按原则免除知情同意。
1.2 研究方法所有ECPR患者均于ECMO建立后立即采集静脉血,本中心ECPR实施方案在ECMO建立期间不使用抗凝药物。采用Sysmex XE-2100全自动血液分析仪进行血小板计数(platelet, PLT)测定,采用Sysmex CS-5100全自动血凝分析仪进行凝血功能检测,指标包括凝血酶原时间(prothrombin time, PT)、活化部分凝血活酶时间(activated partial thromboplastin, APTT)、凝血酶时间(thrombin time, TT)、纤维蛋白原(fibrinogen, Fib)和D-二聚体(D-dimer, D-D)。同时,记录所有ECPR患者一般临床资料和围CA期相关信息,包括:CA地点、有无目击者CA、有无旁观者CPR、CA病因、初始心律、CCPR时间及ECMO转机时间等。以患者出院时格拉斯哥-匹兹堡脑功能表现分级(cerebral performance category, CPC)评分作为临床预后判断的依据,CPC 1~2分为神经功能预后良好,CPC 3~5分为神经功能预后不良。
1.3 统计学方法采用SPSS 23.0软件和R 4.2.3软件进行统计分析并绘制限制性立方样条(RCS)图。计量资料采用Kolmogorov-Smirnov法进行正态性检验,符合正态分布变量以均数±标准差(x±s)表示,采用成组t检验;非正态分布数据以中位数(四分位数)[M (Q1, Q3)]表示,采用Mann-Whitney U检验。计数资料以率或构成比表示,采用χ2检验或Fisher确切概率法。应用RCS模型,在调整协变量(年龄、性别、基础疾病史、CA地点、CCPR时间和ECMO转机时间)后,确定各凝血指标RCS拐点作为最佳截断值(cut-off),并分组。将研究人群分为高水平组(高于cut-off)和低水平(低于cut-off)组。基于Cox比例风险模型,采用风险比(hazard ratio, HR)及其95%可信区间(confidence interval, CI)评价各指标对ECPR患者神经功能不良预后的影响。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料比较接受ECPR治疗的CA患者共158例,最终纳入133例患者。根据患者出院时CPC评分分组,预后良好组有37例(27.8%),年龄(52.08±14.45)岁,男性25例;预后不良组有96例(72.2%),年龄(49.16±16.82)岁,男性74例,30 d病死率为87.5%。两组在年龄、性别、基础疾病史、有无目击者、心源性病因等方面差异无统计学意义(均P > 0.05)。预后不良组院内CA、旁观者CPR及初始可除颤心律比例均显著低于预后良好组(均P < 0.05)。与预后良好组比较,预后不良组CCPR时间显著延长、ECMO转机时间明显减少(均P < 0.05)。见表 1。
| 指标 | 预后不良组(96例) | 预后良好组(37例) | t/χ2/Z值 | P值 |
| 年龄(岁)a | 49.16±16.82 | 52.08±14.45 | 0.933 | 0.353 |
| 男性(例,%) | 74 (77.1) | 25 (67.6) | 1.271 | 0.260 |
| 基础疾病史(例,%) | ||||
| 高血压 | 32 (33.3) | 14 (37.8) | 0.240 | 0.625 |
| 糖尿病 | 17 (17.7) | 8 (21.6) | 0.268 | 0.605 |
| 冠心病 | 8 (8.3) | 2 (5.4) | 0.043 | 0.836 |
| 脑卒中 | 6 (6.3) | 2 (5.4) | 0.034 | 0.854 |
| 院外CA(例,%) | 41 (42.7) | 7 (18.9) | 6.553 | 0.010 |
| 有目击者(例,%) | 88 (91.7) | 37 (100) | 1.972 | 0.160 |
| 旁观者CPR(例,%) | 80 (83.3) | 37 (100) | 5.524 | 0.019 |
| 心源性病因(例,%) | 73 (76.0) | 30 (81.1) | 0.388 | 0.533 |
| 初始可除颤心律(例,%) | 46 (47.9) | 25 (67.6) | 4.144 | 0.042 |
| CCPR时间[min) b | 50.0 (33.0, 84.5) | 39.0 (12.0, 52.5) | -2.938 | 0.003 |
| ECMO转机时间[h) b | 92.0 (40.8, 161.8) | 140.0 (123.0, 186.0) | -3.806 | < 0.001 |
| 凝血功能 | ||||
| 血小板计数(×109/L) a | 140.62±74.31 | 167.92±64.32 | 2.098 | 0.039 |
| PT (s) b | 20.65 (16.43, 31.33) | 16.00 (14.10, 19.25) | -4.093 | < 0.001 |
| APTT (s) b | 59.65 (42.63, 90.00) | 41.50 (33.30, 55.30) | -3.571 | < 0.001 |
| TT (s) b | 67.55 (22.00, 146.88) | 34.40 (22.85, 98.25) | -1.052 | 0.293 |
| 纤维蛋白原(g/L)b | 1.46 (0.74, 2.22) | 2.09 (1.40, 2.54) | -2.604 | 0.009 |
| D-二聚体(mg/L)b | 10.00 (8.23, 36.99) | 10.00 (3.83, 15.79) | -1.872 | 0.061 |
| 30 d病死率(例,%) | 84 (87.5) | 0 (0) | — | — |
| 注:a为x±s,b为M(Q1, Q3);CA为心脏骤停,CPR为心肺复苏,CCPR为常规心肺复苏,ECMO为体外膜肺氧合,PT为凝血酶原时间,APTT为活化部分凝血活酶时间,TT为凝血酶时间 | ||||
与预后良好组比较,预后不良组PLT、Fib水平显著降低,PT、APTT明显延长(均P < 0.05)。TT、D-D在两组间差异无统计学意义(均P > 0.05)(表 1)。同时,本研究进一步采用RCS模型评价各凝血指标与神经功能不良预后风险的相关性。结果显示,PT、APTT、D-D与ECPR患者不良预后风险存在非线性正相关,而Fib、PLT与ECPR患者不良预后风险存在非线性负相关(均P < 0.05)。TT改变与不良预后风险无显著相关性(P > 0.05)。见图 1。
|
| 图 1 各凝血指标与神经功能不良预后风险的相关性 Fig 1 Correlation of coagulation-related indicators with risk of poor neurological outcomes |
|
|
依据各凝血指标RCS最佳截断值(PT 18.4 s、APTT 55 s、TT 47 s、Fib 1.58 g/L、D-D 10 mg/L和PLT 141×109/L),将研究人群分为高水平组和低水平组。Cox分析结果显示,在调整协变量(CA地点、CCPR时间和ECMO转机时间)后,ECPR患者PT(HR=1.87,95%CI: 1.17~2.99,P=0.009)、APTT(HR=1.95,95%CI: 1.26~3.00,P=0.003)和D-D(HR=5.18,95%CI: 2.06~13.03,P < 0.001)高水平组神经功能不良预后风险显著高于低水平组。PLT(HR=0.55,95%CI: 0.35~0.84,P=0.007)高水平组神经功能不良预后风险显著低于低水平组。Fib改变在两组间差异无统计学意义(P=0.136)。见表 2和图 2。
| 指标 | 例数 | Model 1 | Model 2 | |||
| HR (95%CI) | P值 | HR (95%CI) | P值 | |||
| PT | ||||||
| ≤18.4 s | 63 | 1.00 (ref) | ref | 1.00 (ref) | ref | |
| > 18.4 s | 70 | 2.40 (1.53~3.79) | < 0.001 | 1.87 (1.17~2.99) | 0.009 | |
| APTT | ||||||
| ≤ 55 s | 67 | 1.00 (ref) | ref | 1.00 (ref) | ref | |
| > 55 s | 66 | 2.25 (1.48~3.41) | < 0.001 | 1.95 (1.26~3.00) | 0.003 | |
| TT | ||||||
| ≤ 47 s | 66 | 1.00 (ref) | ref | 1.00 (ref) | ref | |
| > 47 s | 67 | 1.26 (0.83~1.92) | 0.273 | 1.03 (0.66~1.62) | 0.882 | |
| 纤维蛋白原 | ||||||
| ≤1.58 g/L | 65 | 1.00 (ref) | ref | 1.00 (ref) | ref | |
| > 1.58 g/L | 68 | 0.45 (0.28~0.71) | < 0.001 | 0.68 (0.41~1.13) | 0.136 | |
| D-二聚体 | ||||||
| ≤10 mg/L | 68 | 1.00 (ref) | ref | 1.00 (ref) | ref | |
| > 10 mg/L | 59 | 3.14 (1.24~7.98) | 0.016 | 5.18 (2.06~13.03) | < 0.001 | |
| 血小板计数 | ||||||
| ≤ 141×109/L | 66 | 1.00 (ref) | ref | 1.00 (ref) | ref | |
| > 141×109/L | 67 | 0.52 (0.34~0.79) | 0.002 | 0.55 (0.35~0.84) | 0.007 | |
| 注:HR为风险比,CI为可信区间,PT为凝血酶原时间,APTT为活化部分凝血活酶时间,TT为凝血酶时间;Model 1调整了年龄、性别和基础疾病史;Model 2在Model 1的基础上调整了CA地点、CCPR时间和ECMO转机时间 | ||||||
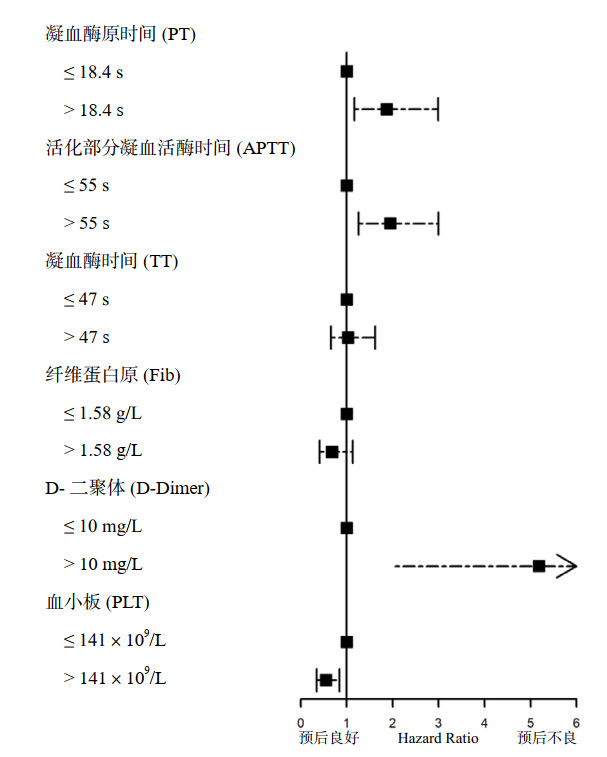
|
| 图 2 各凝血指标影响神经功能不良预后森林图 Fig 2 Forest plot of coagulation-related indicators in predicting poor neurological outcomes |
|
|
凝血/纤溶系统功能异常是CA后患者重要的病理生理学特征。CA后无血流和低血流状态下,较大血管可快速形成血凝块[5]。在CA和复苏过程中,缺氧和酸中毒可造成血管内皮细胞损伤,刺激组织因子释放,从而启动外源性凝血过程。此外,组织细胞损伤后损伤相关分子模式的释放诱导炎症反应过度激活,可进一步加速组织因子依赖性凝血途径的激活,同时促进凝血因子Ⅻ和Ⅺ依赖性凝血过程。同时,抗凝血酶、组织因子途径抑制剂、蛋白C/S和其他抗凝血物质的减少,可部分抑制内源性纤溶系统[6-8]。既往研究发现,凝血和纤溶相关指标包括PT、APTT、D-D和纤维蛋白原降解产物等与CA后患者预后密切相关,有望成为评价神经功能预后的重要生物标志物[8]。本研究评价了凝血功能相关指标对ECPR患者神经功能预后的判断价值。结果显示,PT、APTT、D-D水平与ECPR患者不良预后风险存在非线性正相关,而Fib、PLT水平与ECPR患者不良预后风险存在非线性负相关。
PT作为筛查和评估外源性凝血系统疾病的指标,广泛应用于监测抗凝治疗、评估肝功能不全以及凝血功能异常(如DIC)等[9]。研究表明,PT延长与创伤、脓毒症、脑出血和急性失代偿性心力衰竭等疾病的不良预后密切相关[8]。Kim等[10]报道了PT/INR延长与成人心源性院外CA患者住院存活率低具有显著相关性。APTT是反映内源性和共同途径凝血过程的指标,还可用于评估肝素和类肝素物质的作用。APTT对Fib减少、纤维蛋白(原)降解产物增多及酸中毒敏感[11]。研究表明,CA后缺血促使内皮细胞释放组织型纤溶酶原激活物(t-PA),后者主要调节纤维蛋白(原)降解,并导致APTT延长。CA后乳酸升高导致的酸中毒也可引起APTT延长,并呈剂量依赖关系。此外,溺水相关和创伤性CA患者血管内皮多糖蛋白复合物(类肝素物质)的释放,也可引起APTT延长[12]。Schriefl等[11]研究表明,CA后患者APTT延长与神经功能不良预后具有显著相关性。
本研究结果显示,ECPR患者PT和APTT高水平组神经功能不良预后风险显著高于低水平组。凝血系统过度激活后,凝血因子消耗导致PT延长。APTT延长多提示缺血和组织灌注不足,与CA后无血流和低血流时间密切相关。低血流时间越长,APTT延长越显著,预后越差。此外,因PT延长在肝功能不全中较常见,CA后缺氧性肝损伤也可导致PT延长。由于CA后血供丧失,包括肝脏在内的多个组织器官遭受严重的缺血缺氧,导致小叶中心肝细胞坏死和急性肝损伤。同时,ROSC后再灌注损伤也是肝损伤的重要原因[13]。CA后患者缺氧性肝损伤发生率为19%~21%,可作为评价不良预后的预测指标[14]。
Fib是血浆中含量最高的凝血因子,除直接参与凝血过程外,还是血液粘度和血小板聚集的重要决定因素[15]。D-D作为最主要的纤溶产物,是t-PA释放和内源性纤溶的下游标志物,其水平升高可提示潜在的高凝状态、病理性纤溶和炎症过程等[16]。CA后无血流和低血流导致血凝块形成,Fib明显降低、D-D明显升高。而CA过程中的高凝状态,可产生无复流现象,导致包括大脑在内的重要器官灌注不足,进而影响预后。既往研究已将D-D应用于CA后患者不良预后和病死率预测。结果显示,D-D升高与神经功能不良预后密切相关,且D-D水平与APTT具有显著正相关性[11]。此外,Asano等[17]报道了OHCA后30 d存活患者初始D-D水平显著低于死亡患者,D-D≤10 μg/mL可作为评价CA后患者存活的预测指标。本研究结果表明,D-D高水平组和Fib低水平组神经功能不良预后风险显著增高。但值得注意的是,CA常见病因如急性心肌梗死和肺血栓栓塞症等,本身可引起D-D水平升高,从而影响其预后判断价值。
重症患者血小板减少受多种病因影响,发生率为13%~44.1%,并与病死率相关[18]。血管内皮细胞损伤伴或不伴有DIC被认为是导致血小板活化的主要病理生理学机制,可由全身炎症反应综合征(脓毒症)、血栓性微血管病和药源性(肝素使用)等因素导致。内皮完整性的破坏,可促进血小板粘附聚集,引起血小板减少[19]。CA后全身缺血-再灌注损伤导致的全身炎症反应,与脓毒症所致的表现相似。既往研究发现,CA后内皮损伤活化与高基线水平的全身炎症有关。CA后综合征与血小板数量减少相关,而非其功能改变[20]。Nobile等[21]研究表明,CA后存活和死亡患者中,“血液系统衰竭”(即血小板计数 < 50×109/L)的发生率在两组间差异无统计学意义;但院外CA患者入住ICU时和ICU住院期间,“血液系统衰竭”的发生率显著高于院内CA患者。本研究结果显示,PLT > 141×109/L患者神经不良预后风险明显减小,提示血小板减少可作为评价CA后患者预后的影响因素。
CA后无血流和低血流期细胞和组织的直接损伤、ROSC后全身缺血再灌注损伤以及神经激素过度激活等均可引起内皮细胞功能障碍、组织因子表达、凝血酶产生,并通过一系列级联反应引起凝血/纤溶改变。此外,CA后血小板活化因素,如缺血缺氧、凝血酶和儿茶酚胺等,可促进血小板过度活化,导致血栓性炎症状态[22]。组织因子介导的凝血激活和血小板活化也是DIC发生发展的主要诱因。DIC表现为全身凝血激活和内源性纤溶不足,导致血管内纤维蛋白和微血栓形成。既往研究表明,CA后DIC发生率为42%~54%,是影响CA后患者病情严重程度和预后的重要因素[23]。
本研究为单中心、观察性研究,前瞻性研究设计的结论仍需多中心、更大样本量进行验证。此外,凝血/纤溶系统其他指标,如纤维蛋白(原)降解产物、t-PA及内源性类肝素物质等未纳入本研究范围,后续研究可进一步全面评估CA后凝血/纤溶改变对神经功能预后的影响。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王淦楠、张刚:直接参与研究设计、数据收集与分析、论文撰写;陈旭锋、梅勇:研究设计、文章审阅与指导;张忠满、李伟:数据收集与分析、论文修改
| [1] | Patricio D, Peluso L, Brasseur A, et al. Comparison of extracorporeal and conventional cardiopulmonary resuscitation: a retrospective propensity score matched study[J]. Crit Care, 2019, 23(1): 27. DOI:10.1186/s13054-019-2320-1 |
| [2] | 王淦楠, 张忠满, 许晓泉, 等. 成人体外心肺复苏患者神经功能预后相关指标的预测价值研究[J]. 中华危重症医学杂志(电子版), 2022, 15(1): 9-13. DOI:10.3877/cma.j.issn.1674-6880.2022.01.003 |
| [3] | 王娟, 杨艳敏, 谭慧琼. 心脏骤停复苏后凝血-纤溶改变的研究进展[J]. 中华急诊医学杂志, 2021, 30(11): 1402-1406. DOI:10.3760/cma.j.issn.1671-0282.2021.11.026 |
| [4] | Kim HJ, Michael K, Wee JH, et al. Coagulation measures after cardiac arrest (CMACA)[J]. PLoS One, 2023, 18(1): e0279653. DOI:10.1371/journal.pone.0279653 |
| [5] | Budhram GR, Mader TJ, Lutfy L, et al. Left ventricular thrombus development during ventricular fibrillation and resolution during resuscitation in a swine model of sudden cardiac arrest[J]. Resuscitation, 2014, 85(5): 689-693. DOI:10.1016/j.resuscitation.2014.01.030 |
| [6] | Mizugaki A, Wada T, Tsuchida T, et al. Association of histones with coagulofibrinolytic responses and organ dysfunction in adult post-cardiac arrest syndrome[J]. Front Cardiovasc Med, 2022, 9: 885406. DOI:10.3389/fcvm.2022.885406 |
| [7] | Wada T. Coagulofibrinolytic changes in patients with post-cardiac arrest syndrome[J]. Front Med, 2017, 4: 156. DOI:10.3389/fmed.2017.00156 |
| [8] | Tang YY, Sun J, Yu ZX, et al. Association between prothrombin time-international normalized ratio and prognosis of post-cardiac arrest patients: a retrospective cohort study[J]. Front Public Health, 2023, 11: 1112623. DOI:10.3389/fpubh.2023.1112623 |
| [9] | Plotnikov G, Bracha L, Izhakian S, et al. Prognostic significance of a prolonged international normalized ratio in elderly patients in an internal medicine ward[J]. Arch Gerontol Geriatr, 2018, 74: 141-144. DOI:10.1016/j.archger.2017.10.021 |
| [10] | Kim K, Shin S, Song K, et al. Effect of prothrombin time prolongation on survival outcome in out-of-hospital cardiac arrest: a multicenter observational study[J]. J Korean Soc Emerg Med, 2018, 29: 66-75. |
| [11] | Schriefl C, Schoergenhofer C, Grafeneder J, et al. Prolonged activated partial thromboplastin time after successful resuscitation from cardiac arrest is associated with unfavorable neurologic outcome[J]. Thromb Haemost, 2021, 121(4): 477-483. DOI:10.1055/s-0040-1719029 |
| [12] | Schwameis M, Schober A, Schörgenhofer C, et al. Asphyxia by drowning induces massive bleeding due to hyperfibrinolytic disseminated intravascular coagulation[J]. Crit Care Med, 2015, 43(11): 2394-2402. DOI:10.1097/CCM.0000000000001273 |
| [13] | Oh SH, Kim HJ, Park KN, et al. Hypoxic hepatitis in survivors of out-of-hospital cardiac arrest[J]. Am J Emerg Med, 2015, 33(9): 1166-1170. DOI:10.1016/j.ajem.2015.05.008 |
| [14] | Roedl K, Spiel AO, Nürnberger A, et al. Hypoxic liver injury after in- and out-of-hospital cardiac arrest: risk factors and neurological outcome[J]. Resuscitation, 2019, 137: 175-182. DOI:10.1016/j.resuscitation.2019.02.038 |
| [15] | Kunutsor SK, Kurl S, Zaccardi F, et al. Baseline and long-term fibrinogen levels and risk of sudden cardiac death: a new prospective study and meta-analysis[J]. Atherosclerosis, 2016, 245: 171-180. DOI:10.1016/j.atherosclerosis.2015.12.020 |
| [16] | Favresse J, Lippi G, Roy PM, et al. D-dimer: Preanalytical, analytical, postanalytical variables, and clinical applications[J]. Crit Rev Clin Lab Sci, 2018, 55(8): 548-577. DOI:10.1080/10408363.2018.1529734 |
| [17] | Asano M, Kurabayashi M, Yamauchi Y, et al. Relationship between D-dimer level upon emergency room arrival and the duration of cardiac arrest in patients with witnessed out-of-hospital cardiac arrest[J]. Heart Vessels, 2021, 36(5): 731-737. DOI:10.1007/s00380-020-01745-3 |
| [18] | Hui P, Cook DJ, Lim W, et al. The frequency and clinical significance of thrombocytopenia complicating critical illness: a systematic review[J]. Chest, 2011, 139(2): 271-278. DOI:10.1378/chest.10-2243 |
| [19] | Kim HJ, Park KN, Kim SH, et al. Time course of platelet counts in relation to the neurologic outcome in patients undergoing targeted temperature management after cardiac arrest[J]. Resuscitation, 2019, 140: 113-119. DOI:10.1016/j.resuscitation.2019.05.019 |
| [20] | Cotoia A, Franchi F, De Fazio C, et al. Platelet indices and outcome after cardiac arrest[J]. BMC Emerg Med, 2018, 18(1): 31. DOI:10.1186/s12873-018-0183-4 |
| [21] | Nobile L, Taccone FS, Szakmany T, et al. The impact of extracerebral organ failure on outcome of patients after cardiac arrest: an observational study from the ICON database[J]. Crit Care, 2016, 20(1): 368. DOI:10.1186/s13054-016-1528-6 |
| [22] | Gando S, Wada T. Disseminated intravascular coagulation in cardiac arrest and resuscitation[J]. J Thromb Haemost, 2019, 17(8): 1205-1216. DOI:10.1111/jth.14480 |
| [23] | Kim J, Kim K, Lee JH, et al. Prognostic implication of initial coagulopathy in out-of-hospital cardiac arrest[J]. Resuscitation, 2013, 84(1): 48-53. DOI:10.1016/j.resuscitation.2012.09.003 |
 2024, Vol. 33
2024, Vol. 33