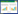2. 睢宁县人民医院急诊医学科,睢宁 221006;
3. 徐州医科大学第二临床医学院急诊医学实验室,徐州 221006;
4. 南京大学医学院附属鼓楼医院急诊医学科,南京 210008;
5. 南京市江宁医院急诊医学科,南京 211100;
6. 徐州医科大学江苏省卫生应急研究所,徐州 221006
2. Laboratory of Emergency Medicine, The Second Clinical College of Xuzhou Medical University, Xuzhou, Jiangsu 221006, China;
3. Department of Emergency Medicine, Suining People's Hospital, Suining 221006, China;
4. Department of Emergency Medicine, Nanjing Drum Tower Hospital, Nanjing University Medical School, Nanjing 210008, China;
5. Department of Emergency Medicine, Nanjing Jiangning Hospital, Nanjing 211100, China;
6. Jiangsu Institute of Health Emergency Response, Xuzhou Medical University, Xuzhou 221006, China
心脏骤停(cardiac arrest, CA)是急危重症医学的重大挑战,有研究显示,2020年中国七大地理区域的院外心脏骤停患者中,自主循环恢复(return of spontaneous circulation, ROSC)率为6.0%,存活出院率为1.2%,出院神经功能预后良好率仅有0.8%[1]。心脏骤停后神经功能障碍是ROSC后主要的致残、致死原因, 尽管目前已提出优化血流动力学目标、目标温度管理等多种措施,但临床上仍然缺乏有效的治疗手段[2-4]。
远端缺血适应(remote ischemic conditioning, RIC)是指在进行一次短暂的、良性的缺血/再灌注损伤后,机体通过启动内源性保护机制,提高重要脏器对缺血/缺氧损伤事件的耐受能力[5]。施行RIC能够有效的减轻CA、心肌梗死、脑卒中等事件造成的缺血/再灌注损伤,具有非常好的应用前景[6-8],但其机制仍然未能完全揭示。
外泌体(exosome)是一种含有多种蛋白及RNA成分的细胞外囊泡,在细胞受到缺血缺氧等刺激后会迅速且大量的分到循环中,已有研究证实不同来源外泌体对于脑缺血/再灌注损伤的神经保护作用[9-10]。因此,笔者推测RIC后产生的外泌体可能是RIC减轻CA后神经功能障碍的主要有效成分。
内皮糖萼是覆盖血管内皮细胞表面的一层物质,对维持微血管正常功能至关重要。目前已有研究证实CA会造成内皮糖萼大量破坏,其主要成分如透明质酸(hyaluronic acid, HA)和多配体蛋白聚糖-1(syndecan-1, Sdc-1)脱落至循环中,进而导致神经功能障碍[11-12]。
因此,本研究从接受RIC的大鼠血浆中提取外泌体,并注射到大鼠CA模型中,以验证RIC来源的血浆外泌体对CA后神经功能障碍的治疗效果,并探讨其保护机制是否涉及了糖萼降解。
1 材料和方法 1.1 实验试剂与仪器本实验所使用常用试剂均为国产分析纯。磷酸盐溶液(phosphate buffered saline, PBS)购自微科曼得生物工程有限公司(中国)。肾上腺素购自远大医药有限公司(中国)。免疫印迹实验中所用抗体包括抗MMP-2(ab92536),抗MMP-9(ab76003)均购自Abcam(英国),兔二抗(A1949)及鼠二抗(A0168)购自Sigma-Aldrich(德国)。HA试剂盒(DHYAL0)购自R&D Systems(美国)。Sdc-1试剂盒(EK4131)购自SignalWay Antibody(美国)。异氟烷及R407小动物呼吸机及通用型小动物麻醉机购自瑞沃德生命科技股份有限公司(中国)。生物信号采集与分析系统BL-420N购自成都泰盟软件有限公司(中国)。动物行为学分析软件ANY-maze购自Stoelting(美国)。全自动化学发光图像分析系统Tanon-4160购自上海天能公司。Epoch全波长酶标仪购自Biotek公司(美国)。Zetaview PMX-120纳米粒径跟踪分析仪购自Particle Metrixd公司(德国)。
1.2 动物准备本实验获得徐州医科大学实验动物伦理道德委员会批准(202301T008)。实验选用健康成年雄性Sprague Dawley大鼠,体重300~400 g,由徐州医科大学实验动物中心提供。动物购进后于SPF级动物房饲养,可随意获取水和饲料。
1.3 RIC模型制备3%异氟烷麻醉大鼠,弹力止血带结扎大鼠四肢,进行5个连续的缺血/适应循环,每个循环包括5 min缺血和5 min再灌注,完成5个缺血/适应循环1 h后取血[13]。
1.4 外泌体制备及鉴定外泌体通过超速离心法获取[14]:大鼠全血离心分离出血浆,经0.22 μm滤器过滤后以100000g离心90 min,取沉淀重悬,以100 000g离心90 min。沉淀用100 μL PBS重悬。使用NTA分析外泌体粒径及浓度,并用PBS溶液稀释至1×Particles/mL用于后续实验干预[15-16]。
1.5 CA模型制备建立大鼠窒息法CA模型[17]:3%异氟烷麻醉大鼠后经口气管插管,连接呼吸机,设置潮气量6.0 mL/Kg,呼吸频率为100次/min。加热垫维持体温在(37±0.5)℃。皮下放置电极以监测心电图和心率(heart rate, HR)。PE-50导管插入左侧股动、静脉,分别用于监测平均动脉压(mean arterial pressure, MAP)和给药。关闭气管导管,窒息诱导CA。CA定义为MAP低于20 mmHg(1 mmHg=0.133 kPa)。窒息7 min后开始心肺复苏,予胸外按压(300次/min),并恢复机械通气(FiO2:1.0),每3 min注射1次肾上腺素(0.01 mg/kg),直至获得ROSC。ROSC定义为自行维持MAP≥60 mmHg且持续≥5min的室上性心律。ROSC后2 h,大鼠脱离呼吸机并拔管,返回笼中。
1.6 实验动物分组大鼠随机分为三组(每组n=12):①假手术组(Sham组),仅对大鼠进行手术操作;②对照组(Control组),诱导CA,ROSC后静脉缓慢注射1 ml PBS溶液;③外泌体组(Exosome组)诱导CA,ROSC后静脉缓慢注射1 mL外泌体悬液(1× Particles/mL)[15]。每组大鼠分为两部分进行试验:第一部分(每组n=6)大鼠于造模后第1、4、7~11天序贯进行神经功能缺陷评分(neuropsychological deficit score, NDS)以及行为学实验;第二部分(每组n=6)大鼠于造模后24 h断头处死,留取脑海马CA1区及血浆用于后续检测。
1.7 NDS评分在CA后第1天开展NDS评分[18]。对大鼠意识水平、呼吸频率、脑干反射、四肢和尾巴感觉和运动功能、协调性进行评分,总分500分,0分代表神经功能正常,500分代表脑死亡。
1.8 旷场实验在CA后第4天开展[19]。将大鼠背对实验者放在实验箱中央区域并立即离开,记录动物在箱体内5 min的活动,记录大鼠水平运动总距离及中央区运进入总次数。
1.9 Y迷宫实验评估短期神经功能结果在CA后第4天开展。将大鼠放入Y迷宫内,让其穿梭于3个臂,记录5 min内大鼠进出各个臂的顺序,以连续进入3个不同臂为正确选择,记录每只大鼠自发交替正确率。
1.10 Morris水迷宫实验评估长期神经功能结果在CA后第7~11天开展[20]。在CA后第7~10天,将大鼠头面向池壁依次从四个象限放入池中,每次实验总时间为60 s。在大鼠登上平台后,保障其在平台上站立10 s以强化记忆。如果大鼠在规定时段内未找到平台,则将其引导至平台上。记录大鼠登上平台的时间作为逃避潜伏期。在CA后第11天,移除水下的隐蔽平台,大鼠自由探索60 s。记录大鼠在60 s内第1次到达平台位置时间、穿越原来平台放置区域的次数、平台所在象限探索时间。
1.11 Elisa检测血浆中糖萼降解标志物水平ROSC后24 h利用ELISA试剂盒检测血浆HA和Sdc-1水平。按照说明书制备所有试剂、工作标准品和样品,每个样本设置3个复孔,全程严格按照说明书进行操作。使用酶标仪在规定波长处测定吸光度。
1.12 免疫印迹法检测大鼠海马CA1区中MMP-2/9含量ROSC后24 h,大鼠充分麻醉后断头,快速冰上分离海马CA1区,匀浆提取组织蛋白。采用BCA法测定蛋白浓度和含量。制备SDS-PAGE凝胶进行电泳,结束后湿转法将蛋白转移至PVDF膜上并进行封闭。在4℃下用抗MMP-2/9抗体孵育过夜(12 h)。以β-actin为内参,加入对应二抗孵育1 h,加入显色液显色。全自动化学发光图像分析系统采集图像,采用ImageJ分析图像。
1.13 统计学方法计量资料数据采用均数±标准差(x±s)表示。两组计量资料之间的比较采用t检验进行统计学分析;多组计量资料之间的比较采用单因素方差分析,重复测量数据采用重复测量的方差分析,两两比较采用Turkey检验。数据的统计学分析均由统计软件GraphPad Prism 9.0完成,以P<0.05为差异有统计学意义。
2 结果 2.1 各组大鼠基线和复苏特征三组动物的体重、窒息前的HR和MAP之间无统计学意义(P>0.05)。Control组及Exosome组的CA时长、CPR时长和肾上腺素剂量之间差异无统计学意义(P>0.05)。和Sham组相比,Control组和Exosome组ROSC后2 h内的HR和MAP明显降低(P<0.05),Control组与Exosome组之间没有统计学差异(P>0.05)。见表 1。
| 指标 | Sham组(n=12) | Control组(n=12) | Exosome组(n=12) | F/t值 | P值 |
| 基线特征 | |||||
| 体重(g) | 371.9±19.3 | 372.1±16.8 | 379.5±14.8 | 0.772 | 0.4700 |
| HR(次/min) | 375.8±37.3 | 382.5±38.0 | 380.3±32.1 | 0.343 | 0.7120 |
| MAP (mmHg) | 111.0±11.6 | 128.8±8.9 | 126.6±17.8 | 0.816 | 0.4510 |
| 复苏特征 | |||||
| CA时长(s) | - | 147.8±51.50 | 133±37.50 | 1.884 | 0.3080 |
| CPR时长(s) | - | 100.7±40.40 | 106.3±29.40 | 1.882 | 0.3090 |
| 肾上腺素(μg) | - | 4.09±1.15 | 4.14±1.19 | 1.051 | 0.9360 |
| ROSC后1 h | |||||
| HR(次/min) | 360.1±39.3 | 321.3±35.6 a | 341.6±15.6 a | 6.694 | 0.0036 |
| MAP (mmHg) | 109.9±13.5 | 87.3±16.4 a | 91.9±15.4 a | 9.616 | 0.0005 |
| ROSC后2 h | |||||
| HR(次/min) | 365.1±32.9 | 318.4±29.0 a | 329.5±29.8 a | 8.116 | 0.0014 |
| MAP (mmHg) | 110.4±17.2 | 90.4±12.0 a | 93.8±12.6 a | 6.544 | 0.0040 |
| 注:Sham为假手术组,Control为对照组,Exosome为外泌体组,HR为心率,MAP为平均动脉压,CA为心脏骤停,CPR为心肺复苏,ROSC为自主循环恢复;与Sham组比较,aP<0.05 | |||||
NTA检测稀释倍数为1∶1000,和正常大鼠相比,RIC后大鼠血浆中外泌体浓度显著升高(8.97±0.21 ×1010 vs. 3.27±0.12 ×1010,P<0.01),见图 1。
|
| A: 正常大鼠血浆外泌体浓度;B:RIC后大鼠血浆外泌体浓度 图 1 NTA分析结果 Fig 1 Results of NTA analysis |
|
|
CA后24 h的NDS评分,与Sham组相比,Control组和Exosome组大鼠在CA后均出现明显的NDS评分升高[(8.3±12.9) vs. (33.3±12.9), (8.3±12.9) vs. (37.5±20.9), P<0.05]。Control组和Exosome组之间比较差异无统计学意义[(33.3±12.9) vs. (37.5±20.9), P>0.05]。
2.3 旷场实验结果CA后第4天的旷场实验结果,与Sham组相比,Control组大鼠进入旷场中心区域次数显著下降[(6.67±2.66) vs. (1.17±0.41),P<0.05,图 3A],且水平运动总距离显著减少[(16.95±7.57) vs. (5.86±2.89),P<0.05]。与Control组相比,Exosome组大鼠进入中心区域次数[(1.17±0.41) vs. (3.83±1.17),P<0.05]及水平运动总距离[(5.86±2.89) vs. (17.53±5.51),P<0.05]显著增加,见图 2。

|
| Sham为假手术组,Control为对照组,Exosome为外泌体组 图 2 三组大鼠在旷场实验中的轨迹图 Fig 2 Results of open field test |
|
|
|
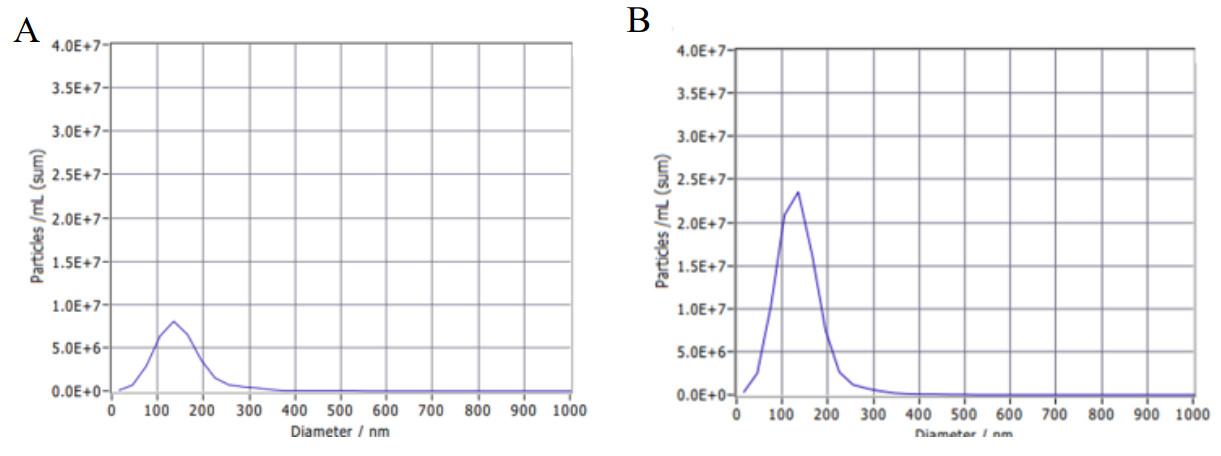
| A:三组大鼠自发交替正确率;B:三组大鼠总进臂次数;与Sham组比较,aP<0.05;与Control组比较,bP<0.05 图 3 Y迷宫实验结果 Fig 3 Results of the Y-maze test |
|
|
CA后第4天的Y迷宫实验结果显示(图 3),与Sham组相比,Control组大鼠在Y迷宫中自发交替正确率明显降低,差异具有统计学意义[(67.72±20.82) vs. (13.29±15.07), P<0.05];与Control组相比,Exosome组大鼠在Y迷宫中自发交替正确率明显升高,差异具有统计学意义[(13.29±15.07) vs. (42.63±10.25), P<0.05]。各组大鼠总进臂次数差异无统计学意义(P>0.05)。
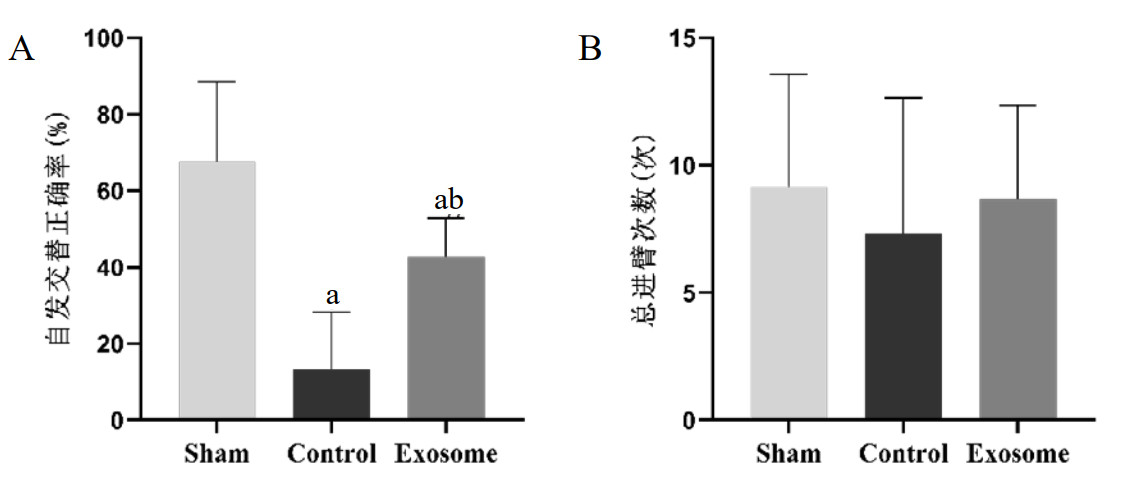
2.5 Morris水迷宫结果CA后第7~11天的水迷宫实验结果显示(图 4),与Sham组相比,Control组大鼠的逃避潜伏期显著延长[(6.79±3.24) vs. (25.83±8.54),P<0.05];与Control组相比,Exosome组大鼠的逃避潜伏期显著缩短[(25.83±8.54) vs. (13.49±4.55),P<0.05]。在CA后第11天的空间探索表现中,与Sham组相比,Control组大鼠的穿越原平台位置次数减少[(3.83±1.47) vs. (0.33±0.52),P<0.05]、第一次到达平台位置时间延长[(4.6±2.26) vs. (55.48±7.59),P<0.05]、目标象限探索时间减少[(47.86±10.44) vs. (25.17±6.82),P<0.05],均具有统计学差异;与Control组相比,Exosome组大鼠穿越原平台位置次数增多[(0.33±0.52) vs. (2.00±0.89),P<0.05];、第一次到达平台位置时间缩短[(55.48±7.59) vs. (15.9±7.54),P<0.05],差异均具有统计学差异。
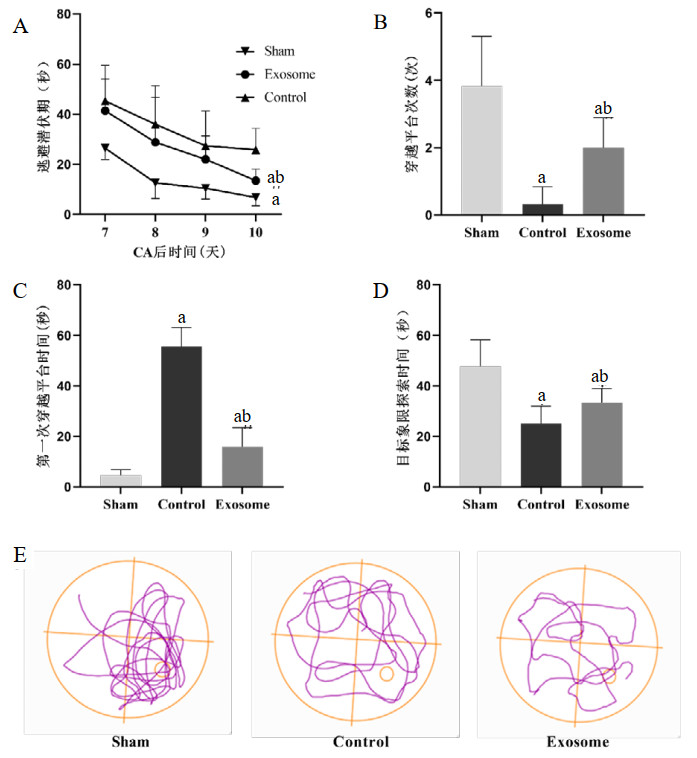
|
| A:CA后第7~10天三组大鼠平均逃避潜伏期;B:CA后第11天三组大鼠穿越平台次数;C:CA后第11天三组大鼠第一次穿越平台所用时间;D:CA后第11天三组大鼠目标象限探索时间;E:CA后第11天三组大鼠水迷宫空间探索轨迹图;与Sham组比较,aP<0.05;与Control组比较,bP<0.05 图 4 水迷宫实验结果 Fig 4 Results of the water maze test |
|
|
CA后24 h的Elisa结果显示,与Sham组相比,Control组大鼠血浆中HA、Sdc-1含量显著升高,差异具有统计学意义[HA:(4.01±4.66) vs. (26.34±9.83),P<0.05;Sdc-1:(0.01±0.02) vs. (0.05±0.03),P<0.05];与Control组相比,Exosome组大鼠HA、Sdc-1含量显著降低,差异具有统计学意义[HA:(26.34±9.83) vs. (14.84±6.26),P<0.05;Sdc-1:(0.05±0.03) vs. (0.02±0.02),P<0.05]。
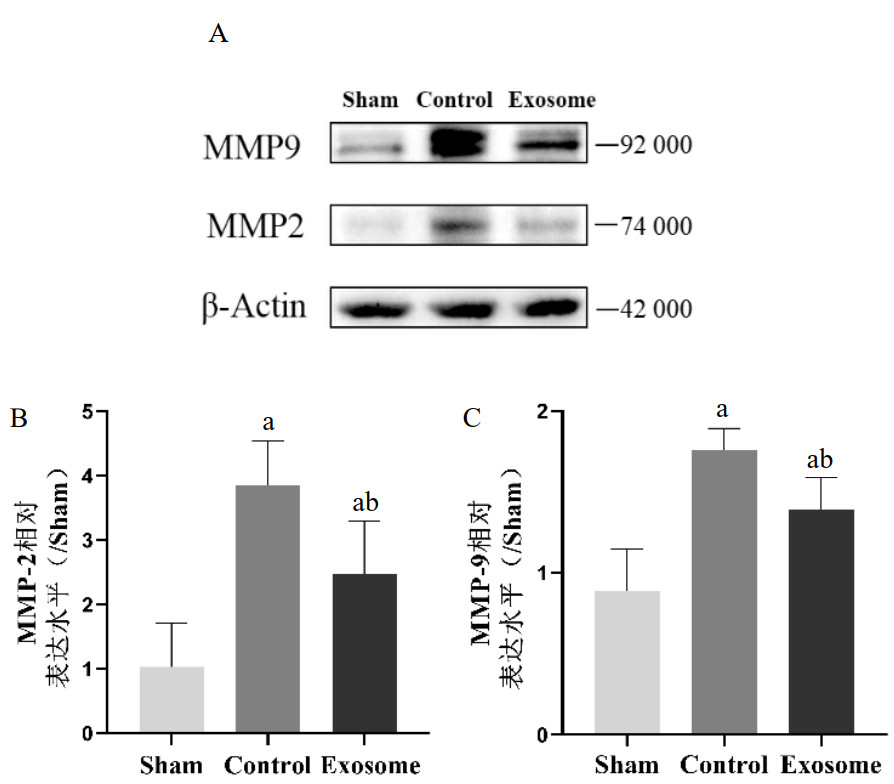
2.7 大鼠海马CA1区中MMP-2/9表达情况CA后24 h,大鼠海马CA1区免疫印迹结果显示(图 5),与Sham组相比,Control组大鼠脑组织中MMP-2/9的表达显著升高,差异具有统计学意义(P<0.05);而与Control组相比,Exosome组大鼠脑组织中MMP-2/9的含量显著降低,差异具有统计学意义(P<0.05)。
|
| A:CA后第24 h三组大鼠MMP-2/9蛋白含量;B:海马CA1区MMP-2相对表达水平(/Sham);C:海马CA1区MMP-9相对表达水平(/Sham);与Sham组比较,aP<0.05;与Control组比较,bP<0.05 图 5 各组大鼠海马CA1区MMP-2/9表达情况 Fig 5 Expression of MMP-2/9 in the hippocampal CA1 subfield of rats in each group |
|
|
本研究探讨了RIC来源的外泌体对于窒息性心脏骤停大鼠神经功能预后的影响。实验结果表明,通过四肢间断缺血实现远端缺血适应后,大鼠血浆中外泌体含量明显增多,这些外泌体可以有效促进CA大鼠的神经功能恢复。目前已有大量相关研究证实RIC对于心、脑等多个重要脏器功能的保护作用[6-7, 21]。但在临床实际中,由于心脏骤停事件的不可预知性,RIC难以直接应用于临床。我们推测外泌体可能是RIC发挥远端保护作用的重要机制之一,因此本研究从RIC处理后的大鼠血液中提取出外泌体,相对于直接施行RIC方案更加快速和直接,为RIC的临床应用提供了新的证据和思路。
既往已有研究证明多种不同来源的外泌体能够在缺血性脑卒中、创伤性脑损伤等不同疾病以及体外模型中起到对抗神经元损伤的作用[22-24]。在经历RIC后,由于远端组织中的脂肪细胞和内皮细胞遭受了短暂的缺血、缺氧刺激,细胞内迅速启动了多种转录过程,并且以外泌体的形式分泌到循环中,从而增强远端脏器对缺血/再灌注损伤的抵抗力[25-26]。本研究从RIC大鼠血浆中提取出外泌体注射到CA后大鼠体内,并通过行为学实验观察到此类外泌体对CA后大鼠神经功能的保护作用,我们认为这和既往的研究结果是一致的,证实RIC来源的外泌体是RIC过程中能够起到缓解ROSC后神经功能障碍作用的有效成分。
旷场实验、Y迷宫及水迷宫均是目前应用较多的行为学实验,主要反映动物焦虑水平以及空间学习记忆能力。实验中观察到,注射RIC来源外泌体的CA后大鼠与对照组相比在旷场实验、Y迷宫以及水迷宫中均表现出较好的神经功能结果。但是在大鼠ROSC后24 h的NDS评分中,发现对照组和实验组大鼠并没有表现出明显的统计学差异。这在Wolf等[18]在幼年大鼠窒息性心脏骤停的报道中也提示类似的现象,分析可能的原因是大鼠ROSC后24 h的神经功能障碍较重,且由于模型制备的需要,大鼠左下肢运动功能受到一定程度的影响,导致NDS评分区分度下降。
糖萼是广泛分布于内皮细胞表面的一层凝胶网状结构,是内皮屏障的重要组成部分,多项研究证实糖萼损伤可以导致不同程度的组织水肿,而在心脏骤停中,保护糖萼能够减少心脏骤停后的脑损伤[27-29]。实验中观察到注射RIC来源的外泌体可以降低大鼠心脏骤停后体内糖萼层的降解。笔者推测糖萼损伤减少可能与外泌体实现神经功能保护有一定关联。MMP是脑缺血和炎症研究中广泛存在的血脑屏障破坏性介质,其具有修饰内皮糖萼的能力,从而促进其成分的脱落[30-31],而抑制MMP活性可以在一定程度上减轻脑部缺血损伤后的炎症和血脑屏障渗漏[32-33]。既往有研究显示,外泌体可通过其中包含的miRNA及蛋白等成分抑制细胞或组织内MMP的表达[34-35]。本实验通过免疫印迹法检测了脑组织中MMP含量的变化,结果显示,注射RIC来源的外泌体可以一定程度上抑制MMP-2/9在大鼠脑海马CA1区的表达。这进一步提示了外泌体的神经保护机制可能与抑制脑组织中金属蛋白酶的合成有关。
本实验尚存在以下局限性。首先,为了保证大鼠ROSC后能够活到实验终点,采用了7 min窒息时间,这可能会导致整体损伤偏轻,难以全面反映ROSC后神经功能障碍的真实情况。第二,本实验没有对RIC源性外泌体包含的内容物进行分析,其中可能存在更下游的有效成分未被探讨。第三,对于对照组大鼠采用静脉泵入PBS溶剂作为对照,没有提取正常大鼠外泌体用于对照,这可能导致实验结果与RIC来源外泌体真实治疗效果有一定程度的偏差。第四,本实验没有对脑血管内皮糖萼进行组织学分析,仅研究了血浆中糖萼降解物的水平,不能可靠的反映脑血管中糖萼的损伤情况,且仅通过行为学实验反映神经功能损伤情况,没有开展脑组织影像学检查或者形态学实验加以佐证。这些都需要在进一步的实验中继续探讨。
利益冲突 所有作者声明无利益冲突
作者贡献声明 翟恒:实验操作、论文撰写;王吉慧,陈习,张扬:采集及分析数据;胡书群,王军,彭易根:实验指导;赵宁军,燕宪亮:论文审阅;苏成磊、许铁:实验设计和指导、论文修改、获取研究经费
| [1] | 中国心脏骤停与心肺复苏报告编写组, 徐峰, 陈玉国. 中国心脏骤停与心肺复苏报告(2022年版)概要[J]. 中国循环杂志, 2023, 38(10): 1005-1017. DOI:10.3969/j.issn.1000-3614.2023.10.002 |
| [2] | Panchal AR, Bartos JA, Cabañas JG, et al. Part 3: adult basic and advanced life support: 2020 American heart association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care[J]. Circulation, 2020, 142(16_suppl_2): S366-S468. DOI:10.1161/CIR.0000000000000916 |
| [3] | Sekhon MS, Ainslie PN, Griesdale DE. Clinical pathophysiology of hypoxic ischemic brain injury after cardiac arrest: a "two-hit" model[J]. Crit Care, 2017, 21(1): 90. DOI:10.1186/s13054-017-1670-9 |
| [4] | Yan SJ, Chen M, Wen J, et al. Global research trends in cardiac arrest research: a visual analysis of the literature based on CiteSpace[J]. World J Emerg Med, 2022, 13(4): 290-296. DOI:10.5847/wjem.j.1920-8642.2022.071 |
| [5] | Przyklenk K, Whittaker P. The future of remote ischemic conditioning[J]. J Cardiovasc Pharmacol Ther, 2017, 22(4): 295-296. DOI:10.1177/1074248417710151 |
| [6] | Jiao YM, Wang JL, Jia YJ, et al. Remote ischemic preconditioning protects against cerebral ischemia injury in rats by upregulating miR-204-5p and activating the PINK1/Parkin signaling pathway[J]. Metab Brain Dis, 2022, 37(4): 945-959. DOI:10.1007/s11011-022-00910-z |
| [7] | Sawashita Y, Hirata N, Yoshikawa Y, et al. Remote ischemic preconditioning reduces myocardial ischemia-reperfusion injury through unacylated ghrelin-induced activation of the JAK/STAT pathway[J]. Basic Res Cardiol, 2020, 115(4): 50. DOI:10.1007/s00395-020-0809-z |
| [8] | Zhao ZZ, Shi QB, Guo Q, et al. Remote ischemic preconditioning can extend the tolerance to extended drug-coated balloon inflation time by reducing myocardial damage during percutaneous coronary intervention[J]. Int J Cardiol, 2022, 353: 3-8. DOI:10.1016/j.ijcard.2022.01.049 |
| [9] | Jiang YB, He RY, Shi YJ, et al. Plasma exosomes protect against cerebral ischemia/reperfusion injury via exosomal HSP70 mediated suppression of ROS[J]. Life Sci, 2020, 256: 117987. DOI:10.1016/j.lfs.2020.117987 |
| [10] | Li H, Luo Y, Liu P, et al. Exosomes containing miR-451a is involved in the protective effect of cerebral ischemic preconditioning against cerebral ischemia and reperfusion injury[J]. CNS Neurosci Ther, 2021, 27(5): 564-576. DOI:10.1111/cns.13612 |
| [11] | Stoddart P, Satchell SC, Ramnath R. Cerebral microvascular endothelial glycocalyx damage, its implications on the blood-brain barrier and a possible contributor to cognitive impairment[J]. Brain Res, 2022, 1780: 147804. DOI:10.1016/j.brainres.2022.147804 |
| [12] | Xiao Y, Su CL, Zhang GZ, et al. Vitamin C improves the outcomes of cardiopulmonary resuscitation and alters shedding of syndecan-1 and p38/MAPK phosphorylation in a rat model[J]. J Am Heart Assoc, 2022, 11(7): e023787. DOI:10.1161/JAHA.121.023787 |
| [13] | Xu JF, Sun SJ, Lu XY, et al. Remote ischemic pre- and postconditioning improve postresuscitation myocardial and cerebral function in a rat model of cardiac arrest and resuscitation[J]. Crit Care Med, 2015, 43(1): e12-e18. DOI:10.1097/CCM.0000000000000684 |
| [14] | 马礼秀, 肖策, 章智哲, 等. 诱导性多能干细胞来源的外泌体抑制小胶质细胞炎症反应[J]. 中华急诊医学杂志, 2023, 32(1): 52-58. DOI:10.3760/cma.j.issn.1671-0282.2023.01.009 |
| [15] | Gupta D, Zickler AM, El Andaloussi S. Dosing extracellular vesicles[J]. Adv Drug Deliv Rev, 2021, 178: 113961. DOI:10.1016/j.addr.2021.113961 |
| [16] | Yang J, Gao X, Xing XT, et al. An isolation system to collect high quality and purity extracellular vesicles from serum[J]. Int J Nanomedicine, 2021, 16: 6681-6692. DOI:10.2147/IJN.S328325 |
| [17] | Zhang R, Bryson TD, Fogo GM, et al. Rapid treatment with intramuscular magnesium sulfate during cardiopulmonary resuscitation does not provide neuroprotection following cardiac arrest[J]. Mol Neurobiol, 2022, 59(3): 1872-1881. DOI:10.1007/s12035-021-02645-x |
| [18] | Wolf MS, Manole MD, New LA, et al. Ascorbate deficiency confers resistance to hippocampal neurodegeneration after asphyxial cardiac arrest in juvenile rats[J]. Pediatr Res, 2022, 91(4): 820-827. DOI:10.1038/s41390-021-01515-5 |
| [19] | Frick T, Springe D, Grandgirard D, et al. An improved simple rat model for global cerebral ischaemia by induced cardiac arrest[J]. Neurol Res, 2016, 38(4): 373-380. DOI:10.1179/1743132815Y.0000000090 |
| [20] | 周娇娇, 阙建宇, 于雯雯, 等. Morris水迷宫检测动物学习记忆水平的方法学[J]. 中国老年学杂志, 2017, 37(24): 6274-6277. DOI:10.3969/j.issn.1005-9202.2017.24.116 |
| [21] | Randhawa PK, Bali A, Jaggi AS. RIPC for multiorgan salvage in clinical settings: evolution of concept, evidences and mechanisms[J]. Eur J Pharmacol, 2015, 746: 317-332. DOI:10.1016/j.ejphar.2014.08.016 |
| [22] | Zhang ZG, Buller B, Chopp M. Exosomes—beyond stem cells for restorative therapy in stroke and neurological injury[J]. Nat Rev Neurol, 2019, 15: 193-203. DOI:10.1038/s41582-018-0126-4 |
| [23] | Li Y, Ren CH, Li HY, et al. Role of exosomes induced by remote ischemic preconditioning in neuroprotection against cerebral ischemia[J]. Neuroreport, 2019, 30(12): 834-841. DOI:10.1097/WNR.0000000000001280 |
| [24] | Guo XF, Gu SS, Wang J, et al. Protective effect of mesenchymal stem cell-derived exosomal treatment of hippocampal neurons against oxygen-glucose deprivation/reperfusion-induced injury[J]. World J Emerg Med, 2022, 13(1): 46-53. DOI:10.5847/wjem.j.1920-8642.2022.015 |
| [25] | Alfì E, Thairi C, Femminò S, et al. Extracellular vesicles (EVs) in ischemic conditioning and angiogenesis: focus on endothelial derived EVs[J]. Vascul Pharmacol, 2021, 140: 106873. DOI:10.1016/j.vph.2021.106873 |
| [26] | Han YD, Bai Y, Yan XL, et al. Co-transplantation of exosomes derived from hypoxia-preconditioned adipose mesenchymal stem cells promotes neovascularization and graft survival in fat grafting[J]. Biochem Biophys Res Commun, 2018, 497(1): 305-312. DOI:10.1016/j.bbrc.2018.02.076 |
| [27] | Zhu JJ, Li X, Yin J, et al. Glycocalyx degradation leads to blood-brain barrier dysfunction and brain edema after asphyxia cardiac arrest in rats[J]. J Cereb Blood Flow Metab, 2018, 38(11): 1979-1992. DOI:10.1177/0271678X17726062 |
| [28] | Kutuzov N, Flyvbjerg H, Lauritzen M. Contributions of the glycocalyx, endothelium, and extravascular compartment to the blood-brain barrier[J]. Proc Natl Acad Sci USA, 2018, 115(40): E9429-E9438. DOI:10.1073/pnas.1802155115 |
| [29] | 吴丁烨, 高飞, 梁锋鸣, 等. 探讨内皮糖萼降解产物对急性呼吸窘迫综合征患者肺水肿的评估价值[J]. 中华急诊医学杂志, 2023, 32(1): 95-100. DOI:10.3760/cma.j.issn.1671-0282.2023.01.016 |
| [30] | Gronski TJ Jr, Martin RL, Kobayashi DK, et al. Hydrolysis of a broad spectrum of extracellular matrix proteins by human macrophage elastase[J]. J Biol Chem, 1997, 272(18): 12189-12194. DOI:10.1074/jbc.272.18.12189 |
| [31] | 董佳慧, 李慧敏, 李南熹, 等. 糖萼与疾病的相关性及其降解机制研究进展[J]. 解放军医学杂志, 2023, 48(3): 345-354. DOI:10.11855/j.issn.0577-7402.2023.03.0345 |
| [32] | Arkelius K, Wendt TS, Andersson H, et al. LOX-1 and MMP-9 inhibition attenuates the detrimental effects of delayed rt-PA therapy and improves outcomes after acute ischemic stroke[J]. Circ Res, 2024, 134(8): 954-969. DOI:10.1161/CIRCRESAHA.123.323371 |
| [33] | Shi TR, Yue SQ, Xie C, et al. MMP-2-mediated Scube2 degradation promotes blood-brain barrier disruption by blocking the interaction between astrocytes and endothelial cells via inhibiting Sonic hedgehog pathway during early cerebral ischemia[J]. J Neurochem, 2023. DOI:10.1111/jnc.16021 |
| [34] | Cai H, Huang LY, Hong R, et al. Momordica charantia exosome-like nanoparticles exert neuroprotective effects against ischemic brain injury via inhibiting matrix metalloproteinase 9 and activating the AKT/GSK3β signaling pathway[J]. Front Pharmacol, 2022, 13: 908830. DOI:10.3389/fphar.2022.908830 |
| [35] | Jiang K, Chen HY, Fang YM, et al. Exosomal ANGPTL1 attenuates colorectal cancer liver metastasis by regulating Kupffer cell secretion pattern and impeding MMP9 induced vascular leakiness[J]. J Exp Clin Cancer Res, 2021, 40(1): 21. DOI:10.1186/s13046-020-01816-3 |
 2024, Vol. 33
2024, Vol. 33