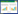Sepsis3.0将脓毒症定义为宿主对感染的反应失调,导致免疫抑制和多脏器功能衰竭,危及患者生命[1]。脓毒症患者存在CD8+T细胞功能衰竭,造成机体不能有效清除病原体,促进脓毒症疾病进展[2]。如何恢复CD8+T细胞功能是脓毒症治疗研究的热点之一。Toll样受体(Toll-like receptor, TLR)是固有免疫应答中的重要成员,是机体抗感染免疫应答的第一道防线,在利什曼原虫感染和乳腺癌中,TLR介导的信号通路还可调控CD8+T细胞功能活性[3-4]。TLR也参与诱导相关细胞因子风暴[5],参与脓毒症相关炎症、组织损伤和死亡预后[6]。但有关脓毒症患者中TLR表达谱及其对CD8+T细胞的调控作用罕见报道。因此,本研究首先分析了脓毒症患者外周血中TLR表达谱,根据TLRs表达变化,观察活化TLR7对CD8+T细胞杀伤功能的变化,初步阐释TLR7介导的信号通路对脓毒症患者CD8+T细胞功能的影响。
1 资料与方法 1.1 研究对象本研究为横断面研究,选择2020年6月至2021年6月新乡医学院第一附属医院收治的脓毒症患者。纳入标准:(1)年龄≥18岁且<65岁;(2)诊断标准符合Sepsis3.0国际脓毒症专家共识诊断标准[可疑感染且序贯器官衰竭评分(sequential organ failure assessment, SOFA)增加2分[1]]。排除标准:(1)合并慢性肝炎病毒或人类免疫缺陷病毒感染;(2)合并自身免疫性疾病需长期使用免疫抑制剂;(3)合并恶性肿瘤;(4)妊娠期或哺乳期妇女。选择同时期在本院进行查体的健康志愿者作为对照者。研究方案通过新乡医学院第一附属医院医学伦理委员会审批,批准号:EC-023-467,所有患者或家属签署知情同意书。
1.2 主要试剂和仪器人淋巴细胞分离液购自美国Sigma公司;Trizol试剂、TLR7激动剂CL097购自Invitrogen公司;PrimeScript逆转录试剂盒、TB Green实时定量PCR试剂盒购自Takara公司;小鼠抗人CD3-PerCP(克隆:SP34-2)、小鼠抗人CD8-FITC(克隆:HIT8α)、小鼠抗人TLR7-PE(克隆:A94B10)、大鼠抗人TLR9-APC(克隆:eB72-1665)购自美国BD Pharmingen公司;人CD8+T细胞分选试剂盒购自德国美天旎公司;穿孔素、颗粒酶B、颗粒溶素、干扰素-γ(interferon-γ, IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)试剂盒购自武汉华美生物公司;乳酸脱氢酶(lactate dehydrogenase, LDH)细胞毒性检测试剂盒购自武汉碧云天生物公司。Transwell培养平板购自美国康宁公司。ABI7500实时定量PCR仪为美国Applied Biosystems公司产品;FACS Calibur流式细胞仪为美国BD公司产品;磁力分离架为德国美天旎公司产品;微孔读板仪为美国伯乐公司产品。
1.3 Ficoll密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)脓毒症患者入院后1 h内、对照者清晨空腹采集外周血20 mL,使用乙二胺四乙酸二钠抗凝,Hank’s液等倍稀释,加入人淋巴细胞分离液,采用密度梯度离心法离心,吸取中间层悬浮白色云雾状细胞层即为PBMCs,洗涤2次后,以107个/mL冻存于液氮中备用。
1.4 逆转录实时定量PCR法检测TLR1~10和免疫检查点受体mRNA表达使用Trizol试剂提取PBMCs总RNA,取1 μg总RNA,使用PrimeScript逆转录试剂盒将总RNA逆转录为cDNA,反应系统:5×缓冲液2 μL、逆转录酶混合物Ⅰ 0.5 μL、随机六核苷酸引物0.5 μL、寡聚胸腺嘧啶引物0.5 μL、总RNA 1 μg、不含RNA酶的去离子水调整总体积至10 μL,反应条件:37℃ 15 min,85℃ 5s。使用TB Green实时定量PCR试剂盒进行PCR反应,反应系统:TB Green预混Taq酶缓冲液10 μL、ROX参考染料0.4 μL、上游引物(10 μmol/L)0.4 μL、下游引物(10 μmol/L)0.4 μL、cDNA 2 μL、灭菌去离子水6.8 μL,反应条件:预变性95℃ 30 s 1个循环,PCR反应95℃ 5 s、60℃ 30 s 40个循环。采用2-ΔΔCT法以β-肌动蛋白为内参照分析TLR 1~10 mRNA表达。引物序列参考既往文献[7-8],由上海生工生物技术公司合成。
1.5 流式细胞术检测CD8+T细胞中的TLR7和TLR9表达取105个PBMCs转入流式检测管中,洗涤2次后加入小鼠抗人CD3-PerCP、小鼠抗人CD8-FITC各5 μL进行表面染色,室温避光孵育30 min,破膜固定后加入小鼠抗人TLR7-PE、大鼠抗人TLR9-APC各5 μL进行细胞内染色。使用FACS Calibur流式细胞术获取细胞,使用FlowJo V10软件分析。
1.6 CD8+T细胞的分选、刺激及与靶细胞共培养使用人CD8+T细胞分选试剂盒纯化PBMCs中的CD8+T细胞。取107个PBMCs,离心后使用80 μL分选缓冲液重悬,加入20 μL生物素标记的抗体鸡尾酒(内含:抗CD4、抗CD14、抗CD15、抗CD16、抗CD19、抗CD36、抗CD56、抗CD123、抗T细胞受体γ/δ、抗CD235a),4℃避光孵育5 min,加入40 μL CD8+T细胞免疫磁珠,4℃避光孵育10 min。使用500 μL分选缓冲液充分浸润分离柱,置于磁力分离架上,将上述细胞悬液加入分离柱中,收集穿过分离柱的细胞即为纯化的CD8+T细胞[9]。取105个纯化的CD8+T细胞,加入TLR7激动剂CL097(终浓度:5 μg/mL)刺激培养12 h,收集细胞。选择HLA-A*02限制性脓毒症患者和对照者的CD8+T细胞,105个CD8+T细胞与5×105个HLA-A*02限制性人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVEC)[10]共培养,(1)直接接触共培养:CD8+T细胞与HUVEC直接混合,加入抗CD3/CD28抗体(终浓度:1 ng/mL)维持CD8+T细胞活性。(2)间接接触共培养:CD8+T细胞加入Transwell上层小室,加入抗CD3/CD28抗体(终浓度:1 ng/mL)维持活性,HUVEC加入下层培养板中,两层细胞被0.4 μm孔径的半透膜分隔,仅可溶性分子可通过[9]。培养48 h后收集上清液进行后续检测。
1.7 ELISA法检测培养上清液中穿孔素、颗粒酶B、颗粒溶素、IFN-γ、TNF-α水平使用商品化ELISA试剂盒按说明书要求检测培养上清液中的穿孔素、颗粒酶B、颗粒溶素、IFN-γ、TNF-α水平
1.8 靶细胞死亡比例检测使用LDH细胞毒性检测试剂盒检测培养上清液中LDH,以HUVEC培养上清液中LDH水平为“低水平对照”,以Triton X-100处理的HUVEC培养上清液中LDH水平为“高水平对照”,靶细胞死亡比例=(样本LDH-低水平对照)/(高水平对照-低水平对照)×100%[9]。
1.9 统计学方法采用SPSS 23.0软件分析数据。计量资料进行正态性检测,对于正态分布的计量资料采用均数±标准差(x±s)表示,组间比较采用t检验或配对t检验,两个连续变量的相关性分析采用Pearson相关分析。对于偏态分布的计量资料采用中位数(四分位数)[M(Q1, Q3)]表示,组间比较采用Mann-Whitney U检验或Wilcoxon秩和检验,两个连续变量的相关性分析采用Spearman相关分析。采用受试者工作特征(receiver operating characteristic, ROC)分析TLR7和TLR9预测患者28 d生存结局。以P<0.05为差异有统计学意义。
2 结果 2.1 脓毒症患者和对照者的一般资料共纳入58例脓毒症患者,男37例,女21例,年龄19~64(49.7±12.6)岁。感染部位包括呼吸系统(40例)、消化系统(11例)、泌尿系统(5例)和皮肤软组织(2例)。各SOFA评分分段为:2~6分12例,7~12分36例,13~18分9例,≥19分1例。对照者24例,男15例,女9例,年龄26~59(46.9±8.2)岁。
2.2 脓毒症患者PBMCs中TLR mRNA表达谱变化及其对预后的诊断PBMCs中TLR1、TLR2、TLR3、TLR4、TLR5、TLR6、TLR8、TLR10 mRNA相对表达量在脓毒症患者和对照者之间的差异无统计学意义(P>0.05,表 1),脓毒症患者PBMCs中TLR7 mRNA和TLR9 mRNA相对表达量显著低于对照者(P<0.05,表 1)。TLR1~10 mRNA相对表达量与入院时患者SOFA评分均无显著相关性(r值分别为0.142、0.209、-0.043、-0.122、-0.090、0.007、-0.165、0.243、0.147、-0.020,均P>0.05)。
| 指标 | 脓毒症(n=58) | 对照者(n=24) | t/U值 | P值 |
| TLR1 mRNA a | 1.02±0.36 | 1.01±0.27 | 0.122 | 0.903 |
| TLR2 mRNA a | 0.98±0.34 | 1.11±0.29 | 1.641 | 0.105 |
| TLR3 mRNA a | 0.96±0.18 | 1.05±0.31 | 1.647 | 0.104 |
| TLR4 mRNA a | 1.02±0.33 | 1.07±0.14 | 0.714 | 0.477 |
| TLR5 mRNA a | 0.99±0.19 | 1.06±0.23 | 1.426 | 0.158 |
| TLR6 mRNA a | 1.01±0.38 | 1.09±0.22 | 0.964 | 0.338 |
| TLR7 mRNAb | 1.01 (0.88, 1.15) | 1.61 (1.04, 2.63) | 5.705 | <0.001 |
| TLR8 mRNA a | 1.02±0.25 | 1.03±0.37 | 0.142 | 0.887 |
| TLR9 mRNA b | 0.94 (0.81, 1.15) | 1.14 (0.82, 2.12) | 3.715 | 0.046 |
| TLR10 mRNA a | 1.03±0.22 | 0.97±0.18 | 1.181 | 0.241 |
| 注:TLR为Toll样受体;a为x±s,b为M(Q1, Q3) | ||||
根据患者入院后28 d生存结局,将58例脓毒症患者分为存活组(n=42)和死亡组(n=16),将存活组和死亡组患者TLR7和TLR9 mRNA相对表达量进行ROC曲线分析,ROC曲线如图 1所示。TLR7 mRNA曲线下面积(area under curve, AUC)为0.70(95%CI: 0.56~0.85,P=0.018),提示TLR7 mRNA相对表达量的生存结局预测效能较好。TLR9 mRNA AUC=0.54(95%CI: 0.34~0.72,P=0.596),提示TLR9 mRNA相对表达量的生存结局预测效能较差。
|
| 图 1 TLR7 mRNA和TLR9 mRNA预测脓毒症预后的ROC曲线 Fig 1 The TLR7 mRNA and TLR9 mRNA ROC curve of prognosis of sepsis |
|
|
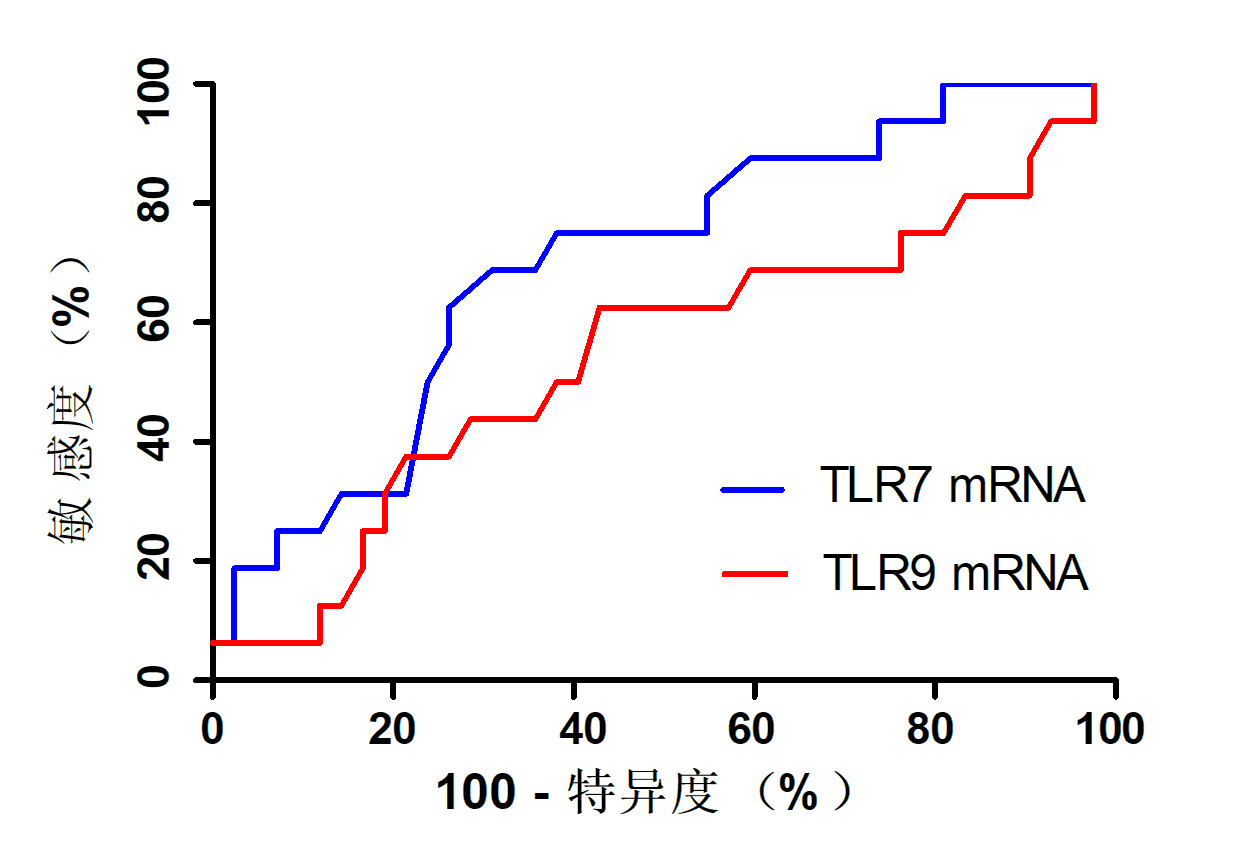
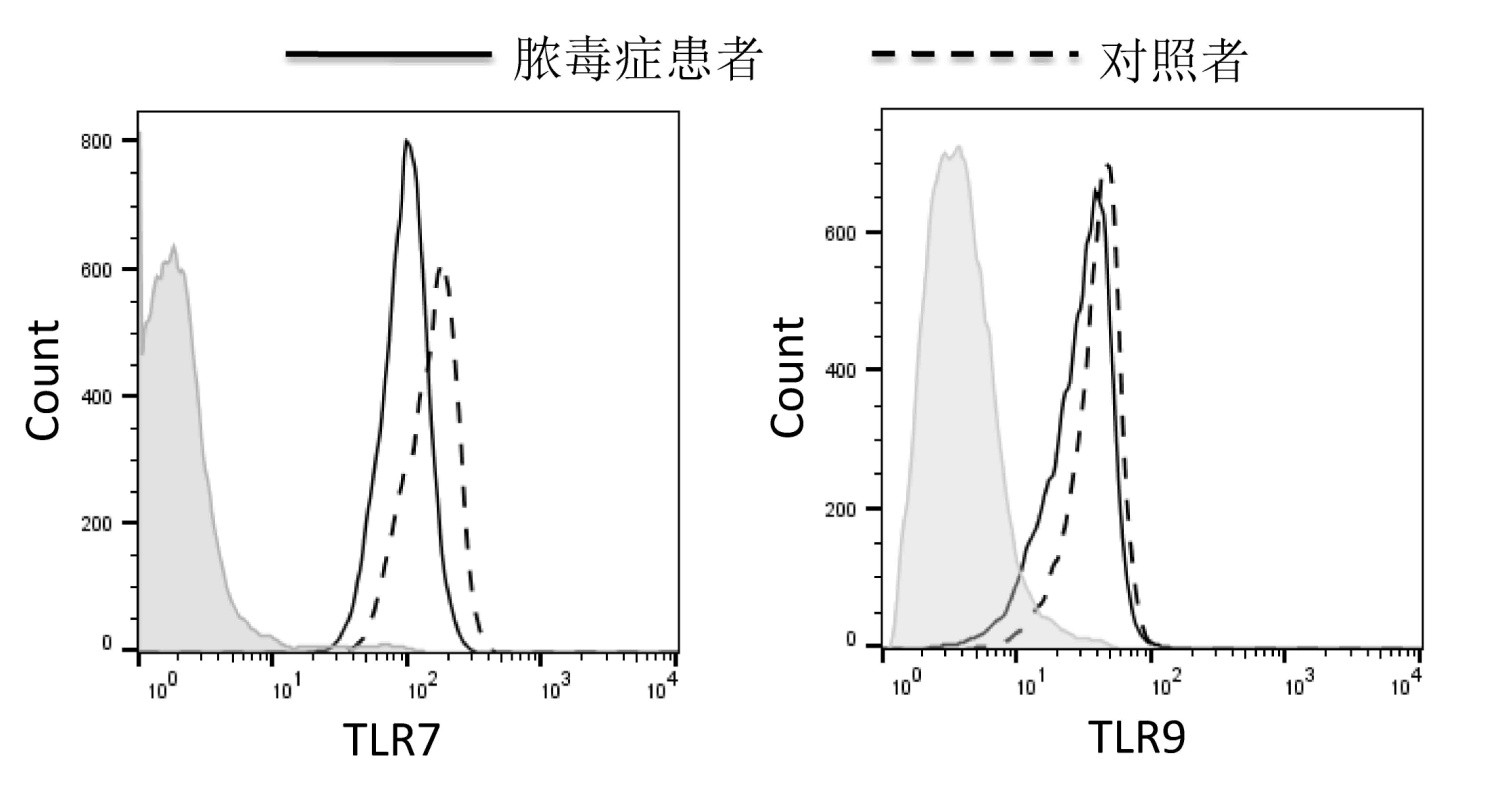
脓毒症患者和对照者CD3+CD8+T细胞中TLR7和TLR9表达的典型流式分析图见图 2。脓毒症患者CD8+T细胞中TLR7平均荧光强度(meanfluorescence intensity, MFI)低于对照者(P<0.001),但CD8+T细胞中TLR9 MFI在脓毒症患者和对照者之间的差异无统计学意义(P=0.548),见表 2。TLR7和TLR9 MFI与入院时患者SOFA评分均无相关性(TLR7: r=0.042,P=0.756;TLR9: r=-0.014,P=0.920)。ROC曲线分析发现,TLR7 MFI的AUC=0.73(95%CI: 0.59~0.88,P=0.007),提示TLR7 MFI的生存结局预测效能较好;TLR9 MFI的AUC=0.62(95%CI: 0.45~0.79,P=0.149),提示TLR9 MFI的生存结局预测效能较差,见图 3。
|
| 图 2 脓毒症患者和对照者CD3+CD8+T细胞中TLR7和TLR9表达的典型流式分析图 Fig 2 The representative flow cytometry analysis of TLR7 and TLR9 expression within CD3+CD8+ T cells in septic patients and controls |
|
|
| 指标 | 脓毒症(n=58) | 对照者(n=24) | t值 | P值 |
| TLR7 MFI | 130.0±45.07 | 250.90±79.09 | 8.745 | <0.001 |
| TLR9 MFI | 23.83±7.44 | 24.95±7.97 | 0.603 | 0.548 |
| 注:TLR为Toll样受体,MFI为平均荧光强度 | ||||
|
| 图 3 TLR7 MFI和TLR9 MFI预测脓毒症预后的ROC曲线 Fig 3 ROC curve of TLR7 MFI and TLR9 MFI for predicting the prognosis of sepsis |
|
|
分选12例脓毒症患者和8例对照者CD8+T细胞,逆转录实时定量PCR法检测CD8+T细胞中免疫检查点受体细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4, CTLA-4)、程序性死亡受体-1(programmed death-1, PD-1)、T细胞免疫球蛋白及黏蛋白结构域的分子-3(T-cell immunoglobulin and mucin domain-3, TIM-3)Mrna。结果发现,脓毒症患者CD8+T细胞中CTLA-4、PD-1、TIM-3 mRNA相对表达量均高于对照者(均P<0.05,表 3)。
| 指标 | 脓毒症(n=12) | 对照者(n=8) | U值 | P值 |
| CTLA-4 mRNA | 5.03 (3.76, 9.66) | 0.99 (0.54, 1.25) | 2.195 | <0.001 |
| PD-1 mRNA | 3.27 (1.84, 16.60) | 0.58 (0.44, 1.63) | 1.584 | 0.002 |
| TIM-3 mRNA | 2.57 (2.21, 3.87) | 0.88 (0.26, 1.76) | 4.412 | 0.001 |
| 注:CTLA-4为细胞毒性T淋巴细胞相关蛋白4,PD-1为程序性死亡受体-1,TIM-3为T细胞免疫球蛋白及黏蛋白结构域的分子-3 | ||||
分选HLA-A*0201限制性脓毒症患者(n=14)和对照者(n=6),与HUVEC建立直接接触和间接接触共培养体系,在直接接触培养中,脓毒症患者CD8+T细胞诱导靶细胞死亡比例低于对照者(P=0.030),培养上清液中穿孔素、颗粒酶B、颗粒溶素、IFN-γ、TNF-α水平均低于对照者(均P<0.05)。在间接接触培养中,虽然脓毒症患者CD8+T细胞培养上清液中穿孔素、颗粒溶素、IFN-γ、TNF-α水平均低于对照者(均P<0.05),但CD8+T细胞诱导靶细胞死亡的比例在脓毒症患者和对照者之间的差异无统计学意义(均P=0.084)。见表 4。
| 指标 | 直接接触共培养 | 间接接触共培养 | |||||||
| 脓毒症(n=14) | 对照者(n=6) | t值 | P值 | 脓毒症(n=14) | 对照者(n=6) | t值 | P值 | ||
| 靶细胞死亡(%) | 9.28±2.03 | 13.05±4.22 | 2.352 | 0.030 | 3.44±1.27 | 4.73±1.82 | 1.831 | 0.084 | |
| 穿孔素(pg/mL) | 127.4±28.90 | 168.2±43.92 | 2.478 | 0.023 | 22.08±7.94 | 33.72±9.38 | 2.852 | 0.011 | |
| 颗粒酶B(pg/mL) | 414.4±107.3 | 539.1±134.6 | 2.212 | 0.040 | 38.99±12.45 | 49.70±14.21 | 1.693 | 0.108 | |
| 颗粒溶素(pg/mL) | 77.41±13.93 | 99.60±21.59 | 2.770 | 0.013 | 10.73±3.92 | 15.22±4.49 | 2.252 | 0.037 | |
| IFN-γ(pg/mL) | 56.82±15.39 | 80.30±27.71 | 2.454 | 0.025 | 49.22±18.67 | 76.05±19.37 | 2.914 | 0.009 | |
| TNF-α(ng/mL) | 1.87±0.52 | 2.63±0.79 | 2.565 | 0.019 | 1.36±0.45 | 2.08±0.61 | 2.953 | 0.008 | |
| 注:IFN-γ为干扰素-γ,TNF-α为肿瘤坏死因子-α | |||||||||
脓毒症患者CD8+T细胞中CTLA-4、PD-1、TIM-3 mRNA在无CL097刺激和经CL097刺激之间的差异无统计学意义(P>0.05),见表 5。在直接接触培养中,HLA-A*0201限制性脓毒症患者CD8+T细胞经CL097刺激后,其诱导靶细胞死亡的比例高于无CL097刺激(P=0.008),培养上清液中穿孔素、颗粒酶B、颗粒溶素、IFN-γ、TNF-α水平均高于无CL097刺激(均P<0.05)。在间接接触培养系统中,虽然HLA-A*0201限制性脓毒症患者CD8+T细胞经CL097刺激后培养上清液中IFN-γ和TNF-α水平高于无CL097刺激(P<0.01),但穿孔素、颗粒酶B、颗粒溶素水平及诱导靶细胞死亡比例在无CL097刺激和经CL097刺激之间的差异无统计学意义(均P>0.05)。见表 6。
| 指标 | 无CL097刺激 | 经CL097刺激 | U值 | P值 |
| CTLA-4 mRNA | 5.03 (3.76, 9.66) | 3.93 (2.14, 11.66) | 0.068 | 0.507 |
| PD-1 mRNA | 3.27 (1.84, 16.60) | 5.55 (1.99, 18.71) | 0.151 | 0.624 |
| TIM-3 mRNA | 2.57 (2.21, 3.87) | 2.65 (1.16, 4.61) | 0.184 | 0.564 |
| 注:CTLA-4为细胞毒性T淋巴细胞相关蛋白4,PD-1为程序性死亡受体-1,TIM-3为T细胞免疫球蛋白及黏蛋白结构域的分子-3 | ||||
| 项目 | 直接接触共培养 | 间接接触共培养 | |||||||
| 无CL097刺激 | 经CL097刺激 | t值 | P值 | 无CL097刺激 | 经CL097刺激 | t值 | P值 | ||
| 靶细胞死亡(%) | 9.28±2.03 | 11.92±2.81 | 2.849 | 0.008 | 3.44±1.27 | 4.18±1.55 | 1.382 | 0.179 | |
| 穿孔素(pg/mL) | 127.4±28.90 | 162.7±43.61 | 2.525 | 0.018 | 22.08±7.94 | 27.88±9.53 | 1.750 | 0.092 | |
| 颗粒酶B(pg/mL) | 414.4±107.3 | 610.9±210.2 | 3.115 | 0.004 | 38.99±12.45 | 45.72±18.84 | 1.115 | 0.275 | |
| 颗粒溶素(pg/mL) | 77.41±13.93 | 137.3±45.09 | 4.748 | <0.001 | 10.73±3.92 | 12.31±4.58 | 0.981 | 0.336 | |
| IFN-γ(pg/mL) | 56.82±15.39 | 78.41±22.39 | 2.973 | 0.006 | 49.22±18.67 | 89.90±32.47 | 4.064 | <0.001 | |
| TNF-α(pg/mL) | 1.87±0.52 | 2.51±0.77 | 2.577 | 0.016 | 1.36±0.45 | 1.99±0.54 | 3.353 | 0.002 | |
| 注:IFN-γ为干扰素-γ,TNF-α为肿瘤坏死因子-α | |||||||||
TLRs在脓毒症中可发挥抗感染和诱导炎症细胞因子风暴的双重作用[5],不同的TLRs在脓毒症中的表达和功能也不尽相同。革兰阴性菌感染中菌体可释放内毒素,诱导TLR4信号通路活化,在脓毒症动物模型中诱导炎症损伤和多脏器功能不全[11-12]。革兰阳性菌、真菌则可激活细胞表面TLR2,可初步判断脓毒症血流感染病原菌类型[13]。本研究发现脓毒症患者PBMCs中TLR4、TLR2及相关TLRs(包括TLR1、TLR6、TLR8等)mRNA表达与对照组比较并无明显变化,这可能与入组患者数量有限、脓毒症患者中存在的CD8+T细胞功能衰竭所致的细胞对细菌以及脂多糖的识别效力降低有关,但仍提示外周血TLR4/2在脓毒症中发挥的作用可能有限。本研究发现无论在蛋白水平还是mRNA水平,脓毒症患者TLR7表达均显著低于对照者,TLR7表达与脓毒症患者预后有关,TLR7水平降低可能是脓毒症患者预后不佳的重要预测因素之一。这与既往TLR7在脓毒症动物模型中表达变化的报道基本一致[6]。刺激TLR7不但可预防脓毒性小鼠模型发生过度炎症应答[14],还可在脓毒症心肌功能障碍小鼠中发挥心肌保护作用[15]。但新近的研究则发现,使用TLR7基因敲除小鼠构建的脓毒症模型可保持血脑屏障完整性,减少病原菌播散,抑制炎症细胞向脑组织募集浸润,减轻脓毒症诱导的脑损伤[16]。因此,TLR7在脓毒症究竟发挥何种作用和相关机制仍有待进一步研究。
CD8+T细胞在清除病原菌感染中发挥重要作用。但脓毒症患者存在CD8+T细胞功能衰竭,特别是在有基础疾病的患者中发生脓毒症,CD8+T细胞杀伤功能降低,甚至出现失能状态,不能有效发挥免疫活性,导致脓毒症患者免疫失衡和疾病进展[17-18]。本研究发现脓毒症患者CD8+T细胞中免疫检查点受体表达升高,这是CD8+T细胞功能衰竭的标志[2]。CD8+T细胞可通过两种不同途径发挥免疫活性作用,一方面,CD8+T细胞可通过MHC-Ⅰ类分子介导的抗原提呈作用识别靶细胞,通过分泌穿孔素、颗粒酶B、颗粒溶素等毒性分子发挥细胞杀伤功能,这一过程依赖CD8+T细胞与靶细胞直接接触[4, 9, 19]。另一方面,CD8+T细胞还可分泌多种可溶型细胞因子,发挥细胞因子介导的抗感染和抗肿瘤活性[4, 9, 19]。本研究利用课题组既往建立的直接接触和间接接触共培养系统[9],分析CD8+T细胞对靶细胞的杀伤功能和机制。在直接接触系统中,CD8+T细胞可通过双重途径发挥功能,在间接接触体系中,CD8+T细胞仅能通过分泌细胞因子发挥作用[9]。在直接接触体系中,脓毒症患者CD8+T细胞诱导靶细胞死亡比例较对照者明显降低,伴有毒性分子和细胞因子分泌降低。在间接接触系统中,脓毒症患者CD8+T细胞分泌部分毒性分子水平较对照组降低,但毒性分子发挥作用依赖细胞的直接接触,且间接接触系统中穿孔素、颗粒酶B、颗粒溶素水平较直接接触细胞中明显降低,说明毒性分子并未参与间接接触系统中CD8+T细胞介导的细胞杀伤,而脓毒症患者细胞毒性分子水平降低可能与CD8+T细胞对免疫原的反应性降低有关。虽然间接接触系统中脓毒症患者CD8+T细胞分泌IFN-γ和TNF-α水平明显降低,但靶细胞死亡比例在脓毒症患者和对照者之间差异无统计学意义,提示CD8+T细胞发挥杀伤作用可能并不依赖细胞因子分泌,也说明脓毒症患者中存在CD8+T细胞功能衰竭。
乳腺癌患者TLR7表达降低可能与CD8+T细胞功能不全有关,TLR7激动剂可增强乳腺癌患者CD8+T细胞抗肿瘤功能[4]。在慢性人类免疫缺陷病毒感染中,TLR7激动剂不但能增强高效抗逆转录治疗应答[20],还可延长停药后病毒反弹的时间[21],这些作用都是通过增加病毒特异性CD8+T细胞应答实现的。本研究发现,TLR7激动剂虽然可增加细胞因子分泌,但并未增加间接接触系统中脓毒症患者CD8+T细胞介导靶细胞死亡比例,进一步说明CD8+T细胞发挥杀伤作用可能并不依赖IFN-γ和TNF-α。在直接接触系统中,TLR7激动剂可显著增强脓毒症患者CD8+T细胞介导的细胞杀伤,伴有细胞毒性分子分泌增加。同时,TLR7激动剂并未影响CD8+T细胞中免疫检查点受体表达,提示活化TLR7可能主要通过增加毒性分子表达增强脓毒症患者CD8+T细胞的杀伤功能。
本研究存在一定局限性,本研究分析了脓毒症患者CD8+T细胞功能和TLR7表达变化,虽然TLR7激动剂可促进CD8+T细胞功能,但尚不明确两者之间是否具有直接相关性,而脓毒症患者中存在免疫功能紊乱,在免疫网络的相互作用下TLR7对CD8+T细胞活性的影响还需要动物实验进一步证实。
总之,TLR7水平降低对脓毒症患者预后不佳有提示意义。脓毒症患者存在CD8+T细胞功能衰竭,TLR7激动剂可增强脓毒症患者CD8+T细胞杀伤功能。TLR7激动剂可能作为提高脓毒症患者细胞免疫应答的治疗方法之一,成为抗感染治疗的研究热点。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李伟伟:实施研究、采集数据、分析解释数据、统计分析、撰写文章;朱斌:酝酿和设计实验、实施研究、分析解释数据、统计分析、对文章的知识性内容作批评性审阅
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Guinault D, Nicolau-Travers ML, Silva S, et al. Expression of exhaustion markers on CD8+ T-cell patterns predict outcomes in septic patients admitted to the ICU[J]. Crit Care Med, 2021, 49(9): 1513-1523. DOI:10.1097/CCM.0000000000005047 |
| [3] | Sánchez-Ruiz M, Polakos NK, Blau T, et al. TLR signals license CD8 T cells to destroy oligodendrocytes expressing an antigen shared with a Listeria pathogen[J]. Eur J Immunol, 2019, 49(3): 413-427. DOI:10.1002/eji.201847834 |
| [4] | 秦双, 董良鹏, 白宾, 等. Toll样受体7对乳腺癌患者CD8+T细胞功能的影响[J]. 中华医学杂志, 2019, 99(20): 1562-1566. DOI:10.3760/cma.j.issn.0376-2491.2019.20.009 |
| [5] | Kumar V. Toll-like receptors in sepsis-associated cytokine storm and their endogenous negative regulators as future immunomodulatory targets[J]. Int Immunopharmacol, 2020, 89(Pt B): 107087. DOI:10.1016/j.intimp.2020.107087 |
| [6] | Jian WL, Gu LL, Williams B, et al. Toll-like receptor 7 contributes to inflammation, organ injury, and mortality in murine sepsis[J]. Anesthesiology, 2019, 131(1): 105-118. DOI:10.1097/aln.0000000000002706 |
| [7] | Chen ZA, Cheng YM, Xu YF, et al. Expression profiles and function of Toll-like receptors 2 and 4 in peripheral blood mononuclear cells of chronic hepatitis B patients[J]. Clin Immunol, 2008, 128(3): 400-408. DOI:10.1016/j.clim.2008.04.006 |
| [8] | Sasidharan Nair V, Saleh R, Toor SM, et al. Epigenetic regulation of immune checkpoints and T cell exhaustion markers in tumor-infiltrating T cells of colorectal cancer patients[J]. Epigenomics, 2020, 12(21): 1871-1882. DOI:10.2217/epi-2020-0267 |
| [9] | 王瑞雪, 李艳芳, 郝崇华, 等. Notch受体表达升高诱导前列腺癌患者CD8+ T细胞功能衰竭[J]. 中华医学杂志, 2020, 100(34): 2669-2674. DOI:10.3760/cma.j.cn112137-20200509-01468 |
| [10] | Boegel S, Löwer M, Bukur T, et al. A catalog of HLA type, HLA expression, and neo-epitope candidates in human cancer cell lines[J]. Oncoimmunology, 2014, 3(8): e954893. DOI:10.4161/21624011.2014.954893 |
| [11] | Wang YM, Ji R, Chen WW, et al. Paclitaxel alleviated sepsis-induced acute lung injury by activating MUC1 and suppressing TLR-4/NF-κB pathway[J]. Drug Des Devel Ther, 2019, 13: 3391-3404. DOI:10.2147/DDDT.S222296 |
| [12] | Shalmani AA, Ghahremani MH, Jeivad F, et al. Monomethyl fumarate alleviates sepsis-induced hepatic dysfunction by regulating TLR-4/NF-κB signalling pathway[J]. Life Sci, 2018, 215: 152-158. DOI:10.1016/j.lfs.2018.11.010 |
| [13] | 路玲, 王勇强, 李寅, 等. 对可溶性TOLL样受体2判断脓毒症患者血流感染病原菌临床价值的研究[J]. 中华急诊医学杂志, 2016, 25(04): 418-422. DOI:10.3760/cma.j.issn.1671-0282.2016.04.005 |
| [14] | Koerner P, Traeger T, Mehmcke H, et al. Stimulation of TLR7 prior to polymicrobial sepsis improves the immune control of the inflammatory response in adult mice[J]. Inflamm Res, 2011, 60(3): 271-279. DOI:10.1007/s00011-010-0265-6 |
| [15] | Xie SY, Wu QQ, Xu M, et al. Activation of Toll-like receptor 7 provides cardioprotection in septic cardiomyopathy-induced systolic dysfunction[J]. Clin Transl Med, 2021, 11(1): e266. DOI:10.1002/ctm2.266 |
| [16] | Zou L, He JY, Gu LL, et al. Brain innate immune response via miRNA-TLR7 sensing in polymicrobial sepsis[J]. Brain Behav Immun, 2022, 100: 10-24. DOI:10.1016/j.bbi.2021.11.007 |
| [17] | Choi YJ, Kim SB, Kim JH, et al. Impaired polyfunctionality of CD8+ T cells in severe sepsis patients with human cytomegalovirus reactivation[J]. Exp Mol Med, 2017, 49(9): e382. DOI:10.1038/emm.2017.146 |
| [18] | Condotta SA, Khan SH, Rai D, et al. Polymicrobial sepsis increases susceptibility to chronic viral infection and exacerbates CD8+ T cell exhaustion[J]. J Immunol, 2015, 195(1): 116-125. DOI:10.4049/jimmunol.1402473 |
| [19] | Jin B, Liang Y, Liu Y, et al. Notch signaling pathway regulates T cell dysfunction in septic patients[J]. Int Immunopharmacol, 2019, 76: 105907. DOI:10.1016/j.intimp.2019.105907 |
| [20] | Del Prete GQ, Alvord WG, Li Y, et al. TLR7 agonist administration to SIV-infected macaques receiving early initiated cART does not induce plasma viremia[J]. JCI Insight, 2019, 4(11): e127717. DOI:10.1172/jci.insight.127717 |
| [21] | Hsu DC, Schuetz A, Imerbsin R, et al. TLR7 agonist, N6-LS and PGT121 delayed viral rebound in SHIV-infected macaques after antiretroviral therapy interruption[J]. PLoS Pathog, 2021, 17(2): e1009339. DOI:10.1371/journal.ppat.1009339 |
 2024, Vol. 33
2024, Vol. 33