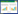急性循环衰竭(acute circulatory failure, ACF)被定义为各种病因引起的有效循环血量不足,使全身组织及器官得不到足够的血液灌注,导致组织缺血缺氧、微循环瘀滞代谢紊乱和脏器功能障碍的一系列病理生理改变。休克是全身组织器官低灌注导致机体氧输送不足和/或组织利用障碍、危及生命的急性循环衰竭。换言之,休克的最佳定义即是急性循环衰竭。作为多种病因引起的临床综合征休克分为四种类型其中低血容量休克与血液和液体区有关,而分布性休克与静脉血管系统有关;心源性休克产生于原发性心脏功能障碍,而梗阻性休克是由血液循环阻塞引起[1]。各种类型的休克均能导致氧供求不平衡的脏器功能衰竭的共同后果,是重症监护中的一种常见情况,影响到ICU大约三分之一的患者。其中脓毒性休克作为分布性休克,是ICU患者中最常见的休克类型,其次是心源性休克和低血容量性休克,梗阻性休克相对少见[2]。
休克在早期发现及早期干预情况下可能被逆转从而降低重症率及病死率,但一旦进展至终末期,将发生不可逆的器官损害直至死亡。因此,临床医生必须立即识别休克早期并治疗,以防进展为不可逆的器官功能障碍[1]。针对急性循环衰竭院内死亡危险因素分析及死亡预测报道相对较少,故本研究探讨ACS患院内死亡的危险因素并进一步构建预测模型。
1 资料与方法 1.1 研究对象本研究通过新疆维吾尔自治区人民医院伦理委员会审批,批号:KY2020041046。回顾性分析2014年1月至2023年1月本院收治的224例休克患者的临床资料。纳入标准:①入院时即诊断为休克并入住ICU的患者。休克诊断符合急性循环衰竭中国急诊临床实践专家共识[1]中提出的主要基于病因、低血压(定义为收缩压<90 mmHg,脉压<20 mmHg,或原有高血压者收缩压自基线下降≥40 mmHg,1 mmHg=0.133 kPa)、血乳酸水平(>2 mmol/L)和组织低灌注临床表现(①意识改变:包括烦躁、淡漠、谵妄、昏迷,是反映脑灌注的敏感指标。②尿量减少:充分补液尿量仍然<0.5/(kg·h),提示肾脏血流减少、循环容量不足。③皮肤湿冷、发绀、苍白、花斑等临床表现;毛细血管充盈时间>2 s)。其中脓毒休克患者诊断参照2017年版国际指南[3]:机体对感染反应失调导致的危及生命的器官功能障碍。感染或者疑似感染的患者,序贯器官衰竭评分(sequential organ failure assessment, SOFA)较基线上升≥2分。在充分液体复苏状态下仍需要血管活性药物来维持平均动脉压大于65 mmHg以上;血浆乳酸大于2 mmol/L。②年龄≥18岁;③临床资料及预后信息完整。排除标准:①长期应用激素、免疫抑制剂或慢性感染者;②有血液系统疾病或肿瘤患者。
1.2 资料收集与分组基本资料通过电子病历系统,收集患者年龄、性别、入院诊断(休克类型)、既往病史、原发疾病等。生命特征指标采集包括:入院时神志、心率、血压、呼吸频率等。入院24 h内完成血液样本采集,并送检。检验包括:血小板、乳酸、淋巴细胞计数、NK细胞计数、CD4、CD8、CD4/CD8、NK细胞计数/淋巴细胞计数等。系统评分根据测定的血液学指标及患者一般资料计算APACHE Ⅱ评分、快速序贯器官衰竭评分(quick sequential organ failure assessment, qSOFA)。本研究终点为ACF患者出院时的情况,分为存活组和死亡组。
1.3 统计学方法本研究数据采用SPSS 25.0和R 4.2.1软件进行统计学分析和绘制统计图。偏态分布的计量资料以中位数和四分位数[M(Q1, Q3)]表示,组间比较采用秩和检验;计数资料以频率和百分表示,组间比较采用卡方检验。将单因素分析中P<0.1的变量纳入最小绝对收缩选择算子(least absolute shrinkage and selection operator, LASSO)回归模型,筛选出ACF患者院内死亡最重要的预测因子,并构建列线图模型。模型的区分度用受试者工作特征(receiver operating characteristic,ROC)曲线、曲线下面积(area under curve,AUC)进行评价;模型校准度用校准曲线和Hosmer-Lemshow检验进行评价;AUC越大,校准曲线图中模型拟合线与理想曲线越接近,模型的预测效果越好。最后用临床决策曲线分析(decision curve analysis, DCA)来检测模型的临床获益和应用价值。检验水准α=0.05(双尾)。
2 结果 2.1 一般情况本研究收集的ACF患者共224例,其中存活患者113例,死亡患者111例,年龄18~95岁,(60.46±19.31)岁。按照7∶3比例将所有研究对象随机拆分成建模集和验证集,建模集157例,验证集67例,建模集和验证集所有指标比较差异无统计学意义(P>0.05),见表 1。
| 指标 | 建模集(n=157) | 验证集(n=67) | Z/χ2值 | P值 |
| 年龄a | 65(46, 77) | 61(49, 76) | -0.166 | 0.869 |
| 神志 | 1.589 | 0.452 | ||
| 清醒 | 77(49) | 35(52.2) | ||
| 嗜睡 | 40(25.5) | 20(29.9) | ||
| 昏迷 | 40(25.5) | 12(17.9) | ||
| 休克类型(n, %) | 0.393 | 0.822 | ||
| 感染性 | 116(73.9) | 51(76.1) | ||
| 失血性 | 31(19.7) | 11(16.4) | ||
| 心源性 | 10(6.4) | 5(7.5) | ||
| 心率(次/min)a | 106(88, 124) | 100(80, 121) | -0.580 | 0.562 |
| 呼吸频率(次/min) a | 23(20, 29.5) | 23(20, 31) | -0.476 | 0.634 |
| 收缩压(mmHg)a | 97(81, 114.5) | 89(79, 113) | -0.716 | 0.474 |
| 舒张压(mmHg)a | 59(48, 70.5) | 57(49, 70) | -0.402 | 0.688 |
| APACHE评分a | 19.99(13.39, 26) | 17.51(13, 24) | -1.092 | 0.275 |
| 血小板(×109/L)a | 155(90.5, 236) | 157(92, 227) | -0.166 | 0.869 |
| 淋巴细胞计数(×109/L)a | 0.91(0.5, 1.58) | 0.74(0.46, 1.22) | -1.671 | 0.095 |
| 乳酸((mmol/L)a | 2.52(1.44, 4.96) | 2.13(1.22, 4.23) | -1.264 | 0.206 |
| CD4(%)a | 246(121, 436.5) | 227(126, 430) | -0.016 | 0.987 |
| CD8(%)a | 190(97, 313.5) | 195(95, 397) | -0.617 | 0.537 |
| NK细胞计数(个/uL)a | 32(21, 56.53) | 38.56(21, 60) | -0.554 | 0.580 |
| qsofa(分)a | 2(1, 2) | 2(1, 2) | -0.779 | 0.436 |
| NK细胞计数/淋巴计数a | 37.46(22.22, 69.7) | 49.05(20.94, 104.35) | -1.184 | 0.236 |
| CD4/CD8a | 1.29(0.81, 1.93) | 1(0.75, 1.62) | -1.307 | 0.191 |
| 注:a为M(Q1, Q3);1 mmHg=0.133 kPa | ||||
单因素分析结果显示,年龄、神志、休克类型、呼吸频率、APACHE评分、淋巴细胞计数、乳酸、CD4、CD8、qsofa等指标在两组之间差异有统计学意义(P<0.05),其他指标差异无统计学意义(P>0.05),见表 2。
| 指标 | 存活(n=77) | 死亡(n=80) | Z/χ2值 | P值 |
| 年龄 | 61(42.5, 73.0) | 70(48, 81) | -2.072 | 0.038 |
| 神志 | 28.133 | <0.001 | ||
| 清醒 | 54(70.1) | 23(28.7) | ||
| 嗜睡 | 14(18.2) | 26(32.5) | ||
| 昏迷 | 9(11.7) | 31(38.8) | ||
| 休克类型 | 8.591 | 0.014 | ||
| 感染性 | 49(63.6) | 67(83.8) | ||
| 失血性 | 22(28.6) | 9(11.3) | ||
| 心源性 | 6(7.8) | 4(5) | ||
| 心率(次/min) | 101(87.5, 118) | 111.5(89, 129) | -1.774 | 0.076 |
| 呼吸频率(次/min) | 22(20, 26) | 25(21, 31.75) | -3.251 | 0.001 |
| 收缩压(mmHg) | 96(84, 112.5) | 101(79.25, 115) | -0.221 | 0.825 |
| 舒张压(mmHg) | 58(51, 72) | 60(44, 70) | -0.557 | 0.578 |
| APACHE Ⅱ评分 | 16(11.9, 20) | 24(16, 29) | -5.234 | <0.001 |
| 血小板(×109/L) | 155(98.5, 226) | 154.37(77.5, 258.5) | -0.088 | 0.930 |
| 淋巴细胞计数(×109/L) | 1.01(0.64, 1.69) | 0.79(0.38, 1.49) | -2.144 | 0.032 |
| 乳酸(mmol/L) | 2.14(1.22, 3.5) | 3(1.69, 6.81) | -3.160 | 0.002 |
| CD4(%) | 361.28(155.5, 602.5) | 183.5(116.25, 337.75) | -3.673 | <0.001 |
| CD8(%) | 240(146, 373) | 126(76.75, 243) | -3.945 | <0.001 |
| NK细胞计数(个/uL) | 34(23.5, 64.5) | 30.4(14, 45.67) | -1.729 | 0.084 |
| qSOFA | 1(1, 2) | 2(1, 3) | -3.103 | 0.002 |
| NK细胞计数/淋巴计数 | 31.85(22.15, 76.1) | 39.31(22.57, 65.82) | -0.277 | 0.781 |
| CD4/CD8 | 1.29(0.79, 1.93) | 1.3(0.81, 1.98) | -0.109 | 0.913 |
| 注:a为M(Q1, Q3);1 mmHg=0.133 kPa | ||||
将单因素分析P<0.1的潜在预测因素纳入到LASSO回归分析进行指标筛选(图 1),结果显示,神志情况、呼吸频率、APACHE评分、CD4等4个因素为ACF患者院内死亡的预测因子,并通过Logistic回归构建预测模型。结果显示,神志嗜睡、昏迷、呼吸频率和APACHE评分增高的患者院内死亡风险增高(OR>1),而CD4水平增高的患者院内死亡风险降低(OR<1),模型中所有指标均有统计学意义(P<0.05),见表 3。
|
| 使用LASSO回归模型进行特征选择。A:图为在LASSO模型中通过10折交叉验证法筛选惩罚系数(λ)最佳值的过程,左垂直线表示最小λ值,即均方误差最小的λ值;右垂线表示最小λ值右侧的1个标准误,在该取值下,纳入方程的变量个数更少,模型更简单;故本研究中选择此值作为最终方程筛选标准,此时λ值为0.074,Log(λ)=-2.603。B:图为变量系数的变化特征。随着惩罚系数(λ)向右增大,越来越多的变量系数被压缩,最后系数被压缩为0,最终选出神志情况、呼吸频率、APACHE Ⅱ、CD4等在Log(λ)=-2.603时非零系数的变量,从而实现变量的降维和筛选 图 1 LASSO回归特征筛选图 Fig 1 LASSO regression feature screening graph |
|
|
| 指标 | β | SE | OR(95% CI) | Z值 | P值 |
| 常数 | -2.463 | 0.878 | 0.085(0.015~0.476) | -2.806 | 0.005 |
| 神志 | |||||
| 清醒 | 1.000 | ||||
| 嗜睡 | 1.110 | 0.452 | 3.034(1.251-7.359) | 2.454 | 0.014 |
| 昏迷 | 1.253 | 0.514 | 3.501(1.278-9.587) | 2.438 | 0.015 |
| 呼吸频率 | 0.059 | 0.029 | 1.061(1.002~1.123) | 2.009 | 0.044 |
| APACHE评分 | 0.061 | 0.026 | 1.063(1.010~1.118) | 2.386 | 0.017 |
| CD4 | -0.003 | 0.001 | 0.997(0.995~0.999) | -2.866 | 0.004 |
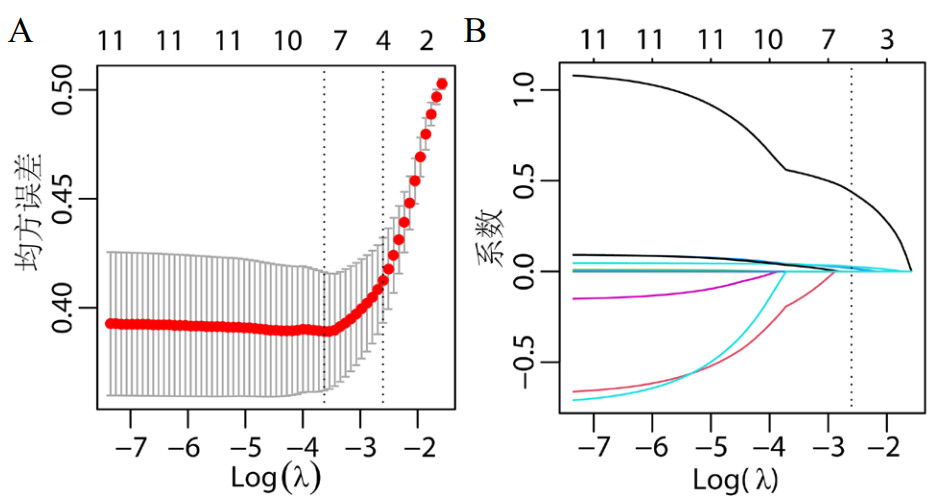
基于建立的多因Logistic回归分析结果,将筛选出的4个指标用于构建ACF患者院内死亡预测列线图模型,此列线图模型预测院内死亡的概率截断值为0.4404,相对应的列线图总分约为136分,即研究对象通过此列线图模型算出来的总分≥136分,则预测结局为死亡,总分<88分,则预测结局为好转。此模型AUC为0.830(0.764~0.895),敏感度为81.25%,特异度为68.83%,阳性预测值为73.03%,阴性预测值为77.94%。见表 3。
|
| 图 2 ACF患者院内死亡预测列线图 Fig 2 Nomogram of in-hospital death prediction for ACF patients |
|
|
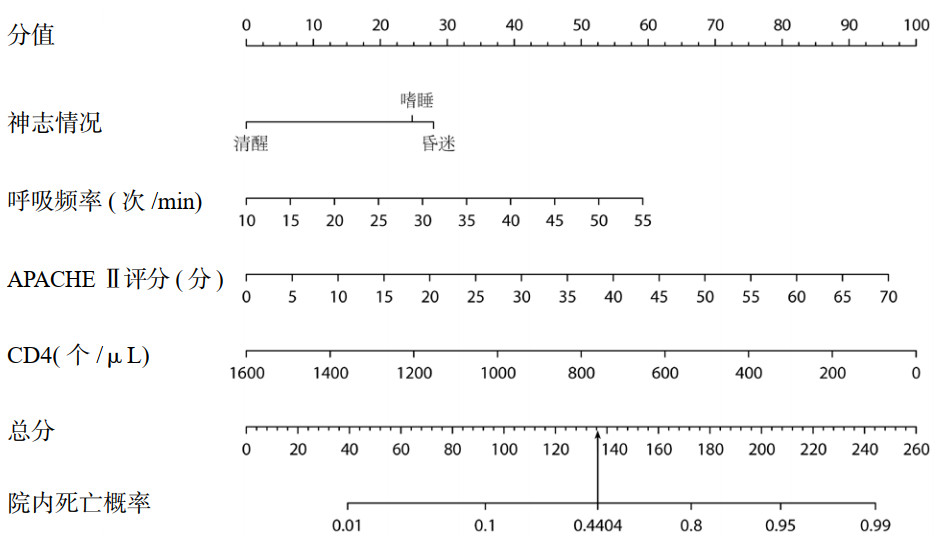
区分度评价:建模集AUC值为0.830(0.764-0.895),验证集AUC值为0.798(0.689-0.908),说明本研究建立的预测模型具有很好的区分能力(图 3A和3B)。校准度评价:建模集和验证集校准曲线图显示,图中黑色的模型拟合曲线与理想曲线有较好的吻合度;建模集Hosmer-Lemshow检验结果显示χ2=7.12和P=0.624,验证集Hosmer-Lemshow检验结果显示χ2=13.478和P=0.142,提示模型预测有较好的准确性(图 3C和3D)。适用性评价:通过DCA分析评估该模型的临床适用性(见图 3E和3F),图中蓝线表示对所有人进行干预时所获取的净收益,黑线表示不对任何人进行干预时所获取的净收益,红色线表示本模型所获取的净收益,结果显示模型红线基本高于蓝线和黑线,表明该模型的净收益显著高于两个极端状况,即患者可从该模型中获益,具有较好的临床适用性。
|
| 图 3 预测模型ROC曲线图、校准图、DCA曲线图 Fig 3 ROC curve, calibration chart and DCA curve of prediction |
|
|
休克是由四种潜在的,但不一定相互排斥的病理生理机制造成的。低血容量性、心源性及梗阻性休克等均因低心输出量导致氧运输不足。而分布性休克因外周全身血管阻力下降导致组织氧提取的改变。通常在这种情况下,心输出量会高,但由于相关的心肌抑制,心输出量可能会降低。急性循环衰竭的患者往往有这些机制的组合,因具有较高的发病率及病死率,积极的管理及治疗的早期开始依赖于早期的识别[4]。
在一项纳入1600多例休克患者的试验中,感染性休克发生率为62%,心源性休克发生率为16%,低血容量性休克发生率为16%,其他类型的分布性休克发生率为4%,梗阻性休克发生率为2%[5]。本研究的224例患者中脓毒性休克患者为165例,占总数的73.66%,故脓毒性休克仍为在ICU常见的高发病率的休克类型。2017年全球共报告了4890万例脓毒症,病死率为22.5%,占全球死亡人数的近20%[6-7]。随着抗生素、液体复苏和多器官支持疗法的及时使用,脓毒症的病死亡逐渐下降,但仍有相当大的改进空间。
脓毒症患者可能死于免疫抑制或因原发感染引起的过度炎症反应早期或晚期的再激活。免疫抑制的发生越来越被认为是脓毒症病死率的一个关键因素。因此,了解脓毒症引起的免疫抑制的病理作用对疾病的预防和治疗至关重要。脓毒症引起的免疫抑制的病理过程是由先天性和适应性免疫系统的紊乱和功能失调造成的[8-9]。T淋巴细胞计数是预测脓毒症诱导免疫抑制的一项指标。在免疫抑制过程中,由于细胞凋亡增加和抑制性免疫检查点分子高表达,T细胞数量明显减少,进一步加重免疫抑制,甚至导致免疫崩塌[10]。脓毒症患者T细胞亚群的变化具有临床预测价值,其中CD4+T数量最多且作用关键,分化为效应T辅助细胞(Th)或抑制性调节性T细胞(Tregs)等,代表着机体特异性免疫系统功能状态,CD4+/CD8+T细胞比例下降表明获得性免疫功能异常。在脓毒症期间,T细胞功能障碍降低CD4+T细胞的增殖,使其数量减少,诱导向T2型反应转变,并伴随T1型反应的丧失。因此,机体CD4和CD8 T淋巴细胞数量及功能的平衡和紊乱也代表了机体免疫稳态情况[11-13]。NK细胞是先天免疫的主要效应细胞,具有识别和攻击病毒和细菌的功能。它们在脓毒症的病理生理中起重要作用[14]。脓毒症患者NK细胞计数明显下降,而NK细胞/淋巴细胞比例高的患者预后较好[15]。在本研究中,淋巴细胞计数、CD4、CD8细胞等在死亡相关因素单因素分析的死亡组及存活组之间有统计学意义。Logistic回归构建预测模型中CD4水平增高的患者院内死亡风险降低,为保护性因素。而NK细胞及NK细胞/淋巴细胞比例在两组之间无统计学意义,但NK细胞数量在死亡组中比存活组明显更少,说明免疫稳态在脓毒性休克为代表的各种休克中的病理生理中起着至关重要的作用,并决定着临床结果。
APACHE评分和SOFA评分是评估脓毒症严重程度及预测28 d病死率的常用方法。在急诊环境中,“快速SOFA”(qSOFA)评分可用于筛查,只需对意识状态、呼吸频率和血压进行初步检查即可。如果这些参数有病理改变(意识模糊、呼吸频率≥22次/min、收缩压≤90 mmHg),并且怀疑有感染,可以假定存在脓毒症。SOFA评分是临床实践中最常用的疾病严重程度评分系统,被列为脓毒症(Sepsis 3.0)的诊断标准,已被证明能够有效评估脓毒症患者的预后[16]。APACHE是临床广泛应用的危重病病情评估系统,可客观、准确、快速预测病情变化。既往报道显示,随着脓毒症病情加重,APACHE评分逐渐升高[17]。在此研究中,qSOFA及APACHE评分在死亡组及存活组之间有意义,且死亡组的平均APACHE评分(24分)明显高于存活组(16分)。
脓毒症期间乳酸升高可能是由于组织缺氧、高肾上腺素状态下糖酵解加速、药物(肾上腺素、β-2受体激动剂)或肝功能衰竭所致。乳酸水平不但作为脓毒症1 h集束化治疗的一部分[18],同时被用于脓毒性休克的识别,近年来其与疑似感染及脓毒症患者预后之间的关系得到了广泛的共识[19]。乳酸水平高,乳酸清除率低,都提示疾病预后差[20]。同样在本研究中差异有统计学意义,死亡组平均值比存活组更高。
微循环障碍作为休克的特点,临床表现为组织低灌注,如意识改变,烦躁、淡漠、谵妄、昏迷,体现了脑组织的灌注不足,在此研究中神志嗜睡、昏迷成为了院内死亡的危险因素,意味着入院时神志昏迷的患者有着更高的病死率[21]。
如何量化临床指标以实现休克患者个体化的风险预测,目前仍是一项巨大的挑战。对休克患者迅速作出病情诊断,早期识别高危患者,进而采取针对性治疗极为重要。相对单一指标,预测模型能相对准确、高效地预测休克患者的死亡风险,成为临床医生的重要工具,提供了客观参数。本研究专门设计用于院内ACF患者死亡风险预测模型,使用基于患者临床观察和实验室检查及评分的模型。统计方法的进步提供了必要的工具来模拟与临床结局相关的许多变量之间的复杂关系。
死亡相关因素的单因素分析筛选出在两组之间差异有统计学意义的10项变量,并通过采用最小绝对收缩和选择运算符(LASSO),通过收缩大的回归系数来降低过拟合程度,最终神志情况、呼吸频率、APACHE评分、CD4等保留在最终模型中。这些变量不同于广泛使用但复杂的评分系统,在大多数医疗机构中都很容易获得,并且与身体的各个系统密切相关。
目前,ACF死亡风险预测模型鲜有报道。本研究基于成人急性循环衰竭患者,开发基于LASSO-Logistic回归法建立了ACF患者院内死亡的预测模型。通过ROC曲线评价其预测性能,AUC为0.830,敏感度为81.25%,特异度为68.83%,均具有较高的预测价值。且较建模集相比,验证集AUC值为0.798,说明本研究建立的预测模型具有很好的区分能力。通过Hosmer-Lemeshow拟合优度检验评估建模集与验证集的拟合度提示模型预测有较好的准确性。通过临床决策曲线分析评估提示该模型有较好的临床适用性,患者可从该模型中获益。且本研究死亡风险预测模型仅包含4个变量,创建的列线图工具可以轻松应用于临床环境,帮助医生识别出具有较高风险的患者进行临床决策,患者提供以个体为导向的治疗。
本研究的局限性为单中心回顾性分析,结果可能存在偏倚,对远期预后的预测作用需进一步验证。
利益冲突 所有作者声明无利益冲突
作者贡献声明 阿米娜·阿不列孜,里提甫江·买买提艾,佧米莱·赛伊提江:研究设计、数据整理与统计分析、论文撰写;阿米娜·阿不列孜,张慧芳,热依汉古丽·艾则孜,佧米莱·赛伊提江:数据收集与整理;阿米娜·阿不列孜:论文修改
| [1] | 中国医师协会急诊医师分会. 急性循环衰竭中国急诊临床实践专家共识[J]. 中华急诊医学杂志, 2016, 25(2): 146-152. DOI:10.3760/cma.j.issn.1671-0282.2016.02.004 |
| [2] | Vincent JL, de Backer D. Circulatory shock[J]. N Engl J Med, 2014, 370(6): 583. DOI:10.1056/NEJMc1314999 |
| [3] | Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016[J]. Crit Care Med, 2017, 45(3): 486-552. DOI:10.1097/CCM.0000000000002255 |
| [4] | Standl T, Annecke T, Cascorbi I, et al. The nomenclature, definition and distinction of types of shock[J]. Deutsches Arzteblatt Int, 2018, 115(45): 757-768. DOI:10.3238/arztebl.2018.0757 |
| [5] | De Backer D, Biston P, Devriendt J, et al. Comparison of dopamine and norepinephrine in the treatment of shock[J]. N Engl J Med, 2010, 362(9): 779-789. DOI:10.1056/NEJMoa0907118 |
| [6] | Gavelli F, Castello LM, Avanzi GC. Management of sepsis and septic shock in the emergency department[J]. Intern Emerg Med, 2021, 16(6): 1649-1661. DOI:10.1007/s11739-021-02735-7 |
| [7] | Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [8] | Delano MJ, Ward PA. Sepsis-induced immune dysfunction: can immune therapies reduce mortality?[J]. J Clin Invest, 2016, 126(1): 23-31. DOI:10.1172/JCI82224 |
| [9] | McBride MA, Patil TK, Bohannon JK, et al. Immune checkpoints: novel therapeutic targets to attenuate sepsis-induced immunosuppression[J]. Front Immunol, 2020, 11: 624272. DOI:10.3389/fimmu.2020.624272 |
| [10] | Francois B, Jeannet R, Daix T, et al. Interleukin-7 restores lymphocytes in septic shock: the IRIS-7 randomized clinical trial[J]. JCI Insight, 2018, 3(5): e98960. DOI:10.1172/jci.insight.98960 |
| [11] | Jiménez-Aguilar R, Sánchez-Zauco N, Tiburcio-Felix R, et al. Effects of cardiopulmonary bypass on the development of lymphopenia and sepsis after cardiac surgery in children with congenital cardiopathy[J]. Exp Ther Med, 2020, 19(1): 435-442. DOI:10.3892/etm.2019.8241 |
| [12] | Wilson JK, Zhao Y, Singer M, et al. Lymphocyte subset expression and serum concentrations of PD-1/PD-L1 in sepsis - pilot study[J]. Crit Care, 2018, 22(1): 95. DOI:10.1186/s13054-018-2020-2 |
| [13] | Markwart R, Condotta SA, Requardt RP, et al. Immunosuppression after sepsis: systemic inflammation and sepsis induce a loss of naïve T-cells but no enduring cell-autonomous defects in T-cell function[J]. PLoS One, 2014, 9(12): e115094. DOI:10.1371/journal.pone.0115094 |
| [14] | Souza-Fonseca-Guimaraes F, Parlato M, Philippart F, et al. Toll-like receptors expression and interferon-γ production by NK cells in human sepsis[J]. Crit Care, 2012, 16(5): R206. DOI:10.1186/cc11838 |
| [15] | Forel JM, Chiche L, Thomas G, et al. Phenotype and functions of natural killer cells in critically-ill septic patients[J]. PLoS One, 2012, 7(12): e50446. DOI:10.1371/journal.pone.0050446 |
| [16] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [17] | 杨燕, 栗延伟. APACHEⅡ评分联合血清NT-proBNP、PCT水平检测在ICU脓毒血症患者预后评估中的应用价值[J]. 包头医学院学报, 2018, 34(5) 26-27, 42. DOI:10.16833/j.cnki.jbmc.2018.05.011 |
| [18] | Levy MM, Evans LE, Rhodes A. The surviving sepsis campaign bundle: 2018 update[J]. Crit Care Med, 2018, 46(6): 997-1000. DOI:10.1097/CCM.0000000000003119 |
| [19] | Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016[J]. Intensive Care Med, 2017, 43(3): 304-377. DOI:10.1007/s00134-017-4683-6 |
| [20] | Wacharasint P, Nakada TA, Boyd JH, et al. Normal-range blood lactate concentration in septic shock is prognostic and predictive[J]. Shock, 2012, 38(1): 4-10. DOI:10.1097/SHK.0b013e318254d41a |
| [21] | 张向阳, 陈旭岩. 《急性循环衰竭中国急诊临床实践专家共识》解读[J]. 中国实用内科杂志, 2016, 36(8): 668-670. DOI:10.7504/nk2016070203 |
 2024, Vol. 33
2024, Vol. 33