急性脑出血占脑卒中的10%~30%[1],具有高致死率及高致残率的特点,35%~52%的脑出血患者在30 d内死亡,致残更是高达80%以上[2]。脑出血患者普遍存在应激性高血糖以及糖代谢异常等情况[3],并且在临床中发现血糖情况可能与患者预后相关,本研究旨在观察脑出血患者血糖水平和血糖波动情况与28 d生存情况的关系。
1 资料与方法 1.1 资料采集选择2020-01到2022-12之间,在本院急诊EICU接受治疗的急性脑出血病例。入选标准为:①与《中国脑出血诊治指南2019》[4]中的急性脑出血诊断标准相一致;②年龄>18周岁;③起病时间在24 h之内;④入院时间超过48 h。排除标准为:①年龄<18周岁;②入院24 h之内死亡/自动出院的患者;③以各种理由而放弃治疗者;④因恶性肿瘤、颅脑外伤、溶栓术后等继发性脑溢血患者;⑤合并其他主要脏器功能衰竭者;⑥疾病最终末期病合并出血性脑中风患者。本研究经中山大学孙逸仙纪念医院伦理委员会审批通过,伦理批号:SYSKY- 2023- 914- 01。
采集患者基础信息,包括入院时的美国国立卫生研究院卒中量表(NIHSS)和格拉斯哥昏迷量表(GCS)评分,入院时头部CT所显示的出血量、出血是否破入脑室,性别、年龄、收缩压和舒张压等基本情况,糖尿病、高血压、吸烟和饮酒等既往病史,以及患者28 d生存情况。
血糖监测、采集及检验:本组患者均在发病后24 h内到院,均由急诊卒中中心接诊,第一时间采集患者静脉血送检验科,用罗氏cobas c 702全自动生化分析仪(罗氏诊断公司,产地:日本)以己糖激酶法测定静脉血随机血糖浓度,以mmol/L为单位(入院首次静脉血糖)。来院后12 h内诊断明确并收入急诊EICU,在EICU治疗期间前7 d,每天6:00 am, 14:00 pm, 21:00 pm采集3次静脉血以上述同样检测方法测定静脉血血糖。收集患者从到院至急诊EICU治疗7 d内的所有静脉血糖资料进行分析,统计入院首次静脉血糖(mmoL/L),入院7 d内静脉血糖平均值(mmoL/L),入院7 d内静脉血糖最高值(mmoL/L),入院7 d内静脉血糖最低值(mmoL/L),24 h内最大静脉血糖波幅(LAGE,每天3个时段静脉血糖最高值与最低值的差值,取7 d中最大值,mmoL/L),静脉血糖变异系数(coefficient of variation,CV; CV=入院7 d内所有静脉血糖的标准差/平均值×100%)。
1.2 方法依照患者28 d生存情况分为生存组及死亡组,对比两组患者各项资料的差异,筛选出差异有统计学意义的因素作为自变量,28 d内存活与否作为因变量构建多因素Logistic回归,进一步分析出可能影响患者生存的危险因素。
1.3 统计学方法应用SPSS 23.0软件,计量资料符合正态分布以均数±标准差(x±s)表示,两组之间比较采用成组t检验;偏态分布以中位数及四分位数表示,两组之间采用秩和检验。计数资料以率(%)表示,两组之间比较采用χ2检验,以P < 0.05为差异有统计意义。
2 结果 2.1 预后的单因素分析74例患者纳入研究,年龄(58±13)岁,男性占比75.7%,其中28 d内生存57例,死亡17例,28 d内病死率22.97%。将患者分成生存组及死亡组,对比两组患者入院时GCS评分、NIHSS评分、出血量不少于30 mL、出血破入脑室、入院时收缩压、最高静脉血糖、最大血糖波幅差异有统计学意义。
| 指标 | 生存组(n=57) | 死亡组(n=17) | t/χ2 /Z值 | P值 |
| 年龄 | 58±13 | 59±13 | -0.456 | 0.650 |
| 男性 | 41(71.9%) | 15(88.2%) | 1.109 | 0.292 |
| 糖尿病病史 | 8(14.0%) | 2(11.8%) | 0.000 | 1.000 |
| 高血压病史 | 31(54.4%) | 14(82.4%) | 3.204 | 0.073 |
| 饮酒史病史 | 12(21.1%) | 2(11.8%) | 0.255 | 0.613 |
| 吸烟史 | 11(19.3%) | 1(5.9%) | 0.888 | 0.346 |
| 是否手术 | 43(75.4%) | 14(82.4%) | 0.071 | 0.790 |
| 入院时舒张压(mmHg) | 96±20 | 96±24 | 0.393 | 0.695 |
| 入院时收缩压(mmHg)a | 161±30 | 181±50 | -2.074 | 0.042 |
| 首次随机静脉血糖(mmol/L) | 9.2±4.5 | 10.6±6.0 | -1.019 | 0.312 |
| 平均血糖(mmol/L) | 9.2±2.9 | 10.7±2.7 | -1.908 | 0.06 |
| 最高静脉血糖(mmol/L)a | 13.6±5.8 | 19.2±7.9 | -3.171 | 0.002 |
| 最低静脉血糖(mmol/L) | 6.0±1.8 | 6.5±1.4 | -0.827 | 0.411 |
| 平均血糖变异系数 | 0.265±0.118 | 0.308±0.157 | -1.203 | 0.233 |
| 最大血糖波幅(mmol/L)a | 5.4(4.05, 9.10) | 9.3(5.55, 17.65) | -2.628 | 0.009 |
| 出血量≥30 mLa | 21(36.8%) | 13(76.5%) | 6.761 | 0.009 |
| 出血破入脑室a | 19(33.3%) | 12(70.6%) | 7.466 | 0.006 |
| 入院时GCS评分a | 9(7, 13) | 5(4, 6) | -4.852 | < 0.001 |
| NIHSS评分a | 13(6, 17) | 17(17, 19) | -3.916 | < 0.001 |
| 注:aP < 0.05 | ||||
将上述有差异的因素作为自变量,以预后生存或死亡为因变量,引入二分类变量多因素Logistic回归模型,结果提示出血量不少于30 mL、入院时GCS评分、入院时收缩压、最大血糖波幅进入模型中,与预后相关,是脑出血预后的独立危险因素。此模型的霍斯默-莱梅肖检验显著性0.981(P> 0.05),模型预测总体正确率90.5%。
| 指标 | β | P值 | OR | 95%CI |
| 出血≥30 mLa | 3.528 | 0.047 | 34.06 | 1.055~1 099.664 |
| 入院时收缩压a | 0.049 | 0.007 | 1.051 | 1.013~1.089 |
| 最大血糖波幅a | 0.351 | 0.022 | 1.42 | 1.052~1.918 |
| 入院时GCS评分a | -0.652 | 0.041 | 0.521 | 0.279~0.973 |
| 注:aP < 0.05;β值:回归系数;OR:优势比;CI:置信区间 | ||||
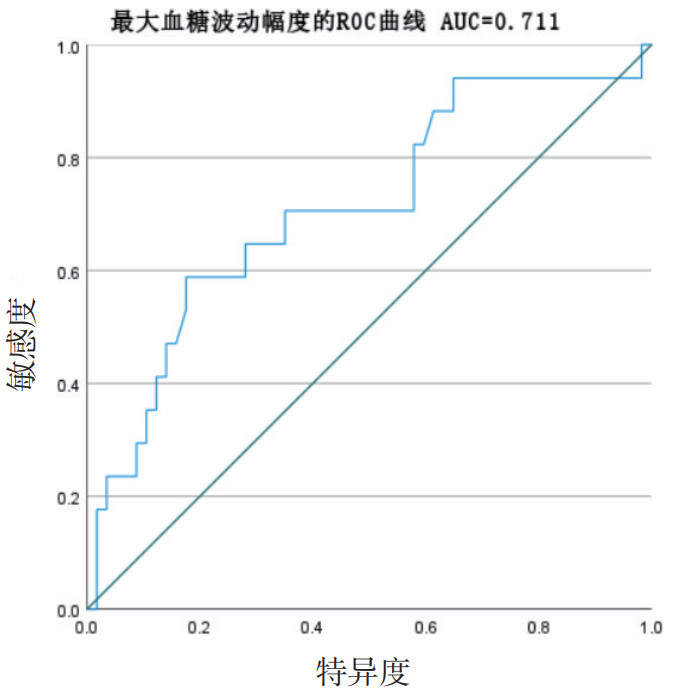
最大血糖波动幅度与28 d内死亡关系建立ROC曲线,曲线下面积AUC=0.711, P=0.009,截点值8.5 mmol/L,提示最大血糖波动幅度对于急性脑出血患者的短期预后具有预警价值。
|
| 图 1 最大血糖波动幅度与28 d内死亡的ROC曲线 Fig 1 ROC curve of maximum blood glucose fluctuation and 28-day mortality |
|
|
脑出血患者会出现血糖升高或剧烈波动的临床表现,这通常被理解为应激的一种表现,因为脑损伤会导致一系列神经内分泌反应,这种反应会激活多种激素,包括肾上腺素、皮质醇和生长激素等,这些激素都具有升高血糖的作用[5]。进一步的机制研究表明,脑损伤引起的应激反应会导致交感神经系统异常激活,不仅增加了肝脏的糖异生功能,同时也抑制了机体对胰岛素的反应,从而引起血糖水平的升高[6]。此外,脑损伤可能影响胰岛功能,造成胰岛对血糖自主调节能力低下使血糖剧烈波动[7]。在脑出血的患者中,血糖的剧烈波动也可能与脑损伤后的炎症爆发相关[8]。炎症介质如肿瘤坏死因子-α (TNF-α)、白细胞介素-1β (IL-1β)和白细胞介素-6 (IL-6)等可以影响胰岛素信号通路,导致胰岛素抵抗。这种胰岛素抵抗不仅增加了血糖水平,还可能加剧脑损伤后的继发性损伤,形成恶性循环[9]。
高血糖在多种类型的重症患者中被认为是一个不良预后的风险因素,系因为高血糖对多个系统器官都可能造成影响。高血糖可以通过促进炎症介质的释放加剧重症患者的炎症反应,其增加了患者多器官损害的风险,导致患者的不良预后[10]。高血糖也可以对免疫系统的影响,在高血糖状态免疫细胞的功能受到抑制使得机体对感染的防御能力下降,从而增加重症患者死亡风险[11]。并且,高血糖容易造成微血管功能障碍,影响组织的氧供导致多器官功能衰竭[12]。此外,高血糖还增加了心血管事件的风险,尤其是在重症监护室(ICU)的患者中,高血糖与心肌损伤和心律失常的发生相关[13]。
近年来许多研究者认为血糖的剧烈波动可能比持续的血糖水平升高对脑组织的危害更大,这涉及到微血管功能障碍、血脑屏障破坏、神经功能损害等方面[14]。血糖水平的快速上升和下降可能导致血管内皮细胞功能紊乱,微血管的通透性增加,破坏血脑屏障使得炎症介质及其他有害分子进入脑组织,干扰神经细胞的正常代谢和信号传递,加剧脑的水肿和损伤[15]。另外,血糖波动还可能激活应激反应途径,增加氧化应激和炎症反应,引起细胞损伤和死亡[16]。同时也通过影响神经递质的释放和神经元的兴奋性,干扰神经系统的正常功能,导致认知功能下降和其他精神神经症状,影响患者的康复进程[17]。Zarean等[18]研究认为,相较于患者入院时高血糖,血糖波动幅度大对脑出血患者院内死亡有更强的预测能力。
上述研究发现强调了在急性脑出血患者中控制血糖的重要性,需要进一步研究以确定最佳的血糖控制策略,以减少脑损伤和改善患者的预后。然而控制血糖并不是不是血糖“越低越好”,而是将血糖的总体水平稳定在一个安全范围[19]。过度严格的血糖控制策略可能反而导致低血糖事件的发生,在重症患者中可能诱发心律失常、心肌梗死、脑功能障碍等严重并发症[20]。因此,把血糖控制在一个平稳区间既能避免高血糖带来的并发症,又能防止低血糖事件的发生,是重症患者血糖管理的终极目标。美国内分泌协会的指南推荐将患者血糖水平维持在7.8~10.0(mmol/L)之间[21],在这一范围内可以有效减少感染风险、改善伤口愈合,减少氧化应激和炎症反应,保护血管内皮功能,又能降低低血糖的风险[22]。
然而有研究发现即便平均控制血糖水平在目标范围内,但血糖的剧烈波动仍可能会对患者的预后产生不利影响[23]。因此,现代临床血糖管理策略不仅着眼于血糖水平的绝对值,还聚焦在血糖的稳定性。血糖变异度(glycemic variability, GV)作为衡量血糖波动状态的一个重要监测指标,越来越受到研究者和临床医生的青睐。GV能够反映血糖水平在一定时间内的变化情况,其包括日内波动和日间波动。这种波动不仅包含血糖水平的大幅改变,也涵盖了较小的、频繁的血糖变异[24]。研究表明,GV与糖尿病的多种并发症相关,如糖尿病视网膜病变、肾病变和神经病变[25]。这些并发症的发生可能与血糖波动引起的氧化应激和炎症反应有关。GV也与心血管疾病的风险增加有关,尤其是动脉粥样硬化的发展。血糖的剧烈波动可能导致血管内皮功能障碍和血压的不稳定,进而增加心血管事件的风险[26]。GV还会影响认知功能,尤其是老年人群,因为血糖波动可能通过影响大脑的代谢和神经递质的平衡,对患者认知功能产生负面影响[27]。降低GV较降低血糖水平对疾病预后帮助更明显[28]。其原因可能是间断的高血糖更容易造成血管内皮细胞造成更严重的损伤,加速内皮细胞凋亡;同时影响胰岛β细胞功能导致机体代谢紊乱[29]。有荟萃研究显示[30],强化胰岛素治疗不能改善患者预后,并且增加低血糖风险,低血糖会对中枢神经系统造成不可逆损伤,并显著增加危重患者的病死率。因此降低GV水平可能是更有效的方式,即使平均血糖较高,降低血糖波动也能显著改善重症患者预后[31]。
目前评价GV的指标很多,研究者们正在开发和验证多种GV测量方法,包括标准差、变异系数、以及平均血糖波动幅度(mean amplitude of glycemic excursions,MAGE)和LAGE[32]。LAGE是其中一种广泛的评价指标,其可以了解患者一天内血糖波动最大幅度,从而反映血糖的变异度。本研究发现,LAGE相较于其他血糖指标与脑出血患者预后有更强的相关性,能较好的预测患者短期预后,希望引起临床医师重视。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王鹏飞、方家俊:设计实验、实施研究、采集数据、分析/解释数据),文章撰写,文章修改,投稿,伦理申请;宋凤卿:实验设计及开展的技术支持、指导统计分析方法,指导文章撰写与修改
| [1] | GBD Stroke Collaborators. Global, regional, and national burden of stroke, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet Neurol, 2019, 18(5): 439-458. DOI:10.1016/S1474-4422(19)30034-1 |
| [2] | Gokhale S, Caplan LR, James ML. Sex differences in incidence, pathophysiology, and outcome of primary intracerebral hemorrhage[J]. Stroke, 2015, 46(3): 886-892. DOI:10.1161/STROKEAHA.114.007682 |
| [3] | Wu SM, Wu B, Liu M, et al. Stroke in China: advances and challenges in epidemiology, prevention, and management[J]. Lancet Neurol, 2019, 18(4): 394-405. DOI:10.1016/S1474-4422(18)30500-3 |
| [4] | 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国脑出血诊治指南(2014)[J]. 中华神经科杂志, 2015, 48(6): 435-444. DOI:10.3760/cma.j.issn.1006-7876.2015.06.002 |
| [5] | Jacka MJ, Torok-Both CJ, Bagshaw SM. Blood glucose control among critically ill patients with brain injury[J]. Can J Neurol Sci, 2009, 36(4): 436-442. DOI:10.1017/s0317167100007757 |
| [6] | Marik PE, Bellomo R. Stress hyperglycemia: an essential survival response![J]. Crit Care Med, 2013, 41(6): e93-e94. DOI:10.1097/CCM.0b013e318283d124 |
| [7] | Ye XH, Zhang JL, Jin YJ, et al. Association between insulin resistance and remote diffusion-weighted imaging lesions in primary intracerebral hemorrhage[J]. Front Immunol, 2021, 12: 719462. DOI:10.3389/fimmu.2021.719462 |
| [8] | Lan X, Han XN, Liu X, et al. Inflammatory responses after intracerebral hemorrhage: from cellular function to therapeutic targets[J]. J Cereb Blood Flow Metab, 2019, 39(1): 184-186. DOI:10.1177/0271678X18805675 |
| [9] | 张诗荧, 栗卓, 丁洪光, 等. 应激性高血糖与脓毒症相关性脑病的关系[J]. 中华急诊医学杂志, 2023, 32(8): 1070-1076. DOI:10.3760/cma.j.issn.1671-0282.2023.08.011 |
| [10] | Becker CD, Sabang RL, Nogueira Cordeiro MF, et al. Hyperglycemia in medically critically ill patients: risk factors and clinical outcomes[J]. Am J Med, 2020, 133(10): e568-e574. DOI:10.1016/j.amjmed |
| [11] | Herder C, Roden M, Venteclef N. Diabetes and pulmonary infection: how hyperglycaemia shapes the immune system[J]. Signal Transduct Target Ther, 2024, 9(1): 67. DOI:10.1038/s41392-024-01784-6 |
| [12] | Li YW, Liu YF, Liu SW, et al. Diabetic vascular diseases: molecular mechanisms and therapeutic strategies[J]. Signal Transduct Target Ther, 2023, 8(1): 152. DOI:10.1038/s41392-023-01400-z |
| [13] | Li L, Ding LG, Zheng LH, et al. U-shaped association between stress hyperglycemia ratio and risk of all-cause mortality in cardiac ICU[J]. Diabetes Metab Syndr, 2024, 18(1): 102932. DOI:10.1016/j.dsx.2023.102932 |
| [14] | 张蓉, 陆丽, 王亚昕, 等. 糖尿病患者血糖波动异常与认知功能障碍关系的研究进展[J]. 上海交通大学学报(医学版), 2022, 42(2): 235-240. DOI:10.3969/j.issn.1674-8115.2022.02.016 |
| [15] | Banks WA. The blood-brain barrier interface in diabetes mellitus: dysfunctions, mechanisms and approaches to treatment[J]. Curr Pharm Des, 2020, 26(13): 1438-1447. DOI:10.2174/1381612826666200325110014 |
| [16] | 王京京, 蒋文佳, 李彦泽, 等. 急性多发伤后早期血糖波动对创伤后应激障碍发病的影响[J]. 中华急诊医学杂志, 2024, 33(5): 623-629. DOI:10.3760/cma.j.issn.1671-0282.2024.05.006 |
| [17] | Luna R, Talanki Manjunatha R, Bollu B, et al. A comprehensive review of neuronal changes in diabetics[J]. Cureus, 2021, 13(10): e19142. DOI:10.7759/cureus.19142 |
| [18] | Zarean E, Lattanzi S, Looha MA, et al. Glycemic gap predicts in-hospital mortality in diabetic patients with intracerebral hemorrhage[J]. J Stroke Cerebrovasc Dis, 2021, 30(5): 105669. DOI:10.1016/j.jstrokecerebrovasdis.2021.105669 |
| [19] | Maiorino MI, Signoriello S, Maio A, et al. Effects of continuous glucose monitoring on metrics of glycemic control in diabetes: a systematic review with meta-analysis of randomized controlled trials[J]. Diabetes Care, 2020, 43(5): 1146-1156. DOI:10.2337/dc19-1459 |
| [20] | Kahal H, Halama A, Aburima A, et al. Effect of induced hypoglycemia on inflammation and oxidative stress in type 2 diabetes and control subjects[J]. Sci Rep, 2020, 10(1): 4750. DOI:10.1038/s41598-020-61531-z |
| [21] | Moghissi ES, Korytkowski MT, DiNardo M, et al. American Association of Clinical Endocrinologists and American Diabetes Association consensus statement on inpatient glycemic control[J]. Diabetes Care, 2009, 32(6): 1119-1131. DOI:10.2337/dc09-9029 |
| [22] | van den Berghe G, Wouters P, Weekers F, et al. Intensive insulin therapy in critically ill patients[J]. N Engl J Med, 2001, 345(19): 1359-1367. DOI:10.1056/NEJMoa011300 |
| [23] | Pei JY, Wang XP, Pei ZY, et al. Glycemic control, HbA1c variability, and major cardiovascular adverse outcomes in type 2 diabetes patients with elevated cardiovascular risk: insights from the ACCORD study[J]. Cardiovasc Diabetol, 2023, 22(1): 287. DOI:10.1186/s12933-023-02026-9 |
| [24] | Ceriello A, Monnier L, Owens D. Glycaemic variability in diabetes: clinical and therapeutic implications[J]. Lancet Diabetes Endocrinol, 2019, 7(3): 221-230. DOI:10.1016/S2213-8587(18)30136-0 |
| [25] | Zaccardi F, Pitocco D, Ghirlanda G. Glycemic risk factors of diabetic vascular complications: the role of glycemic variability[J]. Diabetes Metab Res Rev, 2009, 25(3): 199-207. DOI:10.1002/dmrr.938 |
| [26] | Sun B, Luo ZY, Zhou JC. Comprehensive elaboration of glycemic variability in diabetic macrovascular and microvascular complications[J]. Cardiovasc Diabetol, 2021, 20(1): 9. DOI:10.1186/s12933-020-01200-7 |
| [27] | Lin YF, Gong ZY, Ma CC, et al. Relationship between glycemic control and cognitive impairment: a systematic review and meta-analysis[J]. Front Aging Neurosci, 2023, 15: 1126183. DOI:10.3389/fnagi.2023.1126183 |
| [28] | 王雁, 阿迪力·阿不都热合曼, 王烁, 等. 精准血糖控制对脑卒中相关感染免疫功能的影响[J]. 中华急诊医学杂志, 2017, 26(4): 381-385. DOI:10.3760/cma.j.issn.1671-0282.2017.04.005 |
| [29] | Kumar P, Raman T, Swain MM, et al. Hyperglycemia-induced oxidative-nitrosative stress induces inflammation and neurodegeneration via augmented tuberous sclerosis complex-2 (TSC-2) activation in neuronal cells[J]. Mol Neurobiol, 2017, 54(1): 238-254. DOI:10.1007/s12035-015-9667-3 |
| [30] | Griesdale DEG, de Souza RJ, van Dam RM, et al. Intensive insulin therapy and mortality among critically ill patients: a meta-analysis including NICE-SUGAR study data[J]. CMAJ, 2009, 180(8): 821-827. DOI:10.1503/cmaj.090206 |
| [31] | 郑忠骏, 吴春双, 徐善祥, 等. 连续血糖监测系统在危重患者中的准确性与预后评估价值[J]. 中华急诊医学杂志, 2019, 28(11): 1426-1431. DOI:10.3760/cma.j.issn.1671-0282.2019.11.018 |
| [32] | Leelarathna L, Thabit H, Wilinska ME, et al. Evaluating glucose control with a novel composite continuous glucose monitoring index[J]. J Diabetes Sci Technol, 2020, 14(2): 277-283. DOI:10.1177/1932296819838525 |
 2024, Vol. 33
2024, Vol. 33