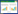创伤性脑损伤(traumatic brain injury, TBI)是发生创伤后癫痫(post-traumatic epilepsy, PTE)的主要原因[1]。TBI后PTE患病率从1.3%到53.3%不等,随着TBI的严重程度增加,癫痫发作的风险也显著增加,但发生癫痫的潜伏期可以维持数年[2]。PTE可以进一步加重脑水肿,因此,PTE发作不仅是TBI后早期发病率和病死率增加的原因,也是晚期导致患者死亡的主要原因[3]。目前临床上的预防主要用于单次发生的急性PTE,对于复发性慢性癫痫效果较差。尽管给予预防性治疗但仍有15%~40%的TBI患者伴随有慢性癫痫发作[4]。由于脑脊液提供了血液、炎症、感染以及退行性疾病的信息,可以对脑代谢有一些了解,具有一定的预后价值[5-6]。因此,本研究目的是寻找TBI后发生PTE的危险因素,以及脑脊液中葡萄糖与乳酸水平对PTE的预测价值。
1 资料与方法 1.1 一般资料回顾性分析本院2018年7月至2022年7月期间收治的TBI患者,在病历系统中根据国际疾病标准编码(ICD-10)中的脑损伤(S06),癫痫(G40)和抽搐(R56.8)抽取TBI患者病历,并逐一查阅每份病例报告及随访资料。根据以下纳入和排除标准共筛选出118例TBI患者,根据随访1年后有无癫痫发作分为PTE组(55例)和无PTE组(63例)。其中PTE组男性31例,年龄(47.02±8.15)岁。无PTE组男性41例,年龄(46.69±10.54)岁。本研究通过本院伦理委员会审核(2023-KS-117)同意免除患者知情同意。
纳入标准:(1)脑损伤是由创伤事件中的外力引起;(2)患者年龄≥18岁;(3)均有入院时影像学资料明确诊断为脑损伤;(4)TBI发生7 d后在没有诱因的情况下发生癫痫发作≥2次,并且有脑电生理证据和典型的癫痫发作表现。
排除标准:(1)发生TBI前存在癫痫或癫痫发作的病史;(2)发生TBI之前存在智力障碍或精神异常;(3)伴随其他颅脑疾病,如脑血管病、感染、颅内占位、中枢神经系统退行性变、脑发育异常等;(4)诊断为原发性全身性癫痫;(5)随访资料不全患者。
1.2 方法收集两组患者的临床数据,包括年龄,性别,体重指数,合并症(高血压,糖尿病,冠心病),格拉斯哥昏迷评分,损伤严重程度,多发性脑挫伤(损伤区域≥2个部位),外伤性蛛网膜下腔出血,颅内血肿,颅骨骨折,脑中线移位 > 5 mm,意识丧失时间,创伤后遗忘时间,治疗方式,多次颅内手术(≥2次),脑脊液生化指标(葡萄糖、乳酸、脑脊液葡萄糖与乳酸比率(cerebrospinal fluid glucose to lactate ratio,CGLR)、微量总蛋白、天冬氨酸氨基转移酶、腺苷脱氢酶)等参数。颅脑损伤严重程度以格拉斯哥昏迷评分为基础,分为轻度组(13~15分),中度组(9~12分),重度组(3~8分)。记录PTE组的第一次癫痫发作的时间和癫痫类型,TBI后发生PTE根据发作时间分为立即发作(< 24 h),早期发作(1~14 d)及晚期发作(TBI后 > 2周)[7]。收集每位PTE患者脑电图数据进行再次评估,根据脑电图结果分为简单部分性发作、复杂部分性发作、继发全面性发作3种癫痫类型。
通过电话和门诊随访,随访时间起始日期为患者受伤日期,截止日期为患者死亡日期或随访截止日期(2023年7月10日),对失访病例按最后一次随访时间为准做删失处理,对于截止到随访日期仍存活患者同样按照删失处理。主要观察终点为PTE发生率;次要观察终点为患者病死率。
1.3 统计学方法所有数据用SPSS 23.0统计学软件包完成,计量资料用均数±标准差(x±s)表示,所有计数资料用例数(百分比)描述,运用独立样本t检验和χ2检验组间进行比较。单因素分析中具有统计学意义的参数作为自变量,发生癫痫为因变量,纳入到多因素logistic回归分析中,通过估计比值比和95%置信区间对TBI后发生PTE的独立危险因素进行分析。应用受试者工作特征(receiver operating characteristic curve,ROC)曲线进行预测价值分析。双侧以P < 0.05为差异有统计学意义。
2 结果 2.1 一般临床资料单因素分析结果显示:入院时格拉斯哥昏迷评分,脑损伤严重程度,多发性脑挫伤(损伤区域≥2个部位),外伤性蛛网膜下腔出血,颅内血肿,脑中线移位 > 5 mm,治疗方式,多次颅内手术(≥2次),入院时脑脊液生化指标(葡萄糖、乳酸、CGLR、微量总蛋白、天冬氨酸氨基转移酶、腺苷脱氢酶水平)在两组之间差异有统计学意义(P<0.05)。其中PTE组中重度脑损伤的比例显著高于无PTE组(P<0.05)(见表 1)。PTE组中根据脑损伤严重程度进行的亚组分析显示在癫痫发作时间和癫痫类型上,轻、中、重三组之间差异无统计学意义(P>0.05)。但PTE组重度脑损伤患者的脑脊液葡萄糖水平显著低于轻度脑损伤患者,而且脑脊液乳酸水平也显著高于轻度脑损伤患者(见表 2)。
| 组别 | 年龄(岁) | 男性(n,%) | 体重指数(kg/m2) | 合并症 | 入院时格拉斯哥昏迷评分(分) | 脑损伤严重程度(n,%) | |||||
| 高血压 | 糖尿病 | 冠心病 | 轻度 | 中度 | 重度 | ||||||
| PTE组(n=55) | 47.02±8.15 | 31(56.36) | 23.65±1.73 | 11(20.00) | 7(12.73) | 5(9.01) | 8.78±3.20 | 7(12.73) | 19(34.55) | 29(52.73) | |
| 无PTE组(n=63) | 46.69±10.54 | 41(65.08) | 23.77±2.29 | 7(11.11) | 3(4.76) | 8(12.69) | 9.95±3.10 | 19(30.16) | 23(36.51) | 21(33.33) | |
| χ2/t值 | 0.182 | 0.938 | 0.326 | 1.795 | 2.402 | 0.390 | 1.917 | 6.688 | |||
| P值 | 0.856 | 0.333 | 0.745 | 0.180 | 0.121 | 0.532 | 0.048 | 0.035 | |||
| 组别 | 开放性脑损伤(n,%) | 多发性脑挫伤(n,%) | 外伤性蛛网膜下腔出血(n,%) | 颅内血肿(n,%) | 颅骨骨折(n,%) | 病变位置(n,%) | 脑中线移位 > 5 mm[n(%)] | ||||
| 弥散性 | 额叶 | 颞叶 | |||||||||
| PTE组(n=55) | 27(49.09) | 21(38.18) | 30(54.55) | 15(27.27) | 10(18.18) | 27(49.09) | 14(25.45) | 14(25.45) | 33(60.00) | ||
| 无PTE组(n=63) | 37(58.73) | 37(58.73) | 22(34.92) | 7(11.11) | 6(9.52) | 35(55.56) | 15(23.81) | 13(23.81) | 25(39.68) | ||
| χ2/t值 | 1.099 | 4.961 | 4.588 | 5.057 | 1.878 | 0.564 | 4.850 | ||||
| P值 | 0.294 | 0.026 | 0.032 | 0.025 | 0.171 | 0.754 | 0.028 | ||||
| 组别 | 多次颅内手术(n,%) | 治疗方式 | 脑脊液生化 | 病死率(n,%) | |||||||
| 保守治疗 | 手术治疗 | 葡萄糖(mmol/L) | 乳酸(mmol/L) | CGLR | 微量总蛋白(mg/L) | 天冬氨酸氨基转移酶(U/L) | 腺苷脱氢酶(U/L) | ||||
| PTE组(n=55) | 11(20.00) | 14(25.45) | 41(74.55) | 2.47±0.91 | 4.42±1.02 | 0.60±0.28 | 310.82±68.34 | 43.36±14.63 | 6.02±1.78 | 9(16.36) | |
| 无PTE组(n=63) | 1(1.59) | 31(49.21) | 32(50.79) | 3.25±0.94 | 3.69±0.74 | 0.93±0.36 | 315.81±46.82 | 39.83±17.31 | 6.09±1.02 | 1(1.59) | |
| χ2/t值 | 10.898 | 7.022 | 4.518 | 4.448 | 5.499 | 4.468 | 1.190 | 0.284 | 8.266 | ||
| P值 | 0.001 | 0.008 | 0.001 | 0.001 | 0.001 | 0.641 | 0.237 | 0.777 | 0.004 | ||
| 项目 | 轻度组(n=7) | 中度组(n=19) | 重度组(n=29) | χ2/t值 | P值 |
| 首次发作时间(n,%) | 4.309 | 0.366 | |||
| 立即发作 | 0(0.00) | 5(26.32) | 10(34.48) | ||
| 早期发作 | 3(42.86) | 5(26.32) | 10(34.48) | ||
| 晚期发作 | 4(57.14) | 9(47.36) | 9(31.03) | ||
| 癫痫类型(n,%) | 5.716 | 0.221 | |||
| 简单部分性发作 | 5(71.43) | 6(31.58) | 8(27.59) | ||
| 复杂部分性发作 | 2(28.57) | 7(36.84) | 11(37.93) | ||
| 继发全面性发作 | 0(0.00) | 6(31.58) | 10(34.48) | ||
| 脑脊液葡萄糖(mmol/L) | 3.58±0.83 | 2.98±0.61a | 1.87±0.60ab | 29.812 | 0.001 |
| 脑脊液乳酸(mmol/L) | 3.83±0.28 | 4.09±0.75 | 4.78±1.14ab | 4.527 | 0.015 |
| CGLR | 0.94±0.21 | 0.75±0.19 | 0.42±0.19ab | 28.003 | 0.001 |
| 微量总蛋白(mg/L) | 365.01±76.65 | 293.11±53.86 | 309.34±70.26 | 3.062 | 0.055 |
| 天冬氨酸氨基转移酶(U/L) | 36.29±14.12 | 43.05±14.56 | 45.36±14.63 | 1.074 | 0.349 |
| 腺苷脱氢酶(U/L) | 5.56±1.49 | 6.28±1.84 | 6.02±1.79 | 0.668 | 0.517 |
| 注:a与轻度脑损伤相比,差异有统计学意义; b与中度脑损伤相比,差异有统计学意义 | |||||
多因素回归分析结果显示,多发性脑挫伤、重度脑损伤、颅内血肿,脑脊液葡萄糖、脑脊液乳酸值均是TBI后发生PTE的独立危险因素(见表 3)。
| 参数 | 沃尔德检验 | 比值比 | 95%置信区间 | 标准误 | P值 |
| 多发性脑挫伤 | 5.152 | 2.25 | 1.227~3.278 | 0.523 | 0.023 |
| 重度脑损伤 | 3.932 | 4.55 | 3.893~5.206 | 0.335 | 0.047 |
| 颅内血肿 | 3.893 | 3.73 | 3.267~4.193 | 0.236 | 0.048 |
| 脑脊液葡萄糖 | 4.288 | 1.92 | 1.269~2.571 | 0.332 | 0.038 |
| 脑脊液乳酸 | 5.058 | 4.13 | 2.896~5.368 | 0.631 | 0.024 |
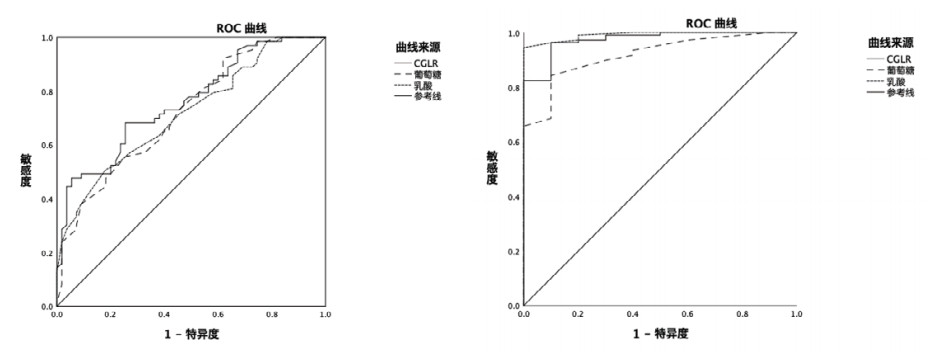
ROC分析结果显示脑脊液葡萄糖、脑脊液乳酸的曲线下面积分别为0.722,0.716。截断值分别为2.95,3.95,敏感度分别为61.9%,63.5%。特异度分别为61.8%,62.8%,CGLR的预测价值更高,AUC为0.760。当截断值为0.72时,敏感度和特异度分别为69.8%,63.6%。(见表 4,图 1A)。此外,在预测患者不良预后的ROC分析结果显示脑脊液葡萄糖、脑脊液乳酸、CGLR也具有较高的预测价值(见表 5,图 1B)。
| 指标 | 曲线下面积(95% CI) | P值 | 截断值 | 敏感度 | 特异度 |
| 脑脊液葡萄糖(mmol/L) | 0.722(0.632~0.812) | 0.001 | 2.95 | 61.9% | 61.8% |
| 脑脊液乳酸(mmol/L) | 0.716(0.626~0.807) | 0.001 | 3.95 | 63.5% | 62.8% |
| CGLR | 0.760(0.675~0.844) | 0.001 | 0.72 | 69.8% | 63.6% |
|
| A:ROC曲线预测PTE的发生;B:ROC曲线预测患者的不良预后 图 1 TBI患者发生PTE的ROC曲线分析 |
|
|
| 指标 | 曲线下面积(95% CI) | P值 | 截断值 | 敏感度 | 特异度 |
| 脑脊液葡萄糖 | 0.919(0.851~0.986) | 0.001 | 45.85 | 76.6% | 60% |
| 脑脊液乳酸 | 0.991(0.978~0.997) | 0.001 | 28.15 | 76.5% | 69% |
| CGLR | 0.974(0.939~0.998) | 0.001 | 0.34 | 96.3% | 90% |
TBI是PTE最常见的原因,并且TBI后发生PTE的患者常存在慢性神经功能,神经认知和心理障碍,对健康和生活质量造成严重影响[8]。相对于无TBI,轻度TBI后PTE风险增加2倍,严重TBI后风险增加7倍[9]。因此,如果可以早期识别高风险患者,则可以进行有针对性的干预措施来预防PTE发生。
既往研究认为PTE的危险因素包括高龄,穿透性损伤,损伤严重程度,多发性挫伤,颅内出血,病变位置,脑中线移位 > 5 mm,多次颅内手术[10-11]。这与本研究结果相似。但是本研究单因素分析中并未发现年龄、病变位置在两组之间的差异。在年龄方面,有研究认为高龄患者由于脑功能减弱,损伤后自主恢复能力较弱,更容易导致神经元的异常放电[11]。但是也有研究持反对观点,认为无论高龄还是年轻人均有发生TBI的风险[12]。尽管研究已经证实颞叶是PTE最常见的病灶部位[13],但是也有研究发现由于顶叶靠近电活动频繁的大脑中央前后回皮质区,给予较低的刺激就能引起异常放电引起癫痫发展。此外,研究还显示额叶癫痫发作多表现为多种运动异常,而枕叶癫痫发作常伴随有初级视幻觉[14]。在癫痫类型上,不同脑损伤程度之间差异无统计学意义,这与既往研究相仿,尽管脑损伤严重程度是PTE的危险因素[15],但是PTE的程度与脑损伤程度之间无相关性,这可能是由于TBI后发生的癫痫类型由于损伤机制不同,引起的异常放电部位和程度也不同[12]。
本研究多因素回归分析结果显示损伤严重程度、损伤类型、颅内血肿、脑脊液中葡萄糖和乳酸水平是TBI后发生PTE的独立危险因素。这与既往研究结果相似[16-20]。这些研究均已证实这些危险因素可以直接或间接的反映脑损伤严重程度,而且PTE的发生率随着TBI严重程度增加而增加。本研究中PTE组中重度损伤患者的比例高达85.7%。研究认为脑挫伤引起PTE是由于脑挫伤后红细胞外渗及其溶解产生的含铁血黄素沉积于神经纤维网内,进而导致癫痫发生,并且动物研究也证实铁离子的氧化还原性与癫痫发作具有相关性[16]。在损伤类型上,开放性损伤由于存在硬脑膜破损,容易造成颅内出血和感染的风险加大,以及异物残留进一步形成脑膜-脑瘢痕,导致异常放电[17]。既往研究也证实颅内血肿除了可以直接刺激脑皮质,引起神经异常放电外,还可以引起邻近的神经组织炎症、胶质细胞增生等一连串反应进而导致癫痫[18],但是确切的病理生理学机制尚未阐明。此外,这些危险因素也可导致血-脑屏障的改变,引起周围神经细胞异常兴奋,兴奋性神经递质如谷氨酸过度释放,以及氧自由基的异常产生释放造成细胞能量代谢异常,而引发癫痫[19]。尽管有研究认为颅骨骨折是发生PTE的独立危险因素,可以直接压迫脑组织和神经元。但是也有研究未能证实该结论,这可能与颅骨骨折是否损伤硬脑膜有关[20]。
本研究结果还显示脑脊液中葡萄糖和乳酸水平均是PTE的危险因素,当发生TBI时患者的脑代谢也会受到影响[21],由于TBI后出现脑血流减少,微血管功能障碍或细胞毒性水肿,导致葡萄糖输送受损,脑组织无法充分将葡萄糖作为能量来源,导致继发性脑损伤[22]。通过使用正电子发射断层扫描后发现在没有增加组织灌注的情况下,无论全身血浆葡萄糖浓度如何,脑内细胞外葡萄糖水平低可能是由于过度糖酵解所致[23]。本研究中PTE患者的脑脊液中乳酸水平高于非PET患者,虽然乳酸升高被认为是无氧代谢和组织缺氧的标志,但这种现象也可能是由于葡萄糖转变为乳酸作为神经元代谢的主要代谢底物,以及循环中乳酸摄取增强或星形胶质细胞中乳酸生成增加而导致[24]。越来越多的研究显示乳酸水平不仅是能量代谢的底物,而且是导致神经元兴奋性变化的化学信使,影响各种生理过程,如学习和记忆,并且对损伤的大脑有神经保护作用[25]。给予高渗乳酸治疗可以改善急性脑损伤后脑灌注和葡萄糖供应[26]。因此,脑脊液中低葡萄糖和高乳酸水平,可能预示着TBI患者的能量代谢耗竭,ROC曲线分析结果显示CGLR降低可以显著预测PTE的发生。这与既往研究结果相同,CGLR降低与TBI后病死率和神经功能恢复不良的风险增加有关[27-28]。
本研究的局限性在于,首先由于本研究为单中心回顾性研究,研究样本量较少,并且部分患者的随访资料不全,因此TBI后PTE的发生率有可能被低估。其次由于研究条件有限,本研究未能对基因有关的危险因素进行分析。最后,本研究未对患者的长期预后进行跟踪随访,仍需进一步研究评估PTE对于TBI后患者远期预后的影响。目前面对TBI后发生PTE的多元化危险因素,仍需要进一步研究寻找治疗靶点,结合本研究结果,笔者认为损伤严重程度、开放性颅脑损伤、颅内血肿、脑脊液中低葡萄糖和高乳酸水平是TBI后发生PTE的独立危险因素,CGLR对PTE的发生和不良预后均有较高预测价值。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张丽楠:论文撰写;张丽楠,王磊:数据收集及整理、统计学分析;林乐清:研究设计、论文修改
| [1] | Golub VM, Reddy DS. Post-traumatic epilepsy and comorbidities: advanced models, molecular mechanisms, biomarkers, and novel therapeutic interventions[J]. Pharmacol Rev, 2022, 74(2): 387-438. DOI:10.1124/pharmrev.121.000375 |
| [2] | Vigil FA, Carver CM, Shapiro MS. Pharmacological manipulation of K v 7 channels as a new therapeutic tool for multiple brain disorders[J]. Front Physiol, 2020, 11: 688. DOI:10.3389/fphys.2020.00688 |
| [3] | Vaibhav K, Braun M, Alverson K, et al. Neutrophil extracellular traps exacerbate neurological deficits after traumatic brain injury[J]. Sci Adv, 2020, 6(22): eaax8847. DOI:10.1126/sciadv.aax8847 |
| [4] | Zhu J, Xu CP, Zhang X, et al. Altered amplitude of low-frequency fluctuations and regional homogeneity in drug-resistant epilepsy patients with vagal nerve stimulators under different current intensity[J]. CNS Neurosci Ther, 2021, 27(3): 320-329. DOI:10.1111/cns.13449 |
| [5] | Fang YJ, Huang L, Wang XY, et al. A new perspective on cerebrospinal fluid dynamics after subarachnoid hemorrhage: from normal physiology to pathophysiological changes[J]. J Cereb Blood Flow Metab, 2022, 42(4): 543-558. DOI:10.1177/0271678X211045748 |
| [6] | 方红龙, 陈城洋, 黄添姹, 等. 脑动脉瘤破裂出血术后脑脊液葡萄糖严重低下1例[J]. 中华急诊医学杂志, 2024, 33(2): 253-256. DOI:10.3760/cma.j.issn.1671-0282.2024.02.021 |
| [7] | Wilson CD, Burks JD, Rodgers RB, et al. Early and late posttraumatic epilepsy in the setting of traumatic brain injury: a meta-analysis and review of antiepileptic management[J]. World Neurosurg, 2018, 110: e901-e906. DOI:10.1016/j.wneu.2017.11.116 |
| [8] | Zhou C, Chen H, Zheng JF, et al. Pentraxin 3 contributes to neurogenesis after traumatic brain injury in mice[J]. Neural Regen Res, 2020, 15(12): 2318-2326. DOI:10.4103/1673-5374.285001 |
| [9] | Neuberger EJ, Gupta A, Subramanian D, et al. Converging early responses to brain injury pave the road to epileptogenesis[J]. J Neurosci Res, 2019, 97(11): 1335-1344. DOI:10.1002/jnr.24202 |
| [10] | Laing J, Gabbe B, Chen ZB, et al. Risk factors and prognosis of early posttraumatic seizures in moderate to severe traumatic brain injury[J]. JAMA Neurol, 2022, 79(4): 334-341. DOI:10.1001/jamaneurol.2021.5420 |
| [11] | Liu HY, Stover KR, Sivanenthiran N, et al. Impaired spatial learning and memory in middLe-aged mice with kindLing-induced spontaneous recurrent seizures[J]. Front Pharmacol, 2019, 10: 1077. DOI:10.3389/fphar.2019.01077 |
| [12] | Chen W, Li MD, Wang GF, et al. Risk of post-traumatic epilepsy after severe head injury in patients with at least one seizure[J]. Neuropsychiatr Dis Treat, 2017, 13: 2301-2306. DOI:10.2147/NDT.S141486 |
| [13] | Beesley S, Sullenberger T, Crotty K, et al. D-serine mitigates cell loss associated with temporal lobe epilepsy[J]. Nat Commun, 2020, 11(1): 4966. DOI:10.1038/s41467-020-18757-2 |
| [14] | Ajithkumar T, Imbulgoda N, Rees E, et al. Uncommon low-grade brain tumors[J]. Neuro Oncol, 2019, 21(2): 151-166. DOI:10.1093/neuonc/noy151 |
| [15] | Tubi MA, Lutkenhoff E, Blanco MB, et al. Early seizures and temporal lobe trauma predict post-traumatic epilepsy: a longitudinal study[J]. Neurobiol Dis, 2019, 123: 115-121. DOI:10.1016/j.nbd.2018.05.014 |
| [16] | Andrade P, Paananen T, Ciszek R, et al. Algorithm for automatic detection of spontaneous seizures in rats with post-traumatic epilepsy[J]. J Neurosci Methods, 2018, 307: 37-45. DOI:10.1016/j.jneumeth.2018.06.015 |
| [17] | Liu ZM, Chen QX, Chen ZB, et al. Clinical analysis on risk factors and prognosis of early post-traumatic epilepsy[J]. Arq Neuropsiquiatr, 2019, 77(6): 375-380. DOI:10.1590/0004-282X20190071 |
| [18] | Tagge CA, Fisher AM, Minaeva OV, et al. Concussion, microvascular injury, and early tauopathy in young athletes after impact head injury and an impact concussion mouse model[J]. Brain, 2018, 141(2): 422-458. DOI:10.1093/brain/awx350 |
| [19] | Hartz AMS, Rempe RG, Soldner ELB, et al. Cytosolic phospholipase A2 is a key regulator of blood-brain barrier function in epilepsy[J]. FASEB J, 2019, 33(12): 14281-14295. DOI:10.1096/fj.201901369RR |
| [20] | Birnbaum AK, Leppik IE, Svensden K, et al. Prevalence of epilepsy/seizures as a comorbidity of neurologic disorders in nursing homes[J]. Neurology, 2017, 88(8): 750-757. DOI:10.1212/WNL.0000000000003629 |
| [21] | Jalloh I, Helmy A, Howe DJ, et al. A comparison of oxidative lactate metabolism in traumatically injured brain and control brain[J]. J Neurotrauma, 2018, 35(17): 2025-2035. DOI:10.1089/neu.2017.5459 |
| [22] | Menet R, Lecordier S, ElAli A. Wnt pathway: an emerging player in vascular and traumatic mediated brain injuries[J]. Front Physiol, 2020, 11: 565667. DOI:10.3389/fphys.2020.565667 |
| [23] | Carteron L, Patet C, Solari D, et al. Non-Ischemic Cerebral Energy Dysfunction at the Early Brain Injury Phase following Aneurysmal Subarachnoid Hemorrhage[J]. Front Neurol, 2017, 8: 325. DOI:10.3389/fneur.2017.00325 |
| [24] | Annoni F, Peluso L, Gouvêa Bogossian E, et al. Brain protection after anoxic brain injury: is lactate supplementation helpful?[J]. Cells, 2021, 10(7): 1714. DOI:10.3390/cells10071714 |
| [25] | Lozano A, Franchi F, Seastres RJ, et al. Glucose and lactate concentrations in cerebrospinal fluid after traumatic brain injury[J]. J Neurosurg Anesthesiol, 2019, 32(2): 162-169. DOI:10.1097/ana.0000000000000582 |
| [26] | Carteron L, Solari D, Patet C, et al. Hypertonic lactate to improve cerebral perfusion and glucose availability after acute brain injury[J]. Crit Care Med, 2018, 46(10): 1649-1655. DOI:10.1097/CCM.0000000000003274 |
| [27] | Gouvêa Bogossian E, Taleb C, Aspide R, et al. Cerebro-spinal fluid glucose and lactate concentrations changes in response to therapies in patIents with primary brain injury: the START-TRIP study[J]. Crit Care, 2023, 27(1): 130. DOI:10.1186/s13054-023-04409-6 |
| [28] | Taccone FS, Badenes R, Arib S, et al. Cerebrospinal fluid glucose and lactate levels after subarachnoid hemorrhage: a multicenter retrospective study[J]. J Neurosurg Anesthesiol, 2020, 32(2): 170-176. DOI:10.1097/ANA.0000000000000584 |
 2024, Vol. 33
2024, Vol. 33