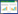2. 遵义医科大学附属医院门诊部,遵义 563003
2. Outpatient Department of Affiliated Hospital of Zunyi Medical University, Zunyi 563003, China
敌草快(diquat, DQ)是引起中毒的常见除草剂之一,作为急诊较常见的急危重症,目前尚无临床指南指导其治疗,也无针对中毒的特效解毒剂,故其治疗效果不佳,病死率较高,是我国急性中毒的广泛难题之一[1]。研究报道,81%急性DQ中毒患者出现急性肾损伤(acute kidney injury, AKI),其损伤的机制可能与氧自由基大量释放、氧化/抗氧化失衡密切相关[2]。氧化应激导致的脏器损伤已有大量文献报道[3],DQ在氧化还原循环中产生大量活性氧簇(reactive oxygen species, ROS),远超机体自我清除能力,ROS可激活细胞内的炎症信号通路,诱导氧化应激,氧化应激后过度产生ROS[3],导致大分子物质损伤,产生级联炎症反应,破坏其信号通路,诱导血清炎性因子及细胞信号通路表达,如白介素(interleukin, IL)-17及核转录因子-κB(nuclear factor kappa-B, NF-κB)信号通路激活,加重肾功能损害[4]。NF-κB作为ROS的间接作用靶点,当被过度激活后,肾脏细胞中IL-17的表达水平增加,引起其下游因子表达含量的升高,进而激活细胞因子的级联反应及其他促炎症介质的生成,最终调节炎症反应[5]。本团队的前期实验已证明IL-17与NF-κB信号通路在DQ中毒所致急性肾损伤中起重要作用[6]。辅酶Q10(coenzyme Q10, CoQ10)是一种强有力的脂溶性抗氧化剂,通过外源性补充CoQ10,具有抗氧化、抗炎、抑制凋亡等作用[7]。也有研究证实CoQ10在各种氧化损伤模型中对肾脏具有保护作用[8]。现尚不清楚CoQ10是否在DQ诱导的肾损伤中起保护作用,本研究旨在通过体内、外实验,确定CoQ10是否能保护大鼠模型减轻DQ中毒所致的肾损伤,并初步探讨其作用机制,为临床治疗DQ中毒所致的肾损伤提供理论依据和潜在的治疗靶点。
1 材料与方法 1.1 实验动物与试剂成年健康雄性SD大鼠32只,体重约300~400 g,8~10周龄,清洁级,由长沙勤生物技术公司提供[许可证号SCXK(湘)2014-0011]。于SPF条件下饲养,饲养温度为20~25℃,(50±5)%相对湿度,24 h昼夜循环,标准饲养至少1周。肾近曲小管上皮细胞(HK-2 cell)购买自武汉大学细胞库。20%敌草快-水合物、戊巴比妥钠、大鼠IL-17 ELISA试剂盒、血胱抑素-C ELISA试剂盒、免疫荧光法ROS试剂盒、Kim-1ELISA试剂盒、NAGL ELISA试剂盒、兔抗小鼠NF-kB P65、兔抗小鼠IκB-α、兔抗小鼠GAPDH、辣根过氧化物酶标记的山羊抗兔IgG抗体购买自武汉Bioswamp公司。超氧化物歧化酶(SOD)ELISA试剂盒、丙二醛(MDA)ELISA试剂盒购买自南京建成公司;肌酐ELISA试剂盒、尿素氮ELISA试剂盒购买自深圳迈瑞公司。
1.2 实验方法 1.2.1 动物实验分组及模型建立32只SD大鼠,随机分为4组:正常组(N组)、辅酶对照组(N+CoQ10组)、DQ中毒组、DQ+CoQ10组;每组8只。通过体外构建DQ中毒大鼠肾损伤模型,据课题组前期实验结果分别于DQ组、DQ+CoQ10组一次性腹腔注射0.2% DQ溶液30 mg/kg诱导肾损伤模型[6],N+CoQ10及DQ+CoQ10组口服20 mg/kg的CoQ10,2次/24 h,预处理7 d,中毒后用药3 d诱导治疗组模型,N组予以等剂量、等体积生理盐水诱导对照组模型。
1.2.2 细胞实验分组及模型建立(肾近曲小管上皮细胞培养与处理细胞)HK-2细胞培养后随机分为4组:N组、N+CoQ10组、DQ中毒组、DQ+CoQ10组。HK-2细胞在含有10%胎牛血清、1%青霉素-链霉素的DMEM培养基中培养,培养条件为37 ℃,5% CO2的培养箱中培养。培养至长满70%~80%后进行药物干预,予以500 µmol/L DQ水溶液预处理细胞48 h,后予以CoQ10处理细胞建立细胞模型。CCK8检测其细胞增殖水平:CCK8实验将HK-2细胞按1×104个/孔接种于96孔板中,正常孵育过夜,然后每孔加入10 µL CCK-8试剂,继续培养2 h,用酶标仪检测450 nm处各孔吸光度值,重复测量三次各孔吸光度值结果后取其平均值。
1.2.3 ELISA检测相关氧化指标、炎症指标、肾损伤标志物从-80 ℃冰箱中取出大鼠血浆及肾脏标本,用酶联免疫吸附法(ELISA)分别检测血浆标本中Cr、BUN含量,肾脏标本中SOD、MDA、IL-17、C-ysc、NGAL、KIM-1含量,操作步骤按照ELISA试剂盒说明书执行。
1.2.4 蛋白表达检测采用Western blot检测核因子κB抑制蛋白α(NF-kappa-B inhibitor alpha, IKB-α)、磷酸化核转录因子κB(nuclear factor kappa B, P-NF-κB)、JNK相关亮氨酸拉链蛋白(JNK-related leucine zipper protein, JLP)、神经保护蛋白PTEN诱导的假定激酶1(neuroprotective protein PTEN-induced putative kinase 1, PINK1)蛋白表达,将肾脏组织称量、研磨后转移至离心管中,用离心机以4 ℃ 14 000r/min条件离心10 min收集肾脏标本;细胞刮刀刮下HK细胞后转移至离心管中,用离心机以4 ℃,1 000 r/min条件离心5 min收集细胞标本;RIPA裂解液提取细胞总蛋白,BCA法进行蛋白浓度测定;各组取10 μg总蛋白进行SDS-聚丙烯酰胺凝胶电泳、转膜、5%脱脂奶粉溶液封闭2 h,根据蛋白相对分子质量剪出合适的膜条带,分别与相应的稀释后一抗(1∶1 000)4 ℃孵育过夜。TBST洗膜10 min×3次后加入HRP标记的兔二抗(1∶1 000)室温孵育2 h,再次洗膜后加入ECL发光剂于暗室中显影、曝光,采用Bio软件对蛋白灰度值进行定量分析,重复三次实验后进行统计。
1.2.5 肾组织HE染色及形态学观察取部分肾组织固定、组织脱水、透明、浸蜡、包埋、切片、粘片、脱蜡、水化、染色、分化、漂洗、脱水及复染,再脱水、透明及封片,普通光镜10×20倍及10×40倍下观察肾组织切片病理学改变。按照TID(Otubular dilation and interstitial expansion with edema, inflammator infiltrate)标准行肾组织病理标本评分:正常小管及间质为0分;轻度TID,影响视野25%以下区域为1分;中度TID,影响视野25%~50%区域为2分;重度TID,影响视野50%以上区域为3分[9],测量最终分值为0~3分。评分结束后,取12个视野得分平均值为该组织切片最终评分。
1.2.6 免疫荧光法测定肾组织ROS表达量(ROS荧光探针)取已固定完成的肾组织载玻片,将湿纸巾铺于载玻片盒底部做成加湿盒,由冰冻切片仪中取出载有切片的载玻片,放入玻片盒中或湿盒中。待载玻片达室湿且未干时,铺加PBS于切片上。稀释的第一杭体于4℃用微量离心机以13 500 g离心2 min。用吸管在切片的一端吸去玻片上的PBS,并从另一端加上抗体,盖上加湿盒,室温温育1 h。以PBS冼玻片3次(5 min/次),从切片一端加入新的PBS缓冲液,由另一端吸去旧的缓冲液。稀释的第二抗体于4 ℃用微量离心机以13 500 g离心2 min。将第二抗体加于切片上,置加湿盒中室温温育1 h,以PBS洗玻片3次(5 min/次)。将盖玻片放于纸巾上,滴加1滴Gelvatol于盖玻片中央。翻过载玻片放于盖玻片上,将玻片置工作台上,用铝箔覆盖避光放置30 min,使Gelvatol凝结。显微镜下观察结果,绿色荧光强度越强,代表ROS水平越高。
1.3 统计学方法采用SPSS 29.0软件(IBM Corp., Armonk, NY, USA, Version 29.0)进行统计学分析,使用GraphPad Prim8软件做柱状图。符合正态分布的定量数据以均数±标准差(x±s)表示,采用单因素方差分析法中的SNK法及Games-Howell法进行组间及组内比较。以P < 0.05为差异具有统计学意义。
2 结果 2.1 DQ中毒后HK-2细胞模型建立及活力测定验证DQ中毒后对肾细胞损伤情况,予以DQ水溶液500 µmol/L预处理细胞,细胞增殖率结果显示:与N组及N+CoQ10组相比,HK-2细胞DQ染毒48 h后,细胞活性显著受损,细胞活力下降至35.1%,差异具有统计学意义(P < 0.05);CoQ10干预后明显增强HK-2细胞活力,为70.9%,差异具有统计学意义(P < 0.05)。见图 1。
|
| aDQ组与N组及N+CoQ10组相比较,均P < 0.05;b与DQ中毒组比较,CoQ10干预组P < 0.05 图 1 DQ中毒后HK-2细胞模型建立及活力测定 Fig 1 Establishment of HK-2 cell model after DQ poisoning and determination of its vitality |
|
|
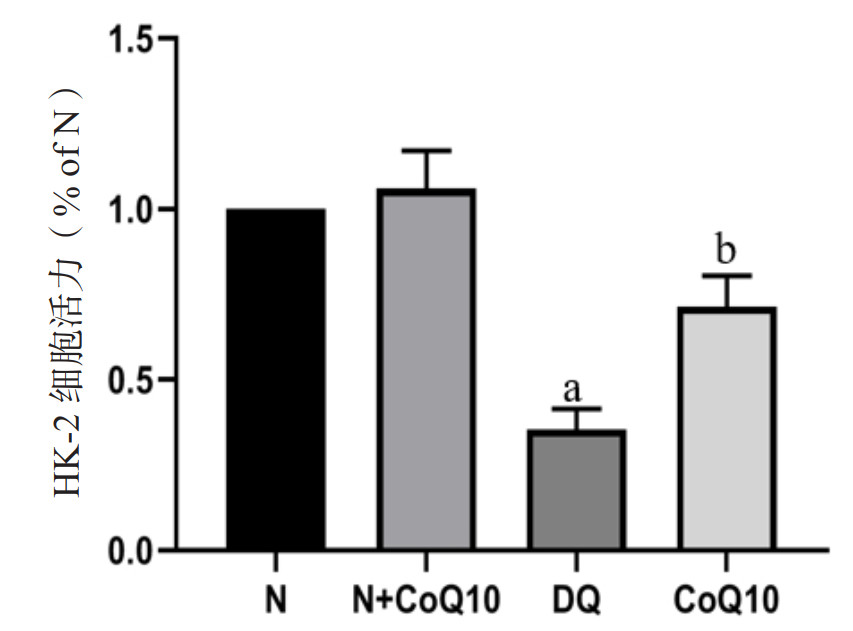
与N组及N+CoQ10组相比较,DQ中毒后HK-2细胞介导的P-NF-κBp65、PINK1蛋白表达被激活,IκB-α、JLP蛋白表达量明显下降,差异具有统计学意义(均P < 0.05);予以CoQ10干预后能减低P-NF-κBp65、PINK1蛋白表达,增强HK-2细胞IκB-α的表达及减低JLP降解,差异具有统计学意义(均P < 0.05)。见图 2。
|
| A、B、C:Westernblot法检测HK-2细胞中IκB-α、P-NF-κBp65蛋白表达量变化;D、E、F:Westernblot法检测HK-2细胞中PINK1、JLP蛋白表达量变化;a与N组及N+CoQ10组相比较,DQ中毒组P < 0.05;b与DQ中毒组比较,CoQ10组P < 0.05 图 2 DQ中毒及CoQ10干预后HK-2细胞介导的蛋白表达情况 Fig 2 The protein expression mediated by HK-2 cells after DQ poisoning and CoQ10 intervention |
|
|
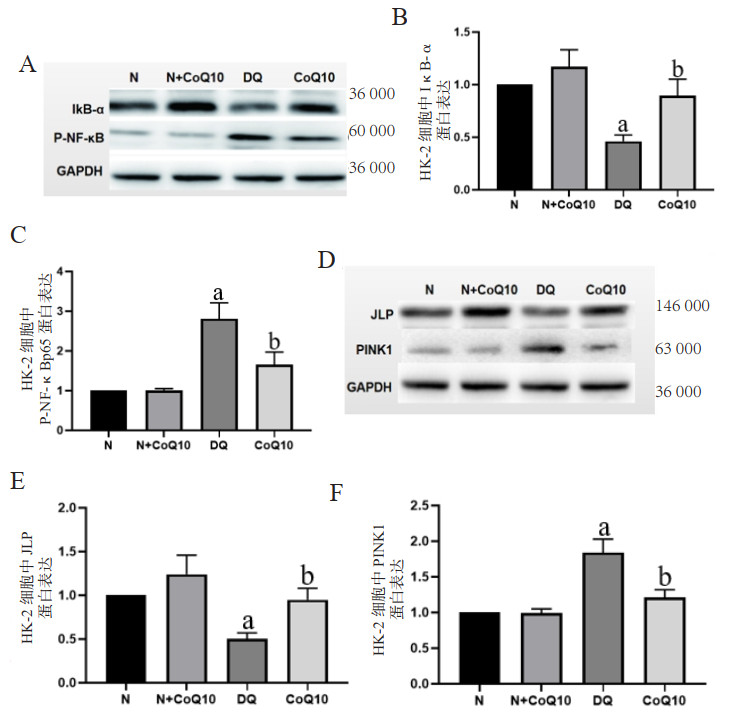
与N组及N+CoQ10组相比,DQ组染毒72 h后肾功能损伤指标(Cr、BUN、CysC、NAGL、KIM-1)及病理损害表达明显增高,差异具有统计学意义(均P < 0.05);予以CoQ10干预后能减轻DQ染毒诱导的大鼠肾损伤,差异具有统计学意义(均P < 0.05)。见图 3。
|
| A~E:ELISA法检测肾损伤相关指标(Cr、BUN、CysC、NAGL、KIM-1);F、G:显微镜下观察肾脏病理变化情况及肾脏病理评分;a与N组及N+CoQ10组比较,DQ中毒组P < 0.05;b与DQ中毒组比较,CoQ10组P < 0.05 图 3 DQ中毒后及CoQ10干预后的肾损伤相关指标及肾脏病理、病理评分 Fig 3 The related parameters of kidney damage and kidney pathology and pathological grading after DQ poisoning and CoQ10 intervention |
|
|
与N组及N+CoQ10组相比,DQ组染毒72 h后肾脏相关氧化应激指标(MDA、ROS)、炎症指标(IL-6、TNF-α和IL-17)表达量增加、SOD下降,差异具有统计学意义(均P < 0.05);予以CoQ10干预后能减轻DQ染毒诱导的大鼠肾脏氧化应激损伤及炎症因子表达,差异具有统计学意义(P < 0.05)。见图 4。
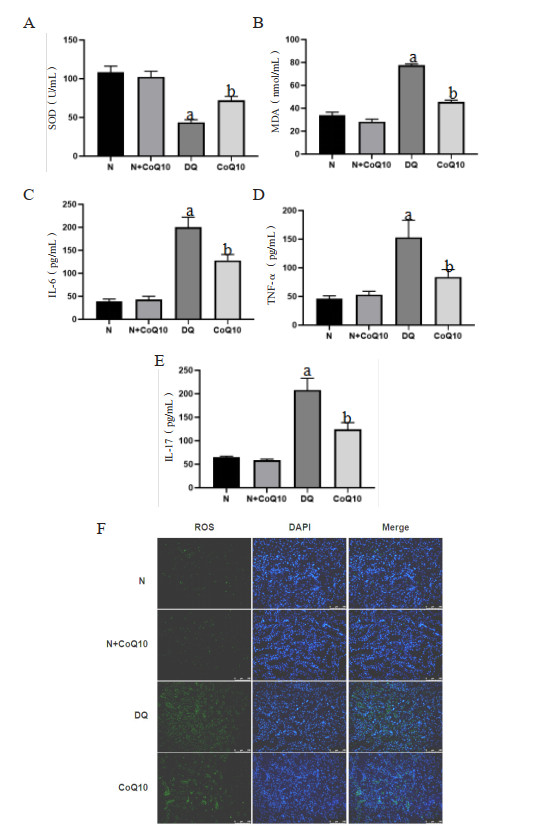
|
| A、B:ELISA法检测氧化应激相关指标(MDA、SOD表达情况);C、D、E:ELISA法检测炎症细胞因子(IL-6、TNF-α和IL-17表达情况);F:免疫荧光法检测氧化应激指标:活性氧表达情况;a与N组及N+CoQ10组相比较,DQ中毒组P < 0.05;b与DQ中毒组比较,CoQ10组P < 0.05 图 4 DQ中毒及CoQ10干预后的大鼠肾脏相关氧化应激及炎症感染程度 Fig 4 The degree of oxidative stress and inflammatory infection after DQ poisoning and CoQ10 intervention |
|
|
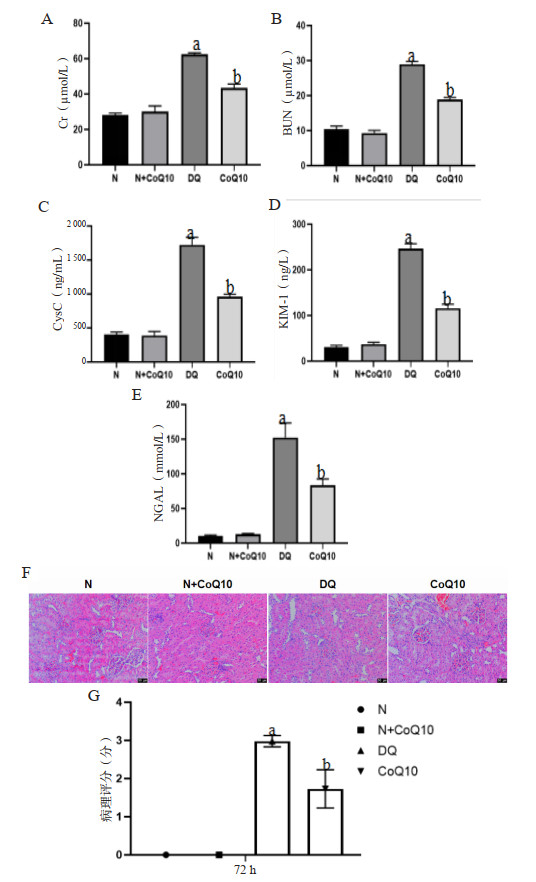
DQ中毒后大鼠肾脏介导的P-NF-κBp65、PINK1蛋白表达被激活,IκB-α、JLP蛋白表达量明显下降,差异具有统计学意义(均P < 0.05);予以CoQ10干预后能减低P-NF-κBp65、PINK1蛋白表达,增强大鼠肾脏PINK1的表达及减低JLP降解,差异具有统计学意义(均P < 0.05)。见图 5。
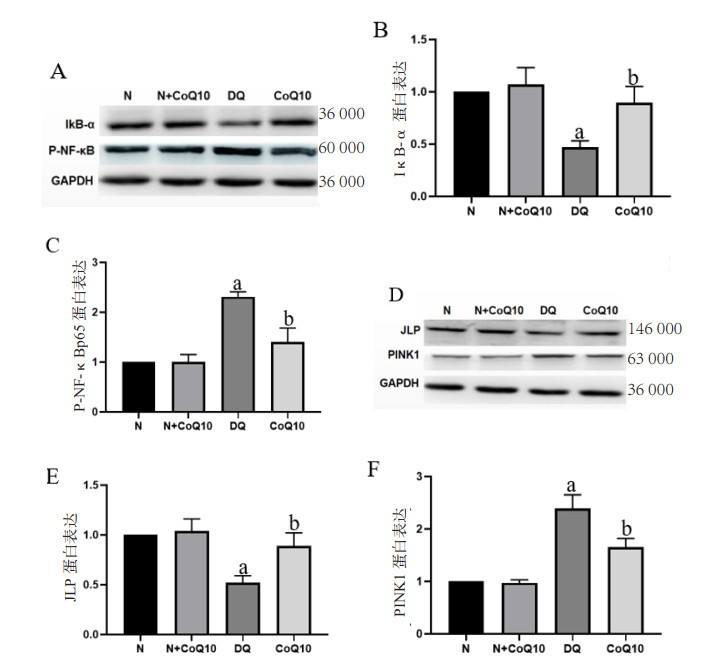
|
| A、B、C:Westernblot法检测肾脏中IκB-α、P-NF-κBp65蛋白表达量变化;D、E、F:Westernblot法检测肾脏中PINK1、JLP蛋白表达量变化;a与N组及N+CoQ10组相比较,DQ中毒组P < 0.05;b与DQ中毒组比较,CoQ10组P < 0.05 图 5 DQ中毒及CoQ10干预后大鼠肾脏介导的蛋白表达 Fig 5 The protein expression mediated by kidney after DQ poisoning and CoQ10 intervention |
|
|
DQ与百草枯(paraquat, PQ)同属联吡啶类除草剂,是一种作用迅速的接触除草剂和植物脱水剂,近年来因禁止使用PQ水剂后,DQ作为替代除草剂在农业生产中广泛应用,导致急性中毒的就诊人数呈明显上升趋势,是急诊较常见的中毒疾病,目前临床上尚无治疗DQ中毒的临床指南,也无针对敌草快中毒的特效解毒剂[10],中毒后治疗效果不佳,故其病死率及发生率均高,尤其是重症DQ中毒,我国往往在治疗上束手无策,是我国目前急性中毒的广泛难题之一[11]。目前,临床上DQ中毒的治疗主要致力于促进毒物排泄及清除毒物吸收,传统方式的洗胃、导泻、吸附、血液灌流、血液透析、ECMO等紧急处理措施对于急性重度中毒患者治疗效果往往不佳[12]。与PQ相比,DQ中毒患者并发严重AKI的发生率较高,肾功能受损将会造成全身器官损伤的进一步加重。DQ中毒损害肾近曲小管上皮细胞的毒性主要源于氧化还原反应过程所产生的ROS,通过诱导氧化应激、炎症反应,导致线粒体功能障碍[13]。据报道,抗氧化应激、减轻炎症反应能减轻DQ中毒肾损害,但具体机制不详。CoQ10作为内源性脂溶性苯醌类化合物,具有强大的抗氧化、抗凋亡、抗炎症、减轻线粒体功能障碍等作用,通过调节ROS产生的状态进而控制细胞的氧化还原状态[14]。近年,有实验表明,通过外源性补充CoQ10可减轻动物组织及器官损伤程度[15]。本研究通过体内及体外实验结果表明,CoQ10可减轻DQ中毒诱导的肾脏损伤,其机制可能与CoQ10通过抗氧化应激作用,调节IL-17及NF-κB信号通路表达,进一步改善线粒体功能障碍有关,为临床DQ中毒治疗提供了理论依据。
DQ中毒主要损害肾脏、肝脏、中枢等脏器,肾脏是DQ吸收后主要排泄器官,同时也是其损伤的主要靶器官,故其对肾脏损害较为突出,尽早改善肾功能有益于改善患者的预后及疾病转归[15]。本实验首先证明DQ染毒后引起大鼠肾脏损伤。结果显示DQ中毒后大鼠肾功能相关指标明显增高,且NGAL、KIM-1升高提示染毒早期肾功能已被损害,肾组织病理表现及评分也证实DQ中毒与肾损伤正相关。与DQ染毒组相比,CoQ10干预后肾损伤指标、组组织病理表现及评分均下降。表明CoQ10能减轻DQ染毒诱导的大鼠肾功能损伤及病理学表现,但具体机制不详。
DQ中毒肾损伤中氧化应激发挥重要作用[3]。氧化应激后过度产生ROS,过量ROS能直接导致大分子物质如蛋白、脂质、核酸等大分子损伤,还能产生级联炎症反应,破坏其信号通路,诱导血清炎性因子及细胞信号通路表达,如IL-17及NF-κB信号通路激活,加重肾功能损害,导致肾组织ROS表达逐渐升高,同时降低SOD活性,增加MDA表达。IL-17是机体重要的炎症因子,NF-κB作为ROS的间接作用靶点,是一种重要的转录因子复合物,当NF-κB被炎症因子、生长因子或趋化因子等过度激活后,可提高肾脏细胞中IL-17的表达水平,并引起其下游因子IL-6和TNF-α表达含量的升高,激活细胞因子的级联反应及促炎症介质的生成[16]。本团队前期研究实验发现,DQ中毒后,IL-17与NF-κB蛋白表达增高,IκB-α蛋白表达减低,抑制IL-17表达,增加IκB-α蛋白表达及减低P-NF-κBp65蛋白表达,可减轻DQ中毒肾损伤[17]。本实验发现,DQ组染毒72 h后肾脏相关氧化应激指标(MDA、ROS)、炎症指标(IL-6和TNF-α、IL-17)表达量显著增加,予以CoQ10干预后能减轻DQ中毒氧化应激作用,能减低肾组织ROS、MDA表达,增加SOD活性表达,减轻IL-6、TNF-α、IL-17等细胞因子表达。证明CoQ10能减轻DQ染毒诱导的氧化应激损伤及炎症介质生成,对肾脏起到保护作用。
NF-κB作为转录因子,是ROS的间接作用靶点,调节免疫反应、炎症反应、细胞黏附、分化、增殖、凋亡和自噬等基因的表达,在DQ诱导的自噬中起重要作用[18]。有研究发现DQ导致线粒体功能障碍和NF-κB相关,DQ通过其过量ROS驱动NF-κB-P65从细胞质转位至细胞核,诱导NF-κB及P53蛋白的细胞核积聚,最终导致其级联炎症反应[19]。DQ中毒诱导氧化应激在肾损伤中起着重要作用,氧化应激导致线粒体功能障碍,是细胞内ROS产生的主要来源,也是ROS损伤作用的重要靶点。线粒体功能障碍在肾脏疾病早期和进展中起着重要作用。PINK1蛋白组成自噬通路是线粒体自噬关键调节蛋白酶,当机体发生急性DQ中毒时,PINK1诱导氧化应激后参与介导受损线粒体的自噬。
CoQ10又名泛醌0和2, 3二甲氧-5-甲基-1, 4苯醌,广泛存在于线粒体中,是氧化还原性泛醌化合物,作为内源性抗氧化剂,无明显毒副作用,它具有很强大的抗氧化活性,主要通过抑制肾细胞膜脂质过氧化的启动及发展来清除氧自由基,使细胞免受损害,对于改善和治疗DQ中毒后氧化应激具有重要临床意义[8]。外源性补充CoQ10可对急性器官损伤(包括AKI)表现出有效的肾脏保护作用。研究表明,CoQ10治疗对各种类型的AKI均具有肾脏保护作用,如肾毒性药物、脓毒症、造影剂等损伤所诱发的AKI,该保护作用机制主要是由于CoQ10的抗氧化、抗炎、抑制凋亡等作用[15]。同时作为呼吸链的复合物,通过促进ATP酶利用的跨膜电位来合成ATP,在线粒体呼吸链中可作为移动电子转运体,是解偶联蛋白的辅助因子,调节线粒体膜的通透性及线粒体膜内脂质的氧化,也具有抗氧化、抗炎、抑制凋亡等作用。有研究报道,CoQ10依赖于NF-κB1的基因具有抗炎作用,以及心脏保护特性,并参与线粒体生物发生。也有研究证实CoQ10在各种氧化损伤模型中对肾脏具有保护作用[18]。本研究通过体内及体外实验证实:线粒体功能障碍后JLP蛋白、IκB-α表达量明显下降,PINK1蛋白、P-NF-κBp65表达量明显升高;DQ染毒后肾损伤可能与JLP、IκB-α表达量下降和PINK1、P-NF-κBp65的表达量升高有关;予以CoQ10干预后逆转该现象。表明CoQ10对DQ诱导的肾损伤的保护作用与降低氧化应激、减少JLP降解及IκB-α生成及促进恢复PINK1、P-NF-κBp65相关。DQ中毒后通过诱发氧化应激及炎症反应损伤大鼠肾脏,予以CoQ10治疗后起到保护作用,表明CoQ10化合物是治疗DQ中毒后AKI的一种潜在治疗方法。
综上所述,CoQ10可减轻DQ中毒诱导的大鼠肾脏损伤,其机制可能与CoQ10通过抗氧化应激作用,调节IL-17及NF-κB信号通路表达,进一步改善线粒体功能障碍有关。
利益冲突 所有作者声明无利益冲突
作者贡献声明 杨登会:完善论文方向、动物及细胞实验研究及实验数据分析;吴瑾、胡杰、詹江珊:完善实验统计分析;陆安静、赖福平、贾映茂:完善后期论文润色及修改;陆元兰:完善实验指导及论文修改
| [1] | Wu YZ, Cui SQ, Wang WJ, et al. Kidney and lung injury in rats following acute diquat exposure[J]. Exp Ther Med, 2022, 23(4): 275. DOI:10.3892/etm.2022.11201 |
| [2] | Yu GC, Wang JR, Jian TZ, et al. Case series: Diquat poisoning with acute kidney failure, myocardial damage, and rhabdomyolysis[J]. Front Public Health, 2022, 10: 991587. DOI:10.3389/fpubh.2022.991587 |
| [3] | Nisar R, Hanson PS, He L, et al. Diquat causes caspase-independent cell death in SH-SY5Y cells by production of ROS independently of mitochondria[J]. Arch Toxicol, 2015, 89(10): 1811-1825. DOI:10.1007/s00204-015-1453-5 |
| [4] | Park A, Koh HC. NF-κB/mTOR-mediated autophagy can regulate diquat-induced apoptosis[J]. Arch Toxicol, 2019, 93(5): 1239-1253. DOI:10.1007/s00204-019-02424-7 |
| [5] | Cui SQ, Zhang XX, Wang C, et al. Study on the therapeutic effect of glucocorticoids on acute kidney injury in rats exposed to diquat[J]. Biomed Pharmacother, 2023, 166: 115310. DOI:10.1016/j.biopha.2023.115310 |
| [6] | 岑祥莹, 李显, 张炉英, 等. 白细胞介素-17介导核转录因子-κB信号通路在敌草快中毒大鼠急性肾脏损伤中的作用机制[J]. 中国急救医学, 2021, 41(5): 431-437. DOI:10.3969/j.issn.1002-1949.2021.05.012 |
| [7] | Ovchinnikov AN, Paoli A, Seleznev VV, et al. Royal jelly plus coenzyme Q10 supplementation improves high-intensity interval exercise performance via changes in plasmatic and salivary biomarkers of oxidative stress and muscle damage in swimmers: a randomized, double-blind, placebo-controlled pilot trial[J]. J Int Soc Sports Nutr, 2022, 19(1): 239-257. DOI:10.1080/15502783.2022.2086015 |
| [8] | Zhao SK, Wu WZ, Liao J, et al. Molecular mechanisms underlying the renal protective effects of coenzyme Q10 in acute kidney injury[J]. Cell Mol Biol Lett, 2022, 27(1): 57. DOI:10.1186/s11658-022-00361-5 |
| [9] | Yang B, Jain S, Ashra SY, et al. Apoptosis and caspase-3 in long-term renal ischemia/reperfusion injury in rats and divergent effects of immunosuppressants[J]. Transplantation, 2006, 81(10): 1442-1450. DOI:10.1097/01.tp.0000209412.77312.69 |
| [10] | Magalhães N, Carvalho F, Dinis-Oliveira RJ. Human and experimental toxicology of diquat poisoning: Toxicokinetics, mechanisms of toxicity, clinical features, and treatment[J]. Hum Exp Toxicol, 2018, 37(11): 1131-1160. DOI:10.1177/0960327118765330 |
| [11] | Xing JH, Chu Z, Han DF, et al. Lethal diquat poisoning manifesting as central pontine myelinolysis and acute kidney injury: a case report and literature review[J]. J Int Med Res, 2020, 48(7): 300060520943824. DOI:10.1177/0300060520943824 |
| [12] | 李蕙伊, 董雪松. 急性敌草快中毒患者死亡风险列线图预测模型的构建和验证[J]. 中国医科大学学报, 2023, 52(8): 673-679. DOI:10.12007/j.issn.0258-4646.2023.08.001 |
| [13] | Choi SE, Park YS, Koh HC. NF-κB/p53-activated inflammatory response involves in diquat-induced mitochondrial dysfunction and apoptosis[J]. Environ Toxicol, 2018, 33(10): 1005-1018. DOI:10.1002/tox.22552 |
| [14] | Emma F, Montini G, Parikh SM, et al. Mitochondrial dysfunction in inherited renal disease and acute kidney injury[J]. Nat Rev Nephrol, 2016, 12(5): 267-280. DOI:10.1038/nrneph.2015.214 |
| [15] | 陈永平. 基于MKP-1/Nrf2/Drp1信号通路探究辅酶Q10对急性肺损伤小鼠的保护作用[D]. 哈尔滨: 东北农业大学, 2022. DOI: 10.27010/d.cnki.gdbnu.2022.000059. |
| [16] | Wang ZP, Sun XY, Wang WB, et al. NF-κB-coupled IL17 mediates inflammatory signaling and intestinal inflammation in Artemia sinica[J]. Fish Shellfish Immunol, 2022, 128: 38-49. DOI:10.1016/j.fsi.2022.07.035 |
| [17] | 岑祥莹. IL-17介导的NF-κB信号通路在敌草快中毒大鼠肾损伤中的机制初探[D]. 遵义: 遵义医科大学, 2021. DOI: 10.27680/d.cnki.gzyyc.2021.000472. |
| [18] | Al-Harbi NO, Imam F, Al-Harbi MM, et al. Rutin inhibits carfilzomib-induced oxidative stress and inflammation via the NOS-mediated NF-κB signaling pathway[J]. Inflammo-pharmacology, 2019, 27(4): 817-827. DOI:10.1007/s10787-018-0550-5 |
| [19] | Zhang HW, Liu YM, Fang X, et al. Vitamin D3 protects mice from diquat-induced oxidative stress through the NF-κB/Nrf2/HO-1 signaling pathway[J]. Oxid Med Cell Longev, 2021, 2021: 6776956. DOI:10.1155/2021/6776956 |
 2024, Vol. 33
2024, Vol. 33