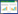2. 绍兴第二医院急诊医学科,绍兴 312000;
3. 广东省急救和生命支持类医疗设备工程技术研究中心,深圳 518000;
4. 宁波市第一医院急诊医学科,宁波 315000;
5. 义乌市中心医院急诊医学科,义乌 322000;
6. 杭州市急救中心,杭州 310003
2. Department of Emergency Medicine, Shaoxing Second Hospital, Shaoxing 312000, China;
3. Guangdong Engineering Research Center of First Aid and Life Support Medical Equipment, Shenzhen 518000, China;
4. Department of Emergency Medicine, Ningbo First Hospital, Ningbo 315000, China;
5. Department of Emergency Medicine, Yiwu Central Hospital, Yiwu 322000, China;
6. Hangzhou First Aid Center, Hangzhou 310003, China
心脏骤停(cardiac arrest, CA)是指各种原因引起心脏泵血功能的突然停止,是全球范围内的重大卫生问题[1]。心肺复苏(cardiopulmonary resuscitation, CPR)作为挽救CA的重要手段,但仅有约10%患者能存活出院[2],而我国的出院存活率只有1.15%[3]。高质量的胸外按压和有效通气是确保患者获得足够血流和氧气供应的关键。传统的呼吸皮囊通气会中断按压、降低胸外按压指数(chest compression fraction, CCF)[4],而间歇正压通气(intermittent positive pressure ventilation, IPPV)容易造成呼吸-按压对抗,难以实现有效通气[5]。临床上常用的双相气道正压(bilevel possitive airway pressure, BIPAP)通气模式及压力控制通气(pressure controlled ventilation, PCV)模式均属于压力控制模式,在CPR期间无法适应快速变化的气道压力,难以保障有效通气量[6]。压力调节容量控制通气模式能改善复苏后氧合[7],但对CPR期间的作用仍未有相关研究。针对上述问题,笔者团队研发新型的按压自主同步通气(automatic compression synchronous ventilation, ACSV)模式,通过通气量精准补给在改进氧供同时克服过度通气,现建立猪CA模型来评价该通气模式对CPR效果的影响。
1 材料与方法 1.1 动物来源与分组健康雄性白猪12头,月龄5~6个月左右,体重(38±3)kg,购自上海甲干生物科技有限公司,生产许可证号:SCXK(沪)2020-0006。标准饲料喂养、自由饮水等适应性饲养一周,以脱离应激期。采用随机数字法将其分为2组:IPPV组(n=6)、ACSV组(n=6)。该实验研究经浙江大学医学院附属第二医院动物伦理委员会审批备案(批准号2022-029)。
1.2 主要仪器与试剂本实验的主要仪器:PMSH-300手持式呼吸末二氧化碳监测仪(苏州贝莱弗医疗科技有限公司),SV300呼吸机(深圳迈瑞生物医疗电子股份有限公司),iM60监护仪和i15血气生化分析仪(深圳市理邦精密仪器股份有限公司),压力监测导管(美国Edwards公司),超声血流监测仪(美国Transonic公司),M Series除颤监护仪(美国ZOLL公司),T7呼吸机和E6心肺复苏机(深圳安保公司)。
本实验的主要试剂:替来他明/唑拉西泮(法国维克有限公司),噻拉嗪(吉林华牧动物保健公司),丙泊酚(中国西安力邦制药有限公司);心肌肌钙蛋白(cardiac troponin I, cTnI)、神经元特异性烯醇化酶(neuron specific enolase, NSE)、丙氨酸氨基转移酶(alamine aminotransferase,ALT)、肌酐(creatinine, Cr)和肠型脂肪酸结合蛋白(intestinal fatty acid binding protein, IFABP)ELISA检测试剂盒(上海美轩生物公司)。血气分析定标液及检测试纸(深圳市理邦精密仪器股份有限公司)。
1.3 实验动物准备白猪经肌肉注射替来他明/唑拉西泮5 mg/kg与噻拉嗪1 mg/kg诱导麻醉后,予丙泊酚2 mg/kg经耳缘静脉实施静脉全麻,此后予丙泊酚4 mg/(kg·h)维持麻醉状态。进行经口气管插管,并连接呼气末二氧化碳(end-respiratory carbon dioxide, ETCO2)监测仪及呼吸机,参数设置为容量控制模式、潮气量10 mL/kg、吸呼比1∶2、氧浓度21%,调节呼吸频率维持初始ETCO2在35~40 mmHg(1 mmHg=0.133 kPa);经体表电极动态监测心电图,尾部接脉氧饱和度监测探头。在直视下切开皮肤,经右侧股动脉置入压力监测导管直至胸主动脉位置,用以连续监测主动脉血压、以及采集CPR期间动脉血标本;经右股静脉置入压力监测导管至右心房,用于监测右心房压;经右颈外静脉置入诱颤电极至右心室,用于诱导CA;使用超声血流探头包绕右侧颈动脉,用以监测颈动脉血流流速(carotid blood flow, CBF)。
1.4 模型制备参照笔者团队的方法制作动物模型[8]。动物妥善固定后,通过诱颤电极释放1 mA交流电至右心室,以诱导心室颤动。诱颤成功标准包括心电图呈室颤波形,动脉血压显著下降、搏动波形消失。在成功诱颤后,即刻脱开呼吸机,不做任何干预处理,并观察6 min,然后开始CPR。
在CPR期间,两组均应用复苏机进行机械胸外按压,参数设置一致,即按压深度5 cm、频率100次/min。另外,ACSV组应用T7呼吸机进行ACSV模式通气,设置参数为潮气量3 mL/kg,按压通气比1∶1,即通气频率100次/min,吸入氧气浓度(fraction of inspiration O2, FIO2)100%。IPPV组应用SV300呼吸机进行IPPV模式通气,参数为潮气量7 mL/kg,频率10次/min,FIO2 100%。
在CPR 8 min时,予以150 J电除颤1次,并判断是否ROSC。ROSC标准为室上性自主心律且平均动脉压≥50 mmHg持续5 min以上。若未能ROSC,则立即重启CPR,2 min后再进行一次除颤及判断,重复此循环≤5次,直至复苏成功或宣告失败。整个CPR过程中未使用肾上腺素或其他药物。复苏成功的动物继续予以机械通气及常规监护治疗,4 h后将猪伤口妥善处理并放置回猪圈继续观察至满24 h。
1.5 观察指标记录每只白猪的基础数据,包括体重、心率(heart rate, HR)、平均动脉压(mean arterial pressure, MAP)、ETCO2、CBF,同时抽取动脉血样用以检测血气分析,获取pH、PaO2、PaCO2、HCO3-、乳酸(lactic acid, Lac)等指标。
于CPR 1、4、7 min时,抽取动脉血样,检测血气分析并获取相应结果。于CPR 8 min内,动态监测并记录每分钟冠脉灌注压(coronary perfusion pressure, CPP)、ETCO2和CBF等血流动力学指标的变化,并记录CPR结局。
于CA前及复苏后1、2和4 h,通过压力监测导管记录每搏输出量(stroke volume, SV)及全心射血分数(global ejection fraction, GEF)。同时,在各时间点及复苏后24 h采集静脉血标本,离心获取上清液,置于-80℃深低温冰箱保存,择期应用ELISA法检测cTnI、NSE、ALT、Cr、iFABP等器官损伤标志物的血清水平。
1.6 统计学方法采用SPSS 25.0软件(美国IBM公司)进行分析。计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验;率的比较采用Fisher精确检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 两组动物的一般生命体征情况两组实验动物的体重、基础的血流动力学指标(HR、MAP、ETCO2、CBF),以及血气分析指标(pH、PaO2、PaCO2、HCO3-、Lac),组间比较均差异无统计学意义(均P > 0.05)。见表 1。
| 指标 | ACSV组(n=6) | IPPV组(n=6) | t值 | P值 |
| 体重(kg) | 38.83±2.32 | 39.33±2.25 | 0.379 | 0.712 |
| 心率(次/min) | 95.83±6.56 | 89.17±9.17 | 1.448 | 0.178 |
| 平均动脉压(mmHg) | 104.33±2.73 | 105.67±2.16 | 0.938 | 0.371 |
| ETCO2(mmHg) | 39.17±1.72 | 37.83±0.98 | 1.647 | 0.131 |
| 颈动脉血流流速(mL/min) | 208.67±9.27 | 205.33±6.22 | 0.732 | 0.481 |
| pH值 | 7.44±0.03 | 7.46±0.04 | 1.474 | 0.171 |
| PaO2(mmHg) | 89.17±11.13 | 86.17±7.11 | 0.557 | 0.590 |
| PaCO2(mmHg) | 42.28±4.38 | 40.53±5.38 | 0.618 | 0.551 |
| HCO3-(mmol/L) | 27.70±1.51 | 29.55±2.45 | 1.576 | 0.146 |
| Lac(mmol/L) | 1.41±0.74 | 1.10±0.37 | 0.933 | 0.373 |
| 注:ETCO2为呼气末二氧化碳,PaO2为动脉血氧分压,PaCO2为动脉二氧化碳分压,HCO3-为碳酸氢根,Lac为乳酸 | ||||
CPR期间,ACSV组CPP、ETCO2、CBF等指标数值均略高于IPPV组,但组间比较差异均无统计学意义(均P > 0.05,图 1)。
|
| CPP为颈动脉血流,ETCO2为呼气末二氧化碳,CBF为冠状动脉灌注压 图 1 两组实验动物复苏期间血流动力学指标的变化情况 Fig 1 Changes in the flow of blood flow dynamics in the two groups of experimental animals |
|
|
ACSV组和IPPV组的pH、PaCO2、HCO3-、Lac等指标比较,组间差异均无统计学意义(均P > 0.05)。然而,ACSV组在CPR期间4 min和7 min时的PaO2均高于IPPV组,组间比较差异有统计学意义(均P < 0.05)。见表 2。
| 时间 | pH值 | PaO2(mmHg) | PaCO2(mmHg) | Lac(mmol/L) |
| BL | ||||
| ACSV组 | 7.44±0.03 | 89.17±11.13 | 42.28±4.38 | 1.41±0.74 |
| IPPV组 | 7.47±0.04 | 86.17±7.11 | 40.53±5.38 | 1.10±0.37 |
| t值 | 1.474 | 0.557 | 0.618 | 0.933 |
| P值 | 0.171 | 0.590 | 0.551 | 0.373 |
| CPR 1 min | ||||
| ACSV组 | 7.37±0.67 | 237.00±115.12 | 42.42±9.41 | 3.16±0.79 |
| IPPV组 | 7.40±0.09 | 148.33±101.37 | 42.55±14.62 | 4.27±1.22 |
| t值 | 0.619 | 1.416 | 0.019 | 1.866 |
| P值 | 0.549 | 0.187 | 0.985 | 0.092 |
| CPR 4 min | ||||
| ACSV组 | 7.29±0.05 | 306.50±132.45 | 48.55±7.01 | 5.02±1.14 |
| IPPV组 | 7.37±0.08 | 120.33±73.36 | 40.60±15.99 | 5.92±1.70 |
| t值 | 2.169 | 3.012 | 1.115 | 1.080 |
| P值 | 0.055 | 0.013 | 0.291 | 0.306 |
| CPR 7 min | ||||
| ACSV组 | 7.26±0.06 | 360.33±109.00 | 48.70±14.34 | 6.48±1.01 |
| IPPV组 | 7.33±0.13 | 97.00±56.94 | 44.28±17.37 | 8.08±2.92 |
| t值 | 1.279 | 5.245 | 0.480 | 1.269 |
| P值 | 0.230 | < 0.001 | 0.641 | 0.233 |
| 注:PaO2为动脉血氧分压,PaCO2为动脉二氧化碳分压,Lac为乳酸,BL为基线,CPR为心肺复苏 | ||||
ACSV组和IPPV组中复苏成功率均为83.3%(5/6),复苏时长均为(9.7±4.1)min,除颤次数均为(1.8±2.0)次,组间比较差异无统计学意义(均P > 0.05)。复苏前后两组间SV及GEF值相近,组间比较差异无统计学意义(均P > 0.05)。见表 3。
| 组别 | BL | 复苏后1 h | 复苏后2 h | 复苏后4 h |
| SV(mL) | ||||
| ACSV组 | 43.4±2.7 | 19.4±2.3 | 25.4±6.0 | 27.8±4.1 |
| IPPV组 | 44.6±3.4 | 18.2±3.0 | 23.2±3.5 | 27.0±3.1 |
| t值 | 0.62 | 0.71 | 0.71 | 0.35 |
| P值 | 0.55 | 0.50 | 0.50 | 0.74 |
| GEF(%) | ||||
| ACSV组 | 34.6±2.3 | 16.8±2.2 | 20.4±3.2 | 23.6±3.8 |
| IPPV组 | 35.4±1.7 | 14.8±4.1 | 18.6±5.1 | 20.8±4.8 |
| t值 | 0.63 | 0.96 | 0.67 | 1.02 |
| P值 | 0.55 | 0.37 | 0.53 | 0.34 |
| 注:BL为基线,CPR为心肺复苏,SV为每搏输出量,GEF为全心射血分数 | ||||
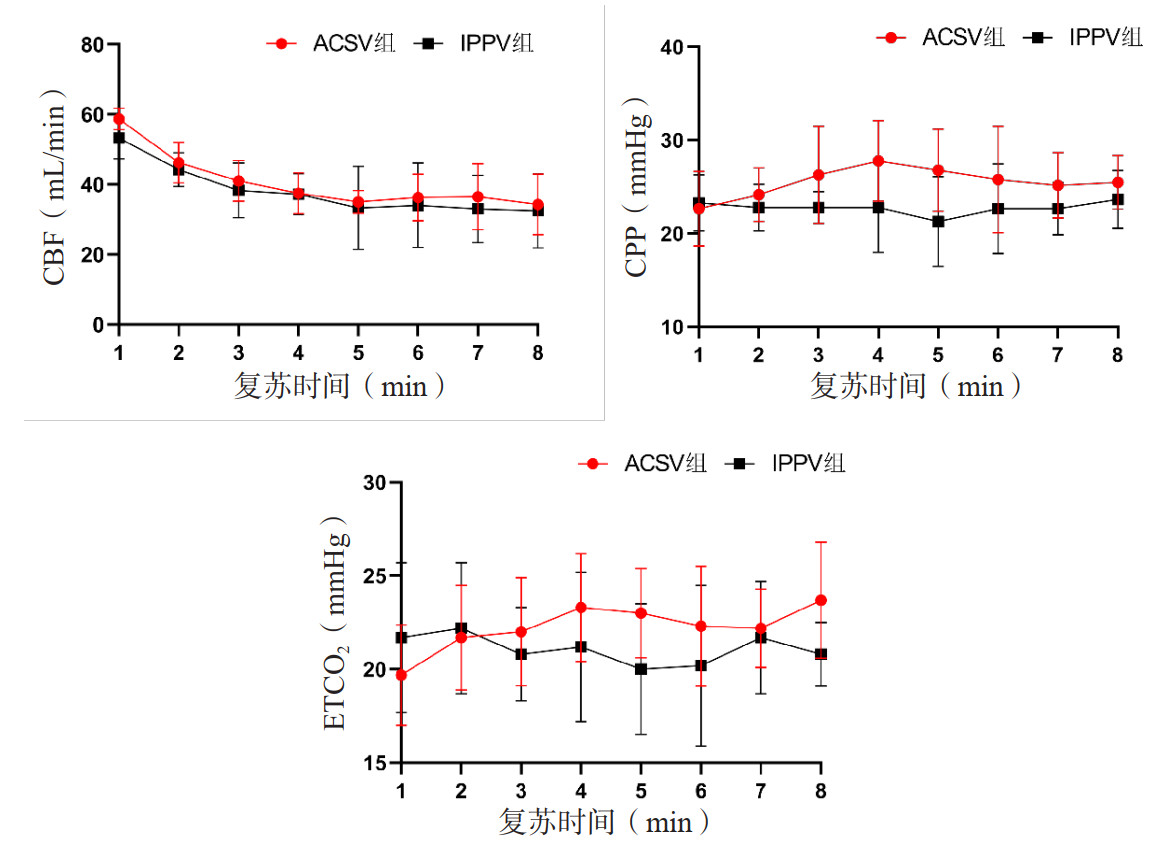
复苏后,ACSV组cTnI、NSE等心脑损伤标志物的血清水平均略低于IPPV组,且cTnI在复苏后24 h时明显降低,组间比较差异有统计学意义(P < 0.05)。见图 2。
|
| BL为基线,NSE为神经元特异性烯醇化酶,cTnI为心肌肌钙蛋白;与IPPV组比较,aP < 0.05 图 2 两组动物复苏后心、脑损伤标志物的变化 Fig 2 Changes of markers of heart and brain injury after resuscitation in two groups of animals |
|
|
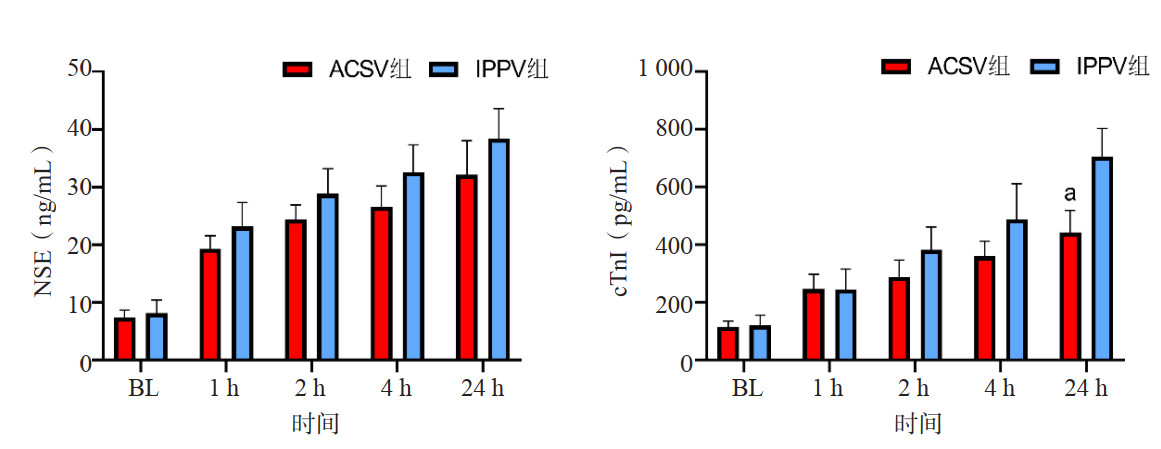
复苏后,ACSV组ALT、Cr、IFABP等肝肾肠损伤标志物的血清水平均略低于IPPV组,且ALT在复苏后2 h和24 h时、IFABP在复苏后4 h和24 h时明显降低,组间比较差异均有统计学意义(均P < 0.05)。见图 3。
|
| BL为基线,ALT为丙氨酸氨基转移酶,Cr为肌酐,IFABP为肠型脂肪酸结合蛋白;与IPPV组相比,bP < 0.05 图 3 两组动物复苏后肝、肾、肠损伤标志物的变化 Fig 3 Changes of markers of liver, kidney and intestinal injury after resuscitation in two groups of animals |
|
|
高质量的胸外按压和有效通气是CPR成功的关键要素。2021年欧洲复苏协会指南建议,在CPR期间能提供正压通气的情况下,应进行不间断的胸外按压,并尽可能提高气道内氧浓度,以最大限度地将氧气输送到大脑,从而最大程度地减少缺氧缺血损伤[9]。当前呼吸机通常选用IPPV模式,在CPR中进行固定频率和潮气量的通气,容易与胸外按压形成通气对抗,导致气通气量无法达标及氧供不足[5]。既往研究提出胸外按压同步通气(chest compression synchronized ventilation, CCSV)模式,并在动物模型上与IPPV及BiPAP模式相比较,结果显示CCSV模式能提高CPR期间血氧分压水平,不影响动脉血压,但由于为压力触发的通气模式,在按压期间胸腔内压力变化较为迅速,易导致通气过度或者不足[10-11]。CCSV通气模式提示在CPR期间进行同步通气及按压的可行性,也存在改进的空间。
针对上述问题,笔者团队选择与人类在解剖结构、生理功能相似的猪作为实验对象[12],开展新型ACSV通气模式在CPR阶段应用的探索。该模式的工作原理为:在CPR前将同一厂家的复苏机及呼吸机通过蓝牙相连接;在CPR过程中,复苏机对按压对象进行持续胸外心脏按压,在每次胸廓回弹时,复苏机通过无线方式向呼吸机发送通气指令,呼吸机立即进行一次短促的小潮气量压力支持通气;当复苏机按下胸廓时,会通知呼吸机打开呼气阀让气体呼出(图 4)。相较于传统的IPPV模式,ACSV模式与按压同步,能够确保每次通气的潮气量及每次按压的效率,并且本模式选择在回弹阶段根据目标通气量自动调整通气压力,以确保通气量稳定的同时维持气道内压力的相对稳定;此外,在按压初始阶段关闭气阀,以增强胸部按压时产生的胸内压,从而确保冠脉灌注。ACSV模式在初始调整完成后能在整个CPR过程中保持胸腔内压力变化相对稳定的状态(图 5)。因此,该模式相较于IPPV模式可以获得更佳的气体交换效果和良好的按压效果。
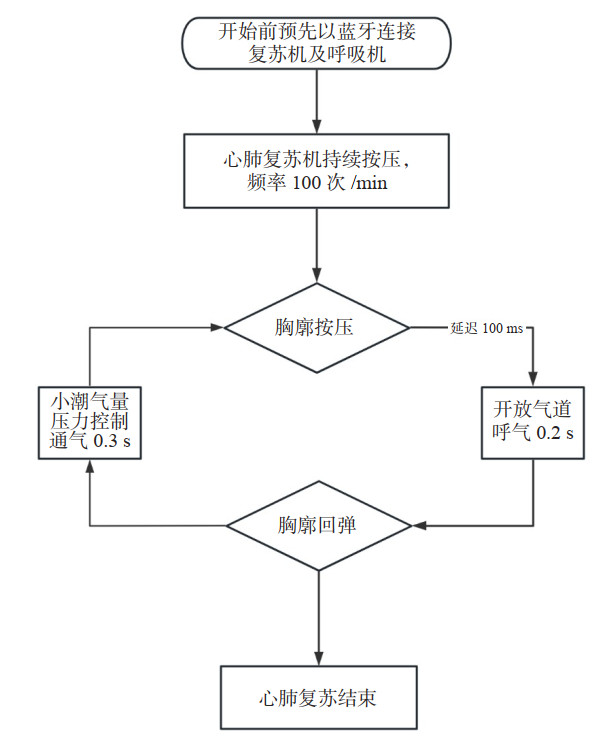
|
| 图 4 ACSV工作流程图 Fig 4 ACSV working flow chart |
|
|
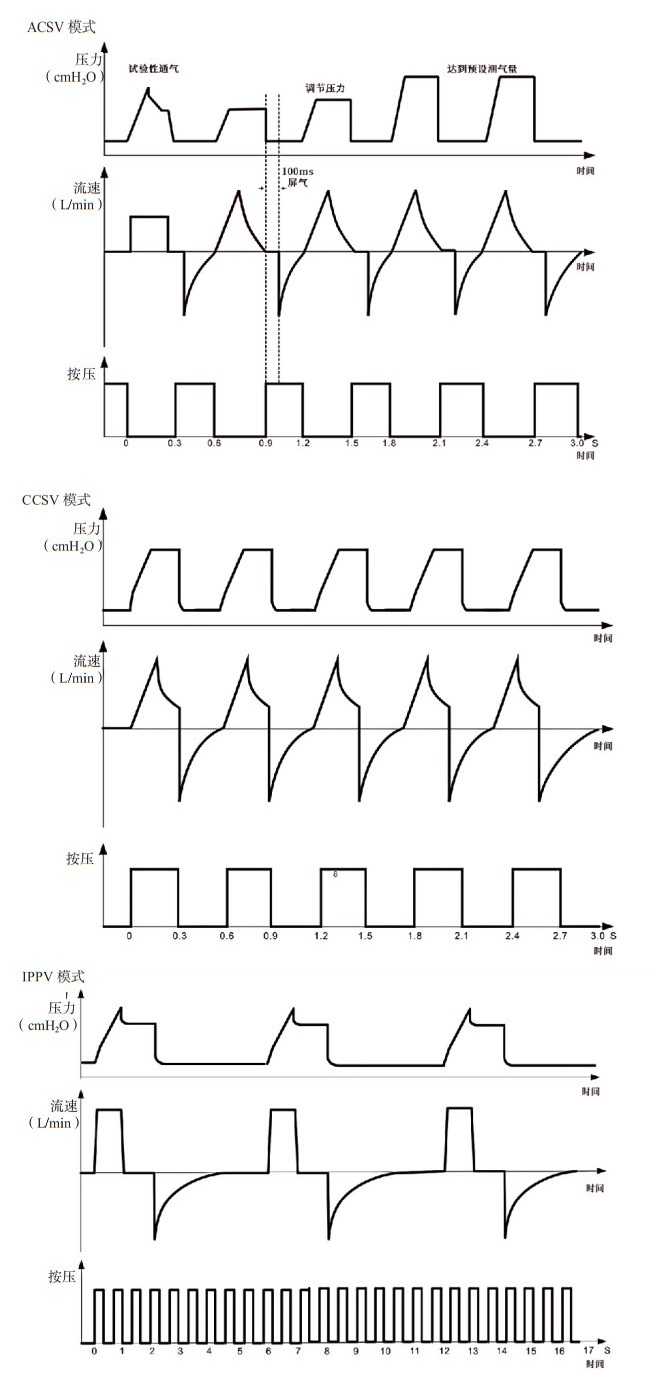
|
| (1)ACSV模式工作流程,按压开始第一个周期通过一次恒流量容量控制通气计算患者肺部顺应性阻力参数,用于确定后续通气起始控制压力;第二个周期开始进入压力调节容量控制阶段,通过潮气量监测反馈,反复调节压力控制目标值,最终以压力控制的形式达到预设的目标潮气量;(2)CCSV模式工作流程,按压开始呼吸机根据按压状态同步进行通气,通气模式为固定的目标压力的压力支持通气;(3)IPPV模式工作流程,呼吸机按照预设的通气参数持续通气,通气时按压与通气过程不同步 图 5 三种呼吸机模式工作对比图 Fig 5 Comparison of operation of three ventilator modes |
|
|
在CPR期间潮气量的选择方面,团队在预实验阶段尝试了不同的通气量,包括1、2和3 mL/kg。然而,结果显示使用1、2 mL/kg通气量无法有效提高动脉血氧饱和度,并且导致实验猪ROSC率较低。研究表明,在气管导管内持续通气12 L/min条件下,可产生约10 cmH2O(1 cmH2O=0.098 kPa)的气道内正压,从而能够维持动脉中的氧分压[13]。因此,本研究最终选择3 mL/kg的小潮气量,以达到12 L/min的通气量,并预期避免过度通气。而对于送气时机选择,团队尝试采用CCSV模式进行通气支持,在按压阶段给予40 cmH2O通气压力。然而,本团队观察到超过半数实验猪在按压开始不久即出现了气道出血情况。研究表明,送气压力与胸廓按压所产生的气道内正压对冲会导致气道内瞬时高压,超过呼吸机高压报警上限,从而引发气压伤,并提前开启气阀,导致潮气量不足[14]。因此,本模式采用回弹阶段进行送气,并在按压初始阶段进行短暂的屏气。结果显示,ACSV组在整个CPR过程中PaO2水平明显高于IPPV组,且随着CPR时间增加,两组间差异更加明显;另外,两组间PaCO2、HCO3-、乳酸等指标相近,且PaCO2维持在正常上限水平,因而提示在CPR期间,ACSV模式能显著提高PaO2水平,同时避免过度通气的发生。目前临床上已有部分便携式呼吸机配备了参数调节功能,然而在CPR期间快速压力变化的识别能力仍存在不足,应用小潮气量通气容易导致通气不充分,因此需要进一步提高呼吸机感应设备的灵敏度以满足临床需求。
胸外按压作为CPR成功的关键之一,其质量往往受操作者技能和体力等因素的影响,难以保证[15]。现有最佳按压仅能产生正常心脏输出量的35%左右,而按压期间因各种因素中断按压,进一步减少了CPR期间全身血液供应。2015年国际心肺复苏和心血管急救指南首次强调了CCF值的重要性,并建议目标比例不低于60%[16]。研究显示随着CCF值的增加,复苏成功率也相应提高,并且当CCF值达到80%~100%时,ROSC率最高[17]。本实验中两组动物均采取持续按压模式,按压频率达100次/min以上,CCF值基本达到了100%。因此,在复苏期间,两组动物血流灌注情况相似,包括CPP、CBF及ETCO2值均接近,其中ACSV组各项指标略有增高趋势。复苏结局方面,两组复苏的成功率均为83.3%,复苏时间、除颤次数基本相近,并且SV及GEF值也基本相近。由此提示,CPR期间在充分按压的情况下,ACSV模式对血流动力学的改善力度有限。鉴于当前大多数CPR机器均配备持续按压模式,因此在临床实践中可以广泛推广持续按压技术。
CA复苏之后的全身性缺血-再灌注将启动一系列病理损伤途径,诱导细胞程序性死亡,引起复苏后心、肝、脑、肾等多器官损伤[18-19]。而复苏的目标是在提高复苏成功率的同时,进一步改善患者复苏后的多器官功能与生存质量[20-22]。研究表明,随着CPR期间PaO2逐步升高,患者的生存率及脏器功能恢复率也相应提高[23]。cTnI及NSE是临床上常用的用于评估心脑损伤的指标[24-25],而ALT、Cr及IFABP则是经典的用于判断肝脏、肾脏和肠道损伤的生物标志物[26-28]。本研究中观察到ACSV组在ROSC后,cTnI、NSE、ALT、Cr、IFABP等指标的血清水平均略低于IPPV组。具体而言,cTnI在ROSC后24 h、ALT在ROSC后2 h和24 h以及IFABP在ROSC后4 h和24 h均呈明显降低。示在CPR期间应用ACSV模式能通过改善氧合状态,从而减轻ROSC后多脏器的损伤程度。
本研究有一些局限性。首先,实验中使用的模型过于单一,没有充分考虑不同情况或不同模型下的效果,无法确定本实验方法在其他损伤程度模型的效果是否一致。其次,本研究未监测呼吸力学参数,无法全面分析ACSV模式对呼吸力学的影响,未阐明最佳的潮气量选择策略。第三,没有直接和CCSV模式进行比较。以上问题都有待在后续进一步的研究中明确。
综上所述,本研究初步提示新型的ACSV能显著提高猪心肺复苏期间的氧供水平,同时保持按压效率不受影响,避免过度通气,并且能减轻复苏后多器官的损伤,值得进一步研究。
利益冲突 所有作者声明无利益冲突
作者贡献声明 曹光立、王旭光、葛风、朱锦江、周梅亚、徐杰丰:实验操作;曹光立、高贵锋:论文撰写、数据收集及整理、统计学分析;张茂、王双卫:研究设计、论文修改
| [1] | 吴黎明. 高质量心肺复苏: 探索与挑战[J]. 中华危重病急救医学, 2013, 25(11): 642-645. DOI:10.3760/cma.j.issn.2095-4352.2012.11.002 |
| [2] | Genbrugge C, Eertmans W, Salcido DD. Monitor the quality of cardiopulmonary resuscitation in 2020[J]. Curr Opin Crit Care, 2020, 26(3): 219-227. DOI:10.1097/MCC.0000000000000726 |
| [3] | Xie X, Zheng JQ, Zheng W, et al. Efforts to improve survival outcomes of out-of-hospital cardiac arrest in China: basic-OHCA[J]. Circ Cardiovasc Qual Outcomes, 2023, 16(2): e008856. DOI:10.1161/circoutcomes.121.008856 |
| [4] | Jabre P, Penaloza A, Pinero D, et al. Effect of bag-mask ventilation vs endotracheal intubation during cardiopulmonary resuscitation on neurological outcome after out-of-hospital cardiorespiratory arrest: a randomized clinical trial[J]. JAMA, 2018, 319(8): 779-787. DOI:10.1001/jama.2018.0156 |
| [5] | Ruemmler R, Ziebart A, Moellmann C, et al. Ultra-low tidal volume ventilation-a novel and effective ventilation strategy during experimental cardiopulmonary resuscitation[J]. Resuscitation, 2018, 132: 56-62. DOI:10.1016/j.resuscitation.2018.08.031 |
| [6] | 文才, 余涛, 王立祥. 心肺复苏过程中机械通气策略研究进展[J]. 中华危重病急救医学, 2017, 29(09): 853-856. DOI:10.3760/cma.j.issn.2095-4352.2017.09.018 |
| [7] | 庄载受, 梁艳, 薛盛东, 等. 压力调节容量控制通气模式在心肺复苏中的临床疗效观察[J]. 中华重症医学电子杂志, 2017, 3(1): 55-59. DOI:10.3877/cma.j.issn.2096-1537.2017.01.012 |
| [8] | Xu JF, Zhao X, Jiang XK, et al. Tubastatin A improves post-resuscitation myocardial dysfunction by inhibiting NLRP3-mediated pyroptosis through enhancing transcription factor EB signaling[J]. J Am Heart Assoc, 2022, 11(7): e024205. DOI:10.1161/JAHA.121.024205 |
| [9] | Soar J, Böttiger BW, Carli P, et al. European Resuscitation Council Guidelines 2021: Adult advanced life support[J]. Resuscitation, 2021, 161: 115-151. DOI:10.1016/j.resuscitation.2021.02.010 |
| [10] | Kill C, Galbas M, Neuhaus C, et al. Chest compression synchronized ventilation versus intermitted positive pressure ventilation during cardiopulmonary resuscitation in a pig model[J]. PLoS One, 2015, 10(5): e0127759. DOI:10.1371/journal.pone.0127759 |
| [11] | Speer T, Dersch W, Kleine B, et al. Mechanical ventilation during resuscitation: how manual chest compressions affect a ventilator's function[J]. Adv Ther, 2017, 34(10): 2333-2344. DOI:10.1007/s12325-017-0615-7 |
| [12] | Idris AHAH, Becker LANB, Ornato JP, et al. Utstein-style guidelines for uniform reporting of laboratory CPR research[J]. Resuscitation, 1996, 33(1): 69-84. DOI:10.1016/s0300-9572(96)01055-6 |
| [13] | Brochard L, Mion G, Isabey D, et al. Constant-flow insufflation prevents arterial oxygen desaturation during endotracheal suctioning[J]. Am Rev Respir Dis, 1991, 144(2): 395-400. DOI:10.1164/ajrccm/144.2.395 |
| [14] | 田昕, 方伟钧, 吴建荣. 心肺复苏机械通气时选择不同流速模式对气道峰压的影响[J]. 中华危重病急救医学, 2014(10): 722-725. DOI:10.3760/cma.j.issn.2095-4352.2014.10.009 |
| [15] | Heidenreich JW, Bonner A, Sanders AB. Rescuer fatigue in the elderly: standard vs. hands-only CPR[J]. J Emerg Med, 2012, 42(1): 88-92. DOI:10.1016/j.jemermed.2010.05.019 |
| [16] | Nolan JP, Hazinski MF, Aickin R, et al. Part 1: executive summary: 2015 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations[J]. Resuscitation, 2015, 95: e1-31. DOI:10.1016/j.resuscitation.2015.07.039 |
| [17] | Christenson J, Andrusiek D, Everson-Stewart S, et al. Chest compression fraction determines survival in patients with out-of-hospital ventricular fibrillation[J]. Circulation, 2009, 120(13): 1241-1247. DOI:10.1161/CIRCULATIONAHA.109.852202 |
| [18] | Burstein B, Jentzer JC. Comprehensive cardiac care after cardiac arrest[J]. Crit Care Clin, 2020, 36(4): 771-786. DOI:10.1016/j.ccc.2020.07.007 |
| [19] | Perkins GD, Callaway CW, Haywood K, et al. Brain injury after cardiac arrest[J]. Lancet, 2021, 398(10307): 1269-1278. DOI:10.1016/S0140-6736(21)00953-3 |
| [20] | Cronberg T. Neuroprognostication of cardiac arrest patients: outcomes of importance[J]. Semin Respir Crit Care Med, 2017, 38(6): 775-784. DOI:10.1055/s-0037-1607988 |
| [21] | Henson T, Rawanduzy C, Salazar M, et al. Outcome and prognostication after cardiac arrest[J]. Ann N Y Acad Sci, 2022, 1508(1): 23-34. DOI:10.1111/nyas.14699 |
| [22] | Dichtwald S, Matot I, Einav S. Improving the outcome of in-hospital cardiac arrest: the importance of being EARNEST[J]. Semin Cardiothorac Vasc Anesth, 2009, 13(1): 19-30. DOI:10.1177/1089253209332212 |
| [23] | Izawa J, Komukai S, Nishioka N, et al. Outcomes associated with intra-arrest hyperoxaemia in out-of-hospital cardiac arrest: a registry-based cohort study[J]. Resuscitation, 2022, 181: 173-181. DOI:10.1016/j.resuscitation.2022.11.008 |
| [24] | Kehl DW, Iqbal N, Fard A, et al. Biomarkers in acute myocardial injury[J]. Transl Res, 2012, 159(4): 252-264. DOI:10.1016/j.trsl.2011.11.002 |
| [25] | Arnason S, Molewijk K, Henningsson AJ, et al. Brain damage markers neuron-specific enolase (NSE) and S100B in serum in children with Lyme neuroborreliosis-detection and evaluation as prognostic biomarkers for clinical outcome[J]. Eur J Clin Microbiol Infect Dis, 2022, 41(7): 1051-1057. DOI:10.1007/s10096-022-04460-1 |
| [26] | Tamber SS, Bansal P, Sharma S, et al. Biomarkers of liver diseases[J]. Mol Biol Rep, 2023, 50(9): 7815-7823. DOI:10.1007/s11033-023-08666-0 |
| [27] | Yoon SY, Kim JS, Jeong KH, et al. Acute kidney injury: biomarker-guided diagnosis and management[J]. Medicina (Kaunas), 2022, 58(3): 340. DOI:10.3390/medicina58030340 |
| [28] | Blaser A, Padar M, Tang J, et al. Citrulline and intestinal fatty acid-binding protein as biomarkers for gastrointestinal dysfunction in the critically ill[J]. Anaesthesiol Intensive Ther, 2019, 51(3): 230-239. DOI:10.5114/ait.2019.86049 |
 2024, Vol. 33
2024, Vol. 33