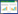脓毒症是由宿主感染引起的危及生命的器官功能障碍,发展至脓毒性休克时,其病死率高达35%~40%[1]。全球每年新发脓毒症4 890万例[2]。脓毒症合并急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)的病死率为27%~37%[3]。脓毒症时肠道屏障功能被破坏,有益菌群及其代谢产物减少,从而损害宿主的免疫细胞功能,而肠道微生物群紊乱可加剧脓毒症相关急性肺损伤(sepsis-induced acute lung injury, SALI)[4]。目前SALI尚无有效的治疗手段。
二甲双胍是临床一线口服抗糖尿病药物,具有很好的降低血糖的作用[5]。对二甲双胍的深入研究表明,它还可抑制炎症介质的表达,具有抗肿瘤、抗衰老的作用。有趣的是,二甲双胍和西维来司他一样可显著改善脓毒症相关脏器损伤[6-7]。此外,二甲双胍还可通过调节肠道微生物群,改善老年肥胖小鼠的代谢和肠道损伤[8],并增加产生粘蛋白的杯状细胞数量,从而改善肠道屏障的功能。此外,有研究表明二甲双胍可抑制细胞凋亡,改善脓毒症相关的脑损伤[9]。本研究探讨了二甲双胍对老年脓毒症大鼠肺脏炎症介质的表达和肠道代谢物的影响,以确定二甲双胍是否是SALI潜在的有效的治疗方法,并为后续研究提供理论基础。
1 材料与方法 1.1 动物饲养与分组24只6~8周的SD大鼠饲养至20~21个月时,剩余14只。所有大鼠均被饲养在郑州大学SPF级动物实验中心。动物实验按照动物实验的伦理标准(2022-KY-0215)进行。在控制的实验室条件下(12 h光/暗循环)给大鼠喂食标准饮食。将14只20~21个月的SD大鼠随机均分为三组:假手术组(age-Sham, AgS组,n=4)、盲肠结扎穿孔诱导脓毒症组(age-Cecal ligation and puncture, AgCLP组,n=5)、AgCLP处理1 h后二甲双胍(100 mg/kg)经灌胃处理组(age-Metformin, AgMET组,n=5)。
1.2 CLP诱导脓毒症模型手术前测量大鼠体温、体重,使用腹腔注射水合氯醛(10%,3~4 mL/kg)进行麻醉。剃除剑突至耻骨联合中间区域毛发,剃毛宽度要达到腹侧,充分暴露手术区域,并用碘伏对该区域进行2~3次消毒。采用刀片沿腹正中线切开皮肤层,筋膜和肌肉层2~3 cm左右长度的切口。盲肠一般位于腹部的左侧,分离盲肠并将其取出腹腔,在盲肠穿孔前,将盲肠内容物轻轻推向远端盲肠,在结扎处和盲肠游离端之间的1/2处,用21号针单次贯穿性穿刺盲肠,并轻轻挤出少量的粪便。将盲肠回纳原位,使用间断缝合或连续缝合法缝合手术切口。切口闭合后,大鼠皮下注射37 ℃的生理盐水(1 mL/100 g),将其在37 ℃恒温垫上维持体温,直至其苏醒后再送回笼内。AgS组行剖腹手术,但盲肠未结扎和穿刺,其余步骤与AgCLP组相同。AgMET组在AgCLP组的基础上于CLP处理1 h后(复苏后)采用二甲双胍灌胃治疗一次(100 mg/kg)。CLP术后24 h,AgCLP组炎症反应,组织病理损伤与假手术组对比更严重,证明造模成功。24 h后收集肺与粪便,组织保存在-80 ℃冰箱中。
1.3 RT-qPCR实验使用TRIzol试剂(Takara,东京,日本)提取肺的mRNA。使用TaqMan逆转录试剂盒(UE,苏州,中国)将mRNA逆转录为cDNA。RT-qPCR采用qPCR superMIX(Yeasen,上海,中国)进行。结果采用2-ΔΔCT方法进行分析。AgS组基因表达量设为100%。内参采用还原甘油醛-磷酸脱氢酶(Glyceraldehyde -3-phosphate dehydrogenase, GAPDH)。见表 1。
| 基因 | 引物序列 | 产物 |
| CCL4 | 正向引物:5’-cgtgtctgccttctctctcc-3’ | 212 bp |
| 反向引物:5’-gcacagatttgcctgccttt-3’ | ||
| IL-6 | 正向引物:5’-ttgttgacagccactgcctt-3’ | 507 bp |
| 反向引物:5’-tggtccttagccactccttct-3’ | ||
| TNF-α | 正向引物:5’-gaggcgctccccaaaaagat-3’ | 573 bp |
| 反向引物:5’-tctccagctggaagactcct-3’ | ||
| CXCL1 | 正向引物:5’-cagacagtggcagggattca-3’ | 114 bp |
| 反向引物:5’-aagcctcgcgaccattcttg-3’ | ||
| GAPDH | 正向引物:5’-gaaggtcggtgtgaacggat-3’ | 534 bp |
| 反向引物:5’-agtgatggcatggactgtgg-3’ | ||
| 注:CCL4为趋化因子配体4,IL-6为白细胞介素-6,TNF-α为肿瘤坏死因子-α,CXCL1为趋化因子(C-X-C基序)配体1,GAPDH为甘油醛-磷酸脱氢酶 | ||
采用苏木精-伊红(Hematoxylin-eosin staining, H & E)染色法分析脓毒性大鼠肺组织病理学特征。肺损伤根据先前报道的标准[10]进行评分,采用5分评分;0:最小(小)损伤;1+:轻度损伤;2+:中度损伤;3+:严重损伤;4+:最大损伤。积分相加,以损伤评分的平均值±标准差表示。最高分16分。
使用原位末端转移酶标记技术(Terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling assay, TUNEL assay)和荧光显微镜测定凋亡细胞的比例。切片于荧光显微镜下观察并采集图像。
1.5 采用非靶向代谢组学测粪便代谢物使用液相色谱-串联质谱法进行非靶向代谢组学研究。粪便样本用Q Exactive质谱仪进行分析(Thermo Scientific公司)。实验方法如下:向粪便样品中加入1/10(w/v)的80%预冷甲醇溶液;室温条件下震荡混匀10 min后,放置-20℃冰箱静置30 min;将样品14 000 g,4℃离心15 min,离心后,转移上清液到质谱上样瓶中;QC样品制备:分别从每个样品中取等体积上清液,混匀离心后,转入质谱上样瓶中。色谱条件色谱柱:Atlantis PREMIER BEH C18 AX VanGuard FIT Column,柱温:35 ℃,流动相A:10 mA甲酸铵,流动相B:10 mA甲酸铵、90%乙腈。质谱条件扫描范围选择m/z 70~1 050;ESI源的设置如下:Spray Voltage:3.5 kV(+)、3.2 kV(-);Sheath gas flow rate:40 arb;Aux Gasflow rate:10 arb;Capillary Temp:350 ℃;Polarity:positive;negative;MS/MS二级扫描为data-dependent scans。
1.6 统计学方法两组间(AgS vs. AgCLP,AgCLP vs. AgMET)的代谢物差异,差异代谢物的变化趋势和各组间代谢变化的可视化分别用正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis, OPLS-DA),热图和非监督的主成分分析(principal components analysis, PCA)来展示。代谢物的通路分析使用MetaboAnalyst 3.0(http://www.metaboanalyst.ca/),该软件基于KEGG数据库(http://www.genome.jp/kegg/)和人类代谢组数据库(https://hmdb.ca/)。数据的分析采用单因素方差分析和Tukey’s事后检验(GraphPad Prism7.0)。
2 结果 2.1 二甲双胍治疗对SALI大鼠炎症反应的影响大鼠肺组织中的CCL4(F=203.00,P < 0.001)、CXCL1(F=65.69,P < 0.001)、IL-6(F=38.94,P < 0.002)、TNF-α(F=14.85,P=0.005)的表达量在两组间比较(AgS vs. AgCLP,AgCLP vs. AgMET)均差异有统计学意义。AgCLP组肺组织的炎症因子(CCL4、CXCL1、IL-6、TNF-α)表达水平与AgS组比较明显增加;而二甲双胍治疗后,与AgCLP组比较炎症因子水平明显降低(图 1)。然而,CCL2在AgCLP组和AgMET组间差异无统计学意义。上述结果提示,二甲双胍对SALI大鼠肺组织的炎症反应具有保护作用。
|
| A、B、C、D:分别为TNFα、IL-6、CXCL1、CCL4在三组中的相对浓度;与AgS比较,a P < 0.05;与AgCLP比较,b P < 0.05 图 1 二甲双胍对SALI大鼠肺组织炎症因子表达的影响 Fig 1 Effect of metformin on the expression of inflammatory factors in lung tissue of SALI rats |
|
|
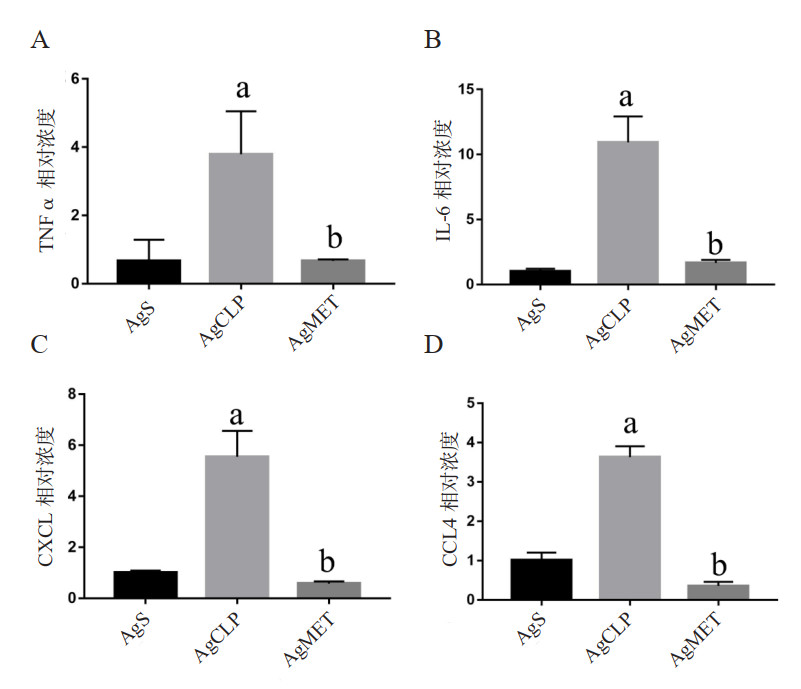
H & E结果显示,AgS组肺部未见明显的病理学改变。然而,AgCLP组可见明显的肺损伤,表现为肺泡出血,肺泡壁明显肿胀;而二甲双胍干预后可逆转上述过程(图 2A、B)。TUNEL试验检测结果显示,AgS组肺组织未见明显的细胞凋亡,AgCLP组肺部的细胞凋亡数量明显增加;而二甲双胍治疗后上述变化得到了明显的改善(图 2C、D)。
|
| A:从左到右分别为AgS组,AgCLP组和AgMET组H & E染色结果。B:与AgS比较,a P < 0.05;与AgCLP比较,b P < 0.05。C:从左到右三列分别为AgS组,AgCLP组和AgMET组TUNEL检测结果。D:与AgS比较,a P < 0.05;与AgCLP比较,b P < 0.05 图 2 二甲双胍对SALI大鼠肺组织病理学改变的影响 Fig 2 Effect of metformin on lung histopathological changes in SALI rats |
|
|
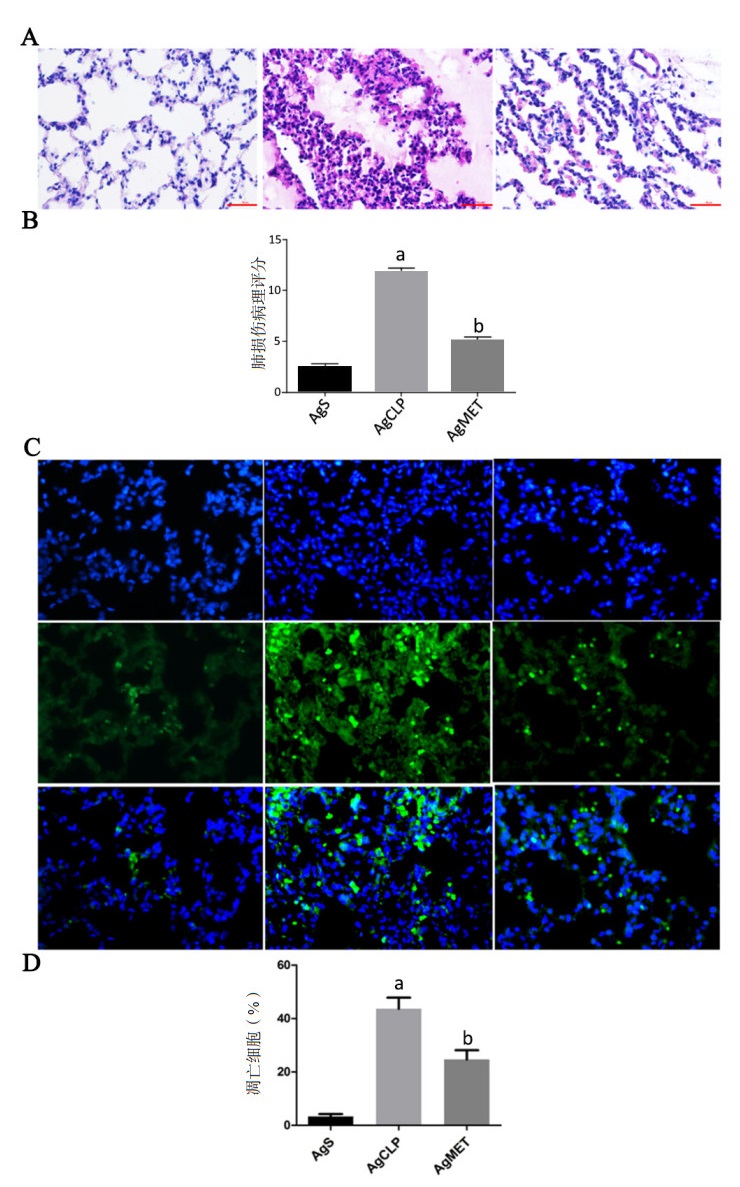
通过上述的液相色谱-串联质谱法采用ESI+和ESI-两种模式分析三组样本,去除代表内标物的峰和任何已知假阳性峰后,在UPLC-Q-TOF/MS的正离子和负离子模式中得到的AgS组,AgCLP组和AgMET组各组总离子流图(图 3),其中正离子模式的原始数据经质控过滤后数目为20 841个,负离子模式的原始数据质控过滤后数目为10 356个。
|
| A、B、C:分别是AgS、AgCLP、AgMET组的粪便代谢物正离子流图;D、E、F:分别是AgS、AgCLP、AgMET组的粪便代谢物负离子流图 图 3 大鼠粪便代谢物典型的GC-MS正离子和负离子流图 Fig 3 Typical GC-MS positive and negative ion chromatogram of rat fecal metabolites |
|
|
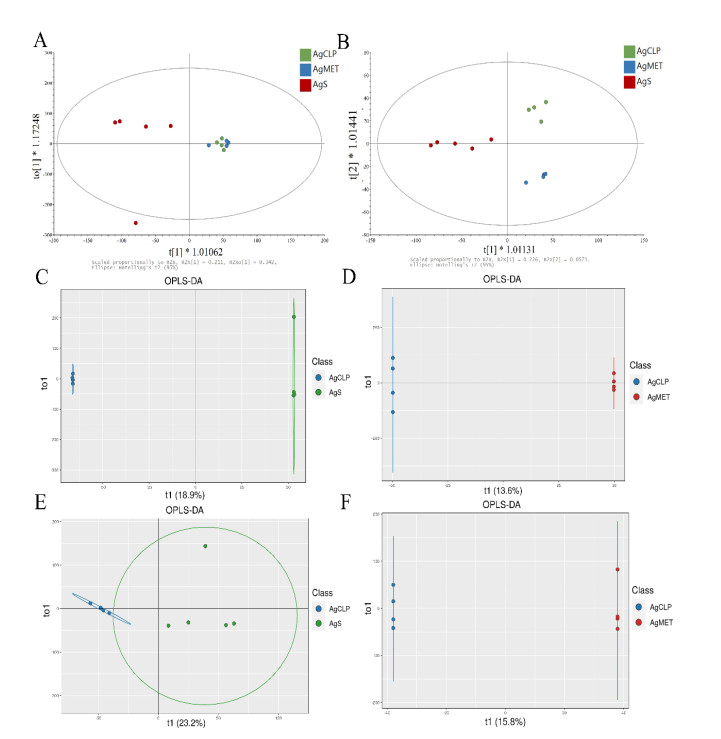
此外,PCA图展示AgS组,AgCLP组和AgMET组三组样本代谢物的总体分布情况。图 4A表示正离子模式下检测的PCA得分散点图,可见AgS组和AgCLP组相距较近,与AgMET组明显分离。图 4B表示负离子模式下检测的PCA得分散点图,可见AgS组,AgCLP组和AgMET组均明显分离。质量控制样本均聚集良好,表明仪器在检测分析中稳定,样本具有明显差异。此外,使用R语言对AgS和AgCLP、AgCLP和AgMET进行OPLS-DA,其判别能力优于PCA。AgS组和AgCLP组,AgCLP组和AgMET组可根据代谢差异分为不同的群,且区分显著。图 4C、D表示正离子模式下的OPLS-DA模型,图 4E、F表示负离子模式下的OPLS-DA模型,模型显示两样本之间存在显著差异,不存在过拟合现象,稳健性良好。可以进一步寻找差异代谢物。
|
| PCA得分散点图:正离子模式(A),负离子模式(B);阳离子模式下的OPLS-DA模型图:正离子模式(C和D),负离子模式(E和F) 图 4 大鼠粪便样本的PCA得分图和OPLS-DA模型 Fig 4 PCA score map and OPLS-DA model of rat stool samples |
|
|
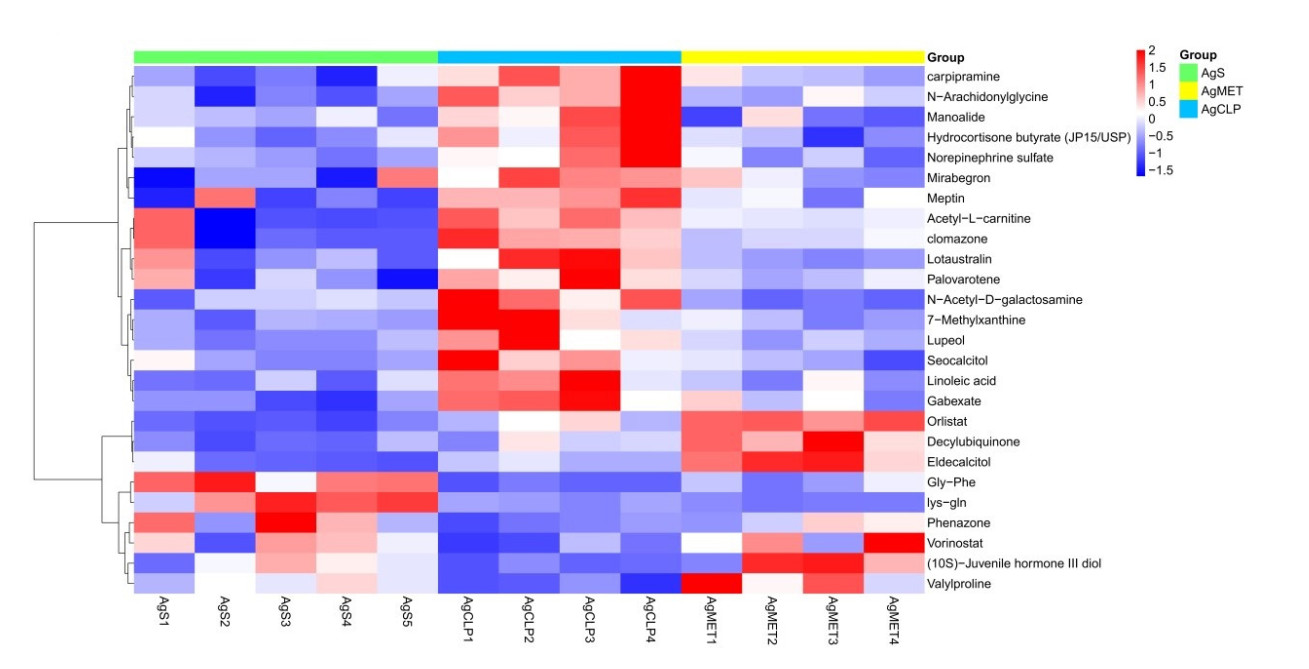
使用多元变量统计分析筛选老年SALI大鼠粪便差异代谢物(VIP > 1和P < 0.05)。对AgS和AgCLP、AgCLP和AgMET的共同差异代谢物进行筛选,代谢物对组间差异的贡献度越大,其VIP值也越大。当VIP值> 1,及P值< 0.05的条件下,筛选并鉴别出26个共同差异代谢物并以热图进行展示(图 5)。
|
| 26种差异代谢物在三组中表达量的热图(Heatmap),暖色表示数值大,冷色表示数值小AgS组、 图 5 AgCLP组、AgMET组三组共有差异代谢物的热图 Fig 5 The heatmap of of common differential metabolites in AgS group, AgCLP group and AgMET group |
|
|
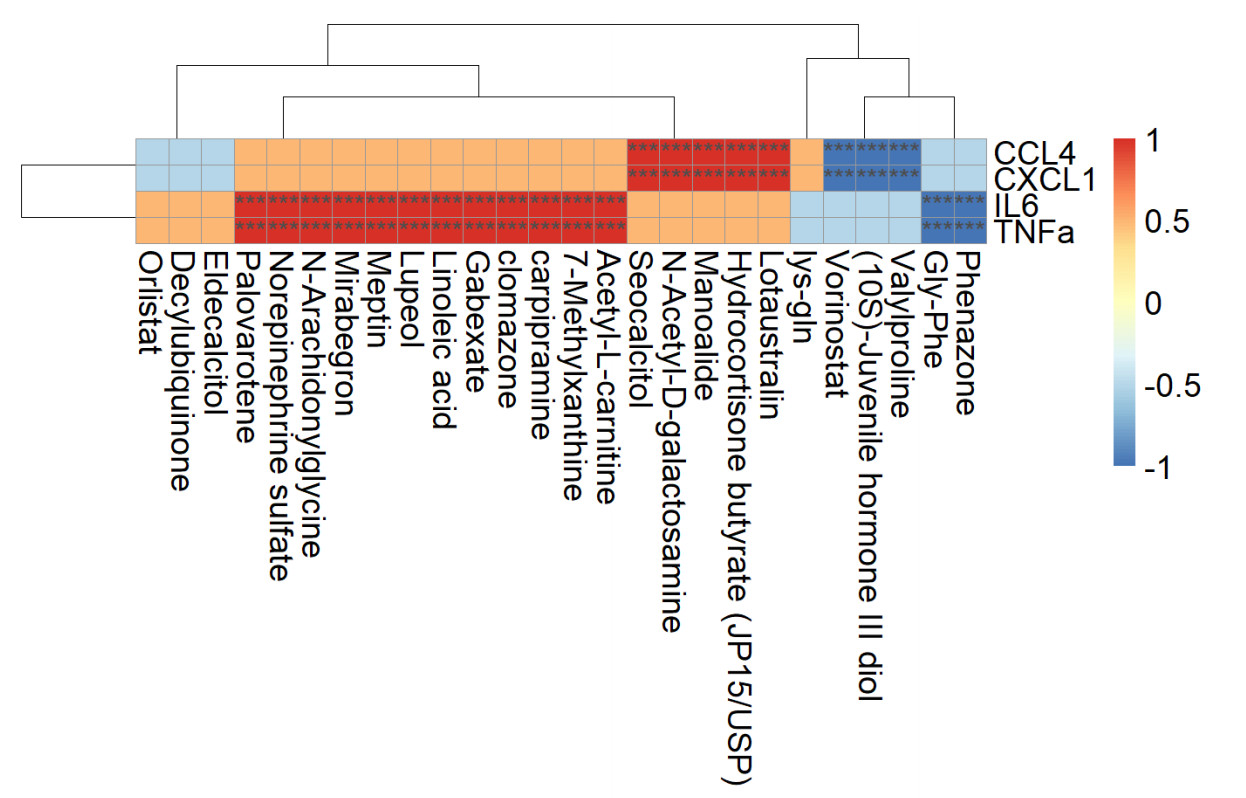
本研究探究了肠道差异代谢物与炎症因子之间的相关性,结果显示炎症因子TNF-α、IL-6与差异代谢物Gly-Phe、安替比林呈负相关关系,而与7-甲基黄嘌呤、乙酰左旋肉碱、卡比咪嗪、异噁草松、加贝酯、亚油酸、羽扇豆醇、瘦素、米拉贝隆、N-花生四烯酰基甘氨酸、硫酸去甲肾上腺素、帕罗伐汀呈正相关关系。趋化因子CCL4和CXCL1与保幼激素3、Valylproline、伏立诺他呈负相关关系,而与丁酸氢化可的松、N乙酰-D-半乳糖胺、西奥骨化醇、Manoalide、百脉根苷呈正相关关系(图 6)。
|
| 图 6 老年SALI大鼠的炎症因子和趋化因子与差异代谢物的相关性分析 |
|
|
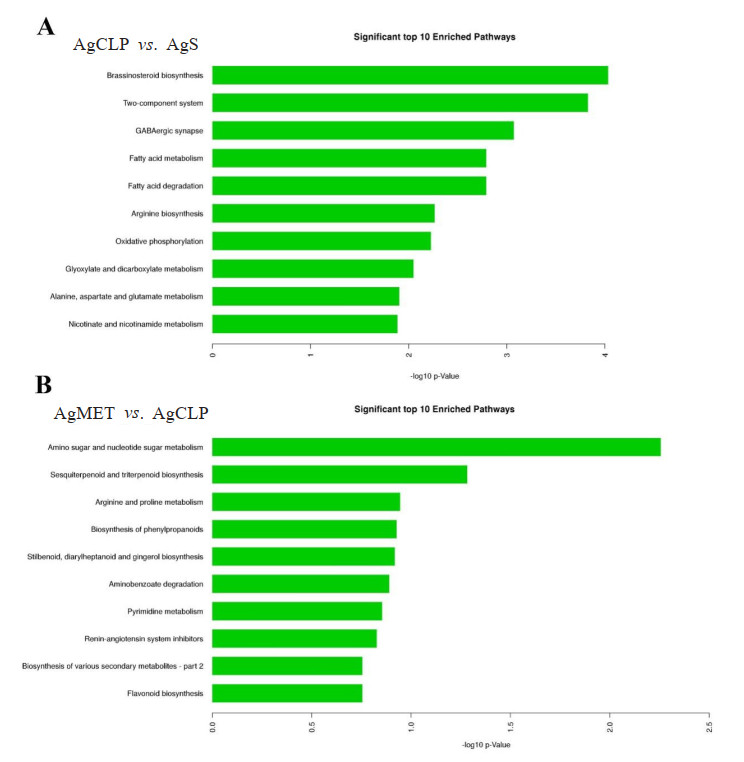
使用MetaboAnalyst 3.0和KEGG数据库分析结果显示,组间的差异代谢物主要富集的十大代谢通路(图 7)。相对于AgS组,AgCLP的差异代谢物主要富集在油菜素内酯生物合成通路、二组分系统、γ-氨基丁酸能突触通路、脂肪酸代谢、脂肪酸的降解、精氨酸生物合成、氧化磷酸化、乙醛酸和二羧酸代谢、丙氨酸天门冬氨酸和谷氨酸代谢、烟酸盐和烟酰胺代谢。此外,相对于AgCLP组,AgMET组老年大鼠的差异代谢物主要富集在氨基酸和核苷酸糖代谢、倍半萜和三萜的生物合成、精氨酸和脯氨酸代谢、苯丙类化合物生物合成、二苯乙烯、二芳基庚酸类和姜酚合成、氨基苯甲酸酯降解、嘧啶代谢、肾素-血管紧张素系统抑制、各种次生代谢产物的生物合成-第二部分、类黄酮生物合成。
|
| 图 7 组间的差异代谢物的通路富集分析 Fig 7 The enriched pathway analysis of differential metabolites intergroup |
|
|
本研究结果表明,二甲双胍治疗可逆转CLP诱导SALI。非靶向代谢组学结果显示,老年脓毒症大鼠的粪便代谢物与假手术大鼠有显著差异,且二甲双胍可逆转这些变化。而相关性分析发现,差异代谢物Gly-Phe、安替比林、保幼激素3、Valylproline、伏立诺他与肺组织的炎症因子和趋化因子呈负相关关系,其余的17个差异代谢与炎症因子或者趋化因子呈正相关关系。此外,差异代谢物主要富集在油菜素内酯生物合成通路、γ-氨基丁酸能突触通路、氨基酸和核苷酸糖代谢、倍半萜和三萜的生物合成、精氨酸和脯氨酸代谢等代谢通路上。这些发现说明了,二甲双胍可用于治疗脓毒症大鼠急性肺损伤,对于理解CLP诱导脓毒症大鼠模型的代谢作用以及二甲双胍治疗对代谢的影响具有重要意义。
先前研究报道,肠道菌群在脓毒症的发生发展中充当着至关重要的角色,菌群失调可加剧脓毒症多器官功能障碍[11]。最近研究表明,SALI小鼠肺组织和肠道的菌群分布存在部分重合[12]。然而,肠道菌群衍生的代谢物在脓毒症进展中也充当着至关重要的角色。在本研究中,通过非靶向代谢组学筛选了差异的肠道衍生代谢物,而这些差异代谢物大多数都有抗炎作用,而Gabexate Mesylate可通过调节脓毒症大鼠的肠道微生物群及其代谢物,从而减轻脓毒症相关的肺损伤,降低脓毒症的病死率[13]。血清瘦素水平可作为感染性疾病和脓毒症的诊断和预后指标[14]。N-Acetyl-D-galactosamine可防止大豆凝集素诱导的猪肠上皮细胞的肠屏障功能障碍[15]。最近研究报道,伏立诺他可通过调控PIK3C3/VPS34-BECN1复合物的过度活化会增加溶酶体差异并增强线粒体自噬[16]。此外,既往研究报道,代谢物Manoalide可通过氧化应激介导的Casapse-3的激活诱导细胞凋亡和DNA损伤[17]。代谢物N-花生四烯基甘氨酸导致呼吸依赖性大量ROS产生,进而导致宿主肝线粒体电子传递活性和细胞色素c释放受到抑制[18]。而在本研究中,上述的代谢物的相对强度在老年SALI过程发生了变化,而二甲双胍干预后可逆转这些改变。
此外,有研究报道,二甲双胍与肠道微生物群变化密切相关[19-20]。既往研究提示,二甲双胍可通过改变微生物叶酸和甲硫氨酸的代谢以减缓线虫的衰老,从而为衰老提供有效的治疗手段[21]。此外,有研究发现二甲双胍通过调节微生物组和代谢组学改善脓毒症相关的脏器损伤[22]。最新研究报道,肠道微生物群及其代谢产物充当肠-肺轴的重要调节剂,肠道微生物群来源的琥珀酸盐通过琥珀酸受体1依赖性肺泡巨噬细胞极化加剧肠道肠缺血-再灌注诱导的急性肺损伤[23]。此外,抗生素可通过耗竭小鼠肠道微生物组,调节肠道菌群和血浆代谢物改善LPS诱导的小鼠急性肺损伤[24]。既往研究发现,甲磺酸加贝酯调控氨基酸代谢、鞘脂代谢等代谢通路发挥改善SALI的作用[25]。上述研究表明,目前很多干预手段改善急性肺损伤是通过肠-肺轴来实现的,与本研究的二甲双胍治疗SALI的潜在机制相似。
本研究存在一定的局限性。首先,实验组的样本量非常小,本研究的结果需要其他类似研究的证实。其次,在本研究中,本研究没有对抗生素处理过或无菌大鼠的粪便进行代谢物分析。此外,本研究只进行了非靶向代谢物分析,这为确定影响老年脓毒症大鼠病理生理的特定代谢物提供了未来的靶向分析范围。
综上所述,二甲双胍干预可逆转老年脓毒症大鼠部分有益肠道代谢物,并可改善其炎症反应和肺损伤,为SALI提供潜在的有效治疗手段。
利益冲突 所有作者声明无利益冲突
作者贡献声明 梁火燕:研究设计、论文撰写、实验操作、论文修改;徐籽力:论文撰写、实验操作、统计学分析、论文修改;邱思敏:实验操作、数据统计、论文修改;张开源、胡智铂、张晓娟、刘韶华、丁显飞:实验操作、科研绘图;孙同文:研究设计、论文修改、指导支持
| [1] | Gotts JE, Matthay MA. Sepsis: pathophysiology and clinical management[J]. BMJ, 2016, 353: i1585. DOI:10.1136/bmj.i1585 |
| [2] | Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [3] | Auriemma CL, Zhuo HJ, Delucchi K, et al. Acute respiratory distress syndrome-attributable mortality in critically ill patients with sepsis[J]. Intensive Care Med, 2020, 46(6): 1222-1231. DOI:10.1007/s00134-020-06010-9 |
| [4] | Han B, Chao K, Wang D, et al. A purified membrane protein from Akkermansia muciniphila blunted the sepsis-induced acute lung injury by modulation of gut microbiota in rats[J]. Int Immunopharmacol, 2023, 121: 110432. DOI:10.1016/j.intimp.2023.110432 |
| [5] | An HY, He L. Current understanding of metformin effect on the control of hyperglycemia in diabetes[J]. J Endocrinol, 2016, 228(3): R97-R106. DOI:10.1530/JOE-15-0447 |
| [6] | Song H, Zhang XJ, Zhai RQ, et al. Metformin attenuated sepsis-associated liver injury and inflammatory response in aged mice[J]. Bioengineered, 2022, 13(2): 4598-4609. DOI:10.1080/21655979.2022.2036305 |
| [7] | Ding QL, Wang Y, Yang CB, et al. Effect of sivelestat in the treatment of acute lung injury and acute respiratory distress syndrome: a systematic review and meta-analysis[J]. Intensive Care Res, 2023: 1-10. DOI:10.1007/s44231-023-00032-9 |
| [8] | Lee H, Lee Y, Kim J, et al. Modulation of the gut microbiota by metformin improves metabolic profiles in aged obese mice[J]. Gut Microbes, 2018, 9(2): 155-165. DOI:10.1080/19490976.2017.1405209 |
| [9] | Tang GM, Yang HY, Chen J, et al. Metformin ameliorates sepsis-induced brain injury by inhibiting apoptosis, oxidative stress and neuroinflammation via the PI3K/Akt signaling pathway[J]. Oncotarget, 2017, 8(58): 97977-97989. DOI:10.18632/oncotarget.20105 |
| [10] | Wan LM, Meng DM, Wang H, et al. Preventive and therapeutic effects of thymol in a lipopolysaccharide-induced acute lung injury mice model[J]. Inflammation, 2018, 41(1): 183-192. DOI:10.1007/s10753-017-0676-4 |
| [11] | Sun TW, Wang LX, Zhang HB. Intestinal microbiota in sepsis[J]. Intensive Care Res, 2022, 2(1): 1-7. DOI:10.1007/s44231-022-00001-8 |
| [12] | 杨舸, 张瑞, 王晓红, 等. 脓毒症急性肺损伤小鼠肠肺菌群结构变化分析[J]. 中华急诊医学杂志, 2023, 32(3): 353-359. DOI:10.3760/cma.j.issn.1671-0282.2023.03.013 |
| [13] | Sun WJ, Cui YQ, Zhang XJ, et al. Effects of gabexate mesylate on the gut microbiota and metabolomics in rats with sepsis[J]. J Inflamm Res, 2022, 15: 6581-6594. DOI:10.2147/JIR.S392060 |
| [14] | Birlutiu V, Boicean LC. Serum leptin level as a diagnostic and prognostic marker in infectious diseases and sepsis: a comprehensive literature review[J]. Medicine (Baltimore), 2021, 100(17): e25720. DOI:10.1097/MD.0000000000025720 |
| [15] | Zhao B, Che DS, Adams S, et al. N-Acetyl-d-galactosamine prevents soya bean agglutinin-induced intestinal barrier dysfunction in intestinal porcine epithelial cells[J]. J Anim Physiol Anim Nutr, 2019, 103(4): 1198-1206. DOI:10.1111/jpn.13091 |
| [16] | Patra S, Praharaj PP, Klionsky DJ, et al. Vorinostat in autophagic cell death: a critical insight into autophagy-mediated, -associated and-dependent cell death for cancer prevention[J]. Drug Discov Today, 2022, 27(1): 269-279. DOI:10.1016/j.drudis.2021.08.004 |
| [17] | Wang HR, Tang JY, Wang YY, et al. Manoalide preferentially provides antiproliferation of oral cancer cells by oxidative stress-mediated apoptosis and DNA damage[J]. Cancers, 2019, 11(9): 1303. DOI:10.3390/cancers11091303 |
| [18] | Zaccagnino P, Saltarella M, D'Oria S, et al. N-arachidonylglycine causes ROS production and cytochrome c release in liver mitochondria[J]. Free Radic Biol Med, 2009, 47(5): 585-592. DOI:10.1016/j.freeradbiomed.2009.05.038 |
| [19] | Wu H, Esteve E, Tremaroli V, et al. Metformin alters the gut microbiome of individuals with treatment-naive type 2 diabetes, contributing to the therapeutic effects of the drug[J]. Nat Med, 2017, 23(7): 850-858. DOI:10.1038/nm.4345 |
| [20] | Fu GL, Meng QY, Chen Y, et al. Metformin exposure altered intestinal microbiota composition and metabolites in amphibian larvae[J]. Ecotoxicol Environ Saf, 2023, 267: 115617. DOI:10.1016/j.ecoenv.2023.115617 |
| [21] | Cabreiro F, Au C, Leung KY, et al. Metformin retards aging in C. elegans by altering microbial folate and methionine metabolism[J]. Cell, 2013, 153(1): 228-239. DOI:10.1016/j.cell.2013.02.035 |
| [22] | Zhao HY, Lyu YJ, Zhai RQ, et al. Metformin mitigates sepsis-related neuroinflammation via modulating gut microbiota and metabolites[J]. Front Immunol, 2022, 13: 797312. DOI:10.3389/fimmu.2022.797312 |
| [23] | Wang YH, Yan ZZ, Luo SD, et al. Gut microbiota-derived succinate aggravates acute lung injury after intestinal ischaemia/reperfusion in mice[J]. Eur Respir J, 2023, 61(2): 2200840. DOI:10.1183/13993003.00840-2022 |
| [24] | Hashimoto Y, Eguchi A, Wei Y, et al. Antibiotic-induced microbiome depletion improves LPS-induced acute lung injury via gut-lung axis[J]. Life Sci, 2022, 307: 120885. DOI:10.1016/j.lfs.2022.120885 |
| [25] | 王宁, 丁显飞, 崔玉青, 等. 甲磺酸加贝酯改善脓毒症急性肺损伤大鼠的代谢组学研究[J]. 中华急诊医学杂志, 2022, 31(2): 191-196. DOI:10.3760/cma.j.issn.1671-0282.2022.02.010 |
 2024, Vol. 33
2024, Vol. 33