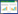2. 贵州中医药大学第一临床医学院,贵阳 550005;
3. 上海市浦东新区凌桥社区卫生服务中心全科医学,上海 200137
2. The First Clinical Medical School of Guizhou University of Chinese Medicine, Guiyang 550005, China;
3. Department of General Medicine, LingQiao Community Health Service Center, Pudong New Area, Shanghai 200137, China
低血糖是糖尿病患者在血糖控制过程中的风险之一,有调查显示有1.8%接受胰岛素治疗的患者每年至少发生一次需要他人帮助治疗的严重低血糖[1]。患者一旦发生低血糖昏迷是严重临床状态,可能导致身体障碍或死亡[2]。有研究发现,高龄及胰岛素治疗是低血糖患者发生昏迷危险因素[3-4]。然而,低血糖值多低才会发生昏迷,或者血糖值与昏迷发生率的相互关系研究报道较少见。为此,本研究将回顾性分析发生在上海市嘉定区的院外急救中从2020—2022年共3年血糖值≤3.9mmol/L患者的临床资料,对低血糖患者发生昏迷概率及其影响因素进行论证。
1 资料与方法 1.1 研究对象本研究为回顾性观察性研究,研究纳入2020年1月1日到2022年12月31日在上海市嘉定区经急救医生现场快速毛细血管血糖检测血糖值≤3.9 mmol/L且年龄≥20岁的患者。资料来源于上海市嘉定区医疗急救中心电子化疾病信息系统、调度派遣系统记录、急救医生的纸质记录,以及医院内就医记录和通过电话随访收集的资料,数据来源的多样性可以提供全面和准确的患者信息。结合医师现场评估和随访资料排除脑血管意外、中毒、癫痫、心脏疾病、心脏骤停、严重创伤等其他可能导致昏迷的院前常见非糖尿患者,进一步排除医院转运和资料不完整的患者,以确保分析的样本是具有一致性和可比性的。
收集的数据覆盖区域包含嘉定区所有12个街镇,急救人员为地理面积463.16 km2、人口189.34万的嘉定区城市和农村地区的居民提供急救护理和转运服务[5]。上海地区的院前急救系统隶属于当地卫生部门,当班的急救车由1名急救医生和2名急救员为患者提供医疗服务,急救医师是急救系统的核心,急救员是专门培训的非医疗专业人员,他们在医生的指导下,执行一系列的基本的急救操作,如心肺复苏、止血、固定等。急救车配备的基本的设备包含除颤监护仪、心肺复苏仪、呼吸机、血糖仪、氧气设备、急救药品等医疗设备。急救医师现场能执行的医疗操作如执行检测血糖、采集并解读心电图、手动除颤、高级生命支持药物的使用、高级气道管理以及呼吸机使用等。
本研究符合医学伦理标准,通过上海市嘉定区中心医院伦理委员会审批(2023K41)。
1.2 研究方法收集患者的基本资料(年龄、性别、是否有糖尿病病史、发病时间段、低血糖诱因和胰岛素的使用)、急救现场采集的临床数值[初测血糖值、心率、收缩压、格拉斯哥昏迷评分(Glasgow coma scale, GCS)、血氧氧饱和度和心电图诊断]和治疗结果(复苏血糖使用的药物、复测血糖值和昏迷苏醒时长)。急救医师第一时间对患者进行评估,采用GCS评分并结合临床表现、病史和其他相关检查结果进行综合判断,判定患者是否昏迷:GCS≤8分判定为昏迷组,GCS > 8分为非昏迷组。昏迷组患者治疗后的结果资料进一步分析,探讨其影响患者苏醒的因素。
根据不同年龄段将患者分为8组,分析低血糖及昏迷的构成比以及不同年龄组低血糖发生昏迷的概率;将24 h分为7个时段进行观察,观察低血糖高峰时段。另外分析不同低血糖值区间昏迷发生的概率,将血糖值分成6组(血糖仪测量结果低于1.1 mmol/L的情况下,科研数据转换为记录为1.1 mmol/L便于统计):1.1~1.5 mmol/L组、1.6~2.0 mmol/L组、2.1~2.5 mmol/L组、2.6~3.0 mmol/L组、3.1~3.5 mmol/L组和3.6~3.9 mmol/L组,计算各组昏迷发生率的点估计。
1.3 统计学方法数据分析采用SPSS 23.0软件处理。符合正态分布的计量资料采用均数和标准差(x±s)表示,组间比较采用成组t检验。分类变量采用构成比表示,组间比较采用卡方检验。构建二元Logistic回归模型,分析低血糖患者发生昏迷的独立危险因素,结果以OR值(odds ratio, OR)95%可信区间(confidence interval, CI)表示。以P < 0.05为差异有统计学意义。
2 结果 2.1 低血糖患者基本特征根据纳入和排除标准,经过急救医生现场快速毛细血管血糖检测血糖值≤3.9 mmol/L且年龄≥20岁患者为754例,具体收集资料流程见图 1。
|
| 图 1 低血糖患者资料收集流程 Fig 1 Flowchart of data collection for hypoglycemic patients |
|
|
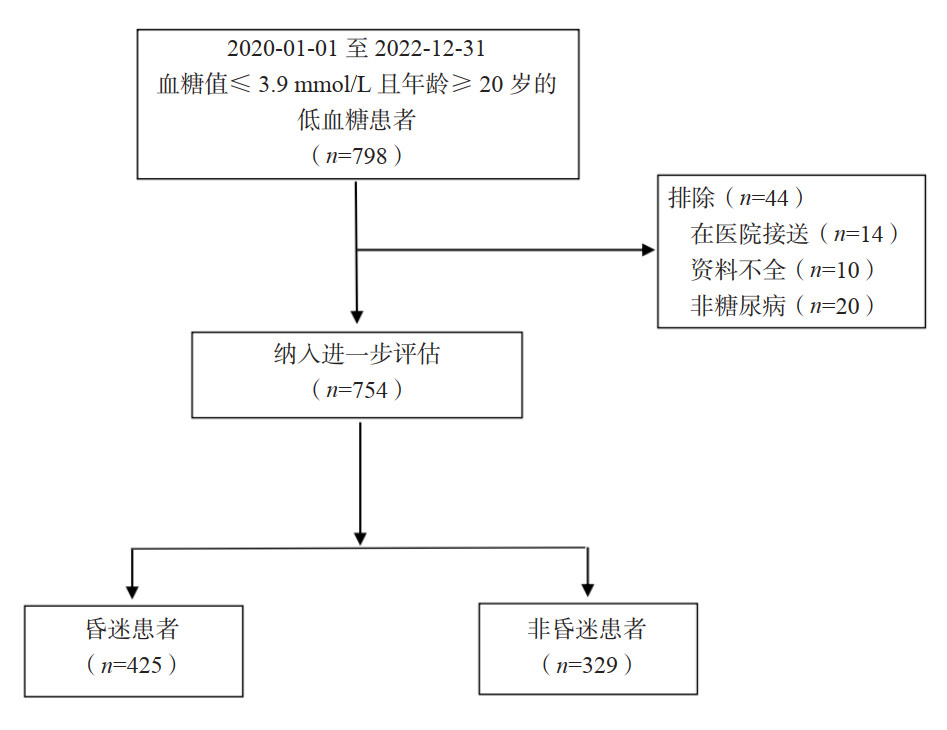
425例患者发生昏迷,发生率为56.37%(95% CI: 52.82%~59.91%),其中心脏骤停2例,发生率为0.27%,329例(43.63%)没有发生昏迷,两组患者性别构成比差异无统计学意义。所有患者年龄(73.05±15.20)岁,昏迷组的患者年龄大于非昏迷组。年龄组别中61~70岁组、71~80岁组和81~90岁组是昏迷患者高发年龄段,且随着年龄的增大,低血糖患者昏迷发生的概率有增加趋势,其中81~90岁组昏迷发生概率为60.18%,91~101岁组昏迷发生概率为64.71%,见图 2。
|
| A为低血糖昏迷患者不同年龄性别组构成比;B为不同年龄组昏迷发生概率;C为昏迷和非昏迷分组低血糖患者时段分布;D为低血糖患者不同血糖值的昏迷发生率 图 2 不同年龄、性别及血糖值对低血糖昏迷患者影响的综合分析 Fig 2 A comprehensive analysis of the impact of age, gender, and blood glucose levels on hypoglycemic coma patients |
|
|
所有患者中,有572例(75.86%)患者有糖尿病病史,昏迷组的糖尿病史者占比高于非昏迷组(82.12% vs. 67.78%,P < 0.001),见表 1。从24 h时间段分布发现,患者发生低血糖及昏迷的高发时间段为0~6时、6~9时和14~18时,见图 2。
| 变量 | 昏迷组(n=425) | 非昏迷组(n=329) | 总体(n=754) | χ2/F值 | P值 |
| 年龄(岁)a | 75.06±13.30 | 70.46±17.03 | 73.05±15.20 | 17.300 | < 0.001 |
| 男性b | 216(50.82) | 190(57.75) | 406(53.85) | 3.581 | 0.058 |
| 糖尿病病史b | 20.815 | < 0.001 | |||
| 是 | 349(82.12) | 223(67.78) | 572(75.86) | ||
| 否 | 76(17.88) | 106(32.22) | 182(24.14) | ||
| 发病时间段b | 2.918 | 0.819 | |||
| 0~6 | 77(18.12) | 73(22.19) | 150(19.89) | ||
| 6~9 | 78(18.35) | 58(17.63) | 136(18.04) | ||
| 9~12 | 55(12.94) | 56(17.02) | 111(14.72) | ||
| 12~14 | 34(8.00) | 21(6.38) | 55(7.29) | ||
| 14~18 | 80(18.82) | 51(15.50) | 131(17.37) | ||
| 18~21 | 58(13.65) | 42(12.77) | 100(13.26) | ||
| 21~24 | 43(10.12) | 28(8.51) | 71(9.42) | ||
| 导致低血糖诱因b | 14.483 | 0.006 | |||
| 注射胰岛素后未进食或进食过少 | 67(15.76) | 24(7.29) | 91(12.07) | ||
| 注射胰岛素过量或使用不当 | 27(6.35) | 21(6.38) | 48(6.37) | ||
| 能量摄入减少 | 28(6.59) | 19(5.78) | 47(6.23) | ||
| 口服降糖药物 | 20(4.71) | 12(3.65) | 32(4.24) | ||
| 无明显诱因 | 283(66.59) | 253(76.90) | 536(71.09) | ||
| 发病前是否使用胰岛b | 8.785 | 0.003 | |||
| 是 | 94(22.12) | 45(13.68) | 139(18.44) | ||
| 否 | 331(77.88) | 284(86.32) | 615(81.56) | ||
| 初测血糖值(mmol/L)a | 1.87±0.72 | 2.48±0.89 | 2.13±0.85 | 108.206 | < 0.001 |
| 心率(次/min)a | 84.56±17.15 | 85.11±18.01 | 84.80±17.52 | 0.179 | 0.673 |
| 收缩压(mmHg)a | n=346,133.09±25.58 | n=278,134.71±21.68 | n=624,133.81±23.92 | 0.709 | 0.400 |
| SPO2(%)a | n=355, 97.03±5.45 | n=272, 97.72±3.22 | n=627,97.33±4.64 | 3.446 | 0.064 |
| 心电图b | 0.789 | 0.674 | |||
| 窦性心律 | 357(84.00) | 271(82.40) | 628(83.30) | ||
| 窦性心动过速 | 57(13.40) | 51(15.50) | 108(14.30) | ||
| 窦性心动过缓 | 11(2.60) | 7(2.10) | 18(2.40) | ||
| 低血糖的治疗b | 49.533 | < 0.001 | |||
| 静脉注射50%葡萄糖液 | 315(74.12) | 163(49.54) | 478(63.40) | ||
| 静脉注射5%葡萄糖液或口服糖类食物 | 44(10.35) | 78(23.71) | 122(16.18) | ||
| 没有治疗 | 66(15.53) | 88(26.75) | 154(20.42) | ||
| 复测血糖值(mmol/L)a | n=164, 7.46±3.80 | n=94, 6.91±3.27 | n=258, 7.26±3.62 | 1.397 | 0.238 |
| 昏迷苏醒时长(min)a | n=215, 18.43±9.09 | - | - | - | - |
| 注:a为x±s,b为例(%) | |||||
调查导致低血糖诱因依次为注射胰岛素后能量摄入减少12.07%,胰岛素使用不当(6.37%),能量摄入减少(6.23%),但多达71.09%的患者无明显诱因。低血糖患者发生前胰岛素使用占比18.44%,对亚组进一步分析发现,使用了胰岛素的占比在昏迷组中明显高于非昏迷组(22.12% vs. 13.68%,P=0.003),见表 1。
2.2 低血糖患者昏迷发生率、与血糖值的对应关系及其影响因素总体初测血糖值为(2.13±0.85)mmol/L,昏迷组的血糖值明显低于非昏迷组(P < 0.001)。各组血糖值发生昏迷的概率分别为:1.1~1.5 mmol/L组为72.97%(95%CI: 67.09%~78.86%)、1.6~2.0 mmol/L组为68.90%(95%CI: 62.00%~75.80%)、2.1~2.5 mmol/L组为54.10%(95%CI: 45.13%~63.07%)、2.6~3.0 mmol/L组为38.20%(95%CI: 27.90%~48.50%)、3.1~3.5 mmol/L组为37.50%(95%CI: 26.00%~49.00%)和3.6~3.9 mmol/L组为19.40%(95%CI: 10.10%~28.80%),见图 2。现场检测两组患者的心率、平均收缩压、血氧饱和度和心率类型构成比均差异(均P > 0.05),见表 1。
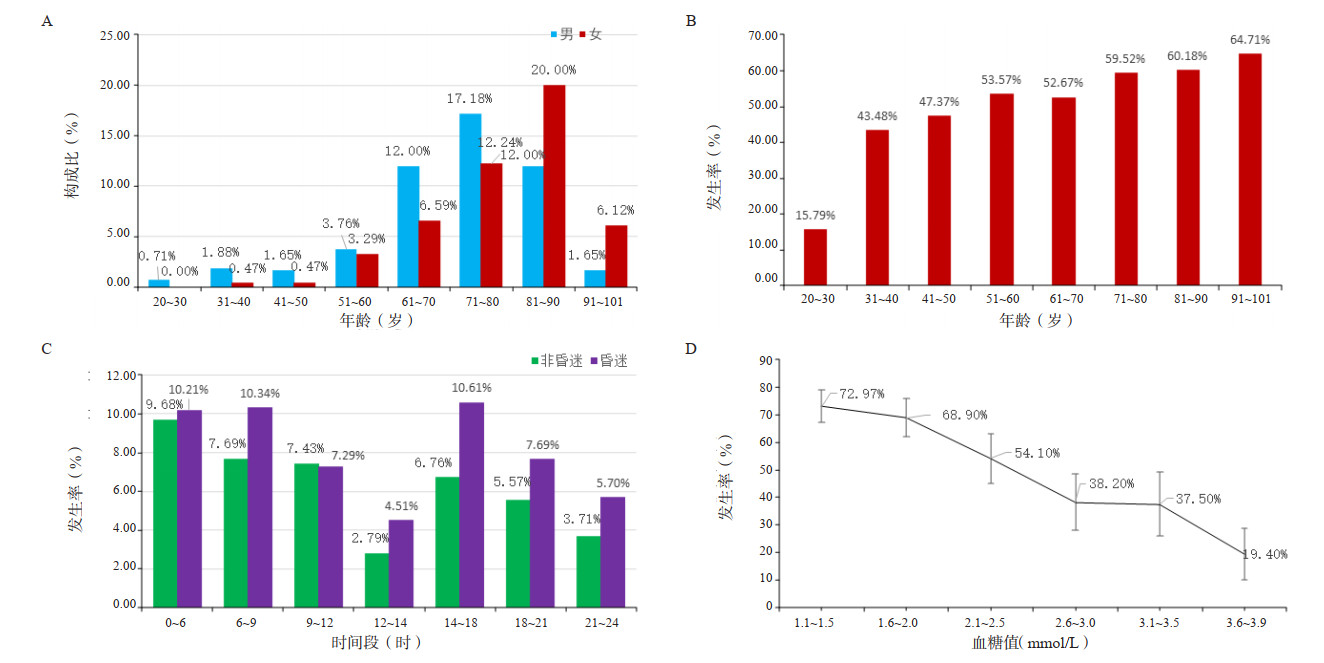
多因素回归分析发现,年龄(OR=1.021,95%CI: 1.010~1.033,P < 0.001)、发病前使用胰岛素(OR=1.948,95%CI: 1.142~3.323,P=0.014)和血糖浓度(OR=0.426,95%CI: 0.347~0.522,P < 0.001)是影响患者低血糖值是否昏迷的独立预测因素,见图 3。
|
| 图 3 低血糖患者发生昏迷多因素回归分析 Fig 3 Multilevel logistic analyses of factors associated with coma in hypoglycemic patients |
|
|
调查发现,低血糖患者现场复苏常规方法有静脉推注50%葡萄糖溶液(glucose solution, GS)、注射糖水(5% GS)或使用0.9%生理盐水扩容。478例(63.40%)患者使用静脉推注50% GS,在昏迷患者组中这一比例为74.12%。经过现场治疗后,有215例患者苏醒,苏醒时长为(18.43±9.09)min。258例复测了静脉指端血糖,其值为(7.26±3.62)mmol/L,昏迷患与非昏迷组的复测血糖值差异无统计学意义[(7.46±3.80)mmol/L vs.(6.91±3.27)mmol/L,P=0.238],见表 1。
对昏迷亚组425例患者分为苏醒组和未苏醒组,进一步分析发现,经过治疗后,苏醒组的患者年龄低于未苏醒组(P=0.037)。苏醒组的初测血糖平均值低于未苏醒组[(1.75±0.58)mmol/L vs.(1.99±0.82)mmol/L,P=0.001],但是复测血糖发现,苏醒组的血糖平均值高于未苏醒组[(7.95±3.95)mmol/L vs.(5.71±2.57)mmol/L,P=0.002]。导致低血糖昏迷诱因上,两组差异并无统计学意义(P=0.107),提示血糖值是影响患者苏醒的关键因素,见表 2。
| 指标 | 苏醒组(n=215) | 未苏醒组(n=210) | x2/F值 | P值 |
| 年龄(岁)a | 73.73±13.72 | 76.42±12.76 | 4.389 | 0.037 |
| 男性b | 113(52.56) | 103(49.05) | 0.524 | 0.469 |
| 既往史b | 11.591 | 0.001 | ||
| 糖尿病病史 | 190(88.37) | 159(75.71) | ||
| 无糖尿病病史 | 25(11.63) | 51(24.29) | ||
| 发病时间段b | 6.155 | 0.406 | ||
| 0~6 | 43(20.00) | 34(16.19) | ||
| 6~9 | 36(16.74) | 42(20.00) | ||
| 9~12 | 28(13.02) | 27(12.86) | ||
| 12~14 | 16(7.44) | 18(8.57) | ||
| 14~18 | 38(17.67) | 42(20.00) | ||
| 18~21 | 33(15.35) | 25(11.90) | ||
| 21~24 | 21(9.77) | 22(10.48) | ||
| 导致低血糖昏迷诱因b | 7.621 | 0.107 | ||
| 注射胰岛素后能量摄入减少 | 37(17.20) | 30(14.30) | ||
| 胰岛素使用不当 | 16(7.40) | 11(5.20) | ||
| 能量摄入减少 | 14(6.50) | 14(6.70) | ||
| 口服降糖药物问题 | 15(7.00) | 5(2.40) | ||
| 无明显诱因 | 133(61.90) | 150(71.40) | ||
| 发病前是否使用胰岛b | 1.621 | 0.203 | ||
| 否 | 162(75.30) | 169(80.50) | ||
| 是 | 53(24.70) | 41(19.50) | ||
| 初测血糖值(mmol/L)a | 1.75±0.58 | 1.99±0.82 | 12.269 | 0.001 |
| 现场医师药物使用b | 131.184 | < 0.001 | ||
| 静推50% GS | 211(98.14) | 104(49.52) | ||
| 注射糖水(5% GS)或口服糖水食物 | 3(1.40) | 41(19.52) | ||
| 没有治疗c | 1(0.47) | 65(30.95) | ||
| 复测血糖值(mmol/L)a | 7.95±3.95 | 5.71±2.57 | 10.350 | 0.002 |
| 注:GS为葡萄糖溶液;a为x±s,b为例(%),c没有治疗的原因主要因为患者烦躁无法开通静脉或家属拒绝治疗等情况 | ||||
本研究纳入3年上海市嘉定区院前急救血糖低于≤3.9 mmol/L患者的资料共754例,其中425例患者是属于需要他人治疗的严重低血糖昏迷,总体昏迷发生率高达56.37%,且昏迷发生率与低血糖值直接相关,其中2例患者到院前发生心脏骤停,说明低血糖昏迷是一种严重且并不罕见的问题,这一结论与Ben-Ami等[6]研究结果相似。另外发现,年龄和胰岛素使用是导致低血糖严重事件的危险因素,文献中也有相似的报道[3, 7-8]。以上重要结论提醒,使用胰岛素和(或)口服降糖药物进行治疗时,尤其是具有上述易感因素和增强低血糖药物作用的老年患者,应该在医生指导下自我检测血糖值,并对患者及护理者进行充分的低血糖教育,以防范严重低血糖昏迷的发生。以下就上述研究结果进一步进行讨论。
3.1 低血糖值与昏迷发生率的关系在正常血糖值的下限水平(≤3.9 mmol/L)时,为一级低血糖,低血糖处于临界状态,患者通常无症状,此时需要用简单碳水化合物予以治疗,同时调整降血糖药物的适应证;如血糖值进一步降低(< 3.0 mmol/L),为二级低血糖,国际低血糖研究小组建议在评估治疗糖尿病的降糖药物的临床实验报告中包含检测到血糖浓度低于3.0 mmol/L的频率,因为这是具有临床意义重大的生化低血糖,患者认知功能可能受损及意识水平下降[9-10]。严重低血糖时(其值到底多低并不清楚),患者将发生低血糖昏迷或癫痫发作,甚至诱发致命性心律失常与心肌缺血[11]。本研究发现,昏迷患者的血糖值为(1.87±0.72)mmol/L,与Otsuka等[12]研究低血糖昏迷患者的血糖值为(31.0±8.1)mg/dL即(1.72±0.45)mmol/L相近。另据van de Ven等[13]研究报道,对1型糖尿病患者和无糖尿病人群,通过13C标记的磁共振分光检测大脑葡萄糖浓度,并与血浆葡萄糖浓度做线性关系分析发现,当大脑葡萄糖浓度接近0时(大脑葡萄糖代谢水平开始降低),此时血浆葡萄糖浓度小于2 mmol/L。本研究还发现,各组血糖值对应发生昏迷的概率分别为:1.1~1.5 mmol/L组为72.97%,1.6~2.0 mmol/L组为68.90%,2.1~2.5 mmol/L组为54.10%,2.6~3.0 mmol/L组为38.20%,3.1~3.5 mmol/L组为37.50%和3.6~3.9 mmol/L组为19.40%。说明血糖值越低,其昏迷发生概率越高,且在血糖值3.1~3.9 mmol/L区间仍然有较高的昏迷风险。研究认为在接受胰岛素、磺酰脲类或噻唑烷类(格列齐特)治疗的糖尿病患者,低血糖症状和血糖对抗调节(包括交感肾上腺)反应的血糖阈值并不固定,在血糖浓度下降时,在血糖控制不良的患者中,血糖阈值较高[9]。因此,对于具体患者而言,确定以及记录需要避免的低血糖水平是非常重要,以避免即时和长期的危险。
3.2 年龄因素对低血糖和昏迷的影响低血糖的发生率随着年龄的增长而增加[3],本研究发现,年龄组别中61~70岁组、71~80岁组和81~90岁组是昏迷患者高发年龄段。研究同时发现,随着年龄的增大,低血糖患者昏迷发生的概率也有增加趋势,其中81~90岁组昏迷发生概率为60.18%,91~101岁组昏迷发生概率为64.71%。另外发现,昏迷组中,有糖尿病病史者占比更高,且年龄更大,这与既往研究结果相似[12]。主要原因为长期糖尿病的高龄患者的认知损害、认知衰退和痴呆的风险增加[14],老年患者自主神经功能失调,导致低血糖感知能力下降,再加老年患者自我管理能力下降,可能更容易忽视血糖监测、饮食控制和药物使用的重要性,因而容易发生无意识低血糖、夜间低血糖甚至严重低血糖昏迷事件。另外,高龄糖尿病患者通常存在其他健康问题,如肾功能减退和心血管疾病等,往往需要服用多种药物,这些药物可能相互作用,增加低血糖或昏迷的风险[15]。因此,高龄糖尿病患者,应根据重要脏器功能,确定个体化的血糖控制方案,适当放宽血糖控制目标,同时控制其他慢性疾病,以减少低血糖严重事件的发生。另外,患者的家人和护理者也应具备相关知识和技能,能够及时处理低血糖紧急情况。
3.3 胰岛素使用与低血糖或昏迷的关系低血糖作为胰岛素治疗糖尿病的不良后果,自从胰岛素发明的一百年来,就已为人们所知[16]。无论是1型糖尿病还是2型糖尿病,胰岛素均是糖尿病患者控制高血糖及减少并发症的重要手段甚至必要手段[17-18],而严重低血糖在使用胰岛素的1型糖尿病和2型糖尿病患者或服用磺脲类药物的2型糖尿病中很常见[9]。本研究发现,发病前使用胰岛素是低血糖患者是否昏迷的独立预测因素。这可能的原因有:(1)老年患者胰岛素使用持续时间过长,或胰岛素剂量过高,一项回顾性研究发现在胰岛素治疗的2型糖尿病中,严重低血糖症的年发病率为15%,与胰岛素治疗的持续时间直接相关[3],另外,在高龄糖尿病患者中,由于胰岛素分泌减少或胰岛素敏感性降低,他们可能需要较低剂量的胰岛素,如果给予过高的剂量,就会导致血糖水平过低。本次调查显示,低血糖发生前,有18.44%患者使用了胰岛素,其中昏迷组中的患者使用胰岛素的比例明显高于非昏迷组(22.12% vs. 13.68%)。(2)饮食不当或餐食间隔过长:胰岛素的使用需要与饮食相匹配。如果患者在使用胰岛素后未及时进食或餐食间隔过长,血糖下降的速度可能超过胰岛素的作用时间,导致低血糖发生。本调查发现,导致低血糖诱因中包含了注射胰岛素后能量摄入减少(占比12.07%)和能量摄入减少(占比6.23%)的因素。同时发现,严重低血糖昏迷发生的高发时间段为0~6时、6~9时和14~18时,其中对于0~6时段发生夜间低血糖,有学者在分析其发生的常见危险因素时,就提到了胰岛素使用不当、碳水化合物摄入不足这些在本次研究中得出的结论[19]。(3)肾功能下降:高龄糖尿病患者常伴有肾功能减退,肾脏对胰岛素的代谢和清除能力可能降低。如果胰岛素的代谢速度降低,或者给予了正常剂量的胰岛素,就会增加低血糖的风险。(4)多重用药的相互作用:有调查显示,近78%成年人糖尿病患者中有多重用药,与成年人相比,老年人(年龄≥60岁)更有可能多重用药[20],某些药物可以增加胰岛素的效应或降低血糖水平,对两种糖尿病的特异性产生了负面影响,增加了低血糖的风险[21]。
本研究尚存在不足之处:(1)本研究为单中心研究,需要进一步开展大样本的多中心研究,以确认当前研究的结果。(2)研究中没有就患者糖尿病持续时间、胰岛素使用剂量纳入研究,其对低血糖昏迷有何种影响,有待进一步研究。本次研究发现有210例昏迷患者在急救医师尝试纠正低血糖后状态后仍然昏迷状态,该组患者昏迷原因除了明确的血糖值低于苏醒组外,是否与患者存在基础疾病、长时间的严重低血糖导致脑损伤或低血糖导致癫痫发作等因素有关(因纠正低血糖后影响因素可能仍然存在),这有待收集更详细的证据进行评估分析。(3)部分患者合并慢性疾病和口服其他降糖药物的情况没有纳入亚组研究,可能对结果产生差异。(4)本次研究恰逢新冠病毒感染大流行期间,在特殊时间段中,人们的心理压力和医疗资源分配等因素可能增加低血糖与昏迷发生概率。
综上所述,本研究揭示了低血糖患者发生昏迷的高风险,并明确了年龄、胰岛素使用及血糖浓度作为独立危险因素。研究结果显示,低血糖值在高龄患者中容易导致昏迷,使用胰岛素是常见的诱因。进一步分析表明,治疗后血糖值将显著影响患者苏醒。为减少低血糖及昏迷事件的发生,应加强对老年糖尿病患者教育,合理管理胰岛素的使用,以预防低血糖发生。
利益冲突 所有作者声明无利益冲突
作者贡献声明 林全洪:研究设计、采集数据、统计学分析、文章撰写;徐耀伟:数据解读、对文章内容批评性审阅;李玉琢、刘乐柏:采集数据、数据整理;林小婉:论文修改、英文部分校对、文献检索;辛照华:研究设计、统计学分析、论文修改、经费支持;汤师范:文章图表加工制作
| [1] | Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group[J]. Lancet, 1998, 352(9131): 837-853. |
| [2] | Auer RN. Hypoglycemic brain damage[J]. Metab Brain Dis, 2004, 19(3/4): 169-175. DOI:10.1023/b:mebr.0000043967.78763.5b |
| [3] | Huang ES, Laiteerapong N, Liu JY, et al. Rates of complications and mortality in older patients with diabetes mellitus: the diabetes and aging study[J]. JAMA Intern Med, 2014, 174(2): 251-258. DOI:10.1001/jamainternmed.2013.12956 |
| [4] | Holman RR, Thorne KI, Farmer AJ, et al. Addition of biphasic, prandial, or basal insulin to oral therapy in type 2 diabetes[J]. N Engl J Med, 2007, 357(17): 1716-1730. DOI:10.1056/NEJMoa075392 |
| [5] | 上海市嘉定区统计局. 2022年上海市嘉定区国民经济和社会发展统计公报[EB/OL]. (2023-03-31)[2024-08-01]. http://www.jiading.gov.cn/tongji/publicity/fdzdgknr/tjsj97/tjgb97/161776. |
| [6] | Ben-Ami H, Nagachandran P, Mendelson A, et al. Drug-induced hypoglycemic Coma in 102 diabetic patients[J]. Arch Intern Med, 1999, 159(3): 281-284. DOI:10.1001/archinte.159.3.281 |
| [7] | Schopman JE, Geddes J, Frier BM. Prevalence of impaired awareness of hypoglycaemia and frequency of hypoglycaemia in insulin-treated type 2 diabetes[J]. Diabetes Res Clin Pract, 2010, 87(1): 64-68. DOI:10.1016/j.diabres.2009.10.013 |
| [8] | Geddes J, Schopman JE, Zammitt NN, et al. Prevalence of impaired awareness of hypoglycaemia in adults with Type 1 diabetes[J]. Diabet Med, 2008, 25(4): 501-504. DOI:10.1111/j.1464-5491.2008.02413.x |
| [9] | Group IHS. Glucose concentrations of less than 3.0 mmol/L (54 mg/dL) should be reported in clinical trials: a joint position statement of the American diabetes association and the European association for the study of diabetes[J]. Diabetes Care, 2017, 40(1): 155-157. DOI:10.2337/dc16-2215 |
| [10] | Battelino T, Danne T, Bergenstal RM, et al. Clinical targets for continuous glucose monitoring data interpretation: recommendations from the international consensus on time in range[J]. Diabetes Care, 2019, 42(8): 1593-1603. DOI:10.2337/dci19-0028 |
| [11] | Desouza CV, Bolli GB, Fonseca V. Hypoglycemia, diabetes, and cardiovascular events[J]. Diabetes Care, 2010, 33(6): 1389-1394. DOI:10.2337/dc09-2082 |
| [12] | Otsuka T, Okada Y, Torimoto K, et al. Risk factors for hypoglycemic Coma: a study of 33 patients on insulin therapy who were transported to the hospital by ambulance[J]. Intern Med, 2018, 57(20): 2923-2927. DOI:10.2169/internalmedicine.0535-17 |
| [13] | van de Ven KCC, van der Graaf M, Tack CJ, et al. Steady-state brain glucose concentrations during hypoglycemia in healthy humans and patients with type 1 diabetes[J]. Diabetes, 2012, 61(8): 1974-1977. DOI:10.2337/db11-1778 |
| [14] | Biessels GJ, Deary IJ, Ryan CM. Cognition and diabetes: a lifespan perspective[J]. Lancet Neurol, 2008, 7(2): 184-190. DOI:10.1016/S1474-4422(08)70021-8 |
| [15] | American Diabetes Association. 12. older adults: Standards of medical care in diabetes-2020[J]. Diabetes Care, 2020, 43(Suppl 1): S152-S162. DOI:10.2337/dc20-S012 |
| [16] | Amiel SA. The consequences of hypoglycaemia[J]. Diabetologia, 2021, 64(5): 963-970. DOI:10.1007/s00125-020-05366-3 |
| [17] | Diabetes Control and Complications Trial Research Group, Nathan DM, Genuth S, et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus[J]. N Engl J Med, 1993, 329(14): 977-986. DOI:10.1056/NEJM199309303291401 |
| [18] | Garber AJ, Abrahamson MJ, Barzilay JI, et al. Consensus statement by the American association of clinical endocrinologists and American college of endocrinology on the comprehensive type 2 diabetes management algorithm-2019 executive summary[J]. Endocr Pract, 2019, 25(1): 69-100. DOI:10.4158/CS-2018-0535 |
| [19] | 瞿霞, 罗说明, 周智广. 1型糖尿病夜间低血糖的危害与防治进展[J]. 中华糖尿病杂志, 2023, 15(8): 780-784. DOI:10.3760/cma.j.cn115791-20230329-00120 |
| [20] | Alwhaibi M, Balkhi B, Alhawassi TM, et al. Polypharmacy among patients with diabetes: a cross-sectional retrospective study in a tertiary hospital in Saudi Arabia[J]. BMJ Open, 2018, 8(5): e020852. DOI:10.1136/bmjopen-2017-020852 |
| [21] | Remelli F, Ceresini MG, Trevisan C, et al. Prevalence and impact of polypharmacy in older patients with type 2 diabetes[J]. Aging Clin Exp Res, 2022, 34(9): 1969-1983. DOI:10.1007/s40520-022-02165-1 |
 2024, Vol. 33
2024, Vol. 33