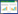毛霉菌病是一种可致命的侵袭性真菌感染,多见于免疫力低下的人群[1]。毛霉菌病具有高发病率和高病死率的特点,人类主要通过吸入孢子获得感染[2]。根据感染的解剖部位通常划分为以下6类:鼻-眶-脑型、肺型、皮肤型、胃肠道型、播散型、少见型[3]。鼻-眶-脑毛霉菌病(Rhino-orbito-cerebral mucormycosis, ROCM)是临床最常见的类型,可造成鼻腔、鼻窦、颈部间隙、眼眶以及颅内结构的感染[4],目前国内的相关报道较少。笔者通过回顾1例肝移植术后多器官功能不全继发ROCM的患者资料,分析总结毛霉菌病的危险因素、临床表现、诊断方法及治疗措施,提高临床工作者对于毛霉菌病的重视程度。
1 病例资料患者,女,61岁,于2022年7月26日突然出现间断性上腹部憋胀,伴有全身乏力、食欲低下及双下肢浮肿,8月15日在外院诊断为“肝硬化失代偿期、肝功能衰竭”,为求进一步诊治转入本院。患者发病以来精神差、食欲欠佳、体重下降。既往乙型病毒性肝炎病史10余年,平素间断服用保肝药物而未系统抗病毒治疗。
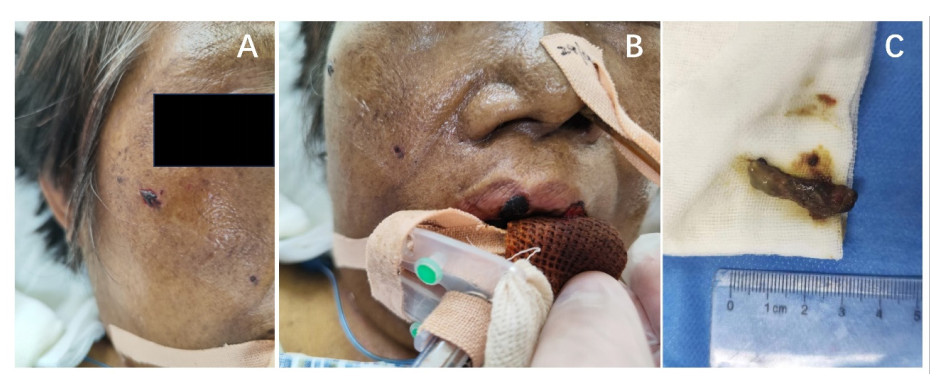
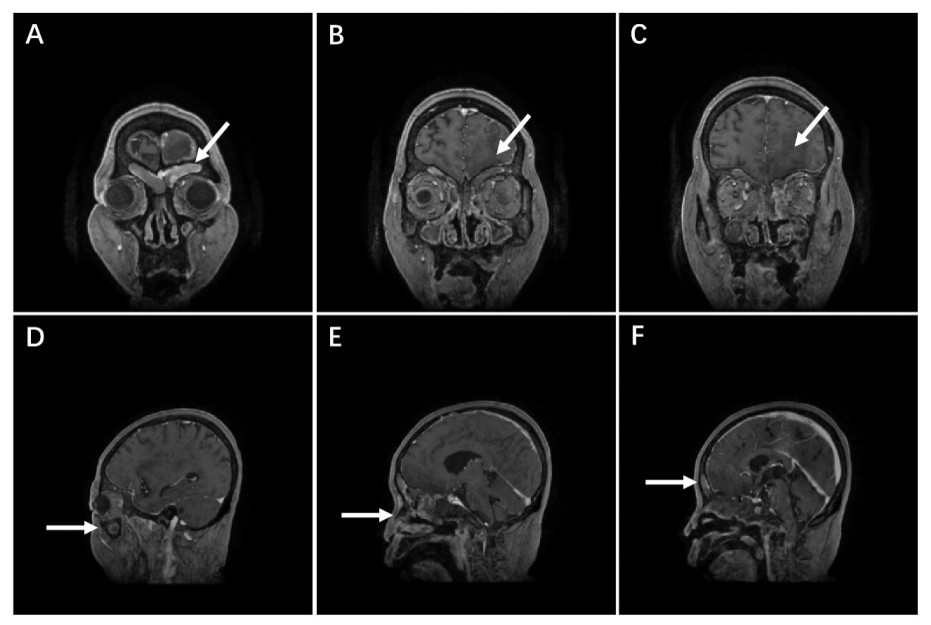
入院后患者查体显示皮肤巩膜黄染,血常规提示白细胞0.8×109/L,中性粒细胞0.35×109/L,红细胞2.35×1012/L,血小板32×109/L。患者血象呈三系减少,血液科会诊考虑与肝炎病毒感染抑制骨髓造血及脾功能亢进破坏血细胞等原因相关。由于粒细胞缺乏容易加重感染,故给予吉粒芬以升高白细胞,同时亚胺培南西司他丁钠、万古霉素及氟康唑联合抗感染治疗,余对症支持。后骨髓穿刺术结果报告患者为继发性贫血、继发性白细胞减少及巨核成熟障碍。考虑患者肝衰竭预后不佳,积极联系肝移植供体,并于8月26日将患者转入肝移植科。此时检验科回报尿培养出屎肠球菌,痰培养出白色念珠菌,肺孢子菌核酸(+),烟曲霉IgG(+),因此使用复方磺胺甲噁唑联合头孢曲松抗感染治疗,将氟康唑替换为伏立康唑。8月27日患者在全麻下行同种异体肝移植术,术后抗感染使用美罗培南、磺胺甲噁唑及伏立康唑联合治疗,同时他克莫司抗排异、恩替卡韦抗病毒等对症支持。3 d后患者转回感染科,出现K+ 7.6 mmol/L,考虑为急性肾损伤,给予降钾治疗,血小板低至4×109/L,故输注血小板。9月9日患者腹腔引流液及痰培养结果提示肺炎克雷伯杆菌感染,于是将美罗培南更换为替加环素,效果欠佳,患者感染症状进一步加重,2 d后转入重症医学科。查体患者为谵妄状态,全身黄染。考虑患者存在肺部及腹腔感染,更改抗感染方案为头孢他啶阿维巴坦钠、替考拉宁及醋酸卡泊芬净,余对症治疗。后患者转为嗜睡状态,考虑与感染复发、营养状态不佳相关,尚不能排除中枢神经系统病变,行头部CT检查未见明显异常。同时肾功能恶化,尿素和肌酐持续升高。床旁胸正位片提示“右侧胸腔积液”,考虑为肺内感染所致。9月17日患者昏睡,意识障碍加重考虑不除外代谢性脑病,后开始出现少尿,故启动连续性肾脏替代治疗以清除体内过量药物及代谢产物。3 d后患者呈浅昏迷状态,感染指标仍未见明显下降,同时心肌酶升高,不排除心肌损伤,因此优化加强容量管理,减轻心脏前负荷,胆红素再次升高不排除胆酶分离。9月25日患者出现了呼吸间停氧合下降,因此急行气管插管呼吸机辅助机械通气,在气管插管过程中发现其痰液粘稠呈黑褐色,已经堵塞主气道,且患者面部及口唇出现黑褐色焦痂(图 1A~B)。后行纤维支气管镜检查,右肺下叶支气管开口处可见较多血性分泌物附着于管壁,充分吸尽后见黏膜明显充血水肿,最后于鼻腔内取出团块状分泌物(图 1C)行一般细菌真菌培养及鉴定。2 d后患者出现双侧瞳孔不等大,右侧直径2.0 mm,左侧直径5.0 mm,对光反射消失,项强(-),kernig征(-),双上肢屈曲可活动,双下肢无活动且肌张力下降、双侧腱反射及病理征未引出。复查头部CT提示左侧放射冠区、半卵圆中心及左侧额叶多发脑梗死,结合患者存在面部及口唇的黑褐色焦痂以及呼吸道内粘稠分泌物,暂不能除外颅内感染,于是行腰椎穿刺术。所得脑脊液呈微黄色,初压200 mmH2O(1 mmH2O=0.098 kPa),末压145 mmH2O,葡萄糖3.95 mmol/L,氯116.3 mmol/L,蛋白0.816 g/L,腺苷脱氨酶3 U/L,白细胞数630 mm3,单核细胞5%,多核细胞95%。脑脊液生化结果提示颅内感染,后行头颅MR检查证实了感染从鼻腔及鼻窦蔓延至颅内(图 2,图 3)。继脑脊液病原微生物高通量测序回报米根霉菌、巨细胞病毒、人类疱疹病毒5型阳性后,鼻腔分泌物也培养出米根霉菌,结合患者临床表现,毛霉菌感染诊断成立,分型为ROCM,给予两性霉素B进行治疗。同时患者鼻咽拭子可见真菌菌丝,告知家属患者目前为肝移植术后多器官功能不全继发ROCM,病情危重预后不佳,家属决定放弃治疗,随访患者于离院后48 h内死亡。
|
| A~B:患者面部及口唇出现黑褐色焦痂;C:纤维支气管镜从患者鼻腔内取出团块状分泌物 图 1 患者肝移植术后继发毛霉菌病表现 |
|
|
|
| A~C:冠状位,提示感染累及左侧额窦及额叶,且出现了向对侧侵袭的趋势(白色箭头标注);D~F:矢状位,提示感染累及左侧上颌窦,由鼻腔向上侵袭至额窦及额叶(白色箭头标注) 图 2 头颅MR T1WI像提示毛霉菌感染入颅 |
|
|
|
| A~B:显示皮质下型分水岭梗死;C~D:显示左侧额叶缺血灶合并皮质后型分水岭梗死;E~F:显示临近眶面病灶范围扩大累及右侧额叶,提示颅内可能存在感染相关性病灶 图 3 头颅MR水平位DWI像显示颅内多发梗死灶(图像高亮处) |
|
|
毛霉菌病感染的特征是侵袭血管导致血栓形成,引起广泛的组织坏死并进行全身播散[5]。在免疫功能低下的个体中,糖尿病、中性粒细胞减少、实体器官移植、应用皮质类固醇激素、预防性抗真菌治疗、血清铁水平升高及去铁胺螯合疗法[2, 4, 6-8]均可增加感染毛霉菌的风险,除此之外,合并HIV感染、静脉吸毒、营养不良、慢性酒精中毒及慢性肝脏疾病等[4]也是其危险因素。
该患者为肝移植术后多器官功能不全继发ROCM,整个病程中存在多个危险因素。患者乙型病毒性肝炎病史十余年而未系统抗病毒治疗,病毒在体内不断复制造成骨髓抑制,从而引起以粒细胞缺乏为明显表现的血象三系减少,粒细胞作为免疫系统的重要组成部分,缺乏会导致自身免疫功能下降而引起反复感染[9],同时继发性贫血也为微生物感染提供了基础条件。随后患者进行了肝移植术,据统计肝移植术后受者感染毛霉菌的发病率为0%~1.6%,且与其他实体器官移植相比,肝移植受者更有可能出现播散性疾病,术后毛霉菌病的发展也更早,发病的中位时间为移植术后0.8个月[3]。移植术后患者服用他克莫司进行抗排异反应治疗,进一步导致免疫功能低下。值得注意的是,在患者痰液标本提示烟曲霉IgG阳性后换用了伏立康唑,这是一种广谱抗真菌药,但是对毛霉菌却没有抑制作用[8]。虽然应用伏立康唑抑制了其他真菌的活性,但却提高了毛霉菌感染的风险[10]。除了以上危险因素外,患者还合并了多器官功能不全和多重耐药菌感染,导致病情持续恶化、机体免疫功能不断下降。一项关于实体器官移植的研究发现,肾功能衰竭、前期应用伏立康唑和(或)卡泊芬净可以增加感染毛霉菌的风险[11],患者后期出现肾功能不全及应用卡泊芬净也可能增加了毛霉菌的感染概率。
在ROCM患者中,发热、头痛、流鼻涕、鼻溃疡、腭溃疡、多发性颅神经麻痹、单侧眶周面部肿胀疼痛、眼眶炎症和急性视力丧失是典型的临床表现[3, 12],而颅内扩散的前兆是海绵窦血栓形成、偏瘫、精神状态改变和局灶性癫痫[13]。该病例考虑患者吸入了毛霉菌的孢子,孢子形成菌丝后开始迅速扩散,向上破坏筛板进入颅腔,向下定植于气管管壁。菌丝侵犯血管引起了海绵窦血栓,导致动眼神经麻痹出现左侧瞳孔散大,而颅内弥漫性感染引起多发动脉血栓形成,因此头颅MR提示多发脑梗死,同时患者的意识状态不断加重,最终进入昏迷阶段。
毛霉菌病的明确诊断需要找到真菌侵袭的组织病理学证据[14],近些年基于聚合酶链反应技术的分子检测也有助于快速诊断[15]。需要特别注意的是,真菌标志物β-D-葡聚糖或半乳甘露聚糖检测结果为阴性的患者尚不能排除毛霉菌感染,因为毛霉菌的细胞壁上不存在上述两种成分[9]。
毛霉菌病的高效治疗依赖于临床检验及影像学的快速诊断,应用两性霉素B脂质制剂抗真菌治疗,结合外科清创术以及去除潜在危险因素是治疗的根本措施,待临床特征及影像学表现趋于稳定或好转时,抗真菌治疗药物可更换为伊沙康唑或泊沙康唑[16]。单独使用抗真菌药物尚不足以控制感染,还需要及时的外科干预包括广泛清创和局部坏死组织的切除手术[4]。除以上常规治疗方案外,高压氧、粒细胞-巨噬细胞集落刺激因子以及γ-干扰素等辅助疗法也有一定效果[17]。
尽管积极抗真菌结合外科清创术治疗,毛霉菌病的预后依然很差,病死率在25%~80%,具体取决于感染扩散程度、治疗的及时性以及存在的危险因素[4],研究表明及时的联合治疗方案更有利于毛霉菌病患者的预后[18]。
临床医生需要高度重视毛霉菌病,在控制和消除危险因素的同时,快速的组织病理学辅以影像学诊断以及及时的抗真菌治疗联合外科清创术是挽救患者生命的重要措施。
利益冲突 所有作者声明无利益冲突
| [1] | 许蕊, 陈芳艳, 赵静雅, 等. 毛霉菌病预防与控制研究进展[J]. 中华医院感染学杂志, 2023, 33(13): 2075-2080. |
| [2] | Prakash H, Chakrabarti A. Global epidemiology of mucormycosis[J]. J Fungi (Basel), 2019, 5(1): 26. DOI:10.3390/jof5010026 |
| [3] | Petrikkos G, Skiada A, Lortholary O, et al. Epidemiology and clinical manifestations of mucormycosis[J]. Clin Infect Dis, 2012, 54(Suppl 1): S23-S34. DOI:10.1093/cid/cir866 |
| [4] | Pai V, Sansi, Kharche R, et al. Rhino-orbito-cerebral mucormycosis: pictorial review[J]. Insights Imaging, 2021, 12(1): 167. DOI:10.1186/s13244-021-01109-z |
| [5] | Ibrahim AS, Spellberg B, Walsh TJ, et al. Pathogenesis of mucormycosis[J]. Clin Infect Dis, 2012, 54(Suppl 1): S16-S22. DOI:10.1093/cid/cir865 |
| [6] | Rammaert B, Lanternier F, Poirée S, et al. Diabetes and mucormycosis: a complex interplay[J]. Diabetes Metab, 2012, 38(3): 193-204. DOI:10.1016/j.diabet.2012.01.002 |
| [7] | McCarthy M, Rosengart A, Schuetz AN, et al. Mold infections of the central nervous system[J]. N Engl J Med, 2014, 371(2): 150-160. DOI:10.1056/NEJMra1216008 |
| [8] | Spellberg B, Edwards J Jr, Ibrahim A. Novel perspectives on mucormycosis: pathophysiology, presentation, and management[J]. Clin Microbiol Rev, 2005, 18(3): 556-569. DOI:10.1128/CMR.18.3.556-569.2005 |
| [9] | Spoor J, Farajifard H, Rezaei N. Congenital neutropenia and primary immunodeficiency diseases[J]. Crit Rev Oncol Hematol, 2019, 133: 149-162. DOI:10.1016/j.critrevonc.2018.10.003 |
| [10] | Lamaris GA, Ben-Ami R, Lewis RE, et al. Increased virulence of Zygomycetes organisms following exposure to voriconazole: a study involving fly and murine models of zygomycosis[J]. 2009, 199(9): 1399-1406. DOI: 10.1086/597615. |
| [11] | Maurer JR, Tullis DE, Grossman RF, et al. Infectious complications following isolated lung transplantation[J]. Chest, 1992, 101(4): 1056-1059. DOI:10.1378/chest.101.4.1056 |
| [12] | Mallis A, Mastronikolis SN, Naxakis SS, et al. Rhinocerebral mucormycosis: an update[J]. Eur Rev Med Pharmacol Sci, 2010, 14(11): 987-992. |
| [13] | Wali U, Balkhair A, Al-Mujaini A. Cerebro-rhino orbital mucormycosis: an update[J]. J Infect Public Health, 2012, 5(2): 116-126. DOI:10.1016/j.jiph.2012.01.003 |
| [14] | 冯亚辉, 李秀国, 史冬梅. 鼻脑型毛霉病病原菌及发病机制研究进展[J]. 中国麻风皮肤病杂志, 2020, 36(12): 754-759. DOI:10.12144/zgmfskin202012754 |
| [15] | Skiada A, Pavleas I, Drogari-Apiranthitou M. Epidemiology and diagnosis of mucormycosis: an update[J]. J Fungi, 2020, 6(4): 265. DOI:10.3390/jof6040265 |
| [16] | Skiada A, Lass-Floerl C, Klimko N, et al. Challenges in the diagnosis and treatment of mucormycosis[J]. Med Mycol, 2018, 56(suppl_1): 93-101. DOI:10.1093/mmy/myx101 |
| [17] | Spellberg B, Ibrahim A, Roilides E, et al. Combination therapy for mucormycosis: why, what, and how?[J]. Clin Infect Dis, 2012, 54(Suppl 1): S73-S78. DOI:10.1093/cid/cir885 |
| [18] | Honavar SG. Code Mucor: guidelines for the diagnosis, staging and management of rhino-orbito-cerebral mucormycosis in the setting of COVID-19[J]. Indian J Ophthalmol, 2021, 69(6): 1361-1365. DOI:10.4103/ijo.IJO_1165_21 |
 2024, Vol. 33
2024, Vol. 33