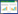脓毒症是临床常见的因宿主对感染的反应失调而致的危及生命的器官功能障碍,尽管医疗技术不断发展,目前全球每年新发脓毒症患者约3 000万例,死亡约600万例,如何降低高病死率是医学界的一项重要任务[1-3]。脓毒症与不同程度的凝血功能障碍有关,发生率约为50%~70%,常表现为静脉血栓栓塞、出血,甚至弥散性血管内凝血(disseminated intravascular coagulation, DIC)[4]。严重的凝血功能障碍或DIC会增加脓毒症患者的病死率,因此尽早识别凝血功能异常并进行有效干预有助于改善脓毒症患者的不良预后[5-6]。传统的凝血检测如凝血酶原时间、活化部分凝血活酶时间和凝血酶时间在临床应用中较为广泛,但只能反映凝血功能的部分变化,无法体现凝血过程的全貌,血栓弹力图(thrombelastography, TEG)和旋转血栓弹力图(rotational thromboelastometry, ROTEM)是一种快速、动态、全面评估凝血、纤溶、血小板功能的检测手段,能够监测整个凝血过程[7]。虽然研究表明TEG/ROTEM对识别脓毒症凝血异常有一定价值,并且发现其与脓毒症患者的预后有关[8-10]。但是部分报道的结果缺乏一致性[11-12],且单个研究反映的结果可能存在一定的片面性,在一些原始研究中脓毒症样本的数量较少,导致研究效能降低。本研究通过Meta分析比较脓毒症患者死亡组和生存组TEG/ROTEM参数簇的统计学差异,探讨TEG/ROTEM对脓毒症患者的预后意义,为临床早期预防、合理治疗、改善预后提供证据。
1 资料与方法 1.1 文献检索策略计算机系统检索PubMed、Embase、The Cochrane Library、Web of Science、中国知网(CNKI)、中国生物医学文献数据库(CBM)、中文科技期刊全文数据库(VIP)及万方数据库,检索时间为建库至2023年4月20日。采用主题词与自由词结合的方式进行检索,英文关键词包括" sepsis" " pyemia" " septic shock" " septicemia" " thrombelastography" " TEG" " thromboelastography" " thromboelastometry" " rotational thromboelastometry" " ROTEM" ;中文关键词包括脓毒症、脓毒血症、脓毒性休克、感染性休克、败血症、血栓弹力图。
1.2 文献纳入标准和排除标准纳入文献需要满足下列全部标准:(1)研究类型:随机对照试验(平行随机对照试验、整群随机对照试验、随机交叉试验)或观察性研究(包括队列研究、病例对照研究、巢式病例对照研究、横断面研究)。(2)研究对象:年龄≥18岁的脓毒症或脓毒性休克患者,且符合当时国际指南对脓毒症或脓毒性休克的定义标准,不限制脓毒症患者的性别、种族和所在地区。(3)结局指标:比较脓毒症患者死亡组与生存组TEG/ROTEM参数簇的差异性,提取的TEG参数包括R值、K值、α角、MA值、CI、LY30。提取的ROTEM参数包括INTEM(CT值、MCF值、LI60)、EXTEM(CT值、MCF值、LI30、LI45、LI60)、和NATEM(CT值、CFT值、MCF值)。R值和CT值表示凝血过程开始的时间,该值延长表示体内缺乏凝血因子,表明存在低凝状态,反之则表示体内存在高凝状态;K值和CFT值反映凝血的动力状态,该值延长表示纤维蛋白原功能降低,反之则表示纤维蛋白原功能亢进;MA和MCF值聚焦于血凝块的强度,该值升高,表示血小板功能过度活跃,反之则表示血小板功能降低;α角反映血凝块形成的速率,角度越大说明形成血凝块的速度越快;CI能对整个凝血过程进行评价;LY30和LI30、LI45、LI60表示血块溶解[10]。(4)脓毒症患者死亡判定时间点明确。(5)死亡组与生存组的基本信息均衡可比,样本量明确。
排除标准:(1)重复发表研究、或报道信息太少、方法学质量低、偏倚严重;(2)系统综述、Meta分析、动物实验、会议摘要或信件;(3)基于同一群脓毒症患者的研究,排除研究样本量更小的文献;(4)原文献的TEG参数结果无法提取或转换为均数或标准差。
1.3 文献筛选和数据提取由2名研究者采用NoteExpress 3.8.0软件进行文献管理,独立地筛选文献、提取数据并交叉核对,若意见不统一,则与第三方共同讨论决定。对纳入文献提取下列的数据:第一作者姓名、发表时间、国家、研究类型、样本量、脓毒症诊断标准、年龄、性别、TEG检验时间、脓毒症患者死亡判定时间与结局指标。如遇到文献数据缺失或存在疑问,与原作者取得联系后予以补充,若最终相关资料无法获取,则排除该篇文献。
1.4 文献质量评价采用纽卡斯尔-渥太华文献质量评价量表(New Castle-Ottawa scale, NOS)[13]进行队列研究的方法学质量评价,评价指标包含以下条目:研究人群的选择(0~4分)、组间可比性(0~3分)、结果测量(0~2分)。评分7~9分为高质量研究,4~6分为中质量研究,≤3分为低质量研究。文献质量的评价由2名研究者独立进行。
1.5 统计学方法采用R 4.3.0软件(meta程序包)进行数据统计分析,分别对不同的TEG/ROTEM参数进行定量分析。连续性变量采用均数差(mean difference, MD)和95%CI作为效应量指标,当结局指标测量单位不同或研究之间数值差异较大时采用标准化均数差(standardized mean difference, SMD)和95%CI作为效应量指标。数据提取过程中利用之前研究的统计学公式[14]将中位数和四分位数转换为均值和标准差。对纳入文献应用Q检验和I2检验检测研究间的异质性,若各研究之间的统计学异质性较小(P≥0.1,I2≤50%),则选择固定效应模型进行Meta分析;若各研究之间存在较大统计学异质性(P < 0.1,I2 > 50%),则选择随机效应模型进行Meta分析[15]。采用漏斗图(如表现为不对称,则存在发表性偏倚,反之,则为无发表偏倚[16])及Egger检验(P > 0.05说明不存在偏倚[17])分析研究结果是否存在发表偏倚。按照年龄、死亡判定时间、样本量进行亚组分析以及Meta回归分析以探究异质性的来源。与其他文献的研究内容、研究方法、结局指标等差异较大时,仅进行描述性分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 文献检索结果中英文数据库检索共获得1 470篇相关文献,经过NoteExpress 3.8.0软件去重后获得846篇文献,阅读题目和摘要后删除不相关文献817篇,通过全文评估对剩余的29篇文献进行二次筛选后排除13篇文献,最终纳入16篇[11-12, 18-31]文献。文献筛选流程见图 1。
|
| 图 1 文献筛选流程及结果 |
|
|
纳入的16篇文献的基本特征和文献质量评价结果见表 1。其中中文文献8篇,英文文献8篇;预后判定时间为10~90 d;血栓弹力图检验时间为入院15 min至确诊后3 d;发表时间主要集中在2011—2022年,合计纳入1 864例脓毒症患者,其中死亡组620例,生存组1 244例。纳入文献的NOS评分为5~8分,高质量(≥7分)文献11篇,文献的整体质量评价较高。
| 作者,发表年份,国家 | 研究时期,研究类型 | 总样本量(死亡/生存) | 年龄{岁,x±s或M[(Q1,Q3)]},男性占比 | 脓毒症诊断标准 | 血栓弹力图的检验时间 | 预后判定时间 | TEG/ROTEM参数 | NOS评分 |
| Guo X[18],2022,中国 | 2016.01-2018.01回顾性队列研究 | 141(49/92) | 死亡组72.0 (63.0, 82.0),75.5% 生存组73.0 (59.3, 80.0),62.0% | 2016年国际脓毒症诊治指南 | 入ICU时 | 28 d | TEG:R(min)、K(min)、α角(°)、MA(mm)、LY30(%) | 7 |
| 张涛[19],2022,中国 | 2020.01-2021.06回顾性队列研究 | 100(40/60) | 死亡组71.6±11.9,60.0% 生存组70.9±13.9,48.3% | 第三个国际脓毒症/脓毒性休克共识 | 入院当天 | 90 d | TEG:R(min)、K(min)、α角(°)、MA(mm) | 8 |
| 梁继芳[20],2022,中国 | 2018.12-2020.02回顾性队列研究 | 63(42/21) | 死亡组81.0±9.4,69.0% 生存组79.8±8.4,57.1% | 2016年第3版脓毒症/脓毒性休克标准 | 入ICU 24 h | 28 d | TEG:MA(mm) | 8 |
| 印明珠[21],2022,中国 | 2020.01-2021.09回顾性队列研究 | 271(115/156) | 死亡组63.0±15.0,64.3% 生存组63.0±18.0,57.7% | 第三个国际脓毒症/脓毒性休克共识 | 入院24 h | 28 d | TEG:R(min)、K(min)、α角(°)、MA(mm)、CI、LY30(%) | 7 |
| Kim SM[11],2021,韩国 | 2016.01-2019.12前瞻性队列研究 | 414(47/367) | 死亡组69.4±12.9,59.6% 生存组65.8±12.3,57.2% | 未报告 | 入院15 min | 28 d | TEG:R(min)、K(min)、α角(°)、MA(mm)、LY30(%) | 7 |
| Ninan KF[22],2021,印度 | 2017.04-2018.06前瞻性队列研究 | 87(26/61) | 死亡组52 (16, 52),69.2% 生存组40 (50, 58),50.8% | 中低收入国家脓毒症器官衰竭快速评分 | 入院24 h | 30 d | TEG:R(min)、K(min)、α角(°)、MA(mm) | 8 |
| Isngadi [23],2021,印度尼西亚 | 2019.03-2019.09前瞻性队列研究 | 30(17/13) | 46.2(均数),53.3% | 未报告 | 未报告 | 10 d | TEG:R(min)、K(min)、α角(°)、MA(mm)、CI、LY30(%) | 5 |
| 张伟[24],2021,中国 | 2020.01-2020.09回顾性队列研究 | 85(20/65) | 未报告 | 第三个国际脓毒症/脓毒性休克共识 | 入院第2 d | 28 d | TEG:R(min)、K(min)、α角(°)、MA(mm)、CI | 6 |
| 贾明雅[25],2021,中国 | 2016.01-2019.05回顾性队列研究 | 117(41/76) | 死亡组65.7±12.4,63.4% 生存组63.1±18.8,61.8% | 2014年中国严重脓毒症/脓毒性休克治疗指南 | 入院当时 | 28 d | TEG:R(min)、K(min)、α角(°)、MA(mm) | 7 |
| 钟林翠[12],2020,中国 | 2018.05-2019.07回顾性队列研究 | 80(29/51) | 死亡组71.2±14.7,65.5% 生存组63.5±16.8,58.8% | 第三个国际脓毒症/脓毒性休克共识 | 入院2 h | 90 d | TEG:R(min)、K(min)、α角(°)、MA(mm) | 8 |
| 郭嘉仲[26],2019,中国 | 2016.07-2018.07回顾性队列研究 | 60(34/26) | 未报告 | 第三个国际脓毒症/脓毒性休克共识 | 入院24 h | 60 d | TEG:MA(mm)、CI | 7 |
| Scărlătescu E[27],2018,罗马尼亚 | 未报告回顾性队列研究 | 76(56/20) | 死亡组65.8±14.8,57.1% 生存组65.5±13.3,70.0% | 第三个国际脓毒症/脓毒性休克共识 | 纳入研究后36 h内 | 未报告 | ROTEM EXTEM:CT(s)、MCF(mm)、LI30(%)、LI45(%)、LI60(%) | 6 |
| 况芳[28],2018,中国 | 2017.04-2017.11未报告 | 50(16/34) | 死亡组66.0±17.0,81.2% 生存组59.0±18.0,61.8% | 第三个国际脓毒症/脓毒性休克共识 | 入ICU 24 h | 28 d | TEG:R(min)、K(mm)、α角(°)、MA(mm) | 7 |
| Davies GR[29],2018,英国 | 未报告未报告 | 100(17/83) | 未报告 | 1992年脓毒症/器官衰竭治疗指南 | 入院24 h | 28 d | ROTEM EXTEM/INTEMo:CT(s)、MCF(mm)、LI60(%) | 5 |
| Yang W[30],2016,中国 | 2014.01-2014.12回顾性队列研究 | 92(22/70) | 71.7±16.2,56.5% | 2008年国际严重脓毒症/脓毒性休克指南 | 未报告 | 未报告 | TEG:R(min)、K(min)、α角(°)、CI | 6 |
| Adamzik M[31],2011,德国 | 未报告前瞻性队列研究 | 98(49/49) | 死亡组55.3±17.4,53.1% 生存组56.3±16.4,69.4% | 2001年国际脓毒症会议 | 诊断脓毒症后24 h | 30 d | TEG/ROTEM NATEM:CT(s)、CFT(s)、MCF(mm)、α角(°) | 8 |
| 注:TEG为血栓弹力图,ROTEM为旋转血栓弹力图,NOS为纽卡斯尔-渥太华量表,R为凝血反应时间(正常值5~10 min),K为凝血形成时间(正常值1~3 min),α角为纤维蛋白凝块形成及加固的速率(正常值53°~72°),MA为最大振幅(正常值50~70 mm),CI为凝血综合指数,正常值(–3~3),LY30为最大振幅后30 min的振幅衰减率(正常范围0%~8%),CT为凝血时间,MCF为最大血凝块强度,CFT为血凝块形成时间,INTEM为ROTEM测量的内源性途径,EXTEM为ROTEM测量的外源性途径,NATEM为非活化血栓弹性体测定法,LI30、LI45、LI60为凝血后30、45、60 min的裂解指数 | ||||||||
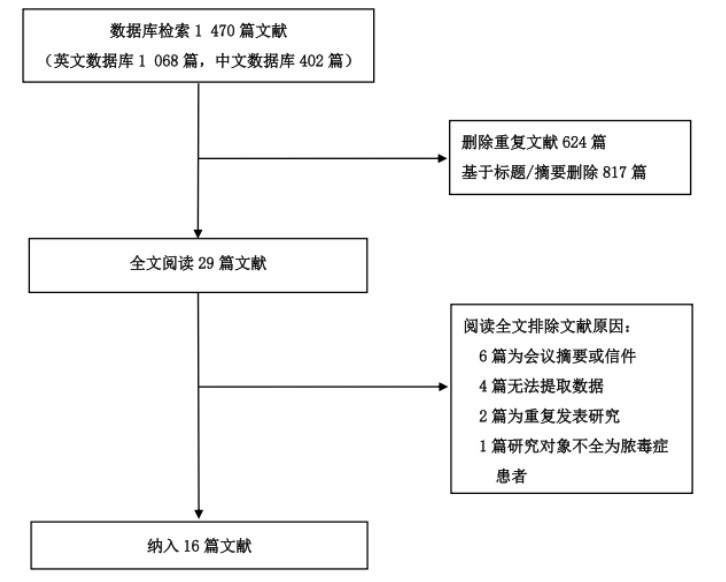
12篇文献研究了TEG-R/ROTEM-CTi值在脓毒症死亡组和存活组间的差异,其中报告TEG-R值11篇[11-12, 18-19, 21-25, 28-30],报告ROTEM-CTi值1篇[29],共1 567例患者,死亡组439例,存活组1 128例。研究间异质性程度较高(P < 0.01,I2=92%),采用随机效应模型合并效应量,Meta分析结果显示脓毒症患者死亡组的R/CTi值高于存活组(SMD=0.98,95%CI: 0.54~1.42,P < 0.01)。见图 2。
|
| 图 2 脓毒症患者死亡组与存活组TEG-R/ROTEM-CTi值的Meta分析森林图 |
|
|
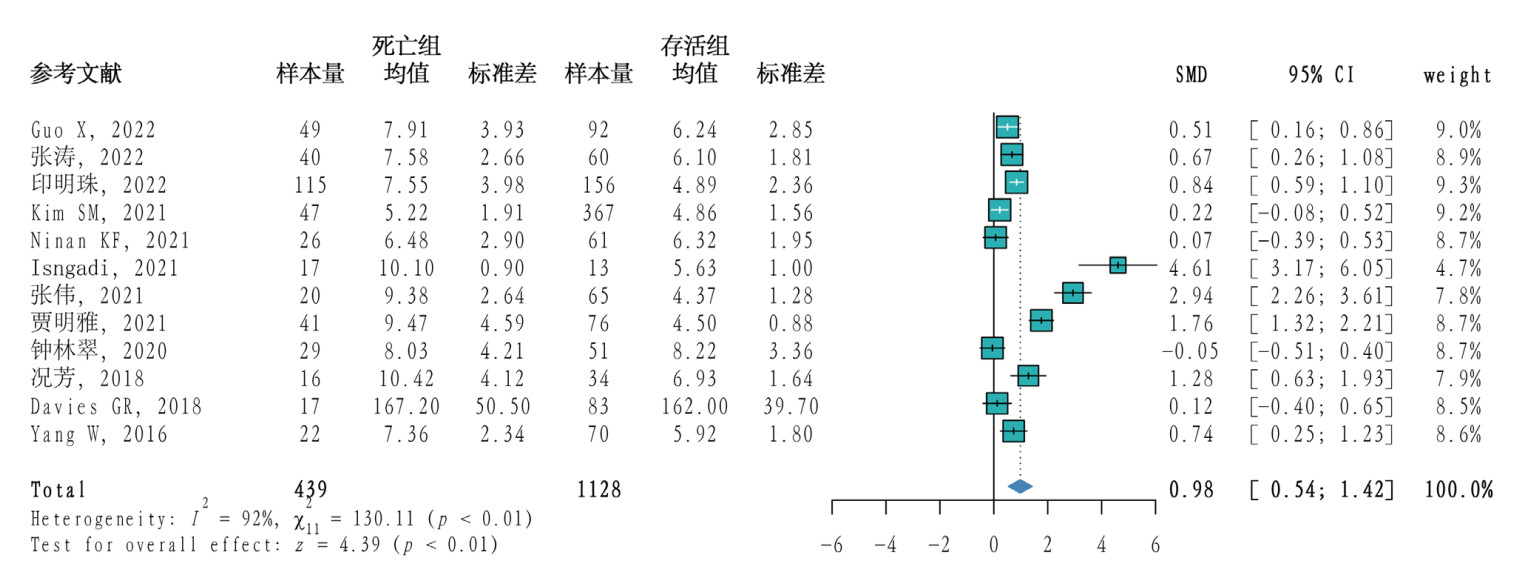
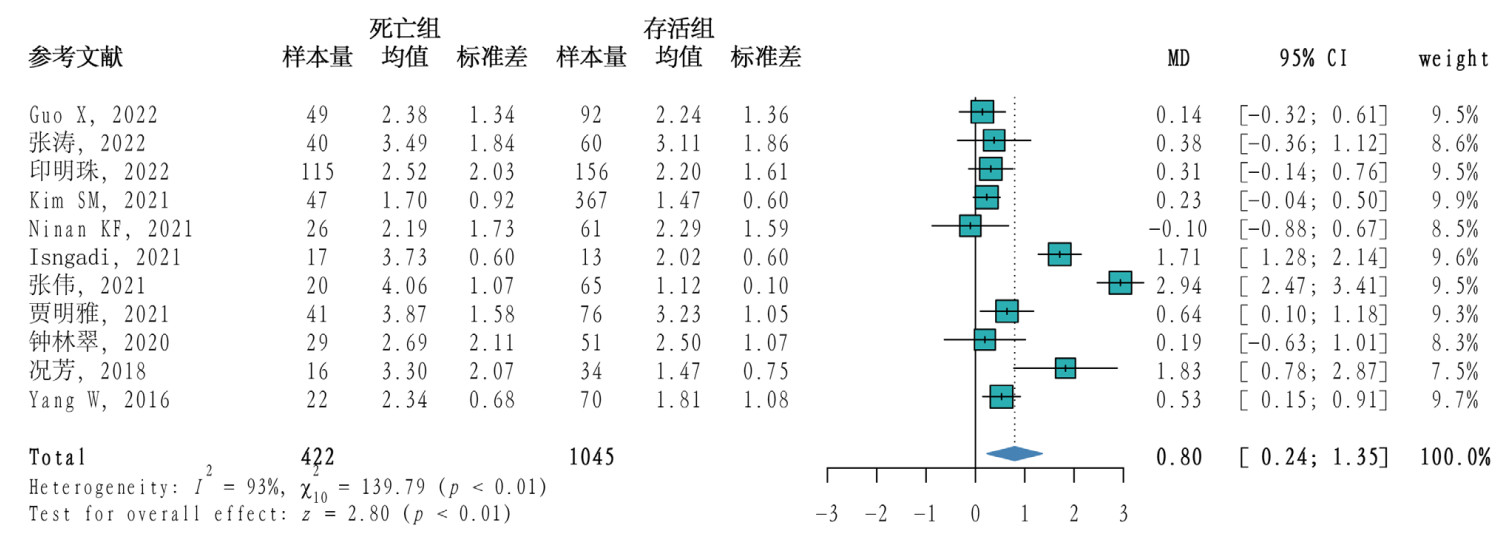
11篇[11-12, 18-19, 21-25, 28, 30]文献研究了TEG-K值在脓毒症死亡组和存活组间的差异,共1 467例患者,其中死亡组422例,存活组1 045例。研究间异质性程度较高(P < 0.01,I2=93%),采用随机效应模型合并效应量,Meta分析结果显示脓毒症患者死亡组的K值高于存活组(MD=0.80,95%CI: 0.24~1.35,P < 0.01)。见图 3。
|
| 图 3 脓毒症患者死亡组与存活组TEG-K值的Meta分析森林图 |
|
|
12篇[11-12, 18-19, 21-25, 28, 30-31]文献研究了TEG-α角在脓毒症死亡组和存活组间的差异,共1 565例患者,其中死亡组471例,存活组1 094例。研究间统计学异质性程度较高(P < 0.01,I2=90%),采用随机效应模型合并效应量,Meta分析结果显示脓毒症患者死亡组α角小于存活组(MD= -9.95,95%CI: -14.15~ -5.75,P < 0.01)。见图 4。
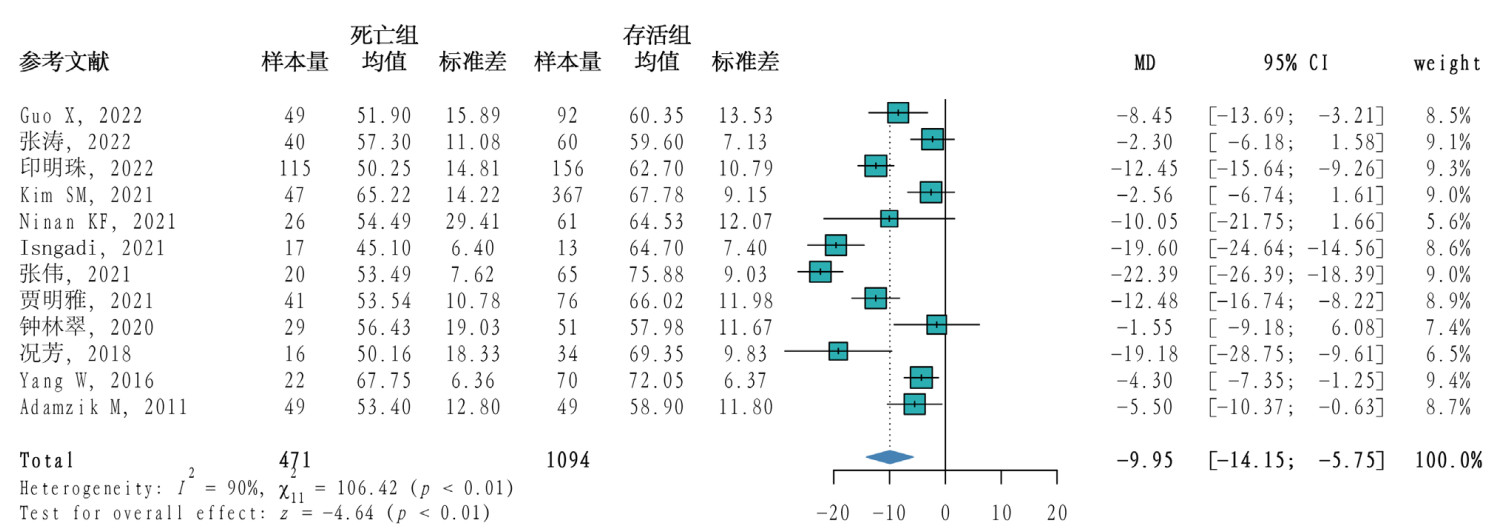
|
| 图 4 脓毒症患者死亡组与存活组TEG-α角的Meta分析森林图 |
|
|
13篇文献比较TEG-MA/ROTEM-MCFi值在脓毒症死亡组和存活组间的统计学差异,其中报告TEG-MA值12篇[11-12, 18-26, 28],报告ROTEM-MCFi值1篇[29],共1 598例患者,其中死亡组493例,存活组1 105例。研究间异质性程度较高(P < 0.01,I2=89%),因此采用随机效应模型合并效应量,Meta分析结果显示脓毒症患者死亡组的MA/MCFi值低于存活组(SMD= -0.84,95%CI: -1.21~ -0.47,P < 0.01)。见图 5。
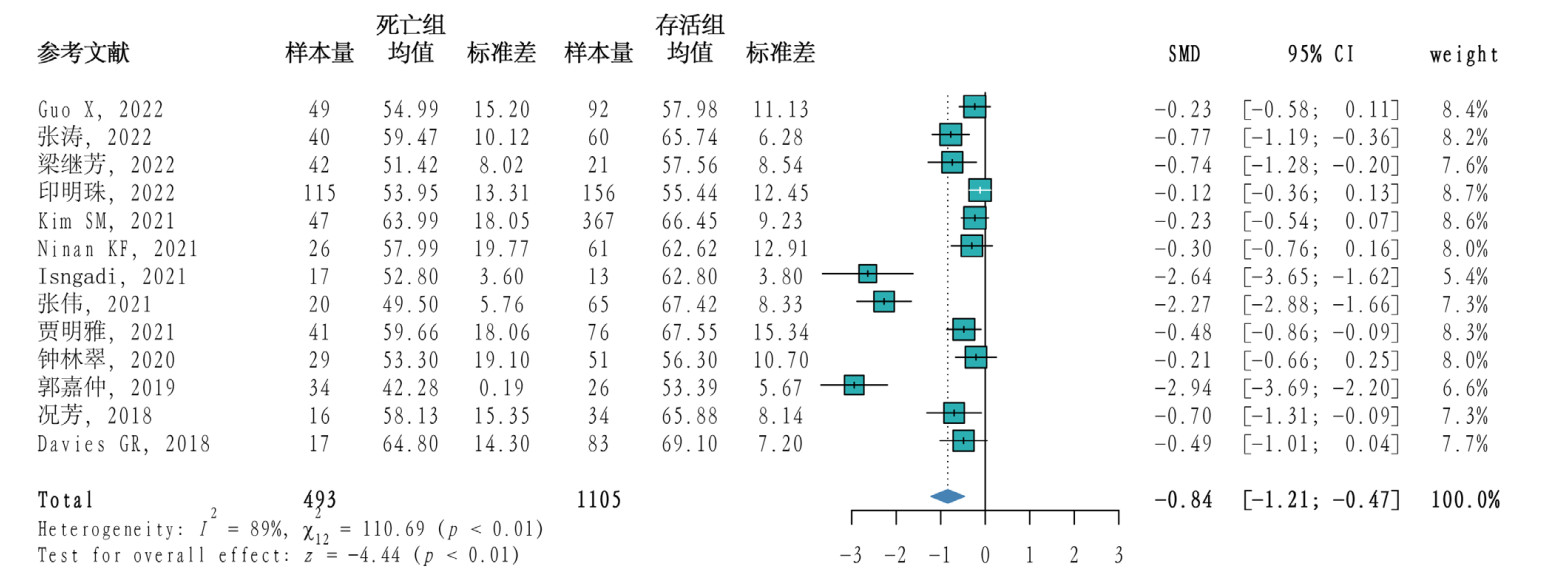
|
| 图 5 脓毒症患者死亡组与存活组TEG-MA/ROTEM-MCFi值的Meta分析森林图 |
|
|
5篇[21, 24, 26, 30]文献研究了TEG-CI在脓毒症死亡组和存活组间的差异,共538例患者,其中死亡组208例,存活组330例。研究间异质性程度较高(P < 0.01,I2=98%),采用随机效应模型合并效应量,Meta分析结果显示脓毒症患者死亡组CI小于存活组(MD= -2.78,95%CI: -3.68~ -1.88,P < 0.01)。见图 6。
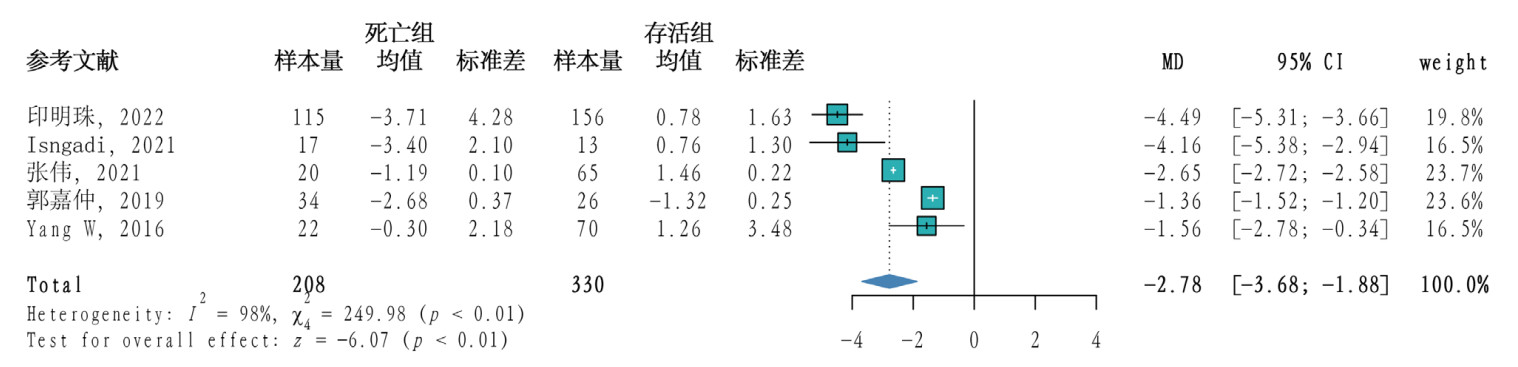
|
| 图 6 脓毒症患者死亡组与存活组TEG-CI的Meta分析森林图 |
|
|
考虑仅4篇[11, 18, 21, 23]文献研究了TEG-LY30,2篇[27, 29]文献研究了EXTEM CT值、MCF值、LI30、LI45、LI60,1篇[31]文献研究了NATEM CT值、CFT值、MCF值,难以实施Meta分析,因此仅进行定性分析。Scărlătescu等[27]发现,脓毒症患者死亡组与生存组在CTe值、MCFe值、LI30、LI45、LI60参数比较中差异无统计学意义。Davies等[29]发现,与生存组相比,死亡组呈低凝状态的趋势;MCFe值差异无统计学意义;不良预后与CTe值延长和纤维蛋白溶解受损(LI60显著增加)有关。Adamzik等[31]发现,与生存组相比,死亡组CFTNa值延长,MCFNa值降低,CTNa值差异无统计学意义。4篇[11, 18, 21, 23]文献研究了LY30,结果均显示脓毒症死亡组与生存组在LY30参数比较差异无统计学意义。
2.3.7 亚组分析和Meta回归结果R/CTi值、K值、α角、MA/MCFi值分别按照脓毒症患者的年龄(≥70岁vs. < 70岁)、死亡判定时间(≥30 d vs. < 30 d)、样本量(≥100例vs. < 100例)进行亚组分析和Meta回归寻找潜在的异质性来源。在所有的亚组中,除了R/CTi值和K值在死亡判定时间≥30 d的研究中差异无统计学意义,其他亚组分析结果均与整体分析结果一致。Meta回归分析未发现各研究指标异质性的来源。见表 2。
| 参数 | 年龄 | P值 | 预后判定时间 | P值 | 总样本量 | P值 | |||||||||
| ≥70岁 | < 70岁 | ≥30 d | < 30 d | ≥100例 | < 100例 | ||||||||||
| ES(95%CI) | I2(%) | ES(95%CI) | I2(%) | ES(95%CI) | I2(%) | ES(95%CI) | I2(%) | ES(95%CI) | I2(%) | ES(95%CI) | I2(%) | ||||
| R/CTi | 0.47 (0.14, 0.80) | 58.5 | 1.24 (0.56, 1.92) | 93.2 | 0.314 | 0.24 (-0.21, 0.70) | 68.7 | 1.37 (0.75, 1.99) | 93.7 | 0.204 | 0.69 (0.28, 1.10) | 87.2 | 1.69 (0.35, 3.03) | 95.7 | 0.273 |
| K | 0.36 (0.10, 0.62) | 0.0 | 0.73 (0.14, 1.33) | 88.2 | 0.343 | 0.16 (-0.29, 0.61) | 0.0 | 1.10 (0.29, 1.90) | 95.4 | 0.205 | 0.29 (0.10, 0.48) | 0.0 | 1.19 (0.23, 2.16) | 94.2 | 0.135 |
| α角 | -4.21 (-6.73, -1.69) | 23.4 | -11.37 (-16.10, -6.63) | 83.2 | 0.070 | -3.64 (-6.38, -0.90) | 0.0 | -13.66 (-18.96, -8.35) | 89.4 | 0.048 | -7.76 (-12.36, 2.99) | 84.9 | -11.80 (-18.96, -4.64) | 92.0 | 0.359 |
| MA/MCFi | -4.47 (-0.78, -0.16) | 51.1 | -0.56 (-0.95, -0.17) | 81.3 | 0.804 | -1.02 (-1.97, -0.08) | 93.1 | -0.78 (-1.20, -0.37) | 88.0 | 0.767 | -0.35 (-0.54, -0.15) | 44.9 | -1.38 (-2.18, -0.57) | 92.2 | 0.070 |
| 注:TEG为血栓弹力图,ROTEM为旋转血栓弹力图,R为凝血反应时间(正常值5~10 min),K为凝血形成时间(正常值1~3 min),α角为纤维蛋白凝块形成及加固的速率(正常值53°~72°),MA为最大振幅(正常值50~70 mm),CT为凝血时间,MCF为最大血凝块强度,INTEM为ROTEM测量的内源性途径 | |||||||||||||||
发表偏倚采用漏斗图和Egger检验进行评估。漏斗图结果显示(图 7),R/CTi值、K值、α角两侧研究分布对称,MA/MCFi值两侧研究分布不对称,由于CI纳入的研究小于10篇,漏斗图的检验效能较低,故不予进行漏斗图分析。Egger检验显示,R/CTi值、K值、α角和CI值均P > 0.05,表明以上四个参数均不存在发表偏倚;MA/MCFi值的P < 0.001,表明存在发表偏倚。
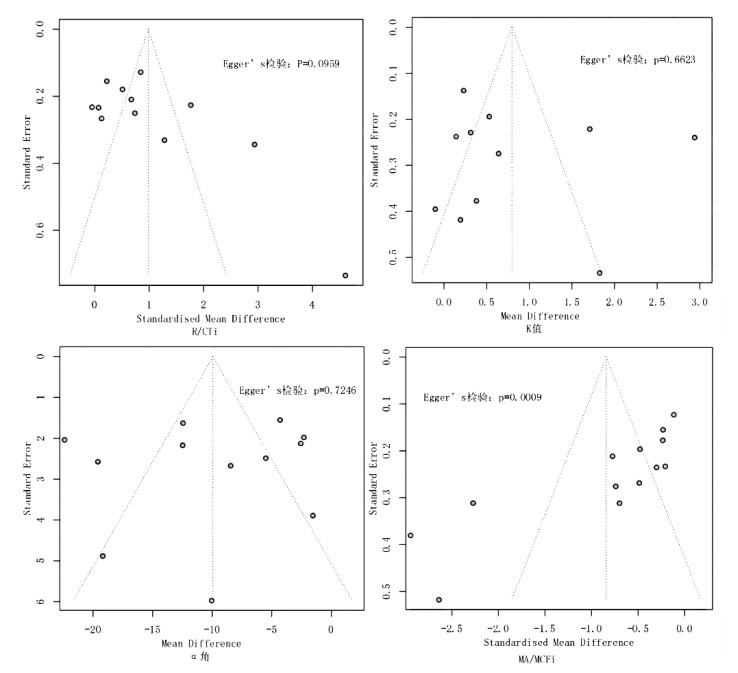
|
| 图 7 脓毒症患者死亡组与存活组TEG/ROTEM各参数的漏斗图及Egger检验 |
|
|
脓毒症会导致多器官功能损害,是危重症患者死亡的主要原因,尽管近年来有关脓毒症基础实验和临床研究取得了一定进展,但由于其发病过程复杂,临床诊治往往面临许多困难,治疗效果不佳[32-33]。凝血功能障碍伴随脓毒症持续存在,脓毒症患者凝血功能的激活以及抗凝和纤溶功能的下调是影响脓毒症预后的重要因素,监测患者凝血状态,及时发现凝血功能紊乱,有利于为患者制定个性化治疗方案,将凝血功能维持在最佳状态[34-35]。
目前临床主要通过常规凝血指标的检测来确定凝血功能,但只能反映凝血的一个阶段,凝血状态不能明确确定。TEG/ROTEM是一种全方面提供凝血功能过程的曲线图,能动态分析血小板、凝血因子、纤维蛋白原等血液成分之间相互作用、血凝块形成和纤维蛋白溶解全过程,在检测DIC风险方面有良好的敏感度和特异度[36-37]。TEG/ROTEM在临床中应用越来越广泛,已被证明可以用于多发创伤的凝血检测、诊断纤维蛋白原缺乏和指导成分输血,并可能降低心脏、创伤和其他出血患者的病死率[38-39]。此外已有研究显示[40],血栓弹力图在评估严重脓毒症或DIC患者的全凝血能力方面是一个有价值的辅助工具。
基于TEG/ROTEM以上特性,有研究者猜想是否可以根据脓毒症患者死亡组与生存组在TEG/ROTEM参数之间的差异性预测脓毒症患者的预后,以此改善脓毒症患者的临床结局。2014年Müller等[41]进行了类似的系统综述共纳入18项研究,结果显示TEG/ROTEM能够检测脓毒症引起的凝血功能障碍。但纳入文献的参数变化不均匀,研究设计差异很大且未进行定量分析。2021年Boscolo等[42]发表的系统评价共纳入11项研究,结果显示R/CTi值、K/CFTi值和CTe延长与死亡风险增加相关。但由于纳入的文献数量相对较少,证据质量较低,其结论有待进一步验证。
本研究全面搜索了国内外针对脓毒症患者死亡组和生存组在TEG/ROTEM参数簇差异的研究。最终纳入了16篇队列研究,共1 864例患者进行Meta分析。根据两组患者TEG/ROTEM各参数的差异结果显示,与生存组比较,死亡组的R/CTi和K值延长,α角、MA/MCFi值、CI降低,提示死亡组的凝血功能处于一种相对低凝状态,这种差异可能增加脓毒症患者的死亡风险。高凝状态是脓毒症早期诱发的凝血功能障碍的显著特征,在脓毒症后期(DIC期)向低凝状态转变。研究显示,处于低凝状态的脓毒症患者发生脓毒症休克的概率更高,这表明低凝状态在脓毒症死亡患者中很常见[43]。此外,脓毒症凝血功能障碍是因为激活炎症介质和血管内皮细胞损伤所导致[21],在全身感染期间会增强凝血功能,减少细菌侵入组织,相反低凝状态可能促进感染的扩散,进而导致死亡[44]。Haase等[45]发现,血栓弹力图中各参数如果总体处于低凝状态,会增加脓毒症的死亡风险,与本研究结果一致。Boscolo等[46]研究表明,血液处于低凝状态和血小板功能受损与脓毒症患者的高死亡风险有关,血栓弹力图有助于识别短期高死亡风险的脓毒症患者,进一步证实了TEG/ROTEM参数对脓毒症患者的预后有参考价值。但本研究纳入文献存在一定的异质性,如疾病严重程度不同、年龄段不同、人种差异以及性别差异等均不可避免地造成一定偏倚,因此,进一步以年龄、样本量、预后判定时间进行亚组分析。亚组分析显示,除了在死亡判定时间≥30 d的研究中未发现脓毒症死亡组和存活组R/CTi值和K值差异存在统计学意义,其他亚组分析结果均差异存在统计学意义。Isngadi等[23]的文献较其他文献异质性高,可能与其纳入的样本量少和预后判定时间较短有关。后续需要不断更新数据库,纳入更多的文献,在文献数量充足的基础上,继续细分亚组,探究异质性的来源。
本研究仍然存在一定的局限性:(1)本研究存在一定的异质性,由于数据缺乏,未能根据疾病病程、严重程度、性别、地区等因素进行亚组分析;(2)只纳入了前瞻性和回顾性队列研究,可能存在混杂因素;(3)纳入文献的患者样本采集、测量时间不一致,检验设备、参数不同,对其结果进行合并分析时可能存在偏倚。
综上所述,R/CTi和K值延长,α角、MA/MCFi值、CI降低,提示患者凝血功能处于低凝状态,脓毒症患者的死亡风险增加。本研究为临床脓毒症患者预后提供了一定的参考价值,识别与不良预后相关的参数,能帮助临床医生为患者提供恰当的临床监测手段和治疗策略。同时考虑到研究的局限性,今后还需要展更多高质量及大样本研究予以验证。
利益冲突 所有作者声明无利益冲突
| [1] | Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021[J]. Intensive Care Med, 2021, 47(11): 1181-1247. DOI:10.1007/s00134-021-06506-y |
| [2] | Machado FR, Zampieri FG, Myatra SN. Fighting sepsis: still a long way to go[J]. Lancet Respir Med, 2023, 11(2): 129-131. DOI:10.1016/S2213-2600(23)00006-1 |
| [3] | Lorencio Cárdenas C, Yébenes JC, Vela E, et al. Trends in mortality in septic patients according to the different organ failure during 15 years[J]. Crit Care, 2022, 26(1): 302. DOI:10.1186/s13054-022-04176-w |
| [4] | 董亦鸣, 曾湘鹏, 赵会鑫, 等. 联合凝血和炎症标志物早期识别脓毒症DIC和评估预后的临床价值[J]. 中华急诊医学杂志, 2022, 31(12): 1654-1662. DOI:10.3760/cma.j.issn.1671-0282.2022.12.015 |
| [5] | Semeraro N, Ammollo CT, Semeraro F, et al. Sepsis, thrombosis and organ dysfunction[J]. Thromb Res, 2012, 129(3): 290-295. DOI:10.1016/j.thromres.2011.10.013 |
| [6] | Samuels JM, Moore HB, Moore EE. Coagulopathy in severe sepsis: interconnectivity of coagulation and the immune system[J]. Surg Infect, 2018, 19(2): 208-215. DOI:10.1089/sur.2017.260 |
| [7] | Whitton TP, Healy WJ. Review of thromboelastography (TEG): medical and surgical applications[J]. Ther Adv Pulm Crit Care Med, 2023, 18: 29768675231208426. DOI:10.1177/29768675231208426 |
| [8] | 陈瑞娟, 望亭松, 车在前, 等. 血栓弹力图在判断脓毒症患者早期凝血功能异常中的价值[J]. 中国急救医学, 2014, 34(6): 490-493. DOI:10.3969/j.issn.1002-1949.2014.06.003 |
| [9] | Ostrowski SR, Windeløv NA, Ibsen M, et al. Consecutive thrombelastography clot strength profiles in patients with severe sepsis and their association with 28-day mortality: a prospective study[J]. J Crit Care, 2013, 28(3): 317. DOI:10.1016/j.jcrc.2012.09.003 |
| [10] | Scarlatescu E, Juffermans NP, Thachil J. The current status of viscoelastic testing in septic coagulopathy[J]. Thromb Res, 2019, 183: 146-152. DOI:10.1016/j.thromres.2019.09.029 |
| [11] | Kim SM, Kim SI, Yu G, et al. Role of thromboelastography in the evaluation of septic shock patients with normal prothrombin time and activated partial thromboplastin time[J]. Sci Rep, 2021, 11(1): 11833. DOI:10.1038/s41598-021-91221-3 |
| [12] | 钟林翠, 宋景春, 邓星平, 等. 血栓调节蛋白联合凝血酶-抗凝血酶复合物判断脓毒症预后的临床价值[J]. 解放军医学杂志, 2020, 45(7): 746-750. DOI:10.11855/j.issn.0577-7402.2020.07.12 |
| [13] | Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J]. Eur J Epidemiol, 2010, 25(9): 603-605. DOI:10.1007/s10654-010-9491-z |
| [14] | Estimating the sample mean and standard deviation (SD) from the five-number summary and its application in meta-analysis[EB/OL]. [2023-05-19]. https://www.math.hkbu.edu.hk/~tongt/papers/median2mean.html. |
| [15] | Higgins JPT, Thompson SG, Deeks JJ, et al. Measuring inconsistency in meta-analyses[J]. BMJ, 2003, 327(7414): 557-560. DOI:10.1136/bmj.327.7414.557 |
| [16] | 康德英, 洪旗, 刘关键, 等. Meta分析中发表性偏倚的识别与处理[J]. 中国循证医学杂志, 2003, 3(1): 45-49. DOI:10.3969/j.issn.1672-2531.2003.01.010 |
| [17] | Sterne JA, Egger M. Funnel plots for detecting bias in meta-analysis: guidelines on choice of axis[J]. J Clin Epidemiol, 2001, 54(10): 1046-1055. DOI:10.1016/s0895-4356(01)00377-8 |
| [18] | Guo X, Shuai XY, Cai TT, et al. The thrombodynamic ratio as a predictor of 28-day mortality in sepsis patients[J]. Clin Chim Acta, 2022, 531: 399-405. DOI:10.1016/j.cca.2022.04.994 |
| [19] | 张涛, 万亚楠, 卢昕媛, 等. 血栓弹力图对脓毒症患者弥散性血管内凝血的诊断价值及预后的影响[J]. 临床急诊杂志, 2022, 23(7): 476-481. DOI:10.13201/j.issn.1009-5918.2022.07.004 |
| [20] | 梁继芳, 王秀哲, 杨晓静, 等. 血栓弹力图最大血块强度值联合动脉血乳酸检测对老年脓毒症患者预后的评估价值[J]. 中华老年医学杂志, 2022, 41(2): 168-172. DOI:10.3760/cma.j.issn.0254-9026.2022.02.009 |
| [21] | 印明珠, 孙明, 燕宪亮. 血栓弹力图、凝血功能与平均血小板体积/血小板计数比值的联合监测对脓毒症患者预后的评估[J]. 中华急诊医学杂志, 2022, 31(10): 1347-1352. DOI:10.3760/cma.j.issn.1671-0282.2022.10.009 |
| [22] | Ninan KF, Iyadurai R, Varghese JK, et al. Thromboelastograph: a prognostic marker in sepsis with organ dysfunction without overt bleeding[J]. J Crit Care, 2021, 65: 177-183. DOI:10.1016/j.jcrc.2021.06.005 |
| [23] | Isngadi, Asmoro AA, Wiraharjanegara HA, et al. Thromboelastography (TEG) and hemostatic parameters as the diagnostic parameter of septic mortality in the intensive care unit[J]. Crit Care Shock, 2021(24): 281-292. |
| [24] | 张伟, 何正琼, 吴希, 等. 血栓弹力图与凝血参数对老年脓毒症患者病情严重程度和预后的评估价值研究[J]. 老年医学与保健, 2021, 27(2) 287-289, 325. DOI:10.3969/j.issn.1008-8296.2021.02.020 |
| [25] | 贾明雅, 郑喜胜, 董照刚, 等. TEG结合PCT sTREM-1对重症肺炎合并脓毒症患者预后的评估价值[J]. 安徽医学, 2021, 42(1): 54-58. DOI:10.3969/j.issn.1000-0399.2021.01.013 |
| [26] | 郭嘉仲, 陈娟, 万吉云, 等. 脓毒症患者凝血功能指标变化及其对预后的预测效能[J]. 山东医药, 2019, 59(27): 56-58. DOI:10.3969/j.issn.1002-266X.2019.27.015 |
| [27] | Scărlătescu E, Lancé MD, White NJ, et al. Thromboelastometric prediction of mortality using the kinetics of clot growth in critically ill septic patients[J]. Blood Coagul Fibrinolysis, 2018, 29(6): 533-539. DOI:10.1097/mbc.0000000000000757 |
| [28] | 况芳, 何志捷, 周明根, 等. 血栓弹力图在评估脓毒症患者28 d生存率中的临床价值[J]. 中华危重症医学杂志(电子版), 2018, 11(4): 233-237. DOI:10.3877/cma.j.issn.1674-6880.2018.04.004 |
| [29] | Davies GR, Lawrence M, Pillai S, et al. The effect of sepsis and septic shock on the viscoelastic properties of clot quality and mass using rotational thromboelastometry: a prospective observational study[J]. J Crit Care, 2018, 44: 7-11. DOI:10.1016/j.jcrc.2017.09.183 |
| [30] | Yang W, Wang CS, Chen J, et al. Thrombelastography and coagulation parameters in septic patients and their clinical significance[J]. INTERNATIONAL J CLINICAL EXPERIMENTAL MEDICINE, 2016, 9(10): 20197-20203. |
| [31] | Adamzik M, Langemeier T, Frey UH, et al. Comparison of thrombelastometry with simplified acute physiology score Ⅱ and sequential organ failure assessment scores for the prediction of 30-day survival: a cohort study[J]. Shock, 2011, 35(4): 339-342. DOI:10.1097/SHK.0b013e318204bff6 |
| [32] | Schuurman AR, Sloot PMA, Wiersinga WJ, et al. Embracing complexity in sepsis[J]. Crit Care, 2023, 27(1): 102. DOI:10.1186/s13054-023-04374-0 |
| [33] | Weng L, Xu Y, Yin P, et al. National incidence and mortality of hospitalized sepsis in China[J]. Crit Care, 2023, 27(1): 84. DOI:10.1186/s13054-023-04385-x |
| [34] | 师灵灵, 韩艳秋, 任慧娟, 等. 脓毒症的病理生理机制研究进展[J]. 中华医院感染学杂志, 2016, 26(8): 1914-1916. DOI:10.11816/cn.ni.2016-152123 |
| [35] | Tsantes AG, Parastatidou S, Tsantes EA, et al. Sepsis-induced coagulopathy: an update on pathophysiology, biomarkers, and current guidelines[J]. Life, 2023, 13(2): 350. DOI:10.3390/life13020350 |
| [36] | Burton AG, Jandrey KE. Use of thromboelastography in clinical practice[J]. Vet Clin North Am Small Anim Pract, 2020, 50(6): 1397-1409. DOI:10.1016/j.cvsm.2020.08.001 |
| [37] | Faraoni D, DiNardo JA. Viscoelastic hemostatic assays: update on technology and clinical applications[J]. Am J Hematol, 2021, 96(10): 1331-1337. DOI:10.1002/ajh.26285 |
| [38] | Sakai T. Comparison between thromboelastography and thromboelastometry[J]. Minerva Anestesiol, 2019, 85(12): 1346-1356. DOI:10.23736/S0375-9393.19.13687-5 |
| [39] | Keene DD, Nordmann GR, Woolley T. Rotational thromboelastometry-guided trauma resuscitation[J]. Curr Opin Crit Care, 2013, 19(6): 605-612. DOI:10.1097/MCC.0000000000000021 |
| [40] | Andersen MG, Hvas CL, Tønnesen E, et al. Thromboelastometry as a supplementary tool for evaluation of hemostasis in severe sepsis and septic shock[J]. Acta Anaesthesiol Scand, 2014, 58(5): 525-533. DOI:10.1111/aas.12290 |
| [41] | Müller MC, Meijers JC, Vroom MB, et al. Utility of thromboelastography and/or thromboelastometry in adults with sepsis: a systematic review[J]. Crit Care, 2014, 18(1): R30. DOI:10.1186/cc13721 |
| [42] | Boscolo A, Spiezia L, De Cassai A, et al. Are thromboelastometric and thromboelastographic parameters associated with mortality in septic patients? A systematic review and meta-analysis[J]. J Crit Care, 2021, 61: 5-13. DOI:10.1016/j.jcrc.2020.09.034 |
| [43] | Bui-Thi HD, Kien To Gia, Le Minh K. Coagulation profiles in patients with sepsis/septic shock identify mixed hypo-hypercoagulation patterns based on rotational thromboelastometry: a prospective observational study[J]. Thromb Res, 2023, 227: 51-59. DOI:10.1016/j.thromres.2023.05.010 |
| [44] | Massberg S, Grahl L, von Bruehl ML, et al. Reciprocal coupling of coagulation and innate immunity via neutrophil serine proteases[J]. Nat Med, 2010, 16(8): 887-896. DOI:10.1038/nm.2184 |
| [45] | Haase N, Ostrowski SR, Wetterslev J, et al. Thromboelastography in patients with severe sepsis: a prospective cohort study[J]. Intensive Care Med, 2015, 41(1): 77-85. DOI:10.1007/s00134-014-3552-9 |
| [46] | Boscolo A, Spiezia L, Campello E, et al. Whole-blood hypocoagulable profile correlates with a greater risk of death within 28 days in patients with severe sepsis[J]. Korean J Anesthesiol, 2020, 73(3): 224-231. DOI:10.4097/kja.19396 |
 2024, Vol. 33
2024, Vol. 33