肠内营养(enteral nutrition, EN)是重症监护室(intensive care unit, ICU)患者营养支持治疗的重要组成部分,因其符合生理需求,增强胃肠道功能,增强免疫等特点,已成为指南推荐的营养支持的首选方法[1-3]。喂养不耐受(feeding intolerance, FI)是ICU患者EN过程中最常见的胃肠道并发症,发生率为2%~75%[4]。欧洲重症医学会(European Society of Intensive Care Medicine, ESICM)[5]指出,FI是指在尝试喂养的72 h内由于任何临床原因导致的无法经肠内途径达到至少20 kcal/(kg·d)的目标热量或出现呕吐、腹泻、消化道出血、高胃残留等胃肠道并发症的一种或多种组合。FI常导致不良预后,包括延长机械通气时间及ICU住院时间、增加营养风险及病死率[6-7]。临床风险预测模型是利用多因素模型估算并定量展示患有某种疾病或将来发生某种结局的风险的方法[8],精准的风险预测能够帮助医务人员早期识别FI高危人群并明确危险因素,及时进行针对性的预防和干预,从而改善重症患者临床结局。近年来,国内外学者已经构建和(或)验证了ICU患者EN的FI风险预测模型,但模型性能及临床适用性差异较大,仍有待进一步验证。因此本研究系统检索并对国内外现有的ICU患者EN的FI风险预测模型的偏倚风险及临床适用性进行系统评价,旨在为临床医护人员对ICU患者EN不耐受风险预测模型选择应用及优化改进提供一定的借鉴和参考。
1 资料与方法 1.1 文献纳入与排除标准纳入标准:(1)研究对象为≥18岁的重症患者,入住各内科ICU、外科ICU或综合ICU;(2)研究内容为重症患者EN的FI预测模型的构建和(或)验证研究;(3)预测因子≥2个;(4)预测结局为EN不耐受,且有明确的诊断标准;(5)研究设计为横断面研究、队列研究和病例对照研究;(6)语种为中文或英文。排除标准:(1)数据不充分的研究(如研究方案、会议记录或摘要等),且联系作者无回复;(2)任何类型的综述、述评、个案报告;(3)重复报告的研究;(4)仅分析FI的危险因素,未构建预测模型;(5)无法获取全文的研究。
1.2 文献检索策略计算机系统检索PubMed、EMBASE、Web of Science、Cochrane Library、中国知网(CNKI)、中国生物医学文献数据库、万方、维普数据库中ICU患者EN的FI预测模型的研究。以“predict*/risk prediction/model/risk calculation/risk score/AUC/area under the curve/c statistic” “feeding intolerance/feeding difficulties” “enteral nutrition/enteral feeding/force feeding/artificial feeding/gastric feeding”为英文检索词。以“肠内营养/肠道营养/人工喂养/管饲营养” “喂养不耐受/喂养困难” “预测/预警/模型/风险评分/评分法则”为中文检索词。以主题词和自由词相结合方式进行检索,对纳入文献的参考文献进一步追踪。检索时间为建库至2023年7月20日。
1.3 文献筛选与资料提取使用EndNote 20进行文献题录的导入与查重。2名研究者独立按照文献的纳入、排除标准进行文献筛选,对于分歧,经过双方讨论达成一致或寻求第3名研究者意见并达成共识。基于预测模型系统评价批判性评估和数据提取清单(critical appraisal and data extraction for systematic reviews of prediction modeling studies, CHARMS)的关键问题制定本研究数据提取的标准化表格,2名研究者对最终纳入的文献独立进行全文阅读、数据提取和交叉核对,对于分歧,经过双方讨论达成一致或寻求第3名研究者意见并达成共识。
1.4 纳入文献的风险偏倚评估与适用性评价2名研究者独立使用预测模型的偏倚风险和适用性评估工具(prediction model risk of bias assessment tool, PROBAST)对纳入文献的偏倚风险(risk of bias, ROB)和适用性进行评价[8-9],对于分歧,经过双方讨论达成一致或寻求第3名研究者意见并达成共识。
1.4.1 偏倚风险评估通过20个标志性问题对预测模型的研究对象(2个信号问题)、预测因子(3个信号问题)、结局(6个信号问题)和分析(9个信号问题)共4个关键领域和研究总体进行ROB评估。研究者使用“是/可能是”、“不是/可能不是”、“没有信息”对4个关键领域的标志性问题进行回答。
1.4.2 适用性评估根据各预测模型与本系统评价3个领域(参与者、预测因子和结局)的适用程度将预测模型的各领域及整体适用性评为好、差或不清楚。
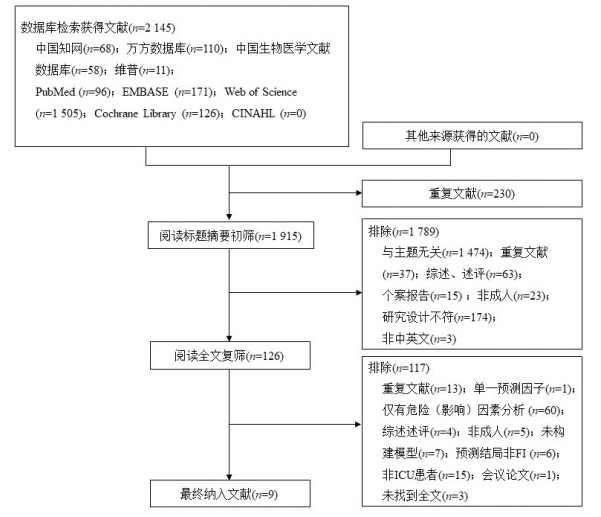
2 结果 2.1 文献检索及筛选过程通过检索共获得2 145篇相关文献,通过去重后剩余1 915篇,逐级筛选后共纳入9篇文献。文献筛选流程见图 1。
|
| 图 1 文献筛选流程图 |
|
|
纳入的文献中有6篇中文文献,3篇英文文献;5篇为前瞻性研究,4篇为回顾性研究;研究场所均在各医院的综合ICU或专科ICU;FI发生率为35.2%~62.6%。6项研究使用美国肠外与肠内营养协会(American Society for Parenteral and Enteral Nutrition, ASPEN)对FI的定义,2项研究使用ESICM对FI的定义,1项研究对FI自定义。纳入文献的基本特征见表 1。
| 纳入文献 | 发表年份 | 样本来源 | 研究对象 | 研究场所 | 研究类型 | FI发生率 | 预测结局(FI)的界定方法 |
| 刘佳欣等[10] | 2023 | 中国 | 入院24~48 h内启动EN,且预计持续 > 5 d的重症脑卒中患者 | 1所综合医院的神经ICU | 回顾性病例对照研究 | 43.22% | 2012年ESICM定义 |
| 李炜等[11] | 2022 | 中国 | 入院后实施EN的神经重症患者 | 1所综合医院神经重症ICU | 前瞻性队列研究 | 36.20% | 2012年ESICM定义 |
| 孙晓岚等[12] | 2022 | 中国 | 入院48 h内启动EN,且预计持续时间 > 3 d的重症脑卒中患者 | 1所综合医院ICU | 回顾性研究 | 37.94% | 2016年ASPEN指南定义 |
| 王富艳等[13] | 2019 | 中国 | 入院后实施EN的重症胰腺炎患者 | 1所综合医院消化内科ICU | 回顾性病例对照研究 | 41.5% | 2012年ESICM定义 |
| Hu等[14] | 2022 | 中国 | 入院后实施EN且住院时间 > 7 d的脓毒血症患者 | 2所综合医院的综合ICU | 回顾性病例对照研究 | 44.1% | 2012年ESICM定义 |
| Yu等[15] | 2023 | 中国 | 入院后启动EN且住院时间 > 24 h的脓毒血症、多器官功能衰竭患者 | 1所综合医院ICU | 前瞻性队列研究 | 62.6% | 自定义(包含上述指南推荐的FI主要症状表现) |
| 苏小平等[16] | 2022 | 中国 | 入院48 h内实施EN的重症患者 | 1所综合医院ICU | 前瞻性观察研究 | 35.2% | 2016年ASPEN指南定义为主,结合文献回顾 |
| 高婷 [17] | 2021 | 中国 | 入院后实施EN的脓毒血症患者 | 1所综合医院综合ICU | 前瞻性观察研究 | 51.7% | 2012年ESICM定义 |
| Lu等[18] | 2022 | 中国 | 重症患者 | 1所综合医院南北院区的综合ICU、急诊ICU、神经外科ICU | 前瞻性队列研究 | 37.95% | 2012年ESICM定义为主,结合专家讨论 |
| 注:EN为肠内营养,FI为喂养不耐受 | |||||||
共纳入9项ICU患者ENFI风险预测模型研究。9个模型的受试者工作特征曲线下面积(area under the receiver operator characteristic curve, AUC)或C-index为0.700~0.889,其中8个模型报告了校准度,3个模型进行了外部验证。各研究的潜在预测变量数为10~31个,有3项研究将连续变量转化成≥2个类别的变量。样本总量为91~282例,结果事件数为49~140例。仅有2项研究对缺失数据进行报告,其余研究均未报告,3项研究报告缺失数据处理方法。在预测变量的选择上,有8项研究均先采用单因素分析,将差异有统计学意义(P < 0.05)的潜在预测变量纳入回归分析中建立模型。8项研究使用传统Logistic回归构建模,1项研究使用人工神经网络建模。模型建立的情况见表 2。
| 纳入文献 | 预测因素 | 样本总量 | 缺失数据 | 是否避免采用单因素分析筛选预测变量 | 模型建立方法 | |||||
| 潜在预测变量数 | 连续变量是否未转化为≥2个类别的变量 | 数量(例) | 结果事件(例) | 数据(例) | 处理方法 | |||||
| 刘佳欣等[10] | 18 | 是 | 118 | 51 | 2 | 直接排除 | 否 | Logistic回归 | ||
| 李炜等[11] | 21 | 是 | 127 | 46 | 未报告 | 未报告 | 否 | Logistic回归 | ||
| 孙晓岚等[12] | 18 | 否 | 282 | 107 | 未报告 | 多重插补 | 否 | Logistic回归 | ||
| 王富艳等[13] | 11 | 是 | 118 | 49 | 未报告 | 未报告 | 否 | Logistic回归 | ||
| Hu等[14] | 27 | 否 | 195 | 49 | 未报告 | 未报告 | 是 | 人工神经网络 | ||
| Yu等[15] | 24 | 是 | 91 | 57 | 32 | 直接排除 | 否 | Logistic回归 | ||
| 苏小平等[16] | 12 | 是 | 230 | 81 | 未报告 | 未报告 | 否 | Logistic回归 | ||
| 高婷 [17] | 31 | 是 | 271 | 140 | 未报告 | 未报告 | 否 | Logistic回归 | ||
| Lu等[18] | 10 | 否 | 203 | 77 | 未报告 | 未报告 | 否 | Logistic回归 | ||
纳入的9项研究中有7个模型表现出了良好的区分度(AUC或C-index≥0.8)。有3项研究进行了拟合优度检验并报告了P值(P > 0.05),表示一致性良好。有6项研究进行了模型的内部验证,3项研究在内部验证的基础上进行了外部验证。最终模型包含3~15个预测因子,预测因子分为5类,分别为生化指标(白蛋白、血钾、血钠水平、空腹血糖等),个体特征(年龄等),疾病状态[格拉斯哥昏迷评分(Glasgow coma scale, GCS)、急性生理学与慢性健康状况(acute physiology and chronic health evaluation, APACHE)-Ⅱ评分、颅内感染胃肠道疾史、急性胃肠道损伤(acute gastrointestinal injury, AGI)分级、肺部感染、休克、高血压等],治疗因素(机械通气、镇静镇痛、抗生素使用种类、早期灌肠等)以及喂养方式(EN开始时间、是否持续喂养、喂养平均输注速度、EN开始时未启动早期喂养、喂养添加谷氨酰胺或膳食纤维等)。使用频率较高的预测因子为年龄、机械通气、GCS评分、APACHE-Ⅱ评分、腹内压、白蛋白水平、血糖水平、抗菌药物使用的种类等。6个模型以列线图形式呈现,1个模型使用在线风险计算器呈现,1个模型使用风险评分计算公式呈现,1个模型未提供具体形式。风险预测模型性能及预测因子详见表 3。
| 纳入研究 | 模型性能 | 验证方法 | 最终包含的预测因子 | 模型呈现形式 | 适用性和局限性 | |
| 区分度 | 校准度 | |||||
| 刘佳欣等[10] | C-index: 0.879 | 校准曲线 | Bootstrap重抽样、外部验证 | 7个:年龄、APACHE-Ⅱ评分、GCS评分、卧床时间、白蛋白、血管活性药物、床头角度≥30° | 列线图 | 适用性良好,单中心小样本,外推性受限 |
| 李炜等[11] | AUC=0.889 | 校准曲线 | — | 7个:ICU住院天数、低GCS评分、高血糖、高血钾、高血压、机械通气、镇静镇痛药物 | 列线图 | 适用性良好,单中心小样本,外推性受限 |
| 孙晓岚等[12] | 建模队列AUC=0.794验证队列AUC=0.764 | Hosmer-Lemeshow拟合优度检验P=0.659 | Bootstrap重抽样、外部验证 | 4个:年龄、使用2种以上抗菌药物、实施机械通气、使用益生菌 | 列线图 | 适应性良好,单中心小样本,外推性受限 |
| 王富艳等[13] | AUC=0.857 C-index: 0.869 | 校准曲线 | Bootstrap重抽样 | 5个:年龄、空腹血糖、EN开始时间、添加膳食纤维、腹内压 | 列线图 | 适应性良好,单中心,小样本,外推性受限 |
| Hu等[14] | AUC=0.820 | 校准曲线 | 网格搜索法、K折交叉验证、外部验证 | 15个:肺部感染、EN制剂类型、休克、皮肤感染、持续喂养、颅内感染、冠心病、腹部感染、抗生素种类、COPD、机械通气、高血压、脑卒中、腹内压、镇痛 | 在线风险预测计算器 | 适应性良好,多中心,小样本回顾性研究 |
| Yu等[15] | AUC=0.877 | 未报告 | — | 3个:胃窦横截面积、急性胃损伤评分、经腹胃肠超声检查 | 未给出具体形式 | 样本量小,某些预测因子测量易受干扰,缺失病例较多,影响结果可靠性 |
| 苏小平等[16] | AUC=0.879 | Hosmer-Lemeshow拟合优度检验P=0.683 | — | 4个:APACHE-Ⅱ评分;NRS2002评分;白蛋白;腹内压 | 以各预测因子的值得出风险评分公式 | 适用性较好,尚待内外部验证,单中心样本,外推性受限 |
| 高婷 [17] | AUC=0.888 | Hosmer-Lemeshow拟合优度检验P=0.714 | Bootstrap重抽样 | 7个:AGI分级、开始EN时间、EN平均输注速度、C-反应蛋白、白蛋白、早期灌肠、添加谷氨酰胺 | 列线图 | 适用性较好,尚待外部验证,单中心小样本,外推性受限 |
| Lu等[18] | AUC=0.700 | 校准曲线 | Bootstrap重抽样 | 5个:年龄、胃肠道疾病史、EN前接受机械通气、EN开始时未接受早期喂养、EN开始时的血清Na+水平 | 列线图 | 适应性良好,单中心小样本,可能导致部分预测因子在两组之间的差异被忽视 |
| 注:AUC为曲线下面积,GCS为格拉斯哥昏迷评分法,C-index为一致性指数,APACHE-Ⅱ评分为急性生理与慢性健康评分系统Ⅱ,EN为肠内营养,COPD为慢性阻塞性肺疾病 | ||||||
使用PROBAST清单对纳入的9篇进行风险偏倚和适用性评价,9项研究存在高偏倚风险。文献总体偏倚风险评价见表 4。
| 纳入文献 | 偏倚风险 | 适用性 | 总体 | ||||||||
| 研究对象 | 预测因子 | 结局 | 分析 | 研究对象 | 预测因素 | 结局 | 偏倚风险 | 适用性 | |||
| 刘佳欣等[10] | - | - | - | - | + | + | + | - | + | ||
| 李炜等[11] | + | + | ? | - | + | + | + | - | + | ||
| 孙晓岚等[12] | - | - | ? | - | + | + | + | - | + | ||
| 王富艳等[13] | - | - | ? | - | + | + | + | - | + | ||
| Hu等[14] | - | - | ? | - | + | + | + | - | + | ||
| Yu等[15] | + | + | ? | - | + | + | - | - | - | ||
| 苏小平等[16] | + | + | ? | - | + | + | + | - | + | ||
| 高婷 [17] | + | + | ? | - | + | + | + | - | + | ||
| Lu等[18] | + | + | ? | - | + | + | + | - | + | ||
| 注:“+”表示“低风险”;“-”表示“高风险”;“?”表示“不清楚” | |||||||||||
在研究对象领域,5项研究[11, 15-18]采用前瞻性队列研究,存在低风险偏倚;4项研究 [10, 12-14]采用回顾性病例对照研究,存在高风险偏倚。9项研究均按照事先制定的纳排标准选择研究对象。
2.5.2 与预测因子有关的偏倚在预测因子领域,5项研究 [11, 15-18]存在低风险偏倚,4项研究[10, 12-14]存在高风险偏倚。具体来看:1项研究[14]使用双中心研究方法,并未指出是否按照相同标准和定义测量预测因子。对于预测因子的测量过程,5项前瞻性研究[11, 15-18]在结局发生之前对预测因子进行测量,默认其采用了肓法;4项研究[10, 12-14]回顾性收集临床资料,对应问题评为“否/可能否”。9项研究均可在模型的使用时点获得预测因子的信息。
2.5.3 与结局有关的偏倚在结局领域,1项研究[10]存在高风险,8项研究偏倚风险不清楚[11-18]。具体来看;对于FI的判定,7项研究[10-11, 13-15, 17-18]使用ESICM [4-5]的标准,1项研究使用ASPEN[19]的标准,1项研究[18]未使用任何指南建议的标准,但客观可测量,且受判定者主观影响不大。对于结局的测量,所有研究均使用预先设定的FI诊断标准,均排除预测因子,FI的定义对所有研究对象相同。对于是否使用盲法测量结局,5项研究[10, 13, 15-17]对结局资料收集人员进行统一培训,但无法确定其在判定FI时是否知晓预测因子信息,4项研究[11-12, 14, 18]未提及FI由谁测量及如何测量。对于结局确定与预测因子的时间间隔,有研究显示[1],FI发生的平均时间为EN启动后的第3天,6项研究[10, 12, 15-18]将确定FI的随访时间设置为5 d~2周,其余研究未提及随访时间。
2.5.4 与分析有关的偏倚所有研究在分析领域存在高偏倚风险。仅2项[16-17]的每个变量的事件数(events per-variable, EPV)≥20个,其余研究样本量相对不足。4项研究[11, 14, 16-17]在构建模型时保持连续型预测因子的连续性,2项研究[13, 18]的所有预测因子均为二分类变量,不涉及连续数据的转化问题,1项研究[9]在构建模型时将连续性变量转化为二分类资料,2项研究[12, 15]未提及预测因子的原始变量类型,无法判断。2项研究[10, 15]未将所有招募对象资料纳入最终的统计分析,将不符合的研究对象直接排除。对于缺失数据的处理,孙晓岚等[12]使用多重插补处理缺失数据,2项研究[10, 15]直接排除临床信息不全的病例,其余7项研究为无法判断。除Hu等[14]避免采用单因素分析筛选预测因子,并将所有候选因子纳入多因素分析外,其余8项研究均在单因素分析的基础上进行多因素分析。对于数据的复杂性,仅1项研究[15]报告了数据的删失,其余研究均未考虑数据的复杂性。7项研究[10-11, 13-14, 16-18]完整报告了模型的性能(区分度、校准度),刘佳欣等[9]未报告模型拟合度,Yu等[15]未报告模型的校准度。对于模型的过度拟合和欠拟合问题,3项研究[11, 15-16]未进行内部验证,5项研究[10, 12-13, 17-18]使用Bootstrap重抽样进行内部验证,3项研究[10, 12, 14]进行外部验证。
3 讨论 3.1 ICU患者EN的FI风险预测模型尚处于发展阶段,存在较高的偏倚风险本研究系统检索了国内外EN的FI风险预测模型的相关研究,经过筛选最终纳入9项研究。从发表时间来看,国内外ENFI风险预测模型的探索开始于2019年,且集中在最近的两年,是EN管理领域的热点问题。值得关注的是,本研究纳入的9项模型均为我国学者构建,分析其原因:就重症患者EN不耐受这个话题,国外学者多以FI作为一项重要的预测因子探索其对患者死亡等不良预后的影响[20-21],我国学者则将FI本身作为一项不良结局,聚焦于探究其危险因素,更强调对不良结局的早期预警和追求不良结局干预靶点的“关口前移”,这可能与我国当前医疗资源紧张、患者需求多样,迫切需要低成本、高效率的预测模型的国情有关。另外,国务院办公厅于2021年发布的《深化医药卫生体制改革2021年重点工作任务》中提出“提升早期监测预警、风险评估研判”等能力,为我国学者研发旨在促进患者不良结局风险因素干预靶点“关口前移”的预测模型研发提供了政策激励。9项模型的AUC或C-index为0.700~0.889,其中有7项研究AUC或C-index > 0.80,预测性能较好。但9项研究均存在较高的偏倚风险,分析领域最为显著。主要偏倚风险来源于:样本量较小,未避免单因素分析方法筛选预测因子,模型构建阶段将连续变量临时转换为二分类变量,缺失数据的报告和处理不当,未考虑模型过度拟合和乐观性能偏差。建议未来研究实践:①扩大并精确样本量。7项研究样本相对不足。陈茹等[22]指出当EPV过小时,模型过度拟合问题较为突出,仅采取内部验证往往高估模型预测性能。基于二元结局构建预测模型时,EPV≥10是公认的经验法则,EPV≥20为理想状态[23-24],若基于机器学习建模型通常EPV > 200[25]。Riley等[26]提出除EPV外,研究样本应考虑特定的研究环境、参与者总数、疾病发病率和预期性能,提出精确的样本计算四步法,并提供Stata和R软件计算的程序包。②使用非统计学方法确立模型中包含的预测因子。Moon等[8]指出,仅依靠统计学结果(P < 0.05)会导致预测因子的错误选择,应综合考虑既往研究已确立的预测因子的可靠性、一致性临床适用性和应用成本确立多因素预测模型的预测因子,也可选择后退法筛选预测因子。③模型构建阶段保持连续预测因子的连续性。常见的误区为将年龄、血压等划分为二分类变量以使模型呈现更加简约,并有助于临床解释,而事实上,这往往会导致信息丢失和降低预测性能[8]。④公开报告缺失数据并使用多重插补方法处理。本研究中未报告缺失值的问题比缺失值处理方法不当更突出,与俞晓慧等[27]糖尿病患者低血糖预测模型系统评价研究一致,仅Hu等[14]报告并使用了多重插补方法。大量研究表明在预测模型开发和验证领域,多重插补相比其他方法表现出良好的精确度[28-29]。
3.2 未来临床实践的趋势和方向目前,仍需要大样本、多中心高质量的前瞻性FI风险预测模型支持最佳临床实践。传统预测模型的可深入借鉴PROBSAT[8]和CHARMS清单[30]控制研究偏倚,开发更加精准的预测模型。此领域模型的开发不断涌现,而仅3项研究在内部验证的基础上进行外部验证,尚未在ICU患者中得到广泛验证和应用,未来应进一步开展ICU患者FI预测模型的验证研究,尤其是小样本、低EPV、对连续预测因子分类和使用单因素分析筛选预测因子的模型,以增强模型准确性及敏感度[8]。8项研究采用传统Logistic回归建模,仅Hu等[14]研究使用多种机器学习算法建模,通过比较保留基于人工神经网络的最优模型。近年来医疗领域涌现了包括神经网络在内的多样的建模技术,如Boost算法、随机森林、决策树模型等[31],未来应在医疗电子病历系统进一步规范化、智能化、共享的基础上,充分借助机器学习技术规避传统建模方法的局限,提高EN的FI风险预测模型的简便性和灵敏性,结合智能化的模型展现形式如网络风险计算器等增强模型的可用性,并构建重症患者FI临床决策支持系统,赋能临床医护人员做出最佳决策,以改善重症患者的临床结局。
3.3 ICU患者EN的FI的风险预测模型的临床指导价值各模型重复报告的预测因子为年龄(n=4)、机械通气(n=4)、腹内压(n=3)、GCS评分(n=2)、APACHE-Ⅱ评分(n=2)、白蛋白水平(n=2)、血糖水平(n=2)、抗菌药物使用的种类(n=2)。各预测因子可相互作用并对患者EN的耐受性产生影响。当患者意识障碍程度越重, APACHE-Ⅱ评分越高,机体应激反应就越强烈,一方面可引起神经-体液改变,腹腔脏器血管剧烈收缩,导致胃肠黏膜缺血、糜烂;另一方面,应激反应造成激素水平异常,抑制胃黏液合成与分泌,诱发机体组织蛋白分解、消耗和丢失,出现低蛋白血症,引起胃肠黏膜水肿,影响胃肠道功能,从而使EN耐受性下降。因此护理人员在给予高龄、低GCS评分、高APACHE-Ⅱ评分患者EN时应给予高度的重视,加强监测胃肠道症状,尤其关注患者血糖水平、血清总蛋白、白蛋白的变化情况,注意补充机体所需蛋白质,调整喂养量,避免患者出现低蛋白血症,减少喂养中断。机械通气为正压通气,其产生的胸腔正压会使腹腔压力增大,腹腔高压导致肠系膜血流灌注减少,压迫管壁薄的肠系膜静脉,从而使肠道静脉血流受阻导致肠水肿,使肠道功能减退、胃肠排空延迟。腹腔高压在ICU患者中的发生率为30%~49%[32],是FI的独立危险因素,导致喂养中断,增加ICU住院时间及病死率。研究显示,腹内压≥12 mmHg(1 mmHg=0.133 kPa)时,发生FI症状数量显著低于IAP < 12 mmHg时的胃肠道症状数量,因此如何根据腹内压大小分级制定和开展个体化的EN喂养方案以减少EN不耐受的发生是今后研究的方向之一[33]。机械通气患者还可通过呼吸机推算的二氧化碳生成量来测定能量消耗(resting energy expenditure, REE)[REE(kcal/d)=8.19×VCO2(mL/min)] [34],据此制订个体化喂养方案,可能是减少EN不耐受干预手段的新的切入点。
综上所述,本研究纳入的9项ICU患者ENFI风险预测模型具有良好的区分度、校准度和较好的适用性,但是整体存在高偏倚风险,仅有少部分模型得到外部验证,使得其临床外推性受到限制。未来的研究应遵循TRIPOD声明及PROBAST风险偏倚评估工具结合机器学习算法来开发、验证更加精准的预测模型并持续优化,促进其临床可用性和安全性。
利益冲突 所有作者声明无利益冲突
| [1] | Li JB, Wang LJ, Zhang H, et al. Different definitions of feeding intolerance and their associations with outcomes of critically ill adults receiving enteral nutrition: a systematic review and meta-analysis[J]. J Intensive Care, 2023, 11(1): 29. DOI:10.1186/s40560-023-00674-3 |
| [2] | Wischmeyer PE, Bear DE, Berger MM, et al. Personalized nutrition therapy in critical care: 10 expert recommendations[J]. Crit Care, 2023, 27(1): 261. DOI:10.1186/s13054-023-04539-x |
| [3] | Compher C, Bingham AL, McCall M, et al. Guidelines for the provision of nutrition support therapy in the adult critically ill patient: The American Society for Parenteral and Enteral Nutrition[J]. JPEN J Parenter Enteral Nutr, 2022, 46(1): 12-41. DOI:10.1002/jpen.2267 |
| [4] | Reintam Blaser A, Deane AM, Preiser JC, et al. Enteral feeding intolerance: updates in definitions and pathophysiology[J]. Nutr Clin Pract, 2021, 36(1): 40-49. DOI:10.1002/ncp.10599 |
| [5] | Reintam Blaser A, Malbrain MLNG, Starkopf J, et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems[J]. Intensive Care Med, 2012, 38(3): 384-394. DOI:10.1007/s00134-011-2459-y |
| [6] | Heyland DK, Ortiz A, Stoppe C, et al. Incidence, risk factors, and clinical consequence of enteral feeding intolerance in the mechanically ventilated critically ill: an analysis of a multicenter, multiyear database[J]. Crit Care Med, 2021, 49(1): 49-59. DOI:10.1097/CCM.0000000000004712 |
| [7] | Peng JJ, Liu GW, Li F, et al. The correlation between feeding intolerance and poor prognosis of patients with severe neurological conditions: a case-control study[J]. Expert Rev Neurother, 2020, 20(5): 415-416. DOI:10.1080/14737175.2020.1750372 |
| [8] | Moons KGM, Wolff RF, Riley RD, et al. PROBAST: a tool to assess risk of bias and applicability of prediction model studies: explanation and elaboration[J]. Ann Intern Med, 2019, 170(1): w1-w33. DOI:10.7326/M18-1377 |
| [9] | Kaiser I, Mathes S, Pfahlberg AB, et al. Using the prediction model risk of bias assessment tool (PROBAST) to evaluate melanoma prediction studies[J]. Cancers, 2022, 14(12): 3033. DOI:10.3390/cancers14123033 |
| [10] | 刘佳欣, 朱艳华, 程培霞, 等. 重症脑卒中患者肠内营养喂养不耐受风险列线图模型的构建与验证[J]. 护士进修杂志, 2023, 38(12) 1069-1073, 1102. DOI:10.16821/j.cnki.hsjx.2023.25.019 |
| [11] | 李炜, 杨富, 王晓平, 等. 神经重症患者肠内营养喂养不耐受风险预警模型的构建[J]. 中国神经免疫学和神经病学杂志, 2022, 29(5): 398-403. DOI:10.3969/j.issn.1006-2963.2022.05.010 |
| [12] | 孙晓岚, 李占肖, 于晓雯, 等. 重症脑卒中病人肠内营养不耐受风险的预警模型构建与评估[J]. 实用老年医学, 2022, 36(9): 942-947. DOI:10.3969/j.issn.1003-9198.2022.09.018 |
| [13] | 王富艳, 赵庆云, 张雪云. 重症急性胰腺炎患者肠内营养喂养不耐受风险的列线图模型的建立[J]. 中华现代护理杂志, 2019, 25(1): 42-48. DOI:10.3760/cma.j.issn.1674-2907.2019.01.010 |
| [14] | Hu K, Deng XL, Han L, et al. Development and validation of a predictive model for feeding intolerance in intensive care unit patients with sepsis[J]. Saudi J Gastroenterol, 2022, 28(1): 32-38. DOI:10.4103/sjg.sjg_286_21 |
| [15] | Yu G, Jin SS, Wang R, et al. Transabdominal gastro-intestinal ultrasonography (TGIU) for predicting feeding intolerance in critically ill patients: a prospective observational study[J]. Clin Nutr ESPEN, 2023, 55: 76-82. DOI:10.1016/j.clnesp.2023.02.010 |
| [16] | 苏小平, 徐静娟, 赵亚东, 等. 危重患者早期肠内营养喂养不耐受风险预测模型的构建[J]. 护理学报, 2022, 29(17): 47-51. DOI:10.16460/j.issn1008-9969.2022.17.047 |
| [17] | 高婷. ICU成人脓毒症患者肠内营养喂养不耐受风险预测模型的构建和评价[D]. 合肥: 安徽医科大学, 2021. DOI: 10.26921/d.cnki.ganyu.2021.001399. |
| [18] | Lu XM, Jia DS, Wang R, et al. Development of a prediction model for enteral feeding intolerance in intensive care unit patients: a prospective cohort study[J]. World J Gastrointest Surg, 2022, 14(12): 1363-1374. DOI:10.4240/wjgs.v14.i12.1363 |
| [19] | McClave SA, Taylor BE, Martindale RG, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: society of critical care medicine (SCCM) and American society for parenteral and enteral nutrition (A.S.P.E.N. )[J]. JPEN J Parenter Enteral Nutr, 2016, 40(2): 159-211. DOI: 10.1177/0148607115621863. |
| [20] | Raphaeli O, Statlender L, Hajaj C, et al. Using machine-learning to assess the prognostic value of early enteral feeding intolerance in critically ill patients: a retrospective study[J]. Nutrients, 2023, 15(12): 2705. DOI:10.3390/nu15122705 |
| [21] | Raphaeli O, Hajaj C, Bendavid I, et al. Using machine learning to support early prediction of feeding intolerance in critically ill patients[J]. Intensive Care Med Exp, 2021, 9(Suppl 1): 50. DOI:10.1186/s40635-021-00415-6 |
| [22] | 陈茹, 王胜锋, 周家琛, 等. 预测模型研究的偏倚风险和适用性评估工具解读[J]. 中华流行病学杂志, 2020, 41(5): 776-781. DOI:10.3760/cma.j.cn112338-20190805-00580 |
| [23] | van Smeden M, de Groot JA, Moons KG, et al. No rationale for 1 variable per 10 events criterion for binary logistic regression analysis[J]. BMC Med Res Methodol, 2016, 16(1): 163. DOI:10.1186/s12874-016-0267-3 |
| [24] | Ogundimu EO, Altman DG, Collins GS. Adequate sample size for developing prediction models is not simply related to events per variable[J]. J Clin Epidemiol, 2016, 76: 175-182. DOI:10.1016/j.jclinepi.2016.02.031 |
| [25] | van der Ploeg T, Austin PC, Steyerberg EW. Modern modelling techniques are data hungry: a simulation study for predicting dichotomous endpoints[J]. BMC Med Res Methodol, 2014, 14: 137. DOI:10.1186/1471-2288-14-137 |
| [26] | Riley RD, Ensor J, Snell KIE, et al. Calculating the sample size required for developing a clinical prediction model[J]. BMJ, 2020, 368: m441. DOI:10.1136/bmj.m441 |
| [27] | 俞晓慧, 章新琼, 杨胜菊, 等. 糖尿病患者低血糖发生风险预测模型的系统评价[J]. 中华护理杂志, 2022, 57(15): 1830-1839. DOI:10.3761/j.issn.0254-1769.2022.15.006 |
| [28] | Jolani S, Debray TP, Koffijberg H, et al. Imputation of systematically missing predictors in an individual participant data meta-analysis: a generalized approach using MICE[J]. Stat Med, 2015, 34(11): 1841-1863. DOI:10.1002/sim.6451 |
| [29] | Vergouwe Y, Royston P, Moons KG, et al. Development and validation of a prediction model with missing predictor data: a practical approach[J]. J Clin Epidemiol, 2010, 63(2): 205-214. DOI:10.1016/j.jclinepi.2009.03.017 |
| [30] | Moons KG, de Groot JA, Bouwmeester W, et al. Critical appraisal and data extraction for systematic reviews of prediction modelling studies: the CHARMS checklist[J]. PLoS Med, 2014, 11(10): e1001744. DOI:10.1371/journal.pmed.1001744 |
| [31] | 王晶, 李玲利, 赵春林, 等. 机器学习在构建护理风险预测模型中的研究进展[J]. 护士进修杂志, 2022, 37(23): 2167-2171. DOI:10.16821/j.cnki.hsjx.2022.23.011 |
| [32] | Khot Z, Murphy PB, Sela N, et al. Incidence of intra-abdominal hypertension and abdominal compartment syndrome: a systematic review[J]. J Intensive Care Med, 2021, 36(2): 197-202. DOI:10.1177/0885066619892225 |
| [33] | Reintam Blaser A, Parm P, Kitus R, et al. Intra-abdominal hypertension and gastrointestinal symptoms in mechanically ventilated patients[J]. Crit Care Res Pract, 2011, 2011: 982507. DOI:10.1155/2011/982507 |
| [34] | 中华医学会神经外科分会, 中国神经外科重症管理协作组. 中国神经外科重症患者营养治疗专家共识(2022版)[J]. 中华医学杂志, 2022, 102(29): 2236-2255. DOI:10.3760/cma.j.cn112137-20220621-01362 |
 2024, Vol. 33
2024, Vol. 33