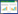急性胰腺炎(acute pancreatitis,AP)是急诊科常见的急腹症,具有起病急、进展快、病死率高的特点[1-2]。近年来,高脂血症引起的AP患病率逐年升高,成为第二大发病原因。与其他类型AP比较,高脂血症性急性胰腺炎(hyperlipidemic acute pancreatitis,HLAP)患者具有年轻化,重症化,并发症多,易复发,预后差等特点[3]。因此在疾病早期找到快速有效的预测指标,对HLAP的治疗和预后有重要价值。但是,目前尚无研究完全阐明HLAP患者预后不良的危险因素。所以,本研究通过回顾性分析本院近3年HLAP患者的临床资料,探究其预后不良的危险因素,并建立早期识别预后不良的预测模型,为早期干预提供依据,从而达到改善预后的目的。
1 资料与方法 1.1 一般资料回顾性收集本院2021年1月至2023年12月收治的HLAP患者的临床资料,包括基本资料、入院时生命体征、入院24 h的首次实验室检查。共纳入118例患者,其中男98例,女20例,年龄20~72岁,(37.17±9.89)岁。
1.2 HLAP诊断标准AP的诊断:临床诊断需要以下3个条件中的2个,(1)典型上腹痛症状;(2)血清淀粉酶(amylase,AMY)或脂肪酶(lipase,LPS)至少大于正常值上限的3倍;(3)腹部影像学提示AP。HLAP诊断[4]:(1)符合AP的诊断;(2)入院时甘油三酯(triglyceride,TG)≥11.3 mmol/L或TG在5.65~11.3 mmol/L,且血清呈乳糜状,并排除其他可能导致AP的病因。
1.3 HLAP不良预后的判定标准在出院之前出现以下情况中的任何一项:包括发展为急性重症胰腺炎,出现包裹性坏死、感染性胰腺坏死、器官功能衰竭、消化道出血、入住重症监护病房、手术治疗及死亡判定为预后不良组[5-7]。
1.4 分组标准根据患者的临床表现及结局,按照HLAP不良预后的判定标准分为预后不良组,其余为预后良好组。
1.5 纳入标准① 符合HLAP诊断;②年龄≥18岁;③发病24 h内入院的患者;④完成急性胰腺炎严重程度床旁指标评分(bedside index score of acute pancreatitis severity,BISAP)及急性生理学与慢性健康状况评分(acute physiology and chronic health status scoring system,APACHE Ⅱ);⑤数据齐全。
1.6 排除标准① 病因不明、病历资料不完整;②既往有心、肝、肾疾病病史;③肿瘤患者;④长期应用激素、免疫抑制剂;⑤妊娠期妇女、儿童等。
1.7 伦理学本研究符合医学伦理学标准,并经郑州大学第一附属医院伦理审查委员会审批通过(审批号:2022-KY-0054-004)。
1.8 统计学方法使用SPSS 21.0软件进行数据处理和分析。定量资料符合正态分布以均数±标准差(x ± s)表示,采用独立样本t检验;否则以中位数(四分位数)[M(QL,QU)]表示,采用非参数(Mann-Whitney U)检验。分类变量以例(%)表示,采用χ2检验,不满足条件采用Fisher确切概率法。对单因素分析得出的影响指标,使用逐步向前似然法进行Logistic回归分析,以识别HLAP预后不良的独立危险因素,并建立联合预测模型。采用受试者工作特征曲线(receive operator characteristic curve,ROC)分析各危险因素单独及联合预测HLAP预后不良的价值。以P<0.05为差异有统计学意义。
2 结果 2.1 两组患者一般资料比较共纳入118例HLAP患者,预后良好组69例,预后不良组49例。预后不良组较预后良好组住院时间明显延长,差异有统计学意义(P<0.05);但是两组患者在性别和年龄方面进行比较,差异无统计学意义(P>0.05);两组患者糖尿病、脂肪肝和高血压情况进行比较,差异无统计学意义(P>0.05)。见表 1。
| 项目 | 预后良好组(69例) | 预后不良组(49例) | Z/χ2值 | P值 |
| 性别(n, 男/女) | 59/10 | 39/10 | 0.712 | 0.399 |
| 年龄(岁) | 36(31, 42) | 33(30, 39) | -0.845 | 0.398 |
| 住院时间(d) | 12(7, 17) | 18(11, 28) | -2.605 | 0.009 |
| 既往史 | 0.469 | 0.791 | ||
| 糖尿病(n,%) | 27 | 16 | 0.519 | 0.471 |
| 脂肪肝(n,%) | 38 | 20 | 2.330 | 0.127 |
| 高血压(n,%) | 9 | 7 | 0.038 | 0.846 |
| 注:P<0.05表示差异有统计学意义 | ||||
预后良好组患者25例合并有胸腔积液、10例合并有腹腔积液、21例合并肺炎、10例合并肾功能不全、1例合并脓毒症、45例合并全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)、5例合并休克、无患者合并急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)、腹腔间隔室综合征(abdominal compartment syndrome,ACS)和死亡;预后不良组患者29例合并有胸腔积液、30例合并有腹腔积液、31例合并肺炎、20例合并肾功能不全、11例合并脓毒症、34例合并SIRS、9例合并休克、18例合并ARDS、3例合并ACS、3例死亡。两组患者在胸腔积液、腹腔积液、肺炎、肾功能不全、脓毒症、ARDS并发症发生率方面差异均有统计学意义(P<0.05);在SIRS、休克、死亡发生率方面差异无统计学意义(P>0.05)见表 2。
| 项目 | 预后良好组(69例) | 预后不良组(49例) | χ2值 | P值 |
| 胸腔积液 | 25(36.23) | 29(59.18) | 6.081 | 0.014 |
| 腹腔积液 | 10(14.49) | 30(61.22) | 27.925 | <0.001 |
| 肺炎 | 21(34.92) | 31(78.79) | 12.530 | <0.001 |
| 肾功能不全 | 10(14.49) | 20(40.82) | 10.472 | 0.001 |
| 脓毒症 | 1(1.44) | 11(22.45) | 13.831 | <0.001 |
| SIRS | 45(65.22) | 34(69.39) | 0.225 | 0.635 |
| 休克 | 5(1.59) | 9(21.21) | 3.389 | 0.066 |
| ARDS | 0 | 18(36.73) | 29.909 | <0.001 |
| ACS | 0 | 3(6.12) | - | 0.069 |
| 死亡 | 0 | 3(6.12) | - | 0.069 |
| 注:SIRS:全身炎症反应综合征;ARDS:急性呼吸窘迫综合征;ACS:腹腔间隔室综合征;P<0.05表示差异有统计学意义 | ||||
入院24 h内两组患者在心率(heart rate,HR)、淋巴细胞(lymphocyte,LYM)、TG、白蛋白(albumin,ALB)、肌酐(creatinine,Cr)、尿素氮(urea nitrogen,BUN)、血钙(calciumion,Ca2+)、血糖(blood sugar,GLU)、C-反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、纤维蛋白原(fibrinogen,FIB)、纤维蛋白原与白蛋白比值(fibrinogen to albumin ratio,FAR)、肌酐与白蛋白比值(creatinine to albumin ratio,CAR)、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)、BISAP评分、APACHE Ⅱ评分指标方面均差异有统计学意义,差异有统计学意义(P<0.05);两组患者在呼吸(breathing,R)、白细胞(white blood cell,WBC)、红细胞(red blood cells,RBC)、血红蛋白浓度(hemoglobin concentration,HGB)、中性粒细胞(neutrophil,NEU)、单核细胞(monocyte,MONO)、平均红细胞体积(mean red blood cell volume,MCV)、平均红细胞血红蛋白浓度(mean erythrocyte hemoglobin concentration,MCHC)、红细胞分布宽度(red blood cell distribution width,RDW)、血小板(platelets,PLT)、平均血小板体积(mean platelet volume,MPV)、血小板分布宽度(platelet distribution width,PWD)、AMY、LPS、总胆固醇(total cholesterol,TC)、D-二聚体(D-dimer,D-D)和血红蛋白与红细胞分布宽度比值(ratio of hemoglobin to erythrocyte distribution width,HRR)临床及实验室指标方面比较结果显示,差异无统计学意义(P>0.05)。见表 3。
| 项目 | 预后良好组(69例) | 预后不良组(49例) | t/Z值 | P值 |
| HR(次/min) | 105(89,117) | 124(98, 138) | -3.147 | 0.002 |
| R(次/min) | 21.5(20, 24) | 22(20, 30) | -0.612 | 0.541 |
| WBC(109/L) | 12.7(9.3, 15.7) | 13.2(9.5, 16.0) | -0.543 | 0.587 |
| RBC(次/min) | 4.9(4.4, 5.5) | 5.1(4.4, 5.5) | -0.718 | 0.473 |
| HGB(g/L) | 155(142, 173) | 159(140, 169) | -0.183 | 0.855 |
| NEU(1012/L) | 10.1±4.3 | 11.7±5.2 | -1.846 | 0.067 |
| LYM(1012/L) | 1.4(1.0.2.2) | 1.0(0.7, 1.4) | -3.706 | <0.001 |
| MONO(1012/L) | 0.45(0.32, 0.83) | 0.52(0.41, 0.50) | -1.095 | 0.273 |
| MCV(fl) | 91.2±5.1 | 91.2±5.7 | 1.111 | 0.269 |
| MCHC(g/L) | 342(337, 352) | 341(336, 352) | -0.615 | 0.539 |
| RDW(fl) | 46(41, 50) | 49(43, 50) | -1.346 | 0.178 |
| PLT(109/L)) | 218(170, 265) | 193(154, 246) | -1.335 | 0.182 |
| MPV(fl) | 9.7(8.8, 10.7) | 9.9(9.0, 11.1) | -1.175 | 0.240 |
| PWD(fl) | 16.7(16.4, 17.0) | 16.7(16.4, 17.1) | -0.186 | 0.853 |
| AMY(U/L) | 278(103, 594) | 235(141, 567) | -0.983 | 0.326 |
| LPS(U/L) | 516(183, 975) | 569(284, 1335) | -1.466 | 0.143 |
| TC(mmol/L) | 8.93(6.76, 10.71) | 8.71(6.40, 12.39) | -0.388 | 0.698 |
| TG(mmol/L) | 11.92(8.57, 15.40) | 19.22(16.11, 27.03) | -5.038 | <0.001 |
| ALB(g/L) | 38(34, 41) | 30(27, 36) | -5.432 | <0.001 |
| Cr(μmol/L) | 64(52, 80) | 75(63, 174) | -3.789 | <0.001 |
| BUN(mmol/L) | 4.59(3.25, 6.19) | 5.70(4.20, 9.93) | -2.875 | 0.004 |
| Ca2+(mmol/L) | 2.12(1.68, 2.26) | 1.54(1.30, 1.95) | -4.593 | <0.001 |
| GLU(mmol/L) | 11.64(7.43, 16.21) | 14.92(8.84, 20.58) | -2.216 | 0.027 |
| CRP(mg/L) | 74(38, 249) | 268(78, 346) | -3.790 | <0.001 |
| PCT(ng/mL) | 0.39(0.12, 3.31) | 3.71(0.86, 6.11) | -3.356 | 0.001 |
| D(mg/L) | 2.10(0.72, 4.15) | 2.37(0.91, 5.34) | -1.494 | 0.135 |
| FIB(μg/mL) | 4.60(2.5, 7.30) | 4.60(2.50, 7.28) | -5.380 | <0.001 |
| HRR | 3.41(3.10, 3.79) | 3.42(2.94, 3.65) | -0.781 | 0.435 |
| FAR | 0.13(0.06, 0.20) | 0.42(0.24, 0.62) | -5.958 | <0.001 |
| CAR | 1.71(1.40, 2.26) | 2.78(1.89, 5.71) | -5.186 | <0.001 |
| PLR | 149(95, 218) | 202(127, 282) | -2.815 | 0.005 |
| BISAP评分 | 1.00(1.00,2.00) | 2.00(2.00,3.00) | -5.809 | <0.001 |
| APACHE Ⅱ评分 | 3.00(2.00,4.00) | 6.00(5.00,7.00) | -6.787 | <0.001 |
| 注:HR:心率;R:呼吸;WBC:白细胞;RBC:红细胞;HGB:血红蛋白浓度;NEU:中性粒细胞;LYM:淋巴细胞;MONO:单核细胞;MCV:平均红细胞体积;MCHC:平均红细胞血红蛋白浓度;RDW:红细胞分布宽度;PLT:血小板;MPV:平均血小板体积;PWD:血小板分布宽度;AMY:淀粉酶;LPS:脂肪酶;TC:总胆固醇;TG:甘油三酯;ALB:白蛋白;Cr:肌酐;BUN:尿素氮;Ca2+:钙离子;GLU:血糖;CRP:C反应蛋白;PCT:降钙素原;D-D:D-二聚体;FIB:纤维蛋白原;HRR:血红蛋白与红细胞分布宽度比值;FAR:纤维蛋白原与白蛋白比值;CAR:肌酐与白蛋白比值;PLR:血小板与淋巴细胞比值;BISAP评分:急性胰腺炎严重程度床旁指标评分;APACHE Ⅱ评分:急性生理学与慢性健康状况评分系统 | ||||
将HR、LYM、TG、ALB、Cr、BUN、Ca2+、GLU、CRP、PCT、FIB、FAR、CAR及PLR指标纳入多因素Logistic回归模型,结果提示,FAR (OR=25.949,95%CI: 3.190~211.080,P=0.002)、CAR(OR=1.453,95%CI: 1.095~1.928,P=0.010)、PLR(OR=1.005,95%CI: 1.001~1.009,P=0.020)是HLAP患者预后不良的独立危险因素(P<0.05)。构建HLAP预后不良模型Logit P=-3.336+ 3.256×FAR +0.374×CAR+0.005×PLR。见表 4。
| 变量 | β | SE | Wald | P值 | OR值 | 95%CI |
| FAR | 3.256 | 1.069 | 9.270 | 0.002 | 25.949 | (3.190, 211.080) |
| CAR | 0.374 | 0.144 | 6.706 | 0.010 | 1.453 | (1.095,1.928) |
| PLR | 0.005 | 0.002 | 5.442 | 0.020 | 1.005 | (1.001, 1.009) |
| 常量 | -3.336 | 0.676 | 24.368 | <0.001 | 0.036 | |
| 注:FAR:纤维蛋白原与白蛋白比值;CAR:肌酐与白蛋白比值;PLR:血小板与淋巴细胞比值;OR:优势比,95%CI:OR的95%置信区间 | ||||||
对HLAP预后不良的预测价值ROC曲线分析显示,FAR、CAR、PLR单独指标预测HLAP患者预后不良的ROC曲线下面积(Area under the ROC curve,AUC)分别为0.823、0.781、0.652;FAR联合CAR、FAR联合PLR、CAR联合PLR的AUC分别为0.840、0.845、0.849;而FAR、CAR、PLR三者联合对HLAP患者预后不良的预测能力为(AUC=0.875,95%CI: 0.814~0.937),其截断值为0.387时,敏感度为83.7%,特异度为79.7%。见图 1,表 5。
|
| 图 1 ROC曲线 Fig 1 ROC curve |
|
|
| 变量 | AUC | 95%CI | 敏感度(%) | 特异度(%) | 约登指数 | 截断值 |
| FAR | 0.823 | (0.745~0.900) | 81.6 | 78.3 | 0.599 | 0.208 |
| CAR | 0.781 | (0.694~0.867) | 81.6 | 68.1 | 0.497 | 1.850 |
| PLR | 0.652 | (0.552~0.753) | 38.8 | 85.5 | 0.243 | 241.444 |
| FAR+CAR | 0.840 | (0.766~0.915) | 89.8 | 73.9 | 0.637 | 0.294 |
| FAR+PLR | 0.845 | (0.733~0.916) | 83.7 | 81.2 | 0.649 | 0.387 |
| CAR+PLR | 0.849 | (0.781~0.916) | 83.7 | 72.5 | 0.562 | 0.313 |
| FAR+CAR+PLR | 0.875 | (0.814~0.937) | 83.7 | 79.7 | 0.634 | 0.378 |
| 注:FAR+CAR:FAR和CAR联合;FAR+PLR:FAR和PLR联合;CAR+PLR:CAR和PLR联合;FAR+CAR+PLR:FAR、CAR和PLR三者联合;AUC:ROC曲线下面积;95%CI:AUC的95%置信区间;P<0.05表示差异有统计学意义。 | ||||||
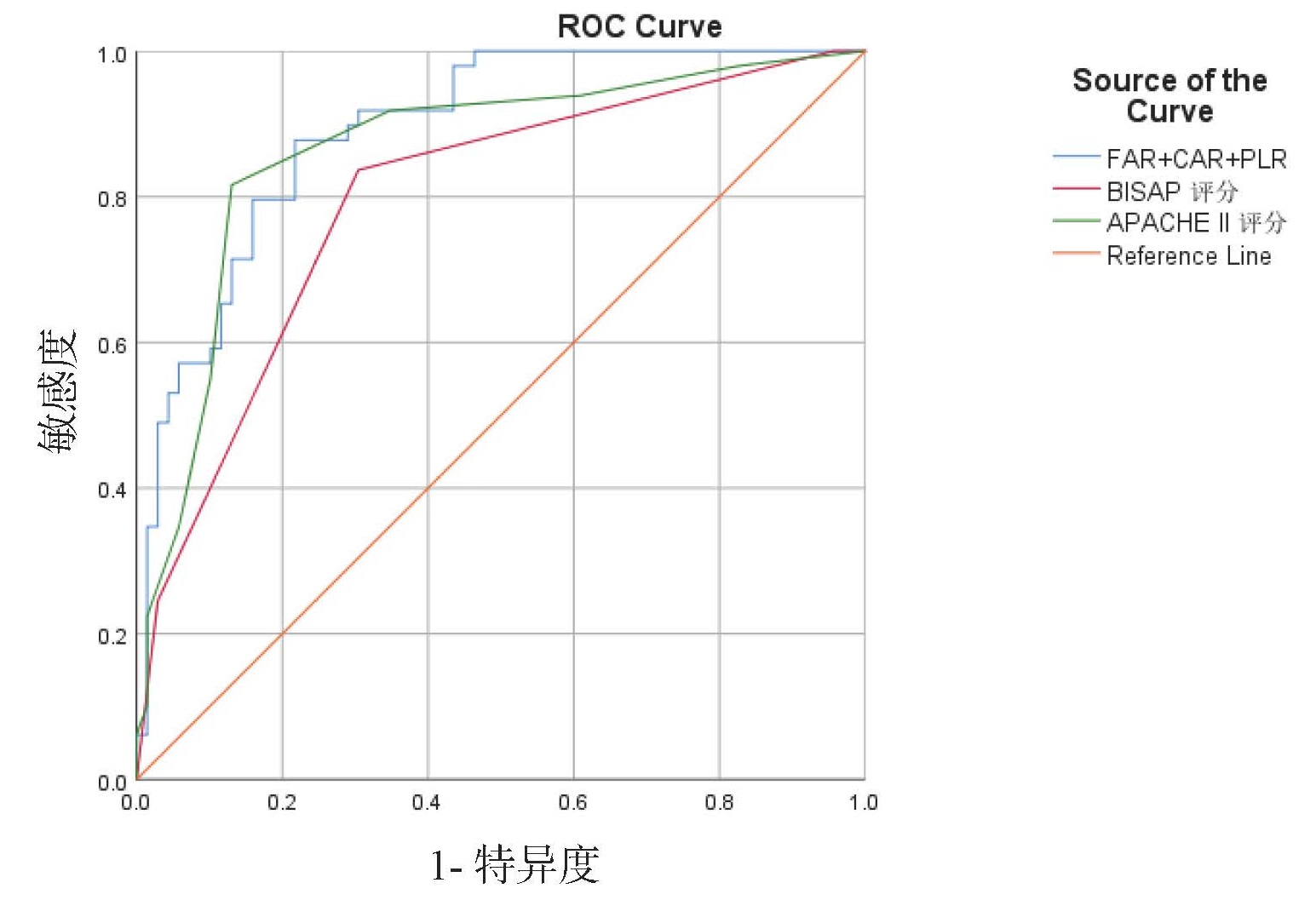
ROC曲线分析显示BISAP评分和APACHE Ⅱ评分预测HLAP患者预后不良的AUC分别为0.795和0.864,均低于FAR、CAR、PLR三者联合对HLAP患者预后不良的预测能力(AUC=0.875)。见图 2,表 6。
|
| 图 2 ROC曲线 Fig 2 ROC curve |
|
|
| 变量 | AUC | 95%CI | 敏感度(%) | 特异度(%) | 约登指数 | 截断值 |
| BISAP评分 | 0.795 | (0.712, 0.877) | 83.7 | 69.6 | 0.533 | 1.5 |
| APACHE Ⅱ评分 | 0.864 | (0.794, 0.935) | 81.6 | 87.0 | 0.686 | 4.5 |
| FAR+CAR+PLR | 0.875 | (0.814, 0.937) | 83.7 | 79.7 | 0.634 | 0.378 |
随着生活水平的提高,高脂血症已经成为AP的第二大病因,而血清中TG升高是HLAP的真正病因[4]。HLAP具有年轻化、重症化、易复发等特点[2]。迫切需要在疾病早期找到预测预后不良的方法,为早期干预提供依据。本研究结果显示在HLAP患者中,男性多于女性,年龄为(37.17 ± 9.89)岁,预后良好组年龄中位数及四分位数为36(31,42)岁,预后不良组患者年龄中位数及四分位数为33(30,39)岁,较其他类型AP患者年龄小[8],均小于AP患者平均年龄50岁[9],可见HLAP患者发病年龄呈现出明显的年轻化趋势。HLAP患者常合并有糖尿病、脂肪肝、高血压等疾病,这些疾病是HLAP潜在的危险因素,可通过影响血脂代谢,导致HLAP的发生和加重病情[4]。本研究可见HLAP患者大多合并糖尿病、脂肪肝、高血压等疾病;预后不良组并发症发生率高、病情重、住院时间长。本研究探讨FAR、CAR、PLR在HLAP疾病早期对预后不良进行预测的价值,以便早期识别预后不良患者,及时给予干预,改善预后。
目前,虽然尚无关于FAR预测HLAP预后不良的相关研究。但刘凯等[10]发现在AP患者中ALB与FIB比值(AFR)在死亡组明显低于生存组,且预测价值为(AUC=0.84,95%CI : 0.79~0.89),这提示FAR也有可能预测HLAP的预后。理论上,在AP早期会出现微循环障碍,激活凝血机制和纤溶系统,导致纤维蛋白原明显变化[11]。本研究中,也可看到预后不良组较预后良好组FIB水平显著升高。ALB是由肝脏合成的蛋白质,是血清蛋白的主要组成部分,反应机体的营养状况,维持血浆胶体渗透压、具有运输游离脂肪酸、发挥抗炎和抗氧化等功能。Zhao等[12]研究表明ALB水平高低与AP的严重程度及预后相关。在本研究中可见预后不良组ALB水平显著降低,这与上述研究结果一致。本研究将FIB与ALB结合起来,发现FIB与ALB比值FAR在预后不良组明显升高,且FAR越高,预后越差;表明FAR值与预后不良正相关,可以作为HLAP患者预后评价的可靠指标,预测价值(AUC=0.823,95%CI : 0.745~0.900)。
目前,CAR在预测HLAP预后中的作用尚未见研究。当AP发生时,引起肌酐升高原因有:释放大量炎症因子,使血管内皮细胞受损,血管通透性增加,导致肾血流减少,引起肌酐升高;腹腔压力增高,减少肾器官灌流、引起肌酐升高;呕吐导致体液丢失、血容量减少、引起肾脏灌注不足,导致肌酐升高;重症急性胰腺炎(Severe acute pancreatitis,SAP)时,胰酶外漏损伤组织,造成肌酐升高。本研究中预后不良组肌酐水平明显升高,提示肌酐与预后不良正相关。耿金婷等[13]发现,肌酐升高,SAP患者的发病率和病死率升高,肌酐是SAP患者严重程度的独立预测因子。那么CAR在HLAP患者中对预后不良的预测价值如何呢?我们发现,肌酐与预后不良正相关,ALB与预后不良负相关,二者比值CAR与预后不良正相关,CAR值越大,预后越差。这表明CAR是预后不良的可靠预测指标,预测价值(AUC=0.781,95%CI : 0.694~0.867)。且本研究结果显示PAR和CAR联合预测HLAP预后不良的价值(AUC=0.840,95%CI : 0.766~0.915)高于两者单独预测。
PLR是一种新兴的全身性炎症标记物,可作为血栓-炎症通路的综合反应[14]。有研究认为PLR的变化在评估AP的严重程度以及并发症方面有重要的临床价值[15],PLR与AP严重程度呈正相关[16],是早期SAP的危险因素[17]。且PLR升高对AP并发急性肾损伤[18]、病死率升高[19]呈正相关。但杨杭妹[20]研究表明PLR与病情严重程度无相关性(OR=0.392,P>0.05)。因此,PLR是否是评价HLAP患者病情严重程度及预后不良的指标仍不明确。AP时会出现炎症反应,损伤血管内皮细胞,激活血小板;由于内皮受损和炎症的联合作用又导致微血栓形成,使血小板过度减少[16]。AP中炎症反应引起皮质醇升高,抑制淋巴细胞的产生[21];CD8+T细胞过表达Fas/FasL引起淋巴细胞向炎症部位迁移增加[22]。PLR最终结果,取决于血小板和淋巴细胞下降的比例。本研究中,预后不良组患者血小板、淋巴细胞水平均降低,但PLR却明显升高,这充分说明了淋巴细胞下降比例超越了血小板的消耗,使PLR明显升高。PLR与预后不良正相关,可作为预测HLAP预后不良的指标,预测价值(AUC=0.652, 95%CI : 0.552~0.753)。且本研究结果显示,对HLAP患者预后不良的预测价值,PAR、CAR和PLR三者联合的预测价值(AUC=0.875,95%CI : 0.814~0.937)更优于两两联合及单独的预测价值。
BISAP评分[23]及APACHEⅡ评分[24]在HLAP患者的病情评估中均具有一定预测价值,本文中可见其预测价值分别为0.795、0.864,均低于FAR、CAR和PLR三者联合的预测价值0.875。BISAP评分操作项目虽然较少,但由于精神因素评估具有主观性,对评估结果会出现一定偏差。APACHEⅡ评分包括急性生理学、慢性健康状况及年龄因素,在评估疾病的严重程度方面更具优势,但是由于指标太多,操作起来比较复杂,不利于早期快速评估病情。本文中FAR、CAR和PLR三项指标在临床中容易得到,操作简单,且预测价值较高,有较高的特异度及敏感度,对临床有一定的指导意义。
本研究也存在一定的局限性,其仅为单中心回顾性研究,样本量较小。后续可能需要进行多中心、大样本的随机前瞻性对照研究进一步探索。
综上,本研究通过对HLAP患者的基线数据和检验检查结果进行统计学分析,发现FAR、CAR、PLR为HLAP患者发生预后不良的独立危险因素;ROC曲线分析结果表明,三者联合具有更高的预测价值,提示在疾病早期三者联合对HLAP预后不良进行预测,可以将HLAP的治疗关卡前移,尽早给予个性化治疗方案,降低并发症发生率,改善预后。
作者贡献声明 朱长举:研究设计、指导;王巧芳、梅超鹏:论文撰写、投稿;宋耀东、刘艳娜、李德剑、崔梦巍、何倩倩:数据收集及整理、统计学分析;李慧慧王海峰:论文修改。王巧芳、宋耀东:经费支持
利益冲突 所有作者均声明无利益冲突
| [1] | 杨鑫敏, 黄伟. 高三酰甘油血症性急性胰腺炎的基因学研究进展[J]. 中华胰腺病杂志, 2020, 20(3): 165-172. DOI:10.3760/cma.j.cn115667-20200515-00074 |
| [2] | Han SB, Chen D, Chen QY, et al. One-step laparoscopic pancreatic necrosectomy verse surgical step-up approach for infected pancreatic necrosis: a case-control study[J]. World J ur Emerg Med, 2022, 13(4): 274-282. DOI:10.5847/wjem.j.1920-8642.2022.058 |
| [3] | Lin XY, Zeng Y, Zhang ZC, et al. Incidenceandclinical characteristics of hypertriglyceridemic acute pancreatitis: a retrospectivesingle-centerstudy[J]. World J Gastroenterol, 2022, 28(29): 3946-3959. DOI:10.3748/wjg.v28.i29.3946 |
| [4] | 中华医学会急诊医学分会, 上海市医学会急诊专科分会. 急性胰腺炎急诊诊治专家共识[J]. 中华急诊医学杂志, 2024, 33(4): 470-479. DOI:10.3760/cma.j.issn.1671-0282.2024.04.004 |
| [5] | 灿海乐. 高甘油三酯血症性胰腺炎合并糖尿病患者严重程度预测模型的构建[D]. 湖北医药学院, 2023. DOI: 10.27913/d.cnki.ghyby.2023.000107. |
| [6] | 艾尼·买买提. 高脂血症性急性胰腺炎不良预后相关危险因素分析[D]. 新疆医科大学, 2022. DOI: 10.27433/d.cnki.gxyku.2022.000341. |
| [7] | 樊景云, 姚勇, 奉镭, 等. 高甘油三酯血症性急性胰腺炎患者血清肌酐、PLT和HCT水平与病情严重程度和预后的关系[J]. 临床和实验医学杂志, 2023, 22(10): 1049-1052. DOI:10.3969/j.issn.1671-4695.2023.10.011 |
| [8] | 李帅, 周晶, 罗贵贤, 等. 首发和复发急性高甘油三酯血症胰腺炎临床特征比较的全国多中心临床研究[J]. 中华消化外科杂志, 2024, 23(5): 703-711. DOI:10.3760/cma.j.cn115610-20240308-00146 |
| [9] | Carr RA, Rejowski BJ, Cote GA, et al. Systematic review of hypertriglyceridemia induced acute pancreatitis: A more virulent etiology?[J]. Pancreatology, 2016, 16(4): 469-476. DOI:10.1016/j.pan.2016.02.011 |
| [10] | 刘凯, 罗红兰, 柯楠, 等. CT评价系统联合白蛋白/纤维蛋白原比值对重症急性胰腺炎预后评估的价值[J]. 安徽医药, 2023, 27(05): 959-963. DOI:10.3969/j.issn.1009-6469.2023.05.024 |
| [11] | 王艳, 李春盛, 吴迪, 等. 血小板及凝血指标对急性胰腺炎患者病情严重度的早期识别价值[J]. 中国医师杂志, 2021, 23(1): 43-47. DOI:10.3760/cma.j.cn431274-20191021-01213 |
| [12] | Zhao Z, Yu Y, Xie R, et al. Prognostic value of the creatinine-albumin ratio in acute pancreatitis debridement[J]. BMC Surg, 2020, 20(1): 322-336. DOI:10.1186/s12893-020-00991-6 |
| [13] | 耿金婷, 王瑞峰, 杨宁, 等. 血尿素氮、血肌酐、C-反应蛋白质对急性胰腺炎严重程度及预后的预测价值[J]. 中国临床医生杂志, 2021, 49(8): 956-995. DOI:10.3969/j.issn.2095-8552.2021.08.023 |
| [14] | Kurtul A, Ornek E. Platelet to lymphocyte ratio in cardiovascular diseases: A systematic review[J]. Angiology, 2019, 70(9): 802-818. DOI:10.1177/0003319719845186 |
| [15] | Cho SK, Jung S, Lee K J, et al. Neutrophil to lymphocyte ratio and platelet to lymphocyte ratio can predict the severity of gallstone pancreatitis[J]. BMC Gastroenterol, 2018, 18(1): 18. DOI:10.1186/s12876-018-0748-4 |
| [16] | Karabuga B, Gemcioglu E, Konca KE, et al. Comparison of the predictive values of CRP, CRP/ albumin, RDW, neutrophil/lymphocyte, and platelet/lymphocyte levels in determining the severity of acute pancreatitis in patients with acute pancreatitis according to the BISAP score[J]. Bratisl Lek Listy, 2022, 123(2): 129-135. DOI:10.4149/BLL-2022-020 |
| [17] | 宋小静, 高伟波, 朱继红. 中性粒细胞/淋巴细胞比率联合血小板/淋巴细胞比率检测对于重症急性胰腺炎早期预测价值[J][J]. 中华急诊医学杂志, 2021, 30(8): 948-953. DOI:10.3760/cma.J.issn.1671-0282.2021.08.006 |
| [18] | 李平, 王东, 代小雨, 等. NLR和PLR以及CAR联合血清胱抑素C对急性胰腺炎合并急性肾损伤的预测价值[J]. 临床急诊杂志, 2021, 22(9) 592-596+602. DOI:10.13201/j.issn.1009-5918.2021.09.005 |
| [19] | Kaplan M, Ates I, Oztas E, et al. A new marker to determine prognosis of acute pancreatitis: PLR and NLR combination[J]. J Med Biochem, 2018, 37(1): 21-30. DOI:10.1515/jomb-2017-0039 |
| [20] | 杨杭妹. NLR、PLR、MLR及抗凝血酶Ⅲ对高脂血症性急性胰腺炎诊断及病情评估的临床意义[J]. 中国当代医药, 2023, 30(27) 8-12+197. DOI:10.3969/j.issn.1674-4721.2023.27.004 |
| [21] | Pinhu L, Qin Y, Xiong B, et al. Overexpression of Fas and FasL is associated with infectious complications and severity of experimental severe acute pancreatitis by promoting apoptosis of lymphocytes[J]. Inflammation, 2014, 37(4): 1202-1212. DOI:10.1007/s10753-014-9847-8 |
| [22] | Bhatia M. Apoptosis versus necrosis in acute pancreatitis[J]. Am J Physiol Gastrointest Liver Physiol, 2004, 286(2): G189-G196. DOI:10.1152/ajpgi.00304.2003 |
| [23] | 笪伟, 杨文蓓, 王兴宇, 等. 胰腺炎活动评分系统对急性胰腺炎活动性的预测价值[J]. 中华急诊医学杂志, 2022, 31(9): 1206-1209. DOI:10.3760/cma.j.issn.1671-0282.2022.09.009 |
| [24] | Zhu XG, Jiang JM, Li Li YX, et al. Development and validation of a nomogram for predicting survival in patients with acute pancreatitis[J]. world J urnal Emerg Med, 2023, 14(1): 44-48. DOI:10.5847/wjem.j.1920-8642.2023.022 |
 2024, Vol. 33
2024, Vol. 33