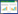2. 中国人民解放军联勤保障部队第901医院(安徽医科大学临床学院)重症医学科,合肥 230031
2. Department of Critical Care Medicine, The 901 Hospital of the Joint Logistic Support Force of the Chinese People's Liberation Army, Clinic College, Anhui Medical University, Hefei 230031, China
急性胰腺炎(acute pancreatitis, AP)是指多种原因引起的胰酶激活致胰腺组织自身消化,进而导致的胰腺炎症反应,临床上可伴或不伴多器官功能障碍。全球AP的总发病率为每年每10万人30例,主要受影响年龄阶段为中老年人群[1]。虽然多数患者发展为轻型胰腺炎,但进入重症监护病房(intensive care unit, ICU)的多已进展为重症急性胰腺炎(severe acute pancreatitis, SAP),临床上SAP约占AP的20%[2],病死率则达20%~40%[2]。SAP伴胰腺或胰周组织坏死,继而并发感染,炎症介质的释放引起全身炎症反应综合征(systemic inflammatory response syndrome, SIRS),最终致脓毒症或脓毒性休克,甚至多器官功能衰竭,是SAP患者死亡的主要原因。脓毒症是指宿主对感染反应的失调引起的危及生命的器官功能障碍[3],脓毒症是ICU常见病,病死率高达30%,如合并脓毒性休克,其病死率甚至高达50%[4-5]。2017年全球疾病负担研究显示,脓毒症与全球近20%的死亡有关[6]。脓毒症是SAP患者加重需要入住ICU的主要原因,也是SAP后期患者死亡的主要原因[7]。目前对于ICU内AP患者合并脓毒症的临床特点和影响因素的研究较少,本研究拟回顾分析收住ICU的住院患者临床资料,以了解影响ICU住院的AP患者并发脓毒症的影响因素并建立预测模型。旨在尽早识别高危人群,为临床医师制订诊疗措施提供依据。
1 资料与方法 1.1 研究对象回顾性分析自2013年10月至2023年10月收治于安徽医科大学第二附属医院重症医学一科的306例诊断为AP的患者临床资料。纳入标准:(1)首次入住ICU;(2)年龄≥18岁;(3)第一诊断为AP的患者。AP的诊断标准是基于满足以下三个标准中的两个: ①与急性胰腺炎一致的腹痛; ②血清淀粉酶活性至少是正常上限的3倍或以上; ③急性胰腺炎在计算机断层显像(CECT)或磁共振成像(MRI)或腹部超声检查上的特征性表现。脓毒症的诊断标准符合脓毒症和脓毒症休克的第3个国际共识定义,即Sepsis3.0标准[3]。排除标准:(1)住ICU时间≤24 h者;(2)合并恶性肿瘤患者;(3)妊娠患者;(4)数据缺失值大于20%者。
本研究严格遵循《赫尔辛基宣言》中的人体医学研究中的伦理原则。且本研究经安徽医科大学第二附属医院伦理委员会批准(伦理批准号:YX2023-136)。
1.2 资料收集收集患者的包括基础信息、实验室检查指标,干预措施和预后的资料。基础信息包括性别、年龄、体重指数(body mass index, BMI)、基础疾病、AP严重程度(分为轻度、中度和重度)、病因(分为胆源性、高脂血症性、酒精性和其他)、急性生理学与慢性健康状况(acute physiology and chronic health evaluation, APACHE)Ⅱ评分、序贯器官衰竭评估(sequential organ failure assessment,SOFA)评分、改良Marshall评分;实验室指标(均为入ICU后24 h内的首次化验结果),包括炎性指标:白细胞(white blood cell, WBC)、中性粒细胞百分比(N%)、C-反应蛋白(C-reactive protein)、降钙素原(procalcitonin, PCT)、白介素-6(interleukin-6, IL-6);生化指标:总胆红素(total bilirubin, TB)、白蛋白(albumin, Alb)、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、丙氨酸转氨酶(alanine transaminase, ALT)、血尿素氮(blood urea nitrogen, BUN)、肌酐(creatinine, Cr)、血糖(glucose, Glu);凝血功能:凝血酶原时间(prothrombin time, PT)、活化部分凝血酶原时间(activated partial thromboplastin time, APTT)、血小板(platelet, PLT);血淀粉酶(blood amylase, Amy)、血钙(blood calcium, Ca),血钾(serum kalium, K);干预措施:包括是否有创机械通气、是否使用血管活性药物、是否应用抗生素、是否行床边连续性肾脏替代治疗(continuous renal replacement therapy, CRRT)、是否行腹腔穿刺引流、是否行外科手术;并发症:包括是否合并腹膜后出血、肠瘘和消化道出血;预后指标:ICU住院时间和全因病死率。
1.3 统计学方法采用R4.1.2进行统计学分析;计数资料用例(n)或率(%)表示,组间比较采用χ2检验或Fisher精确概率法;正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验,不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Wilcoxon秩和检验。所有数据应用多重插补法对缺失值进行插补。将数据随机拆分为训练集和验证集用于模型的内部验证。采用10折交叉验证的最小绝对收缩与选择算子(least absolute shrinkage and selection operator, LASSO)回归加对预测因素进行筛选,使用方差膨胀因子没有发现共线性。将上述筛选出的预测因子进行多因素Logistic回归分析校正混杂因素,筛选出预测AP患者并发脓毒症的独立危险因素。训练集数据用于建立Nomogram图风险预测模型,验证集数据用于模型评价。分别在训练集和验证集中采用受试者工作特征曲线(receiver operating characteristiccurve,ROC)曲线和曲线下面积(area under the curve, AUC)评价模型的预测效能,分布采用校准曲线(Calibration)和决策分析(decision curve analysis,DCA)曲线对模型的校准度和临床有效性进行评估,并采用Hosmer-Lemeshow检验对模型的拟合优度进行评价。应用R4.1.2软件绘制Nomogram图。以P<0.05为差异有统计学意义。
2 结果 2.1 两组一般资料和临床指标的比较本研究共纳入306例AP患者,其中,发生脓毒症者127例,发生率41.5%。两组患者在年龄、BMI、APACHE Ⅱ评分、SOFA评分、改良Marshall评分、血淀粉酶、血小板、IL-6、总胆红素、尿素氮、肌酐、总胆固醇,并发症、是否应用血管活性药物、是否机械通气、是否接受CRRT、是否使用抗生素、是否接受腹腔穿刺引流和是否接受外科手术,ICU住院时间和全因病死率方面差异均有统计学意义(P<0.05)。而两组间性别、基础疾病、AP严重程度、AP病因、白细胞、中性粒细胞百分比、CRP、降钙素原、PT、APTT、丙氨酸转氨酶、白蛋白、甘油三酯、血糖、血钾、血钙、是否行CRRT之间差异均无统计学意义(P>0.05),见表 1。
| 变量 | 训练集 | 统计量 | P值 | 验证集 | 统计量 | P值 | ||
| 非脓毒症(n=127例) | 脓毒症(n=88例) | 非脓毒症(n=52例) | 脓毒症(n=39例) | |||||
| 年龄(岁)a | 49(38.00, 64.00) | 50.50 (38.75, 71.25) | 1.078 | 0.299 | 44.5(34.75, 59.00) | 57(46.00, 68.50) | 6.853 | 0.010 |
| 性别b | 0.002 | 0.963 | 0.297 | 0.586 | ||||
| 男 | 74 (58.27) | 51 (57.95) | 27 (51.92) | 18 (46.15) | ||||
| 女 | 53 (41.73) | 37 (42.05) | 25 (48.08) | 21 (53.85) | ||||
| 体重指数a | 25.42 (23.99~26.50) | 27.07 (25.57~28.25) | 33.243 | < 0.001 | 25.63 (24.11~26.43) | 26.31 (25.24~27.60) | 5.983 | 0.014 |
| 病因b | 2.378 | 0.498 | 4.588 | 0.205 | ||||
| 胆源性 | 69 (54.33) | 56 (63.64) | 27 (51.92) | 28 (71.79) | ||||
| 高脂血症性 | 52 (40.94) | 27 (30.68) | 20 (38.46) | 10 (25.64) | ||||
| 酒精性 | 1 (0.79) | 1 (1.14) | 2 (3.85) | 0 (0.00) | ||||
| 其他 | 5 (3.94) | 4 (4.55) | 3 (5.77) | 1 (2.56) | ||||
| 疾病严重程度b | 0.456 | 0.796 | 5.768 | 0.056 | ||||
| 重症 | 90 (70.87) | 66 (75.00) | 30 (57.69) | 31 (79.49) | ||||
| 中度重症 | 29 (22.83) | 17 (19.32) | 18 (34.62) | 5 (12.82) | ||||
| 轻症 | 8 (6.30) | 5 (5.68) | 4 (7.69) | 3 (7.69) | ||||
| 基础疾病b | ||||||||
| 糖尿病 | 28 (22.05) | 13 (14.77) | 1.782 | 0.182 | 15 (28.85) | 9 (23.08) | 0.382 | 0.537 |
| 高血压 | 27 (21.26) | 20 (22.73) | 0.066 | 0.798 | 9 (17.31) | 11 (28.21) | 1.543 | 0.214 |
| 冠心病 | 7 (5.51) | 6 (6.82) | 0.156 | 0.693 | 4 (7.69) | 1 (2.56) | 1.129 | 0.288 |
| 慢性阻塞性肺疾病 | 8 (6.30) | 6 (6.82) | 0.023 | 0.879 | 2 (3.85) | 2 (5.13) | 0.087 | 0.768 |
| 评分a | ||||||||
| APACHEⅡ评分 | 11.00 (7.00~15.00) | 17.00 (13.75~22.00) | 45.297 | < 0.001 | 8.50 (5.00~14.25) | 16.00 (12.50~21.00) | 21.389 | < 0.001 |
| 改良Marshall评分 | 2.00 (0.00~3.00) | 3.00 (2.00~5.00) | 17.274 | < 0.001 | 2.00 (1.00~3.25) | 2.00 (1.00~4.00) | 3.024 | 0.082 |
| 实验室检查c | ||||||||
| 白细胞(×109/L) | 12.10 (8.93~16.90) | 13.62 (8.82~19.01) | 0.785 | 0.375 | 12.98 (9.43~15.81) | 13.07 (8.72~17.45) | 0.003 | 0.958 |
| 中性粒细胞百分比(%) | 85.70 (80.70~89.11) | 87.50 (82.47~91.93) | 4.991 | 0.025 | 85.90 (80.72~88.85) | 87.50 (82.00~90.60) | 1.981 | 0.159 |
| C~反应蛋白(mg/L) | 178.80 (69.55~253.10) | 192.45 (99.60~294.80) | 0.913 | 0.339 | 154.75 (31.90~254.15) | 200.10 (131.80~288.61) | 4.517 | 0.034 |
| 降钙素原(ng/ml) | 1.63 (0.38~5.21) | 2.14 (0.60~8.14) | 2.03 | 0.154 | 1.65 (0.46~4.57) | 2.27 (0.77~5.25) | 0.432 | 0.511 |
| 白介素_6(pg/ml) | 93.80 (29.27~161.75) | 161.10 (82.33~435.52) | 26.664 | < 0.001 | 51.80 (18.90~105.85) | 322.00 (128.14~706.65) | 34.935 | < 0.001 |
| 总胆红素(μmol/L) | 20.10 (13.35~28.65) | 29.80 (19.18~49.75) | 17.993 | < 0.001 | 20.70 (12.30~32.07) | 25.30 (20.05~48.95) | 4.036 | 0.045 |
| 白蛋白(g/L) | 29.30 (25.05~34.70) | 28.70 (25.20~34.92) | < 0.001 | 0.979 | 30.19±7.12c | 28.08±6.59c | 2.082 | 0.153 |
| 总胆固醇(mmol/L) | 3.96 (2.75~6.36) | 3.64 (2.22~5.03) | 2.401 | 0.121 | 3.92 (3.03~5.75) | 4.12 (2.33~5.03) | 1.688 | 0.194 |
| 甘油三酯(mmol/L) | 1.94 (1.08~9.91) | 2.04 (1.04~5.64) | 0.245 | 0.621 | 2.35 (1.27~5.20) | 1.33 (0.79~2.38) | 8.084 | 0.004 |
| 谷丙转氨酶(U/L) | 43.00 (22.50~108.00) | 66.50 (28.50~160.75) | 7.16 | 0.007 | 42.50 (25.00~90.75) | 42.00 (23.50~76.00) | 0.402 | 0.526 |
| 尿素氮(mmol/L) | 6.73 (4.48~10.70) | 8.43 (5.86~12.28) | 5.228 | 0.022 | 6.23 (3.63~10.52) | 7.60 (4.61~10.30) | 0.568 | 0.451 |
| 肌酐(μmol/L) | 83.00 (59.50~145.50) | 114.50 (73.25~212.50) | 7.905 | 0.005 | 97.00 (62.75~155.25) | 90.00 (59.50~123.00) | 0.487 | 0.485 |
| 血糖(mmol/L) | 8.61 (6.55~13.68) | 8.98 (6.76~12.73) | 0.046 | 0.831 | 8.67 (6.89~12.71) | 8.96 (6.59~11.78) | 0.009 | 0.923 |
| 凝血酶原时间(S) | 13.00 (11.85~14.50) | 13.20 (11.90~15.40) | 1.032 | 0.31 | 12.20 (11.35~14.27) | 13.00 (11.90~14.15) | 1.586 | 0.208 |
| 活化部分凝血酶原时间(S) | 31.20 (26.40~36.50) | 33.20 (26.65~39.60) | 1.883 | 0.17 | 29.35 (25.82~36.23) | 29.20 (23.65~34.80) | 0.709 | 0.4 |
| 血小板(×109/L) | 187.00 (130.50~245.00) | 144.00 (91.25~204.00) | 12.608 | < 0.001 | 169.50 (145.75~204.75) | 124.00 (92.50~183.50) | 7.634 | 0.006 |
| 血淀粉酶(U/L) | 378.00 (118.50~1101.50) | 898.50 (290.50~1749.00) | 10.087 | 0.001 | 494.50 (85.75~1390.00) | 539.00 (248.50~1477.50) | 0.320 | 0.572 |
| 血钙(mmol/L) | 1.89 (1.65~2.04) | 1.86 (1.55~1.99) | 1.034 | 0.309 | 1.96 (1.73~2.13) | 1.89 (1.66~2.02) | 3.086 | 0.079 |
| 血钾(mmol/L) | 4.24 (3.63~4.63) | 4.21 (3.60~4.70) | 0.05 | 0.823 | 4.02 (3.70~4.70) | 4.33 (3.95~4.60) | 1.915 | 0.166 |
| 干预措施b | ||||||||
| 血管活性药物 | 28 (22.05) | 41 (46.59) | 14.368 | < 0.001 | 14 (26.92) | 13 (33.33) | 0.439 | 0.508 |
| 抗生素 | 107 (84.25) | 83 (94.32) | 5.126 | 0.024 | 41 (78.85) | 39 (100.00) | 9.384 | 0.002 |
| 有创机械通气 | 24 (18.90) | 35 (39.77) | 11.376 | < 0.001 | 7 (13.46) | 13 (33.33) | 5.132 | 0.023 |
| 连续性血液净化 | 25 (19.69) | 25 (28.41) | 2.217 | 0.137 | 10 (19.23) | 5 (12.82) | 0.665 | 0.415 |
| 腹腔穿刺引流 | 49 (38.58) | 56 (63.64) | 13.058 | < 0.001 | 16 (30.77) | 27 (69.23) | 13.227 | < 0.001 |
| 外科干预 | 11 (8.66) | 15 (17.05) | 3.437 | 0.064 | 4 (7.69) | 13 (33.33) | 9.645 | 0.002 |
| 并发症 | 35 (27.56) | 65 (73.86) | 44.8 | < 0.001 | 14 (26.92) | 33 (84.62) | 29.703 | < 0.001 |
| 预后b | 7.904 | 0.019 | 3.886 | 0.143 | ||||
| 治愈 | 44 (34.65) | 20 (22.73) | 19 (36.54) | 8 (20.51) | ||||
| 好转 | 73 (57.48) | 51 (57.95) | 28 (53.85) | 23 (58.97) | ||||
| 死亡 | 10 (7.87) | 17 (19.32) | 5 (9.62) | 8 (20.51) | ||||
| ICU住院时间a | 8.00 (6.00~11.00) | 11.00 (5.00~22.25) | 4.266 | 0.039 | 8.00 (6.00~10.00) | 8.00 (5.00~21.00) | 1.271 | 0.260 |
| 注:APACHE Ⅱ评分为急性生理和慢性健康状况评分;ICU为重症监护病房;a为M(Q1,Q3), b为例(%), c为x±s, | ||||||||
单因素分析显示,BMI、APACHE Ⅱ评分、SOFA评分、改良Marshall评分、血小板、IL-6、总胆红素、并发症、是否应用血管活性药物、是否机械通气、是否接受CRRT、是否使用抗生素、是否接受腹腔穿刺引流和是否接受外科手术,ICU住院时间和全因病死率方面差异均有统计学意义(P<0.05),见表 2。
| 变量 | B | SE | OR | CI | Z | P值 |
| 年龄 | 0.008 | 0.008 | 1.01 | 0.99~1.02 | 1.002 | 0.317 |
| 性别 | 0.013 | 0.281 | 1.01 | 0.58~1.76 | 0.046 | 0.963 |
| BMI | 0.484 | 0.088 | 1.62 | 1.37~1.93 | 5.524 | <0.001 |
| 病因 | ||||||
| 高脂血症性 | -0.447 | 0.298 | 0.64 | 0.36~1.15 | -1.5 | 0.134 |
| 酒精性 | 0.209 | 1.426 | 1.23 | 0.08~20.16 | 0.146 | 0.884 |
| 其他 | -0.014 | 0.695 | 0.99 | 0.25~3.85 | -0.021 | 0.983 |
| 疾病严重程度 | ||||||
| 中度重症 | -0.224 | 0.346 | 0.8 | 0.41~1.57 | -0.648 | 0.517 |
| 轻症 | -0.16 | 0.593 | 0.85 | 0.27~2.72 | -0.27 | 0.787 |
| 基础疾病 | ||||||
| 糖尿病 | -0.49 | 0.369 | 0.61 | 0.3~1.26 | -1.327 | 0.184 |
| 高血压 | 0.086 | 0.334 | 1.09 | 0.57~2.1 | 0.256 | 0.798 |
| 冠心病 | 0.227 | 0.575 | 1.25 | 0.41~3.87 | 0.394 | 0.693 |
| 慢性阻塞性肺疾病 | 0.085 | 0.559 | 1.09 | 0.36~3.26 | 0.152 | 0.879 |
| 评分 | ||||||
| APACHE Ⅱ评分 | 0.134 | 0.025 | 1.14 | 1.09~1.2 | 5.436 | <0.001 |
| 改良Marshall评分 | 0.235 | 0.063 | 1.26 | 1.12~1.43 | 3.75 | <0.001 |
| 实验室检查 | ||||||
| 白细胞 | 0.027 | 0.02 | 1.03 | 0.99~1.07 | 1.356 | 0.175 |
| 中性粒细胞百分比 | 0.033 | 0.019 | 1.03 | 1~1.07 | 1.698 | 0.089 |
| C-反应蛋白 | 0.001 | 0.001 | 1 | 1~1 | 0.985 | 0.325 |
| 降钙素原 | 0.008 | 0.007 | 1.01 | 0.99~1.02 | 1.188 | 0.235 |
| 白介素-6 | 0.003 | 0.001 | 1 | 1~1 | 3.901 | <0.001 |
| 总胆红素 | 0.021 | 0.006 | 1.02 | 1.01~1.03 | 3.475 | 0.001 |
| 白蛋白 | -0.004 | 0.019 | 1 | 0.96~1.03 | -0.204 | 0.838 |
| 总胆固醇 | -0.006 | 0.04 | 0.99 | 0.92~1.07 | -0.155 | 0.877 |
| 甘油三酯 | -0.022 | 0.018 | 0.98 | 0.94~1.01 | -1.176 | 0.24 |
| 谷丙转氨酶 | 0 | 0 | 1 | 1~1 | 0.823 | 0.41 |
| 尿素氮 | 0.022 | 0.017 | 1.02 | 0.99~1.06 | 1.328 | 0.184 |
| 肌酐 | 0.001 | 0.001 | 1 | 1~1 | 1.34 | 0.18 |
| 血糖 | 0.018 | 0.015 | 1.02 | 0.99~1.05 | 1.2 | 0.23 |
| 凝血酶原时间 | 0.03 | 0.025 | 1.03 | 0.98~1.08 | 1.178 | 0.239 |
| 活化部分凝血酶原时间 | 0.006 | 0.008 | 1.01 | 0.99~1.02 | 0.721 | 0.471 |
| 血小板 | -0.007 | 0.002 | 0.99 | 0.99~1 | -3.394 | 0.001 |
| 血淀粉酶 | 0 | 0 | 1 | 1~1 | 0.565 | 0.572 |
| 血钙 | -0.173 | 0.345 | 0.84 | 0.43~1.65 | -0.501 | 0.617 |
| 血钾 | -0.075 | 0.169 | 0.93 | 0.67~1.29 | -0.444 | 0.657 |
| 干预措施 | ||||||
| 血管活性药物 | 1.126 | 0.302 | 3.08 | 1.71~5.57 | 3.724 | <0.001 |
| 抗生素 | 1.132 | 0.521 | 3.1 | 1.12~8.61 | 2.174 | 0.03 |
| 有创机械通气 | 1.042 | 0.314 | 2.83 | 1.53~5.24 | 3.314 | 0.001 |
| 连续性血液净化 | 0.482 | 0.325 | 1.62 | 0.86~3.06 | 1.482 | 0.138 |
| 腹腔穿刺引流 | 1.025 | 0.287 | 2.79 | 1.59~4.89 | 3.57 | <0.001 |
| 外科手术 | 0.773 | 0.424 | 2.167 | 0.944~4.975 | 1.823 | 0.068 |
| 并发症 | 2.005 | 0.314 | 7.43 | 4.01~13.75 | 6.396 | <0.001 |
| 预后指标 | ||||||
| 好转 | 0.43 | 0.326 | 1.54 | 0.81~2.91 | 1.32 | 0.187 |
| 死亡 | 1.319 | 0.481 | 3.74 | 1.46~9.6 | 2.741 | 0.006 |
| ICU住院时间 | 0.038 | 0.012 | 1.04 | 1.01~1.06 | 3.135 | 0.002 |
| 注:BMI为体重指数;APACHEⅡ评分为急性生理和慢性健康状况评分;ICU为重症监护病房 | ||||||
将单因素分析中差异有统计学意义的且可能对AP并发脓毒症有影响的因素纳入LASSO回归中进行变量筛选。当调节参数为lambda.1se(λ=0.056)时,对应模型的变量选择为:BMI、APACHE II评分、IL-6、血小板、总胆红素和并发症,见图 1A和图 1B。上述所有预测因子之间经方差膨胀因子检验均不存在共线性。因此,经LASSO回归筛选出的所有预测因子均纳入多因素logistic回归分析。
|
| A:10个变量的LASSO系数曲线;B:在LASSO模型中通过10折交叉验证方法筛选最合适λ的过程 图 1 LASSO回归筛选预测因子 Fig 1 LASSO regression screen for predictors |
|
|
将LASSO回归筛选出的预测因子纳入多因素logistic回归分析,结果显示,BMI升高(OR =1.912,95%CI:1.5~2.438)、APACHE Ⅱ评分升高(OR =1.124,95%CI:1.057~1.194)、IL~6升高(OR =1.002,95%CI:1~1.004)、血小板降低(OR =0.993,95%CI:0.987~0.999)、总胆红素升高(OR =1.019,95%CI:1.004~1.035)、出现并发症(OR =6.247,95%CI:2.71~14.397)均是ICU内AP并发脓毒症的独立危险因素(P<0.05),见表 3。
| 变量 | B | SE | OR | CI | Z | P值 |
| 体重指数 | 0.648 | 0.124 | 1.912 | 1.500~2.438 | 5.232 | <0.001 |
| APACHE Ⅱ评分 | 0.117 | 0.031 | 1.124 | 1.057~1.194 | 3.714 | <0.001 |
| 白介素-6 | 0.002 | 0.001 | 1.002 | 1~1.004 | 2.150 | 0.032 |
| 血小板 | -0.007 | 0.003 | 0.993 | 0.987~0.999 | -2.403 | 0.016 |
| 总胆红素 | 0.019 | 0.008 | 1.019 | 1.004~1.035 | 2.470 | 0.014 |
| 并发症 | 1.832 | 0.426 | 6.247 | 2.71~14.397 | 4.302 | <0.001 |
| 注:APACHE Ⅱ评分为急性生理和慢性健康状况评分 | ||||||
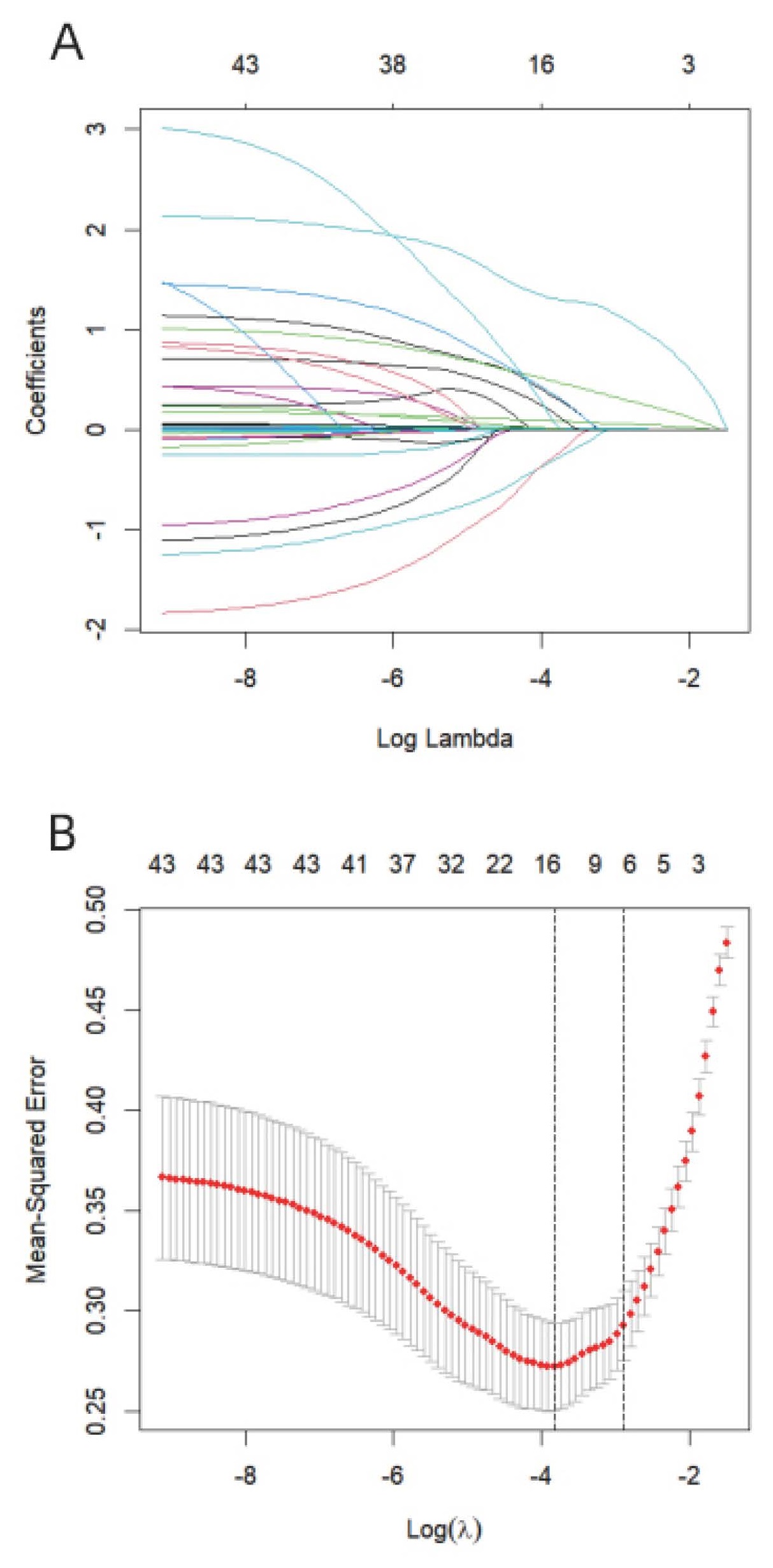
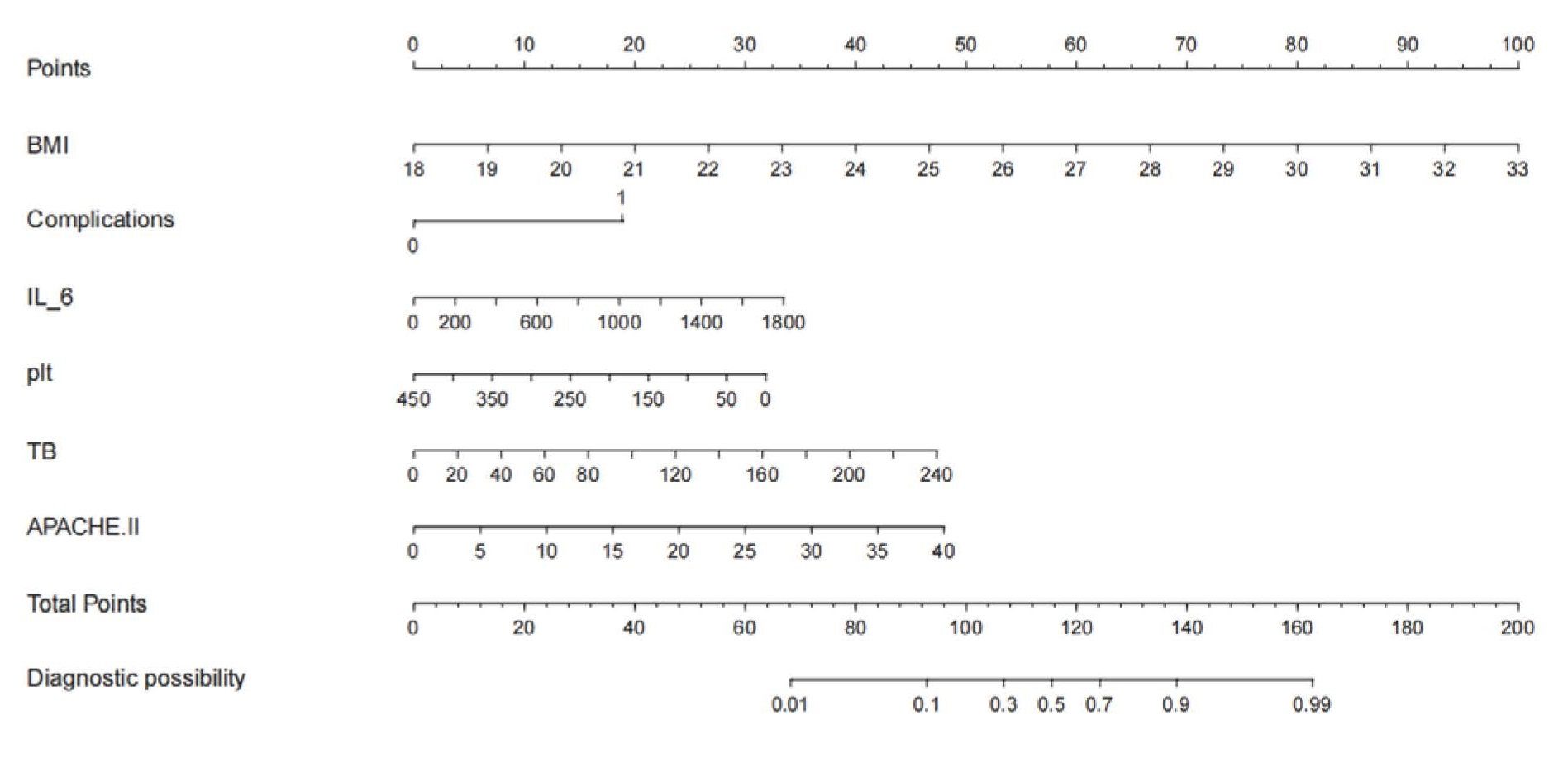
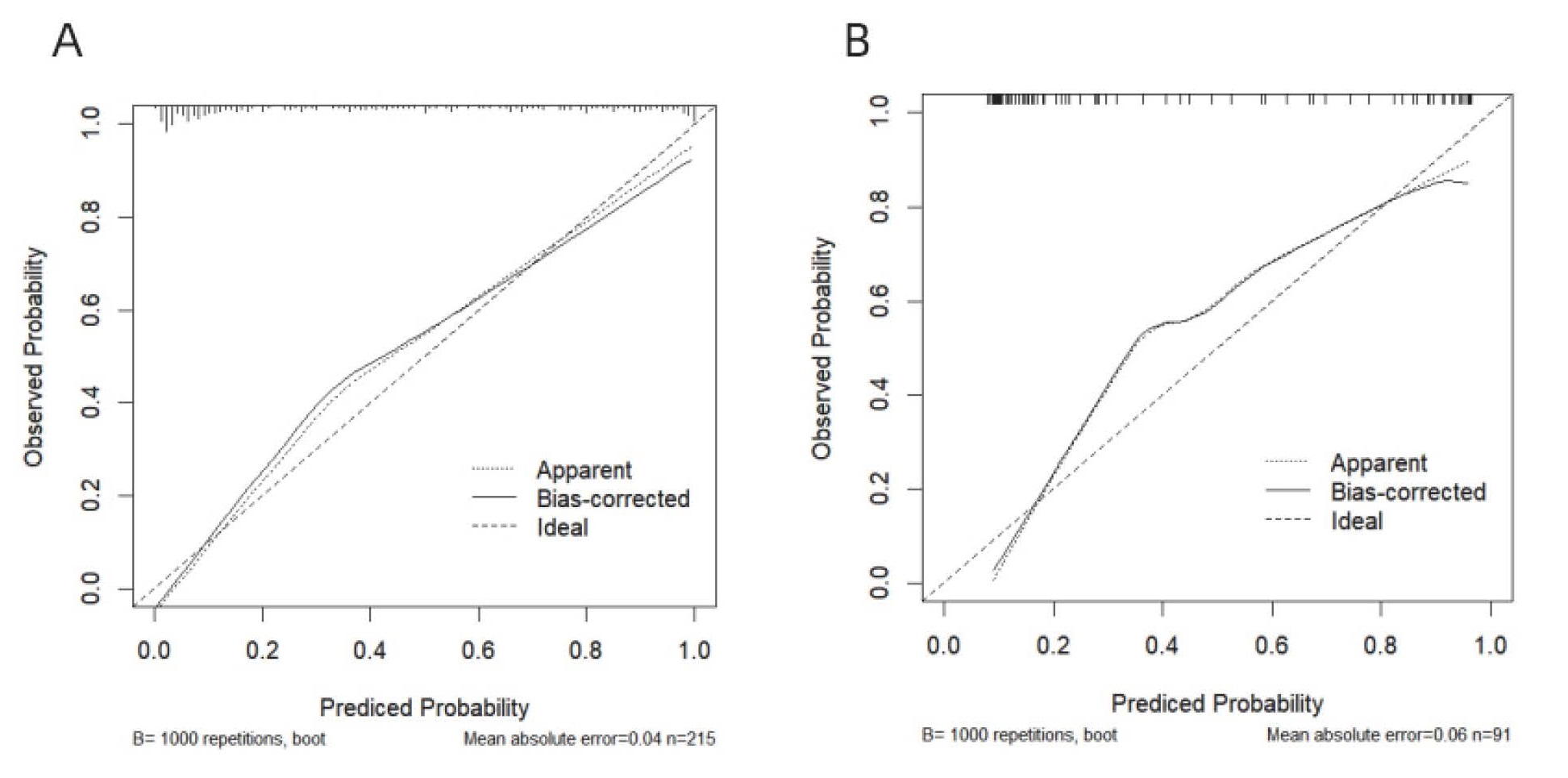
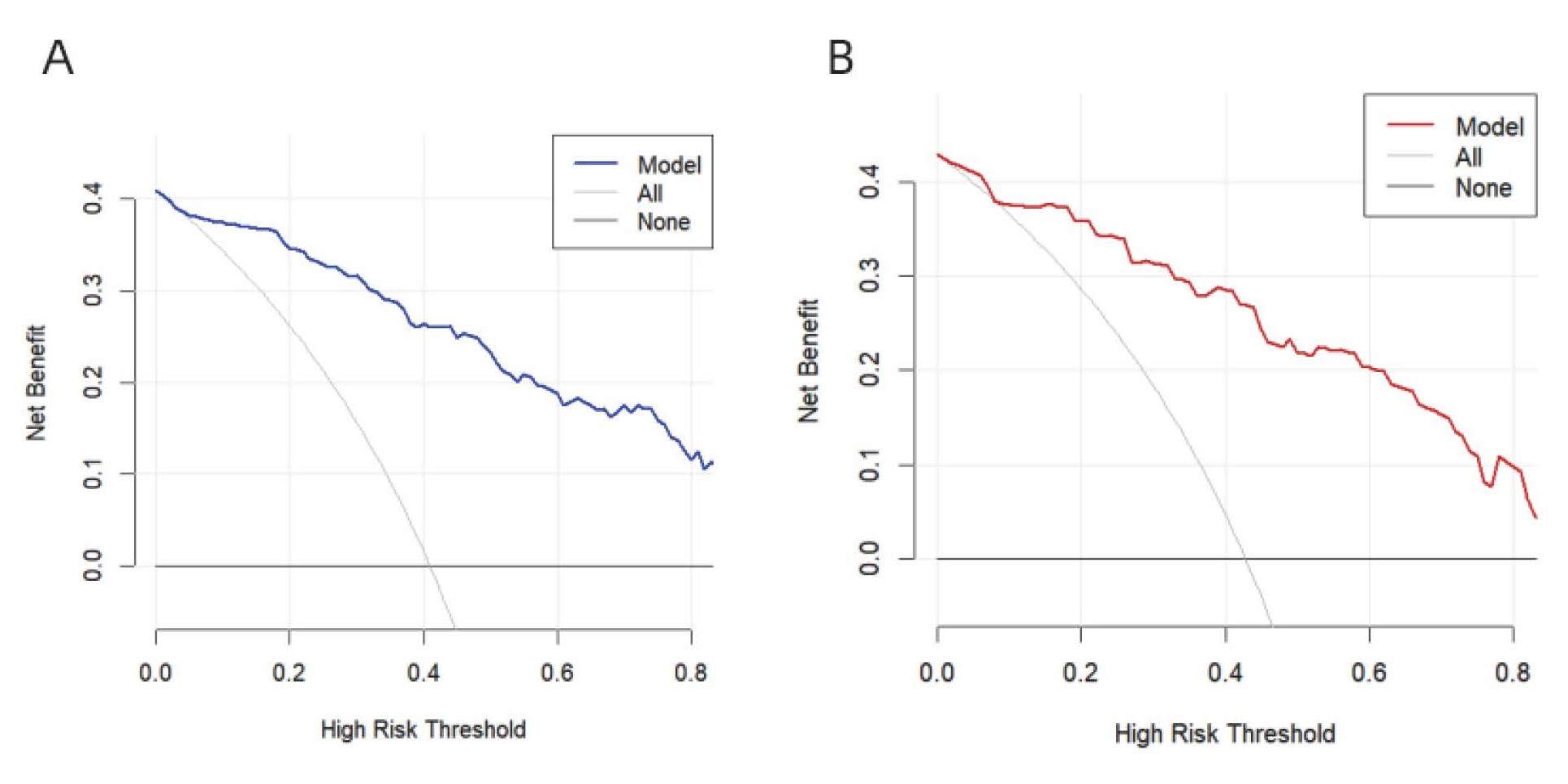
基于上述多因素logistic回归分析结果构建Nomogram图预测模型,见图 2。训练集和验证集中预测AP患者发生脓毒症风险的AUC值分别为0.913(95%CI:0.875~0.951)和0.901(95%CI:0.837~0.965),说明该预测模型在本中心队列中具有良好的敏感度和特异度(图 3);在预测模型的校准度方面,训练集和验证集的校准曲线重叠度较高,说明预测模型的预测概率和实际概率一致性较好,可为临床医生提供较可靠的预测结果(图 4);DCA曲线显示训练集和验证集中的阈值概率范围均较大,均具有较高的临床净获益,临床有效性较好(图 5)。总之,该预测模型在预测ICU内AP患者并发脓毒症发生风险上具有较好的区分度,准确度和临床应用价值。
|
| 图 2 AP患者并发脓毒症的nomogram图 Fig 2 Nomogram of AP patients with sepsis |
|
|
|
| 蓝线:训练集;红色:验证集 图 3 AP患者并发脓毒症受试者工作特征曲线 Fig 3 ROC curve of AP patients with sepsis |
|
|
|
| A: 训练集;B:验证集;实线为标准曲线,虚线为预测模型的实际曲线,对角线为理想模型所在的参考线 图 4 AP患者并发脓毒症模型校准曲线 Fig 4 Model calibration curve of AP patients with sepsis |
|
|
|
| A:训练集;B:验证集;横坐标(X轴)表示干预阈概率,纵坐标(Y轴)表示期望获益;两条极端曲线为All曲线和None曲线,模型曲线越远离两条极端曲线表示临床有效性越好 图 5 AP患者并发脓毒症决策曲线分析 Fig 5 Decision curve analysis of AP patients complicated with sepsis |
|
|
急性胰腺炎,尤其是重症急性胰腺炎,根据发展病程可分为两个阶段,早期(病程<2周)表现为炎症反应,晚期(发病2周以后)常合并感染坏死等并发症,与此相对应的有2个死亡高峰,第一高峰期的AP患者多合并全身炎症反应综合征(systemic inflammatory response syndrome, SIRS),随后出现多器官功能衰竭;第二个高峰期患者常合并局部和全身并发症,局部并发症包括胰腺或胰腺周围组织感染坏死[8];全身并发症则包括脓毒症,脓毒性休克及持续存在的多器官功能衰竭[9]。虽然两个阶段有相互重叠,但晚期并发症直接影响患者病情严重程度,预后较差。尽管目前早期液体复苏,肠内营养的给予等可降低AP患者并发脓毒症及多器官功能衰竭等的风险[10-11],但由于对疾病认识不足,治疗的不及时及抗生素滥用及耐药性等因素使得AP合并脓毒症患者住院时间延长,病死率升高。因此,在疾病早期识别对入ICU的AP患者发生脓毒症的风险预测,并采取积极的干预措施对改善患者临床结局至关重要。
本研究发现,肥胖、较高的APACHE Ⅱ评分、较高的IL-6水平、较低的血小板水平、升高的总胆红素和并发症的发生均是影响ICU内AP并发脓毒症的独立危险因素。据此建立的可视化nomogram预测模型在训练集和验证中的AUC值分别是0.913和0.901,提示预测模型的区分度较好。本研究还采用校准曲线对预测模型的准确性进行评估,结果显示训练集和验证集的模型曲线均贴近标准曲线,提示模型的预测概率与实际观察到的发生概率较接近,准确度较高。DCA曲线主要用于评估预测模型在临床决策中的应用价值,横坐标表示患病风险值,纵坐标表示模型预测效益值。本研究中训练集和验证集的决策曲线均位于两条极端曲线的右上角,说明根据该预测模型对AP患者并发脓毒症的预测进行干预可以带来临床获益,可以为临床医生提供可靠的临床预测价值。
肥胖已被证明是多种疾病的危险因素,如高血压、冠心病、慢性肾脏病[12]和2型糖尿病等,并认为肥胖者体内脂肪组织,特别是内脏脂肪组织的内分泌功能,以及由此分泌的各种细胞因子和脂肪因子是肥胖与慢性疾病之间的生物学联系[13]。肥胖者体内的胰岛素/胰岛素样生长因子轴和慢性低级别炎症反应以及瘦素、脂联素等脂肪因子也可能是肥胖与这些慢性疾病的关联途径[13]。既往研究发现,肥胖可增加AP发生的概率且加重病情,是AP病死率增加的独立危险因素[14-15]。肥胖者体内的由于营养物质过度积累致有储存能力的脂肪细胞被脂肪饱和,易导致脂肪组织肥大,进而缺氧、坏死,而脂肪细胞的缺氧坏死进一步引起炎症介质释放,使得炎症反应程度更重[16]。这可能也是肥胖的AP患者更易并发脓毒症的原因之一。
APACHE Ⅱ评分是ICU内常用的评价危重患者疾病严重程度,预测发病率和病死率的最可靠的评分系统之一[17]。APACHE Ⅱ评分不仅可反应脓毒症患者的病情严重程度和预后[18],有研究显示,APACHE Ⅱ评分也是高甘油三酯血症性SAP合并急性肾损伤的独立危险因素[19]。在AP患者中,APACHE Ⅱ评分在预测胰腺坏死,器官衰竭和入住ICU方面有较高的敏感度和阴性预测值,对于决策是否需要转诊到更高的诊疗中心具有较高的价值,APACHE Ⅱ可以作为一种预测AP严重程度的有用工具[20]。这与本研究结果一致。
血小板是血常规里监测凝血功能的指标,参与机体止血凝血过程。既往研究发现,血小板计数与AP的严重程度相关,重度AP患者血小板计数减少,病情恢复期血小板计可逐步增加至正常水平[21-22]。随着胰腺炎症的发生和进展,血小板活化因子可放大炎症反应,加重胰腺微循环障碍致病情进一步加重[23]。脓毒症时全身炎症反应失控,大量炎性因子使血管内皮损伤,血小板内皮黏附利于微血栓形成,最终致血小板消耗增加[24]。血小板减少也被认为是脓毒症患者死亡的预测因素之一[25]。因此,AP合并脓毒症时可伴血小板的减少。
IL-6是由活化的单核巨噬细胞产生的一种重要的急性反应期炎症介质,还可刺激肝脏合成急性时相反应蛋白。在AP和脓毒症时,IL-6均参与炎症和免疫反应[26]。研究显示,IL-6水平与脓毒症病情严重程度相关,入院时IL-6水平较高的患者死亡风险增大,IL-6水平下降较快时患者预后较好[27]。IL-6与AP疾病严重程度相关[26],可作为胰腺病变和炎症反应的有效指标[28]。脓毒症合并血小板减少时IL-6水平较高,IL-6水平升高可作为脓毒症合并血小板减少的独立危险因素。
另外,本研究还发现,总胆红素升高的患者使AP患者更易合并脓毒症。可能原因在于胰腺炎时患者合并胆管结石以及炎症反应等导致肝细胞受损,其结合分泌胆红素的能力下降,致胆红素水平升高。其次,脓毒症时由于炎症反应对毛细血管和肝细胞的破坏导致肝细胞受损,进而导致肝内胆汁淤积,最终致胆红素水平升高。
本研究有以下局限,一是本研究为回顾性研究,数据来源为单一中心,且样本量少,结果可能存在选择偏倚;其二,研究数据可能缺少部分临床特征数据,对结果可能会造成一定程度的影响。
利益冲突 所有作者声明无利益冲突
作者贡献 李壮丽、吴泽华:数据收集和整理、论文撰写;苑俊:统计分析;李跃东:研究指导;孙昀:论文修改、经费支持
| [1] | Petrov MS, Yadav D. Global epidemiology and holistic prevention of pancreatitis[J]. Nat Rev Gastroenterol Hepatol, 2019, 16(3): 175-184. DOI:10.1038/s41575-018-0087-5 |
| [2] | Boxhoorn L, Voermans RP, Bouwense SA, et al. Acute pancreatitis[J]. Lancet, 2020, 396(10252): 726-734. DOI:10.1016/s0140-6736(20)31310-6 |
| [3] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [4] | Cecconi M, Evans L, Levy M, et al. Sepsis and septic shock[J]. Lancet, 2018, 392(10141): 75-87. DOI:10.1016/s0140-6736(18)30696-2 |
| [5] | Bauer M, Gerlach H, Vogelmann T, et al. Mortality in sepsis and septic shock in Europe, North America and Australia between 2009 and 2019- results from a systematic review and meta-analysis[J]. Crit Care, 2020, 24(1): 239. DOI:10.1186/s13054-020-02950-2 |
| [6] | Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the global burden of disease study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [7] | Mifkovic A, Pindak D, Daniel I, et al. Septic complications of acute pancreatitis[J]. Bratisl Lek Listy, 2006, 107(8): 296-313. |
| [8] | Zhu XG, Jiang JM, Li YX, et al. Development and validation of a nomogram for predicting survival in patients with acute pancreatitis[J]. World J Emerg Med, 2023, 14(1): 44-48. DOI:10.5847/wjem.j.1920-8642.2023.022 |
| [9] | Oláh A, Pardavi G, Belágyi T, et al. Preventive strategies for septic complications of acute pancreatitis[J]. Chirurgia (Bucur), 2007, 102(4): 383-388. |
| [10] | Crockett SD, Wani S, Gardner TB, et al. American gastroenterological association institute guideline on initial management of acute pancreatitis[J]. Gastroenterology, 2018, 154(4): 1096-1101. DOI:10.1053/j.gastro.2018.01.032 |
| [11] | Arvanitakis M, Ockenga J, Bezmarevic M, et al. ESPEN guideline on clinical nutrition in acute and chronic pancreatitis[J]. Clin Nutr, 2020, 39(3): 612-631. DOI:10.1016/j.clnu.2020.01.004 |
| [12] | Susic D, Varagic J. Obesity: a perspective from hypertension[J]. Med Clin North Am, 2017, 101(1): 139-157. DOI:10.1016/j.mcna.2016.08.008 |
| [13] | Nimptsch K, Konigorski S, Pischon T. Diagnosis of obesity and use of obesity biomarkers in science and clinical medicine[J]. Metabolism, 2019, 92: 61-70. DOI:10.1016/j.metabol.2018.12.006 |
| [14] | Blaszczak AM, Krishna SG, Hart PA, et al. Class Ⅲ obesity rather than metabolic syndrome impacts clinical outcomes of acute pancreatitis: a propensity score weighted analysis[J]. Pancreatology, 2020, 20(7): 1287-1295. DOI:10.1016/j.pan.2020.08.011 |
| [15] | Dobszai D, Mátrai P, Gyöngyi Z, et al. Body-mass index correlates with severity and mortality in acute pancreatitis: a meta-analysis[J]. World J Gastroenterol, 2019, 25(6): 729-743. DOI:10.3748/wjg.v25.i6.729 |
| [16] | Kwaifa IK, Bahari H, Yong YK, et al. Endothelial dysfunction in obesity-induced inflammation: molecular mechanisms and clinical implications[J]. Biomolecules, 2020, 10(2): 291. DOI:10.3390/biom10020291 |
| [17] | Tekin B, Kiliç J, Taşkin G, et al. The Comparison of scoring systems: SOFA, APACHE-Ⅱ, LODS, MODS, and SAPS-Ⅱ in critically ill elderly sepsis patients[J]. J Infect Dev Ctries, 2024, 18(1): 122-130. DOI:10.3855/jidc.18526 |
| [18] | Martin-Loeches I, Guia MC, Vallecoccia MS, et al. Risk factors for mortality in elderly and very elderly critically ill patients with sepsis: a prospective, observational, multicenter cohort study[J]. Ann Intensive Care, 2019, 9(1): 26. DOI:10.1186/s13613-019-0495-x |
| [19] | 谢光伟, 孙昀, 曹利军, 等. 高甘油三酯血症型重症急性胰腺炎并发急性肾损伤的临床特点和危险因素研究[J]. 中华急诊医学杂, 2023, 32(9): 1172-1177. DOI:10.3760/cma.j.issn.1671-0282.2023.09.005 |
| [20] | Harshit Kumar A, Singh Griwan M. A comparison of APACHE Ⅱ, BISAP, Ranson's score and modified CTSI in predicting the severity of acute pancreatitis based on the 2012 revised Atlanta Classification[J]. Gastroenterol Rep, 2018, 6(2): 127-131. DOI:10.1093/gastro/gox029 |
| [21] | Jiang LB, Ding W, Zhang M. The progressive increase of the platelet count in a patient with acute severe pancreatitis[J]. Am J Emerg Med, 2017, 35(1): 191.e1-191191.e2. DOI:10.1016/j.ajem.2016.06.081 |
| [22] | Hua ZP, Su YJ, Huang XF, et al. Analysis of risk factors related to gastrointestinal fistula in patients with severe acute pancreatitis: a retrospective study of 344 cases in a single Chinese center[J]. BMC Gastroenterol, 2017, 17(1): 29. DOI:10.1186/s12876-017-0587-8 |
| [23] | Hui LL, Zang K, Wang M, et al. Comparison of the preference of nutritional support for patients with severe acute pancreatitis[J]. Gastroenterol Nurs, 2019, 42(5): 411-416. DOI:10.1097/SGA.0000000000000331 |
| [24] | Greco E, Lupia E, Bosco O, et al. Platelets and multi-organ failure in sepsis[J]. Int J Mol Sci, 2017, 18(10): 2200. DOI:10.3390/ijms18102200 |
| [25] | 张立琳, 章金鹏, 金律, 等. 多指标联合序贯器官衰竭评分对脓毒症患者的预后分析[J]. 中华危重病急救医学, 2023, 35(12): 1245-1249. DOI:10.3760/cma.j.cn121430-20230617-00453 |
| [26] | Ćeranić DB, Zorman M, Skok P. Interleukins and inflammatory markers are useful in predicting the severity of acute pancreatitis[J]. Bosn J Basic Med Sci, 2020, 20(1): 99-105. DOI:10.17305/bjbms.2019.4253 |
| [27] | Thao PTN, Tra TT, Son NT, et al. Reduction in the IL-6 level at 24h after admission to the intensive care unit is a survival predictor for Vietnamese patients with sepsis and septic shock: a prospective study[J]. BMC Emerg Med, 2018, 18(1): 39. DOI:10.1186/s12873-018-0191-4 |
| [28] | Li N, Wang BM, Cai S, et al. The role of serum high mobility group box 1 and interleukin-6 levels in acute pancreatitis: a meta-analysis[J]. J Cell Biochem, 2018, 119(1): 616-624. DOI:10.1002/jcb.26222 |
 2024, Vol. 33
2024, Vol. 33