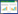2. 北京中医药大学东方医院,北京 100078;
3. 北京市中医药研究所,北京 100010
2. Oriental Hospital of Beijing University of Chinese, Beijing 100078, China;
3. Beijing Institute of Traditional Chinese Medicine, Beijing 100010, China
脓毒症是由感染引起的宿主反应失调导致的能威胁生命的器官功能障碍综合征,脓毒症是世界范围内重症监护病房(intensive care unit,ICU)的常见疾病,也是重症患者死亡的主要原因之一[1],近年来死于脓毒症并发的多器官衰竭综合征(multiple organ dysfunction syndrome,MODS)的人数在逐渐上升[2-3]。肺是脓毒症发生时最容易也是最先受到损伤的器官,约有将近7成引起脓毒症的感染来自肺部,同时,脓毒症合并急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)患者的28 d病死率高达30%~40%,且患者出院后仍保持着较高的病死率[4]。在ARDS中,肺水肿主要由肺泡-毛细血管屏障完整性缺陷引起,在肺泡-毛细血管通透性增加的情况下,肺血管系统中升高的静水压会导致更快的肺泡充盈,但是,足够的组织灌注对于多系统器官衰竭患者至关重要,因而妥善处理肺水肿是临床实践中实现最佳液体管理的基础[5]。黄芪是补气类中药,具有既能增强免疫,又能抑制炎症反应的双向调节作用,临床研究发现每日加用20 mL黄芪注射液有利于减少ARDS患者肺部血管通透性,提高氧合指数,在基础研究中可以降低ARDS大鼠干湿重比并改善氧合,从而提高其生存率。但中药靶点众多,黄芪对ARDS的治疗效果和机制不完全明确,本研究将探索黄芪对ARDS的治疗效果并探究其可能的机制。
1 材料与方法 1.1 实验动物与造模70只SPF级C57BL/6J小鼠,体重(20±2) g,由北京华阜康生物科技公司提供,适应性喂养7 d后通过随机数字表法进行分组,10只小鼠作为假手术组,其余60只小鼠进行盲肠结扎穿孔术(cecal ligation and puncture, CLP)造模,6 h后,除假手术组外,随机(随机数字法)分为模型对照组、黄芪组,每组30只,分别灌胃生理盐水、黄芪水煎剂。CLP手术方法:剖开小鼠腹腔并分离盲肠,使用丝线结扎盲肠远端75%,18 G注射器针头穿刺两次,挤出少量粪便,擦拭干净后将盲肠回纳腹腔并逐层缝合,假手术组小鼠仅麻醉、剖开腹腔随即缝合,不进行盲肠结扎操作。术后于小鼠颈后皮下注射2 mL生理盐水进行液体复苏。
1.2 治疗本研究使用生黄芪水煎剂作为实验组治疗方式,生黄芪由北京中医医院门诊中药房提供,100 g生黄芪加水没过药材浸泡20 min后,大火煮开后转文火煎0.5 h,过200目筛滤取药液,再次加入双蒸水,大火煮开后转文火煎20 min,滤取药液。合并两次药液,加热浓缩至1 000 mL,此时黄芪水煎剂浓度为0.1 g/mL。造模6 h后,CLP组随机(随机数字法)分为对照组、黄芪组,假手术组和对照组使用生理盐水灌胃,黄芪组使用黄芪水煎剂灌胃。四组按照0.2 mL/10 g体重的剂量灌胃,CLP术后6 h开始灌胃,之后每日早晚各1次。造模后12 h、24 h存活的小鼠随机挑选5只处死取材。
1.3 观察指标 1.3.1 肺干湿重比测定取出左肺分别测量干重和湿重并计算干重和湿重的比值。将小鼠处死后并仰卧固定,逐层剪开小鼠胸腔,取出左肺,剪除血管、气管等多余组织,用生理盐水冲掉表面的血液,之后用吸水纸吸干,称重并记录为湿重;将称重完毕的肺组织置于锡纸上,放入60 ℃烘箱内,连续烘烤48 h,称重并记录为干重。以湿重除以干重结果记录为干湿重比。
1.3.2 支气管肺泡灌洗液蛋白浓度测定CLP造模12 h、24 h后,进行双肺支气管肺泡灌洗,留取支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),测定其中总蛋白浓度。操作时,将小鼠处死后并仰卧固定,使用眼科剪沿前颈部前正中线逐层剪开,暴露小鼠气管,将其与周围组织钝性分离,之后沿环状软骨横向剪开,插入注射器针头并捆绑固定。吸取1.5 mL生理盐水,缓缓推入,停留数秒后缓缓吸出,重复3次后将液体存入离心管中,1 500转离心15 min后,取上清液。使用BCA蛋白定量试剂盒测定BALF中总蛋白浓度,测定步骤按照说明书操作。
1.3.3 肺组织切片HE染色及病理评分取出小鼠右肺中叶进行HE染色并进行肺损伤病理评分。每组选取4张病理切片,每张病理切片随机抽取3个40×倍数的视野,由打开位置开始随机方向连续位移选取视野,肺泡面积至少占视野面积50% 以上,若有大面积的空泡或血管则重新选取,由两名提前培训的研究者进行盲评之后按照公式进行加权计算。计算结果为0~1(包含)的数字[6-7]。
1.3.4 蛋白质组学分析CLP造模后12 h、24 h,取小鼠BALF后处死小鼠并分离血清,使用多因子蛋白芯片进行差异蛋白筛选,之后对差异蛋白进行富集分析,具体步骤为:将芯片原始数据用软件归一化后,选择Normalization数据来做分析。分析方法为moderated t-statistics,数据包为limma,来自R/Bioconductor;采用adjust p value(BH方法校正后P值)和logFC(表达差异倍数,以2为底)对差异蛋白进行筛选。挑选条件为:(1)logFC > log2(1.2),差异阈值为1.2;(2)校正后P值(或P) < 0.05。
1.4 统计学方法使用SPSS 24软件进行数据统计和分析,计量资料以均数±标准差(x±s)表示, 三组数据计量资料使用单因素ANOVA方差分析并进行组间比较;涉及百分比、比值使用非参数检验,以P < 0.05为差异有统计学意义。使用graphpad prism 7软件绘图。
2 结果 2.1 黄芪水煎剂减轻了ARDS小鼠的肺部水肿 2.1.1 黄芪减轻了ARDS模型小鼠的BALF总蛋白浓度CLP造模后12、24 h,通过支气管肺泡灌洗收集小鼠BALF,测定其中蛋白浓度。术后12 h,ARDS模型对照组小鼠BALF总蛋白浓度;造模12 h后对照组小鼠BALF中蛋白浓度升高,但24 h后三组BALF总蛋白量浓度差异无统计学意义。见表 1。
| 指标 | 假手术组 | 对照组 | 黄芪组 |
| 12 h BALF蛋白浓度 | 310.70±13.80 | 887.53±225.12a | 563.02±27.83 |
| 24 h BALF蛋白浓度 | 294.10±16.11 | 347.71±72.3 | 346.22±78.22 |
| 12 h肺干湿重比 | 3.53±0.66 | 5.88±1.98a | 3.82±0.71a |
| 24 h肺干湿重比 | 4.13±0.21 | 4.735±0.19a | 4.34±0.10 |
| 12 h急性肺损伤评分 | 0.14±0.03 | 0.69±0.08a | 0.39±0.05ab |
| 24h急性肺损伤评分 | 0.15±0.04 | 0.69±0.06a | 0.41±0.23ab |
| 注:a与假手术组比较, aP < 0.05;与对照组比较,bP < 0.05 | |||
CLP术后12 h,ARDS模型对照组小鼠肺干湿重比比值增高,与假手术组相比差异有统计学意义(P=0.38),说明CLP造模使得小鼠肺脏水肿,但是黄芪水煎剂灌胃小鼠肺组织干湿重与对照组和假手术组均无统计学意义(P=0.074,P=0.758);CLP术后24 h,ARDS模型对照组与黄芪组、假手术组小鼠肺干湿重比比值差异有统计学意义(均P < 0.05),黄芪组与假手术组小鼠肺干湿重比差异无统计学意义(P=0.12)。
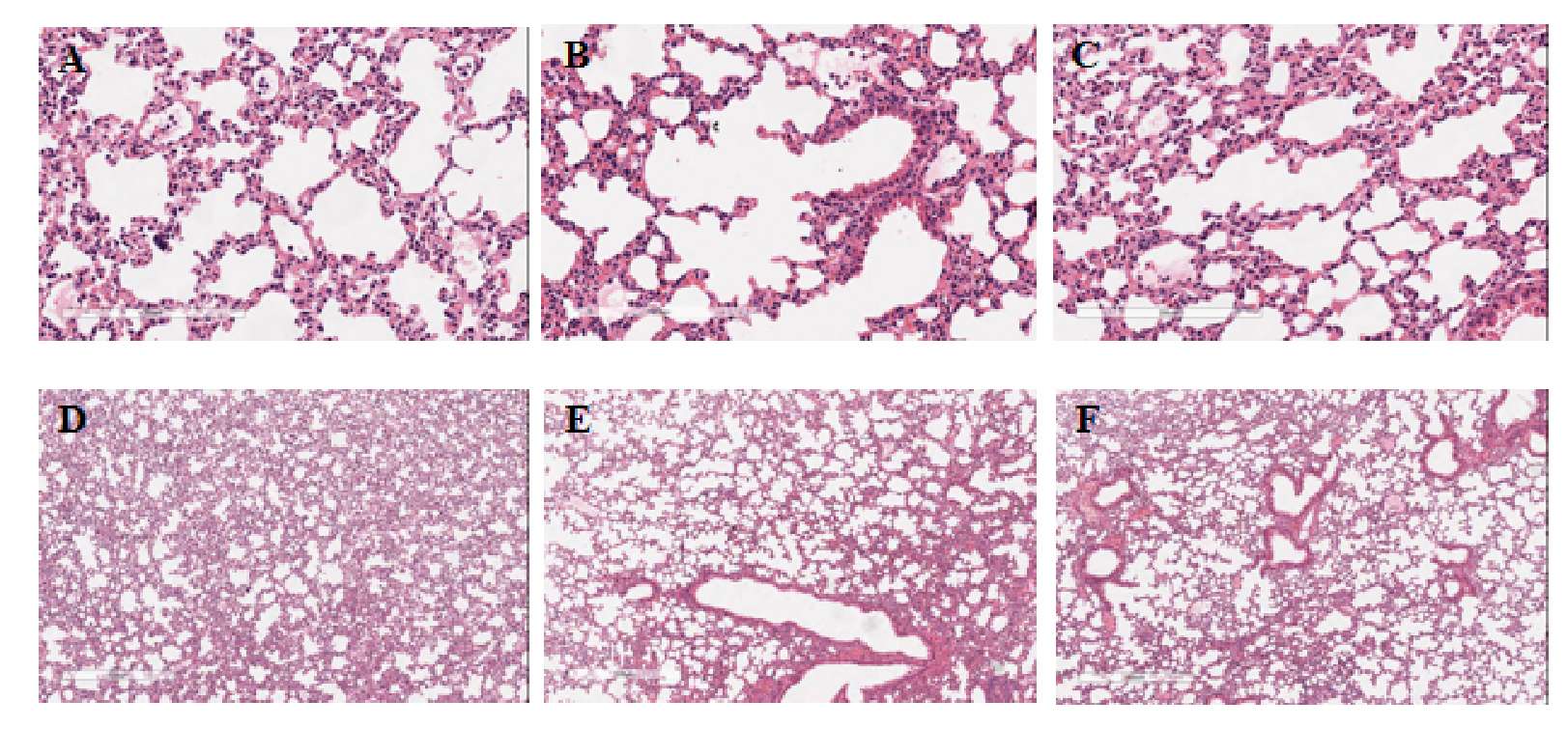
2.2 黄芪水煎剂改善了ARDS小鼠的急性肺泡损伤CLP造模后12、24 h将小鼠处死取材,分离右肺中叶进行HE染色,每组选取4张染色切片由2名培训后的研究生进行肺损伤评分打分,评分内容包括巨噬细胞聚集、透明膜形成和肺泡壁增厚等(见附表1)。CLP术后12 h,对照组与黄芪组肺损伤评分均升高,与假手术组相比差异有统计学意义(均P < 0.01),黄芪灌胃降低了肺损伤评分,差异有统计学意义(P < 0.01);CLP术后24 h,对照组与黄芪组肺损伤评分均升高,与假手术组相比差异有统计学意义(均P < 0.01),黄芪灌胃降低了肺损伤评分,差异有统计学意义(P < 0.01)。见表 1。
2.3 黄芪水煎剂治疗ARDS小鼠的蛋白质组学分析 2.3.1 黄芪水煎灌胃后小鼠血清差异化蛋白筛选为明确黄芪水煎剂对ARDS小鼠蛋白表达差异的影响,利用蛋白芯片对CLP术后12、24 h血清样本进行差异蛋白分析,该蛋白芯片包含共40个蛋白。术后12 h,黄芪组vs.假手术组共9个差异表达蛋白,黄芪组vs.对照组共筛选出4个差异化表达蛋白,黄芪灌胃治疗上调了IL-5、GM-CSF、IL-3及IL-17的表达,对照组vs.假手术组共筛选出8个差异化表达蛋白;术后24 h,黄芪组vs.假手术组共24个差异表达蛋白,黄芪组vs对照组共筛选出22个差异化表达蛋白,除了IL-21、IL-13蛋白的表达下调外,其余均为上调,对照组vs假手术组共筛选出15个差异化表达蛋白。见表 1。
利用蛋白芯片对CLP术后12、24 h BALF样本进行差异蛋白分析,术后12 h,黄芪组vs.对照组共16个差异表达蛋白,黄芪组vs.假手术组共筛选出1个差异化表达蛋白,对照组vs.假手术组共筛选出20个差异化表达蛋白;2 h,黄芪组vs.假手术组共2个差异表达蛋白,黄芪组vs.对照组共筛选出5个差异化表达蛋白,对照组vs.假手术组共筛选出2个差异化表达蛋白。见表 2。
| 指标 | 术后12 h黄芪组vs.对照组 | 术后24 h黄芪组vs.对照组 | |||||
| P值 | Regulation | Threshold | P.Value | Regulation | Threshold | ||
| BLC | 0.25 | down | FALSE | 0.00 | up | TRUE | |
| CD30L | 0.61 | down | FALSE | 0.19 | down | FALSE | |
| Eotaxin | 0.49 | up | FALSE | 0.85 | down | FALSE | |
| Eotaxin-2 | 0.47 | up | FALSE | 0.14 | down | FALSE | |
| Fas L | 0.69 | down | FALSE | 0.87 | down | FALSE | |
| G-CSF | 0.45 | up | FALSE | 0.00 | up | TRUE | |
| GM-CSF | 0.02 | up | TRUE | 0.07 | up | FALSE | |
| ICAM-1 | 0.62 | up | FALSE | 0.00 | up | TRUE | |
| IFNg | 0.38 | up | FALSE | 0.00 | up | TRUE | |
| IL-1a | 0.41 | up | FALSE | 0.11 | up | FALSE | |
| IL-1b | 0.27 | up | FALSE | 0.01 | up | TRUE | |
| IL-2 | 0.35 | up | FALSE | 0.02 | up | TRUE | |
| IL-3 | 0.03 | up | TRUE | 0.01 | up | TRUE | |
| IL-4 | 0.29 | up | FALSE | 0.13 | down | FALSE | |
| IL-5 | 0.01 | up | TRUE | 0.20 | up | FALSE | |
| IL-6 | 0.37 | up | FALSE | 0.00 | up | TRUE | |
| IL-7 | 0.71 | down | FALSE | 0.43 | down | FALSE | |
| IL-10 | 0.27 | up | FALSE | 0.00 | up | TRUE | |
| IL-12p70 | 0.06 | up | FALSE | 0.10 | up | FALSE | |
| IL-13 | 0.87 | down | FALSE | 0.01 | down | TRUE | |
| IL-15 | 0.05 | down | FALSE | 0.11 | down | FALSE | |
| IL-17 | 0.04 | up | TRUE | 0.02 | up | TRUE | |
| IL-21 | 0.30 | down | FALSE | 0.00 | down | TRUE | |
| KC | 0.34 | up | FALSE | 0.00 | up | TRUE | |
| Leptin | 0.70 | up | FALSE | 0.85 | up | FALSE | |
| LIX | 0.67 | up | FALSE | 0.01 | up | TRUE | |
| MCP-1 | 0.43 | up | FALSE | 0.00 | up | TRUE | |
| MCP-5 | 0.89 | up | FALSE | 0.00 | up | TRUE | |
| MCSF | 0.70 | down | FALSE | 0.32 | up | FALSE | |
| MIG | 0.18 | up | FALSE | 0.00 | up | TRUE | |
| MIP-1a | 0.27 | up | FALSE | 0.02 | up | TRUE | |
| MIP-1g | 0.26 | up | FALSE | 0.19 | down | FALSE | |
| PF4 | 0.51 | up | FALSE | 0.97 | down | FALSE | |
| RANTES | 0.19 | up | FALSE | 0.02 | up | TRUE | |
| TARC | 0.35 | up | FALSE | 0.00 | up | TRUE | |
| TCA-3 | 0.96 | down | FALSE | 0.01 | up | TRUE | |
| TIMP-1 | 0.83 | up | FALSE | 0.31 | up | FALSE | |
| TNFa | 0.33 | up | FALSE | 0.03 | up | TRUE | |
| TNF RI | 0.20 | up | FALSE | 0.91 | up | FALSE | |
| TNF RII | 0.33 | up | FALSE | 0.50 | up | FALSE | |
| 指标 | 术后12 h黄芪组vs.对照组 | 术后24 h黄芪组vs.对照组 | |||||
| P.Value | Regulation | Threshold | P.Value | Regulation | Threshold | ||
| BLC | 0.01 | up | TRUE | 0.00 | up | TRUE | |
| CD30L | 0.08 | up | FALSE | 0.19 | down | FALSE | |
| Eotaxin | 0.00 | up | TRUE | 0.05 | up | FALSE | |
| Eotaxin-2 | 0.00 | up | TRUE | 0.10 | down | FALSE | |
| Fas L | 0.06 | up | FALSE | 0.32 | down | FALSE | |
| G-CSF | 0.00 | up | TRUE | 0.00 | up | TRUE | |
| GM-CSF | 0.09 | up | FALSE | 0.38 | down | FALSE | |
| ICAM-1 | 0.34 | up | FALSE | 0.14 | down | FALSE | |
| IFNg | 0.15 | up | FALSE | 0.92 | down | FALSE | |
| IL-1a | 0.04 | up | FALSE | 0.81 | up | FALSE | |
| IL-1b | 0.23 | up | FALSE | 0.62 | down | FALSE | |
| IL-2 | 0.31 | up | FALSE | 0.76 | down | FALSE | |
| IL-3 | 0.32 | up | FALSE | 0.68 | down | FALSE | |
| IL-4 | 0.01 | up | TRUE | 0.89 | down | FALSE | |
| IL-5 | 0.44 | up | FALSE | 0.80 | down | FALSE | |
| IL-6 | 0.00 | up | TRUE | 0.09 | up | FALSE | |
| IL-7 | 0.07 | up | FALSE | 0.32 | down | FALSE | |
| IL-10 | 0.11 | up | FALSE | 0.85 | down | FALSE | |
| IL-12p70 | 0.12 | up | FALSE | 0.54 | down | FALSE | |
| IL-13 | 0.01 | up | TRUE | 0.46 | down | FALSE | |
| IL-15 | 0.52 | up | FALSE | 0.05 | down | FALSE | |
| IL-17 | 0.09 | up | FALSE | 0.96 | down | FALSE | |
| IL-21 | 0.27 | up | FALSE | 0.63 | down | FALSE | |
| KC | 0.00 | up | TRUE | 0.00 | up | TRUE | |
| Leptin | 0.05 | up | FALSE | 0.74 | down | FALSE | |
| LIX | 0.07 | up | FALSE | 0.01 | up | FALSE | |
| MCP-1 | 0.03 | up | FALSE | 0.20 | up | FALSE | |
| MCP-5 | 0.01 | up | TRUE | 0.00 | up | TRUE | |
| MCSF | 0.45 | up | FALSE | 0.98 | down | FALSE | |
| MIG | 0.02 | up | TRUE | 0.33 | up | FALSE | |
| MIP-1a | 0.00 | up | TRUE | 0.23 | up | FALSE | |
| MIP-1g | 0.10 | up | FALSE | 0.31 | up | FALSE | |
| PF4 | 0.05 | up | FALSE | 0.12 | up | FALSE | |
| RANTES | 0.00 | up | TRUE | 0.18 | up | FALSE | |
| TARC | 0.00 | up | TRUE | 0.10 | up | FALSE | |
| TCA-3 | 0.12 | up | FALSE | 0.32 | down | FALSE | |
| TIMP-1 | 0.00 | up | TRUE | 0.00 | up | TRUE | |
| TNFa | 0.00 | up | TRUE | 0.53 | down | FALSE | |
| TNF RI | 0.02 | up | FALSE | 0.30 | up | FALSE | |
| TNF RII | 0.00 | up | TRUE | 0.51 | down | FALSE | |
对上述各组血清的差异蛋白进行GO分析,在生物学过程方面,在CLP术后12 h的血清样本中,黄芪组与对照组相比,差异蛋白主要富集在调节和激活STAT及JAK-STAT信号通路,调节和促进髓细胞的白细胞分化,调节和促进白细胞分化和增值,调节和促进造血功能等过程中,见附图 1;在CLP术后24 h的血清样本中,差异蛋白主要富集在调节白细胞的生成、分化和凋亡,调节和促进淋巴细胞的生成和分化,调节和促进细胞因子的生物合成和代谢,调节和激活STAT及JAK-STAT信号通路,调节造血功能等过程,见附图 2;在分子功能方面,在CLP术后12 h的血清样本中,黄芪组与对照组相比,差异蛋白主要富集在细胞因子与细胞因子受体的激活和连接,生长因子的激活与受体连接,受体与配体的激活等过程,见附图 3;在CLP术后24 h的血清样本中,差异蛋白主要富集在细胞因子与细胞因子受体的激活和连接,受体与配体的激活等过程见附图 4。在细胞组成中,二者差异无统计学意义。
|
| 图 1 CLP术后12 h各组小鼠肺组织病理HE染色 Fig 1 HE staining of lung tissue in each group 12 h after CLP |
|
|
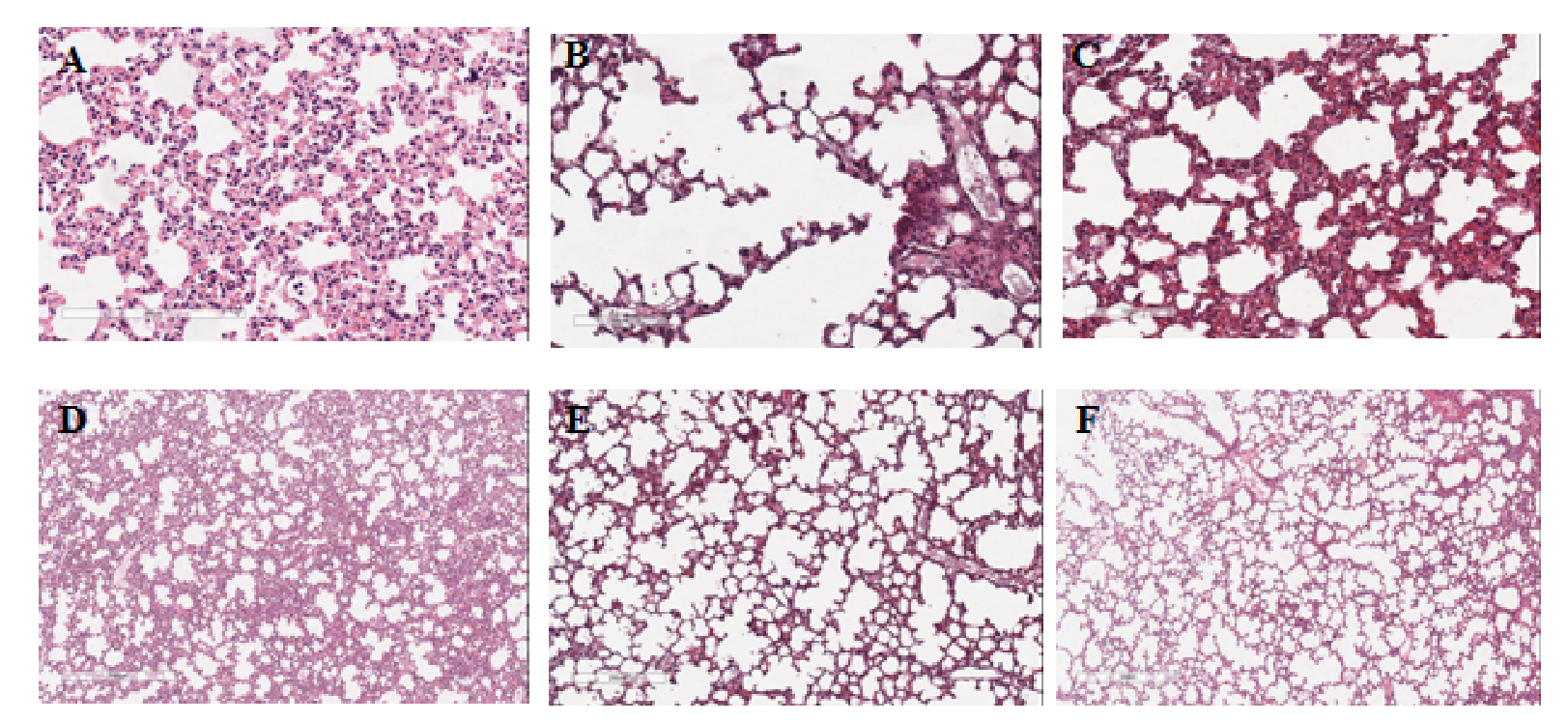
|
| 图 2 CLP术后24 h各组小鼠肺组织病理HE染色 Fig 2 HE staining of lung tissue 24 h after CLP |
|
|
对上述各组BALF的差异蛋白进行GO分析,在生物学过程方面,在CLP术后12 h的BALF样本中,黄芪组与对照组相比,差异蛋白主要富集在白细胞、巨噬细胞、单核细胞及粒细胞的趋化、迁移等过程,见附图 5;在CLP术后24 h的BALF样本中,黄芪组与对照组相比,差异蛋白除了富集在白细胞、巨噬细胞、单核细胞及粒细胞的趋化、迁移等过程中,还富集在抑制细胞运动、凋亡等过程,见附图 6。在分子功能方面,在CLP术后12 h的BALF样本中,黄芪组与对照组相比,差异蛋白主要富集在趋化因子的激活及与受体绑定的过程中,见附图 7;在CLP术后24 h的BALF样本中,黄芪组与对照组相比,差异蛋白主要富集在生长因子、趋化因子等细胞因子及其受体的活动、绑定等过程中,见附图 8;同样的,在细胞组成中,二者差异无统计学意义。
利用KEGG网站搜索数据库对血清样本进行差异蛋白富集通路分析,CLP术后12 h,黄芪组与对照组相比,差异蛋白主要富集在9条信号通路上,即细胞因子与受体连接、JAK-STAT、哮喘、炎性肠病、Fc ε RI、IL-17、造血细胞调控、细胞凋亡和IgA的肠道免疫网络等信号通路中,见附图 9;在CLP术后24 h的血清样本中,黄芪组与对照组相比,差异蛋白主要富集25条信号通路上,即炎性肠病、细胞因子与受体连接、TH17细胞分化、JAK-STAT等信号通路中,见附图 10。
利用KEGG网站搜索数据库对BALF样本进行差异蛋白富集通路分析,CLP术后12 h,黄芪组与对照组相比,差异蛋白主要富集在病毒蛋白与细胞因子、细胞因子受体交互、TOLL样受体等20条信号通路上,见附图 11;CLP术后24 h,黄芪组与对照组相比,差异蛋白主要富集在病毒蛋白与细胞因子、细胞因子受体交互、TNF信号通路等8条信号通路上。
3 讨论ARDS是脓毒症最常见的并发症,CLP造模后,小鼠发生弥漫性肺泡损伤,肺泡壁完整性遭到破坏,肺组织炎性液体渗出,导致弥漫性的肺泡损伤,在本研究中通过CLP造模导致小鼠脓毒症,BALF中蛋白浓度肺干湿重比及HE染色下肺组织的损伤表明模型小鼠合并有ARDS;在本研究中,黄芪水煎剂灌胃改善了急性肺损伤期的炎症液体渗出,减轻了ARDS的弥漫性肺泡损伤;为了探究黄芪的作用机制,本研究使用多因子蛋白芯片对各组小鼠的BALF和血清进行检测,结果表明与对照组相比黄芪组小鼠的BALF及血清存在多种差异蛋白,对这些蛋白进行GO和KEGG富集分析显示,主要富集在JAK-STAT及促炎因子释放等相关功能和通路上,这可能是黄芪起到治疗效果的作用机制。
黄芪能通过抗炎作用降低了炎症因子的表达,减轻炎症对组织的损害,与本研究结果相符合[8];随着时间的推移,单纯抗炎作用的药物对浓度的治疗效果有限,本研究取材的的两个时间点证明,在病程进展到一定程度后黄芪与生理盐水治疗效果相近,其原因可能由于脓毒症ARDS病程发展过程中存在免疫亢进、免疫低下交替出现的免疫紊乱状态,单纯的抗炎治疗不能获益,这与临床实践中观察到的结果相一致[9-10]。事实上,在另一些研究中,黄芪已经被证实对免疫系统的调节具有双向性,如在肿瘤的治疗中黄芪或黄芪提取物能刺激免疫系统应答,其对于脓毒症导致的ARDS的远期治疗效果及机制有待于进一步研究[11-12]。
在本研究中,小鼠的CLP术后ARDS出现的时间尚不明确,还需要进一步研究证实。同时,黄芪注射液已经一些临床研究中应用于脓毒症或ARDS的患者,但是少有研究报道其应用时的免疫状态处于哪一病理阶段,但已有众多临床研究证实黄芪注射液的应用在远期预后对患者有益,说明黄芪的应用于脓毒症早期单纯抗炎治疗(如大剂量糖皮质激素)有所差异,因而我们谨慎地认为脓毒症早期全身炎症反应阶段可以使用黄芪作为抗炎治疗的考虑之一,但其有效性和安全性仍需进一步研究。
利益冲突 所有作者声明无利益冲突
作者贡献申明 哈雁翔:研究设计、实施,文章撰写;黄坡、张瑞、赵春霞:研究实施;徐霄龙、郭玉红:研究设计;王烁、刘清泉:研究设计、论文修改、经费支持
本文有附图,附图1-11可登录中华急诊网(www.cem. org.cn) 浏览本文Html格式
| [1] | Kleinpell R, Blot S, Boulanger C, et al. International critical care nursing considerations and quality indicators for the 2017 surviving sepsis campaign guidelines[J]. Intensive Care Med, 2019, 45(11): 1663-1666. DOI:10.1007/s00134-019-05780-1 |
| [2] | Rhee C, Dantes R, Epstein L, et al. Incidence and trends of sepsis in US hospitals using clinical vs claims data, 2009-2014[J]. JAMA, 2017, 318(13): 1241-1249. DOI:10.1001/jama.2017.13836 |
| [3] | Vincent JL, Rello J, Marshall J, et al. International study of the prevalence and outcomes of infection in intensive care units[J]. JAMA, 2009, 302(21): 2323-2329. DOI:10.1001/jama.2009.1754 |
| [4] | Mart MF, Ware LB. The long-lasting effects of the acute respiratory distress syndrome[J]. Expert Rev Respir Med, 2020, 14(6): 577-586. DOI:10.1080/17476348.2020.1743182 |
| [5] | Dunn JF. Measuring oxygenation in vivo with MRS/MRI: from gas exchange to the cell[J]. Antioxid Redox Signal, 2007, 9(8): 1157-1168. DOI:10.1089/ars.2007.1625 |
| [6] | Matute-Bello G, Downey G, Moore BB, et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals[J]. Am J Respir Cell Mol Biol, 2011, 44(5): 725-738. DOI:10.1165/rcmb.2009-0210ST |
| [7] | Kulkarni HS, Lee JS, Bastarache JA, et al. Update on the features and measurements of experimental acute lung injury in animals: an official American Thoracic Society workshop report[J]. Am J Respir Cell Mol Biol, 2022, 66(2): e1-e14. DOI:10.1165/rcmb.2021-0531ST |
| [8] | Li J, Zhao J, Chai YH, et al. Astragalus polysaccharide protects sepsis model rats after cecum ligation and puncture[J]. Front Bioeng Biotechnol, 2022, 10: 1020300. DOI:10.3389/fbioe.2022.1020300 |
| [9] | Torres LK, Pickkers P, van der Poll T. Sepsis-induced immunosuppression[J]. Annu Rev Physiol, 2022, 84: 157-181. DOI:10.1146/annurev-physiol-061121-040214 |
| [10] | Venet F, Monneret G. Advances in the understanding and treatment of sepsis-induced immunosuppression[J]. Nat Rev Nephrol, 2018, 14(2): 121-137. DOI:10.1038/nrneph.2017.165 |
| [11] | Li CX, Liu Y, Zhang YZ, et al. Astragalus polysaccharide: a review of its immunomodulatory effect[J]. Arch Pharm Res, 2022, 45(6): 367-389. DOI:10.1007/s12272-022-01393-3 |
| [12] | Fu J, Wang ZH, Huang LF, et al. Review of the botanical characteristics, phytochemistry, and pharmacology of Astragalus membranaceus (Huangqi)[J]. Phytother Res, 2014, 28(9): 1275-1283. DOI:10.1002/ptr.5188 |
 2024, Vol. 33
2024, Vol. 33