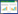2. 连云港市第一人民医院急诊科,连云港 222006;
3. 南京医科大学连云港临床医学院连云港市第一人民医院,连云港 222006;
4. 南京医科大学康达学院第一附属医院连云港市第一人民医院急诊科,连云港 222006
2. Emergency Department, The First People's Hospital of Lianyungang, Lianyungang 222006, China;
3. Emergency Department, Lianyungang Clinical College of Nanjing Medical University, The First People's Hospital of Lianyungang, Lianyungang 222006, China;
4. Emergency Department, The First Affiliated Hospital of Kangda College Of Nanjing Medical University, The First People's Hospital of Lianyungang, Lianyungang 222006, China
急性肺损伤(acute lung injury, ALI)由感染、严重休克或外伤等诱发,可导致肺不张,甚至急性呼吸窘迫综合征的发生,是导致严重呼吸衰竭的主要原因,病死率高达30%~60%[1]。组织学主要表现为内皮屏障破坏、肺泡上皮细胞损伤,导致大量富含蛋白的液体渗透至肺间隔以及肺泡腔[2-4]。铁死亡作为一种铁依赖性的细胞死亡的形式,已被证明在多种疾病的发生发展中发挥着重要的调控作用。最近大量研究表明,铁死亡参与了脂多糖(lipopolysaccharide, LPS)诱导的ALI的发生,抑制肺泡上皮细胞铁死亡可显著减轻LPS诱导的肺组织氧化应激和炎症损伤程度[5-6]。核因子红细胞2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)作为细胞氧化应激调控的转录因子,在细胞抗氧化损伤中发挥重要作用[7]。值得注意的是许多负责抑制脂质过氧化和铁死亡的蛋白质和酶是Nrf2的靶基因[8]。氢分子作为一种抗氧化剂,可以特异性清除细胞内的活性氧自由基,发挥器官保护作用,氢气可激活Nrf2信号通路,调节炎症和细胞凋亡,保护小鼠免受LPS诱导的ALI[9],但分子氢能否通过调控铁死亡发挥ALI保护作用目前尚不清楚,因此本研究通过建立LPS相关ALI小鼠模型,以及铁死亡诱导剂erastin诱导A549细胞铁死亡体外模型,探讨其具体机制。
1 材料与方法 1.1 实验材料人非小细胞肺癌细胞A549细胞,购自中国科学院上海细细胞库;RPMI-1640培养基(含双抗)、胎牛血清购自江苏凯基生物技术股份有限公司;Real-time PCR所用引物购自南京金斯瑞生物科技有限公司;总RNA提取试剂盒、荧光定量PCR试剂盒、逆转录试剂盒购自于江苏南京诺唯赞生物科技有限公司;F4/80抗体、Nrf2抗体、β-actin抗体、山羊抗鼠二抗、山羊抗兔二抗均购自武汉Proteintech公司;BCA法蛋白定量试剂盒、抗体稀释液、抗荧光淬灭剂、碘化丙啶(PI)染色试剂、乳酸脱氢酶细胞毒性检测试剂盒购自上海碧云天生物;丙二醛、亚铁离子检测试剂盒均购自北京索莱宝生物科技有限公司;脂多糖、DAPI染色剂、铁死亡激动剂Erastin购自美国Sigma-Aldrich公司;ROS Assay Kit -Highly Sensitive DCFH-DA-试剂购买于上海东仁化学科技有限公司。
1.2 动物实验 1.2.1 实验动物及分组Balb/c小鼠,24只,220~240g,购自武汉市万千佳兴生物科技有限公司,动物合格证号:SCXK(鄂)2016-0011。本研究中关于动物的处置和操作符合动物实验福利与伦理的基本要求。实验动物于温度20ºC~26ºC,相对湿度40%~70%,12 h明暗交替,自由进食水、饲料,饲养7 d,分为4组,6只/组,control组、control+H2组、LPS组、LPS+H2组,6只/组,LPS组和LPS+H2组采用气道滴注LPS法建立模型。LPS+H2组:将小鼠麻醉后暴露气管,向气管内滴注3 mg/kg LPS 100 μL,随后翻转小鼠,使LPS均匀分布于肺中。然后将小鼠放置于吸氢树脂箱中,使用高纯度氢气通入,将PG610-H2便携氢气探测器置于箱中,监测氢气浓度,维持在2%~4%。LPS组:不接受氢气处理的小鼠放置于相同环境,吸入空气。control组:滴注等量生理盐水后放置于相同环境,吸入空气。control+H2组:滴注等量生理盐水后放置于吸氢树脂箱中,氢气处理方式同LPS+H2组。每组持续36 h后处死小鼠,取新鲜肺组织。
1.2.2 肺组织HE染色、肺湿/干重比取小鼠的左肺上叶组织将肺样本固定在4%甲醛中,石蜡包埋。将组织块切成5 μm切片,用HE染色,光学显微镜下分析,肺损伤评分按照研究中所给的方案[10]。取整个肺组织称定质量为湿质量,放入60℃烘箱中脱水,24 h后再次称定质量为干质量,计算湿/干重比。
1.2.3 肺组织免疫荧光染色肺组织石蜡切片脱蜡至水,EDTA抗原修复,5%BSA封闭。用稀释F4/80抗体在4℃下孵育过夜,二抗室温孵育2 h,室温下用DAPI染色10 min,组织切片数字扫描仪进行扫描。
1.2.4 肺组织MDA、Fe2+含量取50 mg肺组织,在冰水浴下机械匀浆,2 500 r/min离心10 min后取上清液进行测定。按照MDA、亚铁离子检测试剂盒说明书进行检测。
1.3 体外实验 1.3.1 细胞培养A549细胞培养在含10%胎牛血清、100 U/L青霉素、100 U/L链霉素的RPIM-1640培养基中,于37℃、5%CO2条件下,隔天更换新鲜培养基,细胞长至80%密度时,开始传代。
1.3.2 富氢培养基制备每次实验前制备新鲜的富氢培养基,氢气发生器经导管在高压(0.4 MPa)下溶解于无血清RPMI-1640培养基中4 h至过饱和,采用针型氢传感器定氢浓度,根据已有的实验方法制备富氢培养基[11],保证浓度为(0.6±0.3)mmol/L。
1.3.3 A549细胞实验分组本实验将A549细胞分为4组,分别为control组,control+H2组,erastin组,erastin+H2组,erastin组使用20 μmol erastin处理24 h,erastin+H2组预先使用富氢培养基处理30 min,然后加入20 μmol erastin处理24 h,control组加入等量的二甲基亚砜处理24 h,control+H2组予以新鲜的富氢培养基预处理细胞30 min,加入等量的二甲基亚砜。
1.3.4 细胞LDH释放量、MDA、GSH测定收集干预好的待检细胞,根据GSH和MDA、乳酸脱氢酶细胞毒性检测试剂盒说明书进行检测。
1.3.5 细胞ROS水平检测将细胞按照1×105/mL的密度接种于12孔板中, 每孔1 mL。分组处理后,吸除原培养基,PBS清洗3次。去除上清液,HBSS清洗2次,加入Highly Sensitive DCFH-DA Dye working solution,37℃、5% CO2培养箱培养30 min。去除Working solution,HBSS清洗2次,再次加入HBSS,用荧光显微镜观察。
1.3.6 碘化丙啶(PI)染色将细胞按照1×105 /mL的密度接种于12孔板中, 每孔1 mL。分组处理后,每孔加入1 μL PI染色液,置于荧光显微镜下进行观察。
1.3.7 实时荧光定量PCR检测将培养好的A549细胞制成细胞悬液,1×106 /mL密度接种于6孔板,每孔2 mL,细胞融合达70%时,分别给予以上不同分组处理,24 h后用Trizol试剂法提取细胞总RNA,按照逆转录试剂盒逆转录为cDNA,RT-PCR仪上进行扩增,引物序列如表 1。
| 基因名称 | 引物序列 |
| GPX4 | |
| 引物正向 | 5’-AACCTGGACAAGTACCGGGG-3’ |
| 引物反向 | 5’-CCGAACTGGTTACACGGGAA-3’ |
| Nrf2 | |
| 引物正向 | 5’-CAACTACTCCCAGGTTGCCC-3’ |
| 引物反向 | 5’-AGCTCCTCCCAAACTTGCTC-3’ |
| HO-1 | |
| 引物正向 | 5’-AAGACTGCGTTCCTGCTCAA-3’ |
| 引物反向 | 5’-GGGGGCAGAATCTTGCACT-3’ |
| β-actin | |
| 引物正向 | 5’-AGGATTCCTATGTGGGCGAC-3’ |
| 引物反向 | 5’-ATAGCACAGCCTGGATAGCAA-3’ |
| 注:以β-actin为内参基因,采用2-△△Ct法对基因表达量进行相对定量 | |
将细胞按照1×105 /mL的密度接种于24孔板中, 每孔1 mL。分组处理后,4%多聚甲醛固定15 min,1%的TritonX-100通透15 min,5% BSA封闭1 h,一抗Nrf2(1:200)过夜,复温后滴加荧光二抗,室温孵育30 min,DAPI染色并封片,荧光显微镜拍照。
1.3.9 蛋白质免疫印迹检测将培养好的A549细胞制成细胞悬液,1×106 /mL密度接种于6孔板,每孔2 mL,细胞融合达70%时,分别给予以上不同分组处理,24 h后收集各组细胞,加细胞裂解液(含蛋白酶抑制剂和磷酸酶抑制剂)后进行超声裂解,12 000 r/min离心10 min获得蛋白上清液,BCA法检测蛋白浓度,调整浓度后进行蛋白变性。利用SDS-PAGE凝胶进行蛋白电泳,采用PVDF膜进行转膜,5%脱脂牛奶封闭过夜,一抗Nrf2(1︰1 000)孵育过夜,二抗室温封闭2 h,利用ECL化学发光法扫描。
1.4 统计学方法应用GraphPad Prism9.0软件进行统计学分析和作图,计量资料统计前进行方差齐性检验,符合正态分布的计量资料以均数±标准差(x±s)表示,多组间差异比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 分子氢显著减轻LPS诱导的ALI与control组相比,LPS组小鼠肺组织病理损伤、肺组织湿/干重比,以及F4/80阳性巨噬细浸润程度明显加重,肺损伤评分显著升高(均P < 0.05)。而LPS+H2组相比于LPS组,小鼠肺损伤情况明显改善,免疫细胞浸润程度明显减轻,差异有统计学意义(均P < 0.05),见图 1。

|
| A:各组小鼠肺组织HE染色(×400),并根据HE染色切片,B:各组小鼠肺组织进行肺损伤评分;C:各组小鼠肺组织干湿重比;D:各组小鼠肺组织F4/80阳性巨噬细胞免疫荧光染色(×400);E:各组肺组织F4/80荧光定量分析;LPS为脂多糖;DAPI可以对细胞核进行染色,呈蓝色;与control组比较,aP < 0.05;与LPS组比较,bP < 0.05 图 1 分子氢显著减轻LPS诱导的ALI Fig 1 Molecular hydrogen significantly reduced LPS-induced ALI |
|
|
与control组相比,LPS刺激显著增加了小鼠肺组脂质过氧化代谢产物MDA水平,组织Fe2+水平明显升高,差异有统计学意义(均P < 0.05);LPS+H2组相比于LPS组,上述指标均下降,明显低于LPS组,差异有统计学意义(均P < 0.05),见图 2。
|
| A:各组小鼠肺组织铁含量;B:各组小鼠肺组织MDA水平;与control组比较,aP < 0.05;与LPS组比较,bP < 0.05 图 2 分子氢抑制肺组织脂质过氧化并抑制铁死亡 Fig 2 Molecular hydrogen decreased the lipid peroxidation of lung tissue and inhibited ferroptosis |
|
|
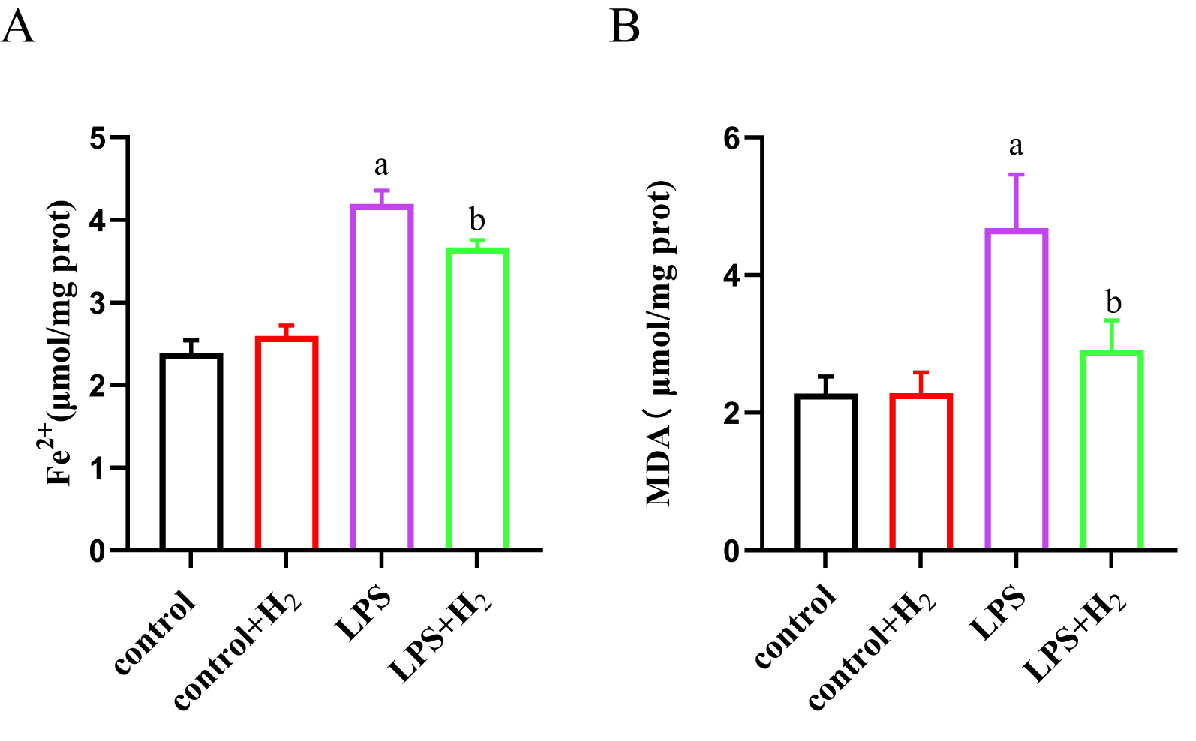
与control组相比,erastin组细胞内ROS、MDA水平上升,GPX4 mRNA、GSH水平下降,差异有统计学意义(均P < 0.05);与erastin组比较,earstin+H2组细胞内ROS、MDA水平下降,GPX4 mRNA、GSH水平升高,差异有统计学意义(均P < 0.05),见图 3。
|
| A:ROS荧光探针检测细胞氧化应激水平(×100);B:各组细胞ROS水平的荧光定量分析;C:各组细胞的GSH水平;D:各组细胞的MDA水平;E:各组细胞GPX4 mRNA水平;与control组比较,aP < 0.05;与erastin组比较,bP < 0.05 图 3 分子氢减轻肺泡上皮细胞脂质过氧化 Fig 3 Molecular hydrogen attenuated lipid peroxidation of alveolar epithelial cells |
|
|
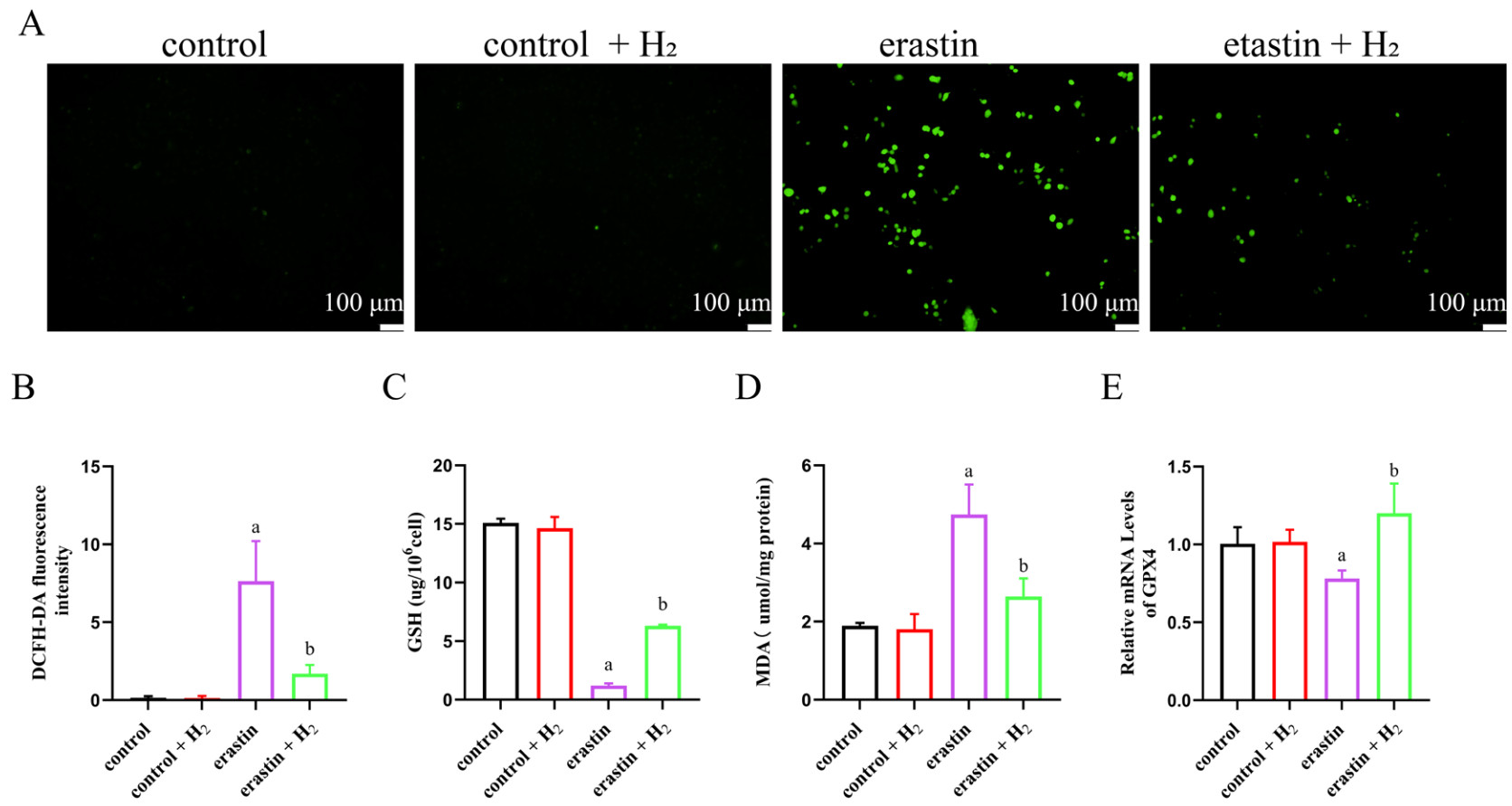
与control组相比,erastin组细胞死亡数量明显增多,LDH释放量明显增高,差异有统计学意义(均P < 0.05);与erastin组比较,earstin+H2组细胞死亡数量明显减少,LDH释放量明显下降,差异有统计学意义(均P < 0.05),见图 4。
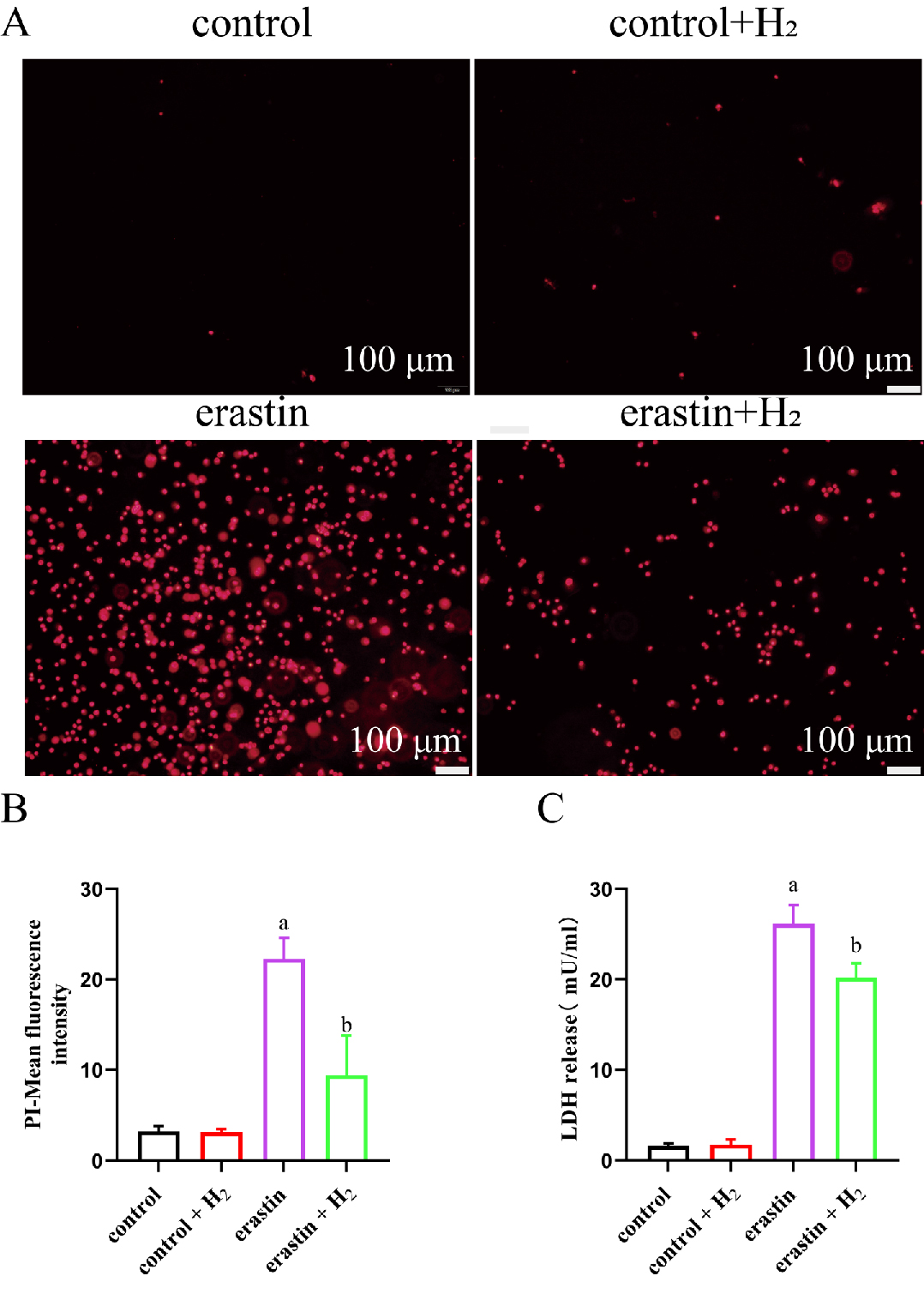
|
| A:PI荧光探针检测细胞死亡水平(×100);B:各组细胞PI荧光探针检测荧光定量分析;C:各组细胞LDH释放量;与control组比较,aP < 0.05;与erastin组比较,bP < 0.05 图 4 分子氢减少肺泡上皮细胞死亡 Fig 4 Molecular hydrogen alleviated the death of alveolar epithelial cells |
|
|
与control组相比,erastin组Nrf2入核增多,差异有统计学意义(P < 0.05);与erastin组相比,erastin+H2组Nrf2入核明显增多,Nrf2 mRNA水平以及下游靶基因HO-1 mRNA水平表达明显增多,且Nrf2下游基因HO-1 mRNA水平表达较erastin组增多,差异有统计学意义(均P < 0.05),见图 5。
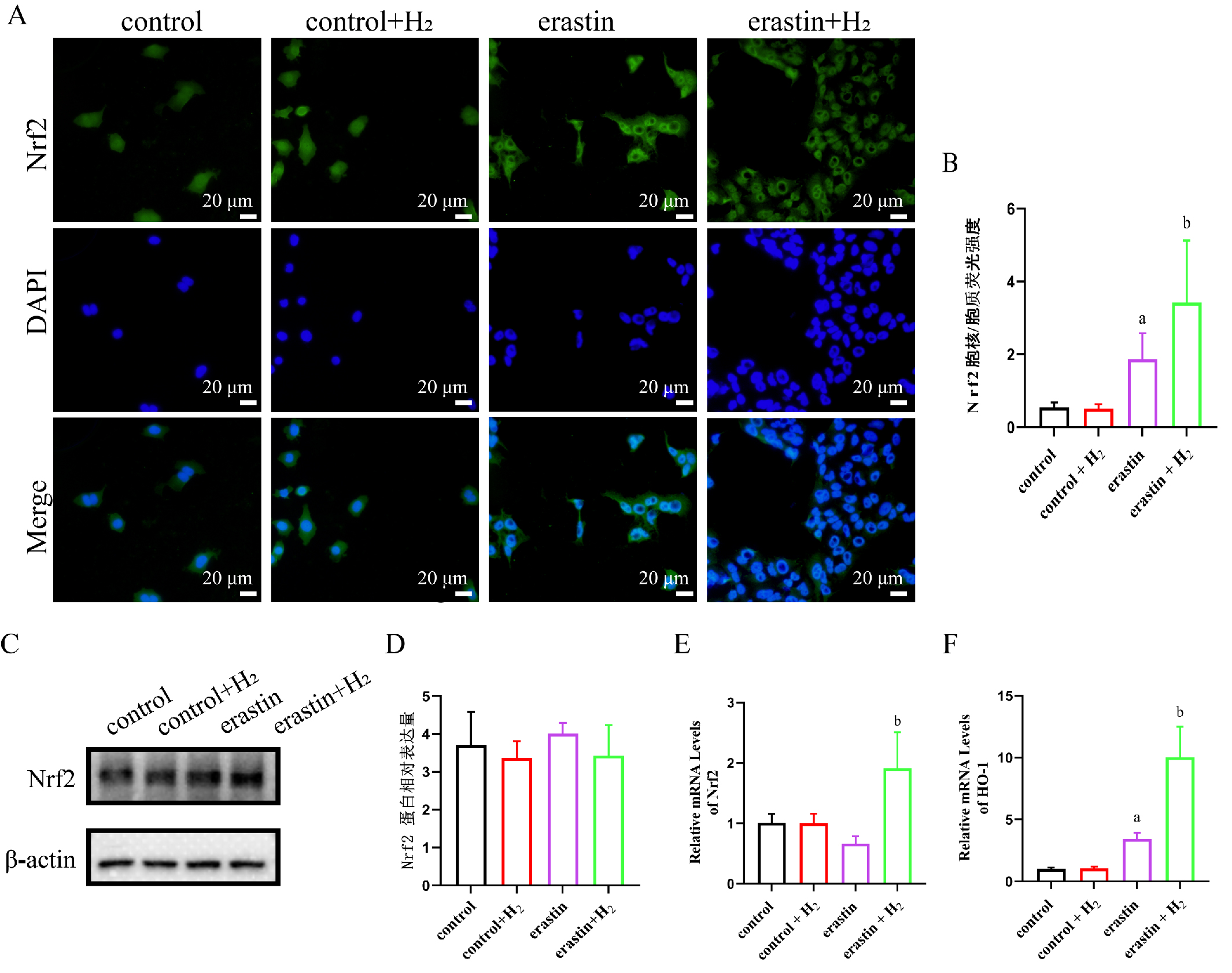
|
| A:各组Nrf2入核情况(×100);B:各组Nrf2入核荧光定量分析;C:各组Nrf2蛋白表达水平;D:各组Nrf2蛋白表达水平定量分析;E:各组Nrf2mRNA表达水平;F:各组HO-1 -mRNA表达水平;与control组比较,aP < 0.05;与erastin组比较,bP < 0.05 图 5 分子氢促进Nrf2核转位 Fig 5 Molecular hydrogen enhanced the translocation of Nrf2 into the nucleus |
|
|

|
| 图 6 分子氢的潜在保护机制 Fig 6 The protective mechanisms underlying molecular hydrogen |
|
|
LPS诱导的ALI模型已广泛应用于研究领域,但其确切机制尚未完全阐明。研究发现ROS在LPS相关ALI的发病机制中发挥着重要作用,ROS介导的脂质过氧化反应是铁死亡的重要机制[5],2012年Dixon提出铁死亡作为一种新型细胞死亡形式,区别于凋亡和坏死,其生化特性主要表现为铁离子和膜脂质过氧化物质的累积[6],越来越多的证据表明铁死亡参与了LPS相关ALI的发病机制,研究发现铁死亡抑制剂ferrostatin-1通过抑制铁死亡减轻LPS相关ALI[12]。阻断铁死亡可能是治疗ALI的一种有前景的策略。分子氢作为一种特殊的抗氧化剂广泛用于各种研究[13],2007年Ohsawa等[14]发现H2可以选择性地还原细胞内的强效活性氧自由基-羟基自由基(·OH)和过氧亚硝酸盐(ONOO-),减轻大鼠缺血/再灌脑损伤;氢分子可以通过抗氧化应激、抗炎、调节自噬等机制,减轻LPS相关ALI[15-18]。然而,在LPS诱导的ALI中,分子氢对铁死亡的影响尚不清楚。本研究发现在LPS诱导的ALI中,肺组织损伤程度与免疫细胞浸润程度加重,Fe2+、MDA等脂质过氧化水平升高,分子氢显著抑制了LPS相关ALI脂质过氧化水平,缓解炎症损伤程度。为进一步探究其机制,本研究利用铁死亡诱导剂erastin,抑制胱氨酸/谷氨酸转运体,阻碍胱氨酸吸收,诱导细胞发生铁死亡,观察到分子氢逆转了erastin诱导的Fe2+、MDA水平升高,显著提高GSH、GPX4 mRNA水平,抑制细胞内过量ROS产生,提高细胞抗氧化能力,减少细胞死亡数量。
Nrf2是抗氧化反应的关键调节因子[19-20]。生理条件下,Nrf2在细胞质中与Kelch样ECH相关蛋白(kelch like ECH associated protein 1, Keap1)结合,当细胞受损伤刺激时,Nrf2和Keap1蛋白分离,易位到细胞核以启动含抗氧化反应元件的基因转录,激活下游调控铁死亡相关靶基因的表达。He等人的研究发现,衣康酸可以激活Nrf2抑制铁死亡,减轻LPS相关ALI[10]。Nrf2是ALI中铁死亡的重要负性调节因子,通过激活Nrf2抑制铁死亡为ALI提供了新的治疗靶点[21-26]。
与先前的研究一致,erastin并不能提高A549细胞的Nrf2转录水平,但是可以促进Nrf2核转位发挥对抗铁死亡作用[25]。本研究中同样发现erastin处理后的A549细胞内Nrf2 mRNA水平并未上升。分子氢显著提高了Nrf2的转录水平,并促进Nrf2核转位,并提高下游靶基因GPX4、HO-1的转录水平,对抗铁死亡。
本研究存在部分局限性。分子氢促进Nrf2核转位的机制尚不明确,本实验未通过敲低或过表达方式对分子氢调控Nrf2进行验证。分子氢是否可以通过其他信号通路调控铁死亡减轻急性肺损伤也尚未探明。
利益冲突 所有作者声明无利益冲突
作者声明贡献 薛皓月:研究设计、实验操作、数据采集、统计学分析、论文撰写;唐心怡、丁锦秋:实验操作、数据采集;陈晓兵:论文修改、工作支持;陈昊然:统计学分析;俞典:实验操作、统计学分析;李小民:研究设计、论文修改、工作支持;谢永鹏:研究设计、论文修改、工作支持
| [1] | 张彬, 杨宗斌, 李祯, 等. 脓毒症急性肺损伤模型中肺组织细胞焦亡与大麻素2型受体的相关性分析[J]. 中华急诊医学杂志, 2022, 31(2): 185-190. DOI:10.3760/cma.j.issn.1671-0282.2022.02.009 |
| [2] | Brower RG, Ware LB, Berthiaume Y, et al. Treatment of Ards[J]. Chest, 2001, 120(4): 1347-1367. DOI:10.1378/chest.120.4.1347 |
| [3] | Ding WC, Zhang W, Chen J, et al. Protective mechanism of quercetin in alleviating sepsis-related acute respiratory distress syndrome based on network pharmacology and in vitro experiments[J]. World J Emerg Med, 2024, 15(2): 111-120. DOI:10.5847/wjem.j.1920-8642.2024.030 |
| [4] | Wei JX, Jiang HL, Chen XH. Endothelial cell metabolism in sepsis[J]. World J Emerg Med, 2023, 14(1): 10-16. DOI:10.5847/wjem.j.1920-8642.2023.019 |
| [5] | Dixon SJ, Stockwell BR. The role of iron and reactive oxygen species in cell death[J]. Nat Chem Biol, 2014, 10(1): 9-17. DOI:10.1038/nchembio.1416 |
| [6] | Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [7] | Anandhan A, Dodson M, Schmidlin CJ, et al. Breakdown of an ironclad defense system: the critical role of NRF2 in mediating ferroptosis[J]. Cell Chem Biol, 2020, 27(4): 436-447. DOI:10.1016/j.chembiol.2020.03.011 |
| [8] | Dodson M, Castro-Portuguez R, Zhang DD. NRF2 plays a critical role in mitigating lipid peroxidation and ferroptosis[J]. Redox Biol, 2019, 23: 101107. DOI:10.1016/j.redox.2019.101107 |
| [9] | Yu Y, Yang YY, Yang M, et al. Hydrogen gas reduces HMGB1 release in lung tissues of septic mice in an Nrf2/HO-1-dependent pathway[J]. Int Immunopharmacol, 2019, 69: 11-18. DOI:10.1016/j.intimp.2019.01.022 |
| [10] | Li Y, Chen HG, Shu RC, et al. Hydrogen treatment prevents lipopolysaccharide-induced pulmonary endothelial cell dysfunction through RhoA inhibition[J]. Biochem Biophys Res Commun, 2020, 522(2): 499-505. DOI:10.1016/j.bbrc.2019.11.101 |
| [11] | Qiu JH, Zhang L, Li KX, et al. Deficiency of IRG1/itaconate aggravates endotoxemia-induced acute lung injury by inhibiting autophagy in mice[J]. Exp Anim, 2023, 72(2): 164-172. DOI:10.1538/expanim.22-0104 |
| [12] | Liu PF, Feng YT, Li HW, et al. Ferrostatin-1 alleviates lipopolysaccharide-induced acute lung injury via inhibiting ferroptosis[J]. Cell Mol Biol Lett, 2020, 25: 10. DOI:10.1186/s11658-020-00205-0 |
| [13] | Tamura T, Suzuki M, Homma K, et al. Efficacy of inhaled hydrogen on neurological outcome following brain ischaemia during post-cardiac arrest care (HYBRIDⅡ): a multi-centre, randomised, double-blind, placebo-controlled trial[J]. E Clinical Medicine, 2023, 58: 101907. DOI:10.1016/j.eclinm.2023.101907 |
| [14] | Ohsawa I, Ishikawa M, Takahashi K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007, 13(6): 688-694. DOI:10.1038/nm1577 |
| [15] | Xie KL, Yu YH, Pei YP, et al. Protective effects of hydrogen gas on murine polymicrobial sepsis via reducing oxidative stress and HMGB1 release[J]. Shock, 2010, 34(1): 90-97. DOI:10.1097/SHK.0b013e3181cdc4ae |
| [16] | Zheng YJ, Zhu DM. Molecular hydrogen therapy ameliorates organ damage induced by sepsis[J]. Oxid Med Cell Longev, 2016, 2016: 5806057. DOI:10.1155/2016/5806057 |
| [17] | Cheng DY, Long JG, Zhao L, et al. Hydrogen: a rising star in gas medicine as a mitochondria-targeting nutrient via activating Keap1-Nrf2 antioxidant system[J]. Antioxidants (Basel), 2023, 12(12): 2062. DOI:10.3390/antiox12122062 |
| [18] | Xie KL, Liu LL, Yu YH, et al. Hydrogen gas presents a promising therapeutic strategy for sepsis[J]. Biomed Res Int, 2014, 2014: 807635. DOI:10.1155/2014/807635 |
| [19] | Duarte TL, Talbot NP, Drakesmith H. NRF2 and hypoxia-inducible factors: key players in the redox control of systemic iron homeostasis[J]. Antioxid Redox Signal, 2021, 35(6): 433-452. DOI:10.1089/ars.2020.8148 |
| [20] | Panieri E, Saso L. Inhibition of the NRF2/KEAP1 axis: a promising therapeutic strategy to alter redox balance of cancer cells[J]. Antioxid Redox Signal, 2021, 34(18): 1428-1483. DOI:10.1089/ars.2020.8146 |
| [21] | Dong H, Qiang ZZ, Chai DD, et al. Nrf2 inhibits ferroptosis and protects against acute lung injury due to intestinal ischemia reperfusion via regulating SLC7A11 and HO-1[J]. Aging, 2020, 12(13): 12943-12959. DOI:10.18632/aging.103378 |
| [22] | Li JC, Lu KM, Sun FL, et al. Panaxydol attenuates ferroptosis against LPS-induced acute lung injury in mice by Keap1-Nrf2/HO-1 pathway[J]. J Transl Med, 2021, 19(1): 96. DOI:10.1186/s12967-021-02745-1 |
| [23] | Luo LX, Huang FF, Zhong SY, et al. Astaxanthin attenuates ferroptosis via Keap1-Nrf2/HO-1 signaling pathways in LPS-induced acute lung injury[J]. Life Sci, 2022, 311(Pt A): 121091. DOI:10.1016/j.lfs.2022.121091 |
| [24] | Wang YC, Chen DY, Xie H, et al. AUF1 protects against ferroptosis to alleviate sepsis-induced acute lung injury by regulating NRF2 and ATF3[J]. Cell Mol Life Sci, 2022, 79(5): 228. DOI:10.1007/s00018-022-04248-8 |
| [25] | Gai CC, Yu MY, Li Z, et al. Acetaminophen sensitizing erastin-induced ferroptosis via modulation of Nrf2/heme oxygenase-1 signaling pathway in non-small-cell lung cancer[J]. J Cell Physiol, 2020, 235(4): 3329-3339. DOI:10.1002/jcp.29221 |
| [26] | 何如愿, 刘博昊, 付庭吕, 等. 衣康酸减轻脂多糖诱导的急性肺损伤的机制研究[J]. 中华急诊医学杂志, 2022, 31(9): 1223-1228. DOI:10.3760/cma.j.issn.1671-0282.2022.09.012 |
 2024, Vol. 33
2024, Vol. 33