2. 南京医科大学公共卫生学院,南京 211166;
3. 南京医科大学第一附属医院放射科,南京 210029
2. School of Public Health, Nanjing Medical University, Nanjing 211166, China;
3. Department of Interventional Radiology, the First Affiliated Hospital of Nanjing Medical University, Nanjing 210029, China
大血管闭塞的患病率估计在所有急性缺血性脑卒中患者的10%~30%之间。然而,目前只有30%的前循环大血管闭塞患者符合血管内治疗的条件,且 < 50%的治疗患者实现了功能独立[1-2]。部分原因是患者大血管受累,缺血面积较大。同时也有部分患者即使时间窗内早期积极开通血管也会出现预后不佳,文献报道多是由于较早出现大核心梗死,近年来学者们进一步发现早期核心梗死增长速率(early infarct growth rate,EIGR)在其中可能有一定预示作用[3]。
EIGR用核心梗死体积与症状发生到CT灌注成像(CT perfusion imaging,CTP)检查时间的比值来表述。前提是假定症状发生时核心梗死体积为0,并且核心梗死体积在24 h内呈线性增长模式[4]。核心梗死增长速率快的患者在发病后缺血区将迅速进展为不可逆的核心梗死区,即使立即血管内治疗也很难实现有效再灌注。
对于急性缺血性脑卒中,无论是通过静脉溶栓,还是血管内取栓,尽早恢复缺血区有效血供是目前循证医学提出的超早期急救最切实可行的治疗核心。尽早恢复缺血区血供,可以挽救良性缺血和缺血半暗带区,阻止核心梗死区进一步扩大。但临床疗效观察中却并非所有良好开通血流的患者均有较好的临床预后。根据文献报道,这个过程中核心梗死速率可能是早期对临床结局进行独立预测的指标,但结论并不统一[5-6]。本中心卒中绿道采用的影像评估手段为一站式CT评估,所有24 h内发病的急性缺血性卒中患者均进行CTP评估,同时重建颅脑CTA血管影像。因此,本研究回顾分析了治疗时间窗内的积极进行开通治疗患者的灌注影像及临床特点,旨在进一步探讨核心增长速率是否可以有效的提示窗内患者早期开通后的预后。
1 资料与方法 1.1 研究对象本文回顾性分析了2020年1月1日至2022-12-31日,就诊于南京医科大学第一附属医院急诊科,经脑卒中绿色通道评估证实为急性缺血性脑卒中,并最终行血管再通治疗,方式包括:静脉溶栓和(或)血管内治疗。收集患者临床基本资料。研究对象纳入标准:①年龄≥18岁;②急诊头颅CT平扫无脑出血;③多模影像提示急性大血管闭塞(包括颈内动脉、大脑前动脉A1段、大脑中动脉M1/M2段、大脑后动脉P1段、椎基底动脉);④多模影像RAPID软件分析提示病例核心梗死体积 > 0 mL;⑤有明确发病时间,并且发病时间在6 h内;⑥接受静脉溶栓和(或)血管内治疗;⑦血管内治疗后患者血流开通级别≥2b级(2b/2c/3级)。排除标准:①临床资料不全;②未能行多模式CT检查;③再灌注TICI等级为0/1/2a级。本研究方案经南京医科大学第一附属医院伦理委员会批准(伦理号:2022-SR-226),并已获得患者或家属知情和同意。
1.2 研究方法共有164例患者符合入组标准,收集这些患者临床基本资料:性别、年龄、发病到CTP时间、入院时美国国立卫生院卒中量表(the national institutes of health stroke scale,NIHSS)、核心梗死体积、治疗方式包括(静脉溶栓和(或)血管内治疗)、既往史(高血压、糖尿病、冠心病、脑卒中、房颤)、出血并发症。所有患者就诊后均行多模态影像扫描:头颅CT、头颅CT灌注成像,根据RAPID软件计算得出脑血流量(cerebral blood flow,CBF),将相对CBF值< 30%对侧正常脑组织的区域定义为核心梗死。CTP血管重建后得到CTA,观察大血管闭塞情况。对符合静脉溶栓适应证的患者,给予重组人组织型纤溶酶原激活物(rt-PA)静脉溶栓。总剂量为0.9 g/kg,其中总量的前10%予静脉推注10 min,总量的后90%予静脉滴注1 h,溶栓过程中观察有无出血、神志改变、症状加剧等,如有异常,立即复查头颅CT。对符合血管内治疗的患者给予血管内治疗,选取血流开通级别为2b/2c/3级的患者。术后24 h常规复查头颅CT排除有无出血。
根据前人研究,假定症状发生前,患者核心梗死体积为0,并且在症状发生后24 h内核心梗死体积呈线性增长模式。核心梗死增长速率计算公式如下:核心梗死增长速率=核心梗死增长体积(mL)/发病到CTP时间(h)[4]。所有患者于就诊时及治疗后72 h由两名神经内科医生判定NIHSS评分。72 h NIHSS评分较就诊时NIHSS评分降低≥4分,定义为预后良好。72 h NIHSS评分较就诊时NIHSS评分降低 < 4分或较就诊时NIHSS值升高,定义为预后不佳[7]。
1.3 统计学方法所有统计数据均采用SPSS 25.0软件进行统计学分析。连续型变量之间的比较:所有连续性变量均通过Shapiro-Wilk正态性检验确定是否服从正态分布,不服从的变量利用Mann-Whitney U检验比较预后良好和预后不佳组之间的差别,连续性变量用中位数(四分位数)表示(最后正态性检验结果显示所有的连续性变量均不服从正态分布)。分类变量之间的比较:均使用χ2检验,用率(%)表示。以P < 0.05为差异有统计学意义。
2 结果本研究最终共纳入164例符合标准的经南京医科大学第一附属医院脑卒中绿色通道诊治的患者,数据分为两组,其中预后良好组93例,年龄中位数71岁,核心梗死增长速率中位数7.67 mL/h;预后不佳组71例,年龄中位数72岁,核心梗死增长速率中位数8.24 mL/h。比较预后良好组和预后不佳组基本资料,结果提示两组核心梗死增长速率(mL/h)(7.67 vs. 8.24,P=0.211)差异无统计学意义,见表 1。
| 指标 | 预后良好(n= 93) | 预后不佳(n= 71) | P值 |
| 年龄(岁) | 71.00[63.00, 77.00] | 72.00[65.50, 82.00] | 0.049 |
| 性别[男性, (n, %)] | 53 (57.0) | 37 (52.1) | 0.643 |
| 核心梗死体积(mL) | 19.00[9.00, 43.00] | 25.00[10.50, 79.50] | 0.139 |
| 核心梗死增长速率(mL/h) | 7.67[3.14, 17.81] | 8.24[3.54, 29.05] | 0.211 |
| 发病到CTP时间(h) | 3.23[1.82, 4.05] | 3.17[1.82, 3.85] | 0.811 |
| 静脉溶栓(n, %) | 57(61.3) | 48(67.6) | 0.502 |
| 血管内治疗(n, %) | 83(89.2) | 52(73.2) | 0.014 |
| 出血并发症(n, %) | 16(17.2) | 21(29.6) | 0.091 |
| 桥接(n, %) | 47(50.5) | 29(40.8) | 0.282 |
| 高血压史(n, %) | 64(68.8) | 54(76.1) | 0.397 |
| 糖尿病史(n, %) | 17(18.3) | 13(18.3) | 1.000 |
| 冠心病史(n, %) | 13(15.7) | 10(20.8) | 0.609 |
| 脑卒中史(n, %) | 18(19.4) | 16(22.5) | 0.762 |
| 房颤史(n, %) | 32(34.4) | 28(39.4) | 0.618 |
通过单因素Logistic回归分析,发现核心梗死增长速率(mL/h)(OR=1.01,95%CI: 1.00~1.02, P=0.204)、年龄(OR=1.02,95%CI:0.99~1.05,P=0.130)和不良预后之间关联无统计学意义。相关既往史(高血压史OR=1.44,95%CI:0.72~2.94、糖尿病史OR=1.00,95%CI:0.44-2.22、脑卒中史OR=1.21,95%CI:0.56~2.59、房颤史OR=1.24,95%CI:0.65~ 2.36、冠心病史OR=1.13,95%CI:0.47~2.70)差异无统计学意义(P > 0.05)。仅核心梗死体积(mL)(OR=1.01,95%CI:1.00~1.02,P=0.004)和血管内治疗(%)(OR=0.33,95%CI:0.14~0.75,P=0.010)差异有统计学意义(见表 2)。
| 指标 | OR | 95% CI | P值 |
| 年龄(岁) | 1.02 | 0.99~1.05 | 0.130 |
| 性别(女性vs.男性) | |||
| 男性 | |||
| 女性 | 1.22 | 0.65~2.27 | 0.534 |
| 核心梗死体积(mL) | 1.01 | 1.00~1.02 | 0.004 |
| 核心梗死增长速率(mL/h) | 1.01 | 1.00~1.02 | 0.204 |
| 发病到CTP时间(h) | 0.98 | 0.77~1.24 | 0.846 |
| 高血压史 | 1.44 | 0.72~2.94 | 0.308 |
| 糖尿病史 | 1.00 | 0.44~2.22 | 0.996 |
| 脑卒中史 | 1.21 | 0.56~2.59 | 0.619 |
| 房颤史 | 1.24 | 0.65~2.36 | 0.508 |
| 冠心病史 | 1.13 | 0.47~2.70 | 0.786 |
| 出血并发症 | 2.02 | 0.97~4.30 | 0.063 |
| 血管内治疗 | 0.33 | 0.14~0.75 | 0.010 |
| 静脉溶栓 | 1.32 | 0.69~2.54 | 0.404 |
| 桥接 | 0.68 | 0.36~1.26 | 0.218 |
结合前述核心梗死增长速率与年龄在关于不良预后的单因素及多因素模型中均无统计学意义,进一步考虑核心梗死增长速率与年龄之间可能存在潜在交互作用。因此,将核心梗死增长速率与年龄的乘积放入模型并同时考虑两者主效应,结果显示交互项有统计学意义(OR=1.002,95%CI:1.000~1.003,P=0.032),校正了其他协变量(性别、高血压史、房颤史、糖尿病史、冠心病史、脑卒中史)后结果仍有统计学意义(OR=1.002,95%CI:1.000~1.003,P=0.027)。提示年龄可能是核心梗死增长速率对不良预后关系中的效应修饰因子,即在不同的年龄水平下,核心梗死增长速率对不良预后效应差异有统计学意义(见表 3)。
| 指标 | Model 1 | Model 2 | |||||
| OR | 95% CI | P值 | OR | 95% CI | P值 | ||
| 核心梗死增长速率(mL/h) | 0.899 | 0.799~0.981 | 0.040a | 0.894 | 0.793~0.977 | 0.035a | |
| 年龄 | 0.991 | 0.957~1.026 | 0.617 | 0.985 | 0.948~1.022 | 0.423 | |
| 核心梗死增长速率×年龄 | 1.002 | 1.000~1.003 | 0.032a | 1.002 | 1.000~1.003 | 0.027a | |
| 注:Model 1纳入EIGR、年龄、EIGR×年龄;Model 2:纳入EIGR、年龄、EIGR×年龄、性别、高血压史、房颤史、糖尿病史、冠心病史、脑卒中史 | |||||||
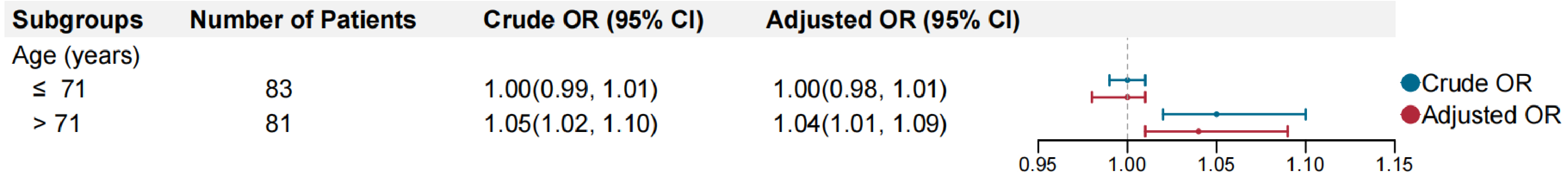
为了展现不同年龄水平下,核心梗死增长速率对不良预后的效应差别,进行了亚组分析(年龄以中位数71岁进行分层)。结果显示:> 71岁人群共有81例,核心梗死增长速率对此人群的OR值是1.05,95%CI:1.02~1.10,有统计学意义,在校正了其他协变量后仍然有统计学意义(OR=1.04,95%CI:1.01~1.09)。≤71岁人群共有83例,核心梗死增长速率对此人群没有统计学意义,在校正了相关协变量后结果仍然没有统计学意义(见图 1)。
|
| 图 1 根据年龄中位数探索EIGR与不良预后的关系 Fig 1 The relationship between EIGR and poor prognosis based on median age(71Y) |
|
|
进一步依据现有文献中不同定义的快速型核心梗死增长速率(> 25 mL/h、> 15 mL/h、> 10 mL/h),分别对高龄组(> 71岁)和低龄组(≤71岁)统计学分析,提示高龄组中,依据25 mL/h(92.3%)和15 mL/h(70.8%)界定的快速型核心梗死增长速率的不良预后占比更高,结果差异有统计学意义(P < 0.05)。低龄组中,依据25 mL/h(39.3%)、15 mL/h(40.0%)、10 mL/h(38.5%)界定的快速型核心梗死增长速率的不良预后比例较缓慢型差异无统计学意义(P > 0.05)(见表 4)。
| 预后 | ≤71岁(n = 83) | P值 | > 71岁(n = 81) | P值 | |||
| EIGR≤25 (n= 55) | EIGR > 25 (n = 28) | EIGR≤25 (n = 68) | EIGR > 25 (n = 13) | ||||
| 不良预后 | 21 (38.2) | 11 (39.3) | 0.9222 | 27 (39.7) | 12 (92.3) | 0.0005 | |
| EIGR≤15 (n = 48) | EIGR > 15 (n= 35) | EIGR≤15 (n = 57) | EIGR > 15 (n = 24) | ||||
| 不良预后 | 18 (37.5) | 14 (40.0) | 0.8172 | 22 (38.6) | 17 (70.8) | 0.0080 | |
| EIGR≤10 (n = 44) | EIGR > 10 (n = 39) | EIGR≤10 (n= 48) | EIGR > 10 (n = 33) | ||||
| 不良预后 | 17 (38.6) | 15 (38.5) | 0.9870 | 20 (41.7) | 19 (57.6) | 0.1591 | |
本研究回顾性分析了本院2020年1月至2022年12月164例大血管闭塞性急性缺血性脑卒中患者,对于4.5 h窗内符合溶栓标准的患者给予静脉溶栓,发病6 h内根据多模影像学结果给予血管内治疗。2020年《中国脑血管病影像应用指南的更新》强调了多模态影像在溶栓和取栓中不可或缺的地位,同时利用CTP一系列参数帮助评估预后[8]。结合本中心的影像评估优势,本研究对所有进入脑卒中绿色通道患者采用一站式影像扫描,通过扫描头颅CT、CT灌注成像,重建CTA血管影像,获取核心梗死、半暗带体积、血管成像等信息,计算核心梗死增长速率,从而尽早实行再灌注治疗、评估患者预后。既往国内外多项临床研究强调对可挽救的脑组织尽早行再灌注治疗,最大限度减少发病至治疗时间,挽救缺血半暗带,减少核心梗死面积,最终改善患者临床预后[9-10]。但是临床上也观察到部分窗内经过积极治疗的患者,预后不尽如人意。当然这里涉及累及病变区、并发症、后期功能康复等复杂的临床问题。也有研究提示,急性大血管闭塞患者,由于侧枝未能代偿,缺血半暗带很快转变为核心梗死,尽管很快开通血管,但是患者仍预后较差;反而慢性血管闭塞或狭窄的患者,由于侧枝丰富,半暗带向核心梗死转变较慢,尽管血管开通较慢,但患者最终仍预后良好[11-13]。Man等[14]的一项荟萃分析显示治疗时间不是影响预后的绝对因素。这些都充分说明,评估预后不仅要考虑开通血管的时间,还可以结合灌注成像中核心梗死上升的速度即核心梗死增长速率进行综合评估。不同于核心梗死体积仅反应某一时间点的情况, 核心梗死增长速率结合核心梗死体积和发病到CTP时间,可动态阐述半暗带向核心梗死演变的快慢。这在2021年Lin等[15]的一项前循环闭塞的缺血性脑卒中回顾性研究中即可说明,并且这一动态演变过程主要受侧枝循环调节。如果患者未建立良好的侧枝循环,往往表现出核心增长速率快,大血管病变时短时间内可能出现大核心梗死。
但是核心梗死增长速率仅是学者按照线性增长模式推算出的,患者颅内的缺血情况明显更为复杂和个体化。本研究希望能验证核心增长速率对早期开通患者预后的判断,但本研究结果发现预后良好组和预后不佳组的核心梗死增长速率并差异无统计学意义。但进一步对年龄进行分层分析后,发现高龄的患者核心梗死速率越高,患者预后越差。进一步考虑核心梗死增长速率与年龄之间可能存在潜在交互作用。因此,本研究将核心梗死增长速率与年龄的乘积放入模型并进行交互分析,结果提示对于预后是有预示作用的。因高龄患者合并症较多,我们进一步校正了其他协变量(性别、高血压史、房颤史、糖尿病史、冠心病史、脑卒中史)后结果仍有统计学意义。这些结果说明在不同的年龄水平下,核心梗死增长速率对不良预后效应有差异,在高龄患者中对预后有一定预测价值。这与临床观察到的现象相吻合:老年患者基础疾病多,常合并多发性动脉粥样硬化性疾病,发生大血管闭塞性脑卒中后如果侧枝循环不佳,加上原有血管条件较差,即使积极血管再通治疗,往往较年轻患者预后更差。
为阐述原因,进一步对高龄组(> 71岁)和低龄组(≤71岁)分别依据文献中不同定义的快速型核心梗死增长速率(> 25 mL/h、> 15 mL/h、> 10 mL/h)[16],分析不良预后的占比。高龄组中,依据25 mL/h和15 mL/h定义的快速型核心梗死增长速率的不良预后占比明显升高,依据10 mL/h定义的快速型核心梗死增长速率人群占比虽然没有统计学意义,但是与缓慢型相比,亦有所升高。低龄组中,依据不同临界值(25 mL/h、15 mL/h、10 mL/h)定义的快速型核心梗死增长速率的不良预后占比与缓慢型比较没有明显区别。高龄组的这一结果与前人的多项研究吻合,例如Sarraj等[17]研究发现,核心梗死增长速率与患者功能独立性相关,其中快速型核心梗死增长速率患者致死率及致残率是缓慢型患者的3倍。
本研究存在不足之处:研究样本量较少,未获得影响不良预后的其他危险因素。在后续研究中将会进一步扩大样本量,寻找更多不良预后的预测因素。
鉴于影像评估的快速发展,我们可以在早期得到越来越多的影像参数,核心梗死增长速率在老年大血管闭塞性缺血性脑卒中患者中可早期预测临床预后。如果能尽早识别快速型核心梗死增长速率的高龄病患,有助于临床医生早期预警病情进展和判断临床预后,结合病情对患者进行个体化的精准治疗。
利益冲突 所有作者声明无利益冲突
作者贡献声明 蒋雷、陈旭锋:研究设计、获取研究经费;李晓慧:论文撰写、数据质控;汪璇:统计分析;许晓泉、李华、季荔、茆丽娜:数据收集及整理;万芬、王瑶、姜丽丽:数据分析及图表绘制
| [1] | Rocha M, Desai SM, Jadhav AP, et al. Prevalence and temporal distribution of fast and slow progressors of infarct growth in large vessel occlusion stroke[J]. Stroke, 2019, 50(8): 2238-2240. DOI:10.1161/STROKEAHA.118.024035 |
| [2] | 张刚, 胡德亮, 周淑兰, 等. NIHSS评分及D-二聚体早期预测缺血性脑卒中患者大血管闭塞的价值研究[J]. 中华急诊医学杂志, 2023, 32(2): 236-240. DOI:10.3760/cma.j.issn.1671-0282.2023.02.019 |
| [3] | 陈科春, 吴秋义, 蒋子贺. 急性前循环大血管闭塞梗死增长速度的影响因素及与取栓预后的关系[J]. 中华急诊医学杂志, 2023, 32(7): 948-951. DOI:10.3760/cma.j.issn.1671-0282.2023.07.016 |
| [4] | Lin LT, Yang JH, Chen CS, et al. Association of collateral status and ischemic core growth in patients with acute ischemic stroke[J]. Neurology, 2021, 96(2): e161-e170. DOI:10.1212/WNL.0000000000011258 |
| [5] | Vagal A, Aviv R, Sucharew H, et al. Collateral clock is more important than time clock for tissue fate[J]. Stroke, 2018, 49(9): 2102-2107. DOI:10.1161/STROKEAHA.118.021484 |
| [6] | Arenillas JF. Infarct core growth velocity: characterizing the hot penumbra without looking at it[J]. Stroke, 2021, 52(12): 4007-4009. DOI:10.1161/STROKEAHA.121.035682 |
| [7] | Seners P, Ben Hassen W, Lapergue B, et al. Prediction of early neurological deterioration in individuals with minor stroke and large vessel occlusion intended for intravenous thrombolysis alone[J]. JAMA Neurol, 2021, 78(3): 321-328. DOI:10.1001/jamaneurol.2020.4557 |
| [8] | 徐运. 中国脑血管病影像应用指南的更新[J]. 中华神经科杂志, 2020, 53(4): 241-243. DOI:10.3760/cma.j.cn113694-20191208-00766 |
| [9] | Nogueira RG, Jadhav AP, Haussen DC, et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct[J]. N Engl J Med, 2018, 378(1): 11-21. DOI:10.1056/NEJMoa1706442 |
| [10] | Albers GW, Marks MP, Kemp S, et al. Thrombectomy for stroke at 6 to 16 hours with selection by perfusion imaging[J]. N Engl J Med, 2018, 378(8): 708-718. DOI:10.1056/NEJMoa1713973 |
| [11] | Rusanen H, Saarinen JT, Sillanpää N. Collateral circulation predicts the size of the infarct core and the proportion of salvageable penumbra in hyperacute ischemic stroke patients treated with intravenous thrombolysis[J]. Cerebrovasc Dis, 2015, 40(3/4): 182-190. DOI:10.1159/000439064 |
| [12] | Cao RY, Ye GF, Wang R, et al. Collateral vessels on 4D CTA as a predictor of hemorrhage transformation after endovascular treatments in patients with acute ischemic stroke: a single-center study[J]. Front Neurol, 2020, 11: 60. DOI:10.3389/fneur.2020.00060 |
| [13] | Xiang XY, Cao F. Time window and "tissue window": two approaches to assist decision-making in strokes[J]. J Neurol, 2019, 266(2): 283-288. DOI:10.1007/s00415-018-8933-5 |
| [14] | Man SM, Aoki J, Hussain MS, et al. Predictors of infarct growth after endovascular therapy for acute ischemic stroke[J]. J Stroke Cerebrovasc Dis, 2015, 24(2): 401-407. DOI:10.1016/j.jstrokecerebrovasdis.2014.09.004 |
| [15] | Lin LT, Zhang H, Chen CS, et al. Stroke patients with faster core growth have greater benefit from endovascular therapy[J]. Stroke, 2021, 52(12): 3998-4006. DOI:10.1161/STROKEAHA.121.034205 |
| [16] | Lin LT, Zhang H, Liu FF, et al. Bridging thrombolysis before endovascular therapy in stroke patients with faster core growth[J]. Neurology, 2023, 100(20): e2083-e2092. DOI:10.1212/WNL.0000000000207154 |
| [17] | Sarraj A, Hassan AE, Grotta J, et al. Early infarct growth rate correlation with endovascular thrombectomy clinical outcomes: analysis from the SELECT study[J]. Stroke, 2021, 52(1): 57-69. DOI:10.1161/STROKEAHA.120.030912 |
 2024, Vol. 33
2024, Vol. 33