在心脏骤停(cardiac arrest, CA)后的复杂病理过程中,神经功能的不良转归是引发后续并发症乃至死亡的主要原因[1]。许多经心肺复苏(cardiopulmonary resuscitation, CPR)后的幸存者,通常会受到缺血缺氧脑损伤所带来的影响,具体表现为长期存在的认知功能衰退与运动能力受限,这些后遗症严重影响了患者的生活质量及医疗决策[2]。2016年,一项包括来自26项研究的23 388名患者的系统评价显示,5%使用传统CPR的患者和超过20%的体外心肺复苏(extracorporeal cardiopulmonary resuscitation, ECPR)患者被诊断为脑死亡,分别占所有死亡的8%和28%[3]。
机器学习(machine learning, ML)作为人工智能(artificial intelligence, AI)领域的关键分支,在临床上的应用日益增多。在心脏骤停患者预后评估的领域中,机器学习技术展现出了其独特的潜力与优势。近年来,研究者们采用了一系列机器学习算法,如随机森林、梯度提升和深度学习网络,这些算法各自具备不同的优势,能够捕捉数据中的复杂模式与非线性关系。通过该项技术,可以对心脏骤停后患者进行早期预测,如使用深度迁移学习方法,通过早期计算机断层扫描(computed tomography, CT)图像,鉴别出早期缺氧缺血性脑病(hypoxic-ischaemic brain injury, HIBI)[4]。除此之外,也有研究表明,人工智能在预测病情危重,临床资料多且复杂的患者时,其预测效能明显优于传统预测模型[5]。
2 心脏骤停后神经功能评估及医疗决策在心肺复苏成功后,通常会发生缺氧缺血性脑病,这也导致了相当一部分自主循环恢复(return of spontaneous circulation, ROSC)患者神经功能预后欠佳,长期处于昏迷状态。HIBI通常由心脏骤停期间缺血所引起的原发性脑损伤,以及ROSC后的继发性缺血-再灌注损伤所引起[6]。美国心脏协会发布的数据显示,在美国,发生院内心脏骤停(in-hospital cardiac arrest, IHCA)后出院存活的病人中,拥有良好的神经系统结局的患者比率从2000年的67.1%上升至了2018年的85%[7]。我国2023年一项关于心脏骤停流行病学调查的结果显示,我国的院外心脏骤停(out-of-hospital cardiac arrest, OHCA)发病率为95.7/10万人,存活出院/存活30 d率为1.2%,神经功能预后良好率仅为0.8%[8]。国外的研究数据显示,在因OHCA复苏后入住重症监护病房的患者中,超过80%的患者因缺氧缺血性脑损伤而昏迷[9],其中约2/3的患者会在出院前死亡[10]。这些死亡大多是由于预测的神经系统结局不良而停止生命维持治疗(withdraw life-sustaining treatment, WLST)所致[1]。因此,准确的预测神经功能预后对于这些患者至关重要,以便为他们的家属提供正确的信息,以做出正确的医疗决策,并避免不适当的WLST或对神经功能预后欠佳的患者进行长期治疗。
心肺复苏后神经功能预后的评价标准通常基于患者的意识恢复程度、生活自理能力以及是否出现神经系统后遗症等。临床上常用的评估工具包括格拉斯哥-匹兹堡脑功能表现分级(cerebral performance category, CPC)、改良Rankin(modified rankin scale, mRS)量表、复苏后良好结局评分(good outcome for cardiac arrest, GO-FAR)、GO-FAR 2评分、心脏骤停复苏后预后评分(cardiac arrest survival prediction instrument, CASPRI)、神经预后综合评分(neurological prognostic composite score, NPCS)、心脏骤停预后评分(cardiac arrest outcome score, CAOS)、意识早期恢复评分(early recovery of consciousness, ERP)等,这些工具能够系统地评估患者的神经功能状态,并为后续治疗提供参考。目前大多数研究[11-12]将不良的神经功能结局被定义为严重的神经功能障碍、持续的植物人状态或死亡,对应于CPC评分3~5分[13]或改良Rankin评分4~6分。
3 神经功能预后的传统预测方法传统预测心肺复苏后神经功能预后的方法主要包括临床评估、生物标志物、近红外光谱、神经影像学检查以及神经电生理检查[14]。临床评估方面,通常使用格拉斯哥昏迷评分(Glasgow coma scale, GCS)来量化患者的意识水平,还包括测量双侧瞳孔对光反射,观察有无肌阵孪等表现来预测神经功能的不良预后。然而,临床评估的准确性受到多种因素的影响,如患者的个体差异(如镇静镇痛程度、肝肾功能状态等)及评估者的主观性等。
常用于预测神经功能预后的标志物包括神经元特异性烯醇化酶(neuron specific enolase, NSE)、S100钙结合蛋白β(S100 calcium-binding protein β, S100β)、胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)、神经纤维丝轻链(neurofilament light chain, NFL)、微管相关蛋白tau(microtubule associated protein tau)和泛素羧基端酯酶L1 (ubiquitin carboxyl terminal hydrolase L1, UCH-L1)等[15]。生物学标志物的检测具有客观、便捷、经济、相对准确等特点,且不受镇静药物的影响。但目前经典的标志物,如NSE,S100β等,因其特异性和敏感性不高,假阳性率较高,存在系统误差,且存在神经系统外来源(如红细胞,神经内分泌肿瘤,小细胞癌)等特点,导致其目前并不被指南推荐作为神经功能预后预测的“金标准”[16-17]。
脑血流改变被认为是导致HIBI的机制之一[18]。近红外光谱(near-infrared spectroscopy, NIRS)是一种用于在微血管水平监测区域脑氧饱和度(cerebral oxygen saturation, SctO2)的非侵入性技术。在一项针对107例心肺复苏后昏迷患者的神经功能预后研究中,发现与神经功能预后较好的患者相比,那些预后较差的患者在ROSC后的最初48 h内,其SctO2明显更低,这一发现预示了心脏骤停后6个月的神经功能结局[19]。目前,有关脑氧饱和度与神经系统预后的关系尚需更多研究进一步证明。
神经影像学检查,其代表为头部CT和磁共振(magnetic resonance imaging, MRI),能够提供关于大脑结构和功能的详细信息,有助于评估心脏骤停后的脑损伤情况。大部分研究[20-21]使用灰质 / 白质比例(gray-white matter ratio, GWR)来评估神经功能预后情况,头部CT显示低GWR可早期准确预测心肺复苏后不良神经功能结局。尽管在绝大多数研究中,ROSC后行头部CT均在24 h内,但是,关于行头部CT测量GWR对心肺复苏后患者进行神经功能预后评估的具体时间尚未达成共识。心肺复苏后的缺血缺氧性脑病在头部MRI上表现为弥散加权成像(diffusion weighted imaging, DWI)的高信号区域,可以使用表观扩散系数(apparent diffusion coefficient, ADC)量化缺血严重程度。全脑ADC[22]、低ADC的脑体积比例[23],以及最常受HIBI影响的特定脑区域的最低ADC值可预测心肺复苏后不良神经功能结局。然而,这些检查方法也存在一定的局限性,CT对于微小的脑损伤可能不敏感,而MRI虽然敏感度较高,但操作复杂且成本较高,不适合作为常规预测手段。
神经电生理检查,如脑电图(electroencephalogram, EEG),通过记录大脑的电活动来评估神经功能,从而提示HIBI的严重程度[24]。在ROSC后,脑电图振幅常明显降低或不连续。抑制(脑电图振幅低于10 mV)或爆发-抑制(高电压慢波与低电压的脑电活动连续交替出现)是重度HIBI的标志[25],特别是在ROSC后24 h出现的抑制几乎总是与较差的神经功能预后或死亡相关[26-27]。然而,EEG需要脑电图专家解读,且其结果受到包括镇静镇痛药物使用剂量、脑电图伪影等多种因素的干扰。
传统预测方法的准确性受到多种因素的影响。首先,不同方法的准确性和可靠性存在差异。例如,临床评估虽然简单易行,但主观性较强;神经影像学检查虽然客观,但操作复杂且成本高昂,且依赖于经验丰富的放射科医生。其次,患者个体差异也会影响预测的准确性。最后,评估时机的选择也会影响预测的准确性。早期评估可能无法准确反映患者的最终预后,而过晚评估则可能错过最佳干预时机。目前,心肺复苏后的患者,推荐在复苏后72 h立刻采用多模式方法[14, 28],进行预后预测。近年来随着AI技术的不断发展,使用AI评估神经功能的方式具有更高的预测价值,可能会在将来逐渐取代传统的评测方法。
4 人工智能在心肺复苏后神经功能预测中的应用 4.1 人工智能的优势及特点传统预测方法在心脏骤停后神经功能预后的评估中具有一定的价值,但也存在诸多局限性和不足之处。因此,临床上需要更加全面、客观和动态的评估方法来准确预测患者的神经功能预后。近年来,随着人工智能技术的不断发展,基于机器学习和深度学习算法[29]的预测模型在医学领域得到了广泛应用。这些模型能够处理大量的临床数据,并自动学习数据中的潜在规律和特征,从而为心肺复苏后神经功能预后的预测提供更加准确和可靠的方法。
在预测心肺复苏后神经功能预后方面,人工智能技术的应用主要体现在对患者数据的深度挖掘和分析上[30]。通过对患者的病史、生理参数、临床数据、影像学资料等多维度数据进行整合和分析,人工智能可以构建出精确的预测模型[31]。这种预测能力不仅有助于医生制定更加个性化的治疗方案,还能为患者家属提供更加明确的心理预期。
具体来说,人工智能在预测心肺复苏后神经功能预后方面的应用,主要依赖于大数据和机器学习技术[32]。通过对大量历史病例数据的学习和分析,人工智能可以识别出与神经功能预后相关的关键特征,如患者的年龄、性别、心率变异率、心跳骤停时复苏时间、生物标志物水平、CT图像、脑电图等[33]。同时,结合实时连续的生命体征监测数据,如心电图、血压、血氧饱和度、脑氧饱和度等,人工智能可以动态地评估患者的神经功能恢复情况,为医生提供及时的反馈和建议。
4.2 机器学习与深度学习ML是人工智能的一个子集,致力于开发与优化计算机算法和统计模型,使计算机系统能够根据学习数据进行科学准确的预测。ML处理多模态数据和复杂变量的能力已在许多研究领域得到证明,例如计算机视觉、自然语言处理。
ML模型分为两类,传统ML和深度神经网络(deep neural network, DNN)模型。这两个类别之间的主要区别在于模型特征的输入。传统ML的输入通常是手动输入的特征,例如年龄、性别、心率等[34]。DNN则会从原始数据中自提取数据和自学习[35]。目前,ML算法日益增多,如逻辑回归分析(logsitic)、近邻法、XG-Boosting(extreme gradient boosting)、支持向量机、随机森林以及决策树等[36]。一项117 674名患者的回顾性分析显示,梯度提升机(gradient boosting machines, GBM)在出院时预测良好的神经功能结局明显优于CASPRI评分(受试者工作特征下面积(receiver operating characteristic area under the curve,AUC-ROC):0.81 vs. 0.73,P < 0.001),并且在区分、校准和准确性测量方面优于所有其他机器学习模型[37]。
早期的研究多采用基于Logistic回归的预测模型。Logistic回归模型简单易懂,计算效率高,对于线性可分的数据集表现出色。然而,心肺复苏后的患者往往病情危重,数据类别多,变量复杂,且这些因素之间可能存在复杂的非线性关系,这使得逻辑回归模型的预测能力受到限制[38]。
深度学习模型,如卷积神经网络(convolutional neural network, CNN)和循环神经网络(recurrent neural network, RNN),能够自动学习数据中的特征,对于处理复杂的非线性问题具有显著优势。在预测心肺复苏后神经功能预后方面,深度学习模型能够综合考虑临床数据和影像学图像,提高预测的准确性。然而,深度学习模型的训练需要大量的数据和时间,且模型的可解释性较差,这在一定程度上限制了其在医学领域的应用。
4.3 人工智能于心肺复苏后神经功能预后预测中的应用 4.3.1 图像分析近年来,随着人工智能的不断应用,研究者们开始尝试利用实验室检查、脑电图、心电图、影像学图片等多模态数据作为变量,构建不同的机器学习或深度学习模型。因为人工智能在数据处理方面的优势,可以快速处理大量图像数据,从中提取出大量超过人眼识别范围的特征,故其在处理脑电图、心电图、CT等图像数据方面有着巨大优势。Mansour等[4]建立了一种深度迁移学习方法来检测心肺复苏后的HIBI。他们使用深度迁移学习的方法,对放射科医生判断为非HIBI的头部CT图像进行分析,发现许多在ROSC后早期出现头部CT正常表现的患者可能已经发生了一定程度的可识别大脑损伤,并且这种损伤可以通过AI识别。Kawai等[39]分析了321例心脏骤停患者复苏3 h内的头部CT图像,他们使用机器学习模型将其与现有的GWR方法预测进行比较,发现机器学习模型能够识别心肺复苏后3 h内完成的头部CT图像特征,精准预测1个月后的神经功能结局。研究发现预测神经功能不良结局的机器学习模型,比传统的复苏后立即完善头部CT,测量GWR的方法具有更高的准确性,从而可以帮助优化治疗,说明了机器学习技术在识别人类视觉阈值外的细微变化方面可能具有很高的准确性。
Zheng等[40]开发了一个用于神经功能预后预测的深度学习模型,该模型利用连续脑电图数据中的趋势信息来改进心肺复苏后昏迷患者的神经功能预后预测。该研究通过一个大型、多中心、国际队列数据集验证其模型性能,发现其预测结果与最终神经功能结局具有高度一致性,显示其有良好的预测效能。Jonas等[41]使用CNN算法,对267名成年接受目标体温管理(targeted temperature management,TTM)期间昏迷患者所记录的脑电图数据进行综合分析,显示CNN建模的预测效能与部分同一队列人群应用其他临床方法预测效能相当或更高,并指出不应该只关注模型的效能,还应该提高模型的可解释性。深度学习进行脑电图分析也存在局限性,首先,因为过于专注于单个结果(神经功能预后,癫痫样活动等),通常选择了没有伪影的脑电图图像,这样在一定程度上可能会提高模型的预测效能,但是降低了泛化性[42]。其次,深度学习的可解释性仍需要进一步深入。Chen等[43]研究发现,使用单一模态的模型,即仅使用EEG或电子健康病例(electronic health records,EHR)数据(例如,年龄、性别和匹兹堡心脏骤停类别)的模型比使用多模态数据的模型(即EEG和EHR数据的组合)的预测效能低。日本的一项研究[44]使用OHCA患者入院后1 h内的连续心电图波形,构建了一个机器学习模型,以预测OHCA患者的生存率及神经功能预后,神经功能结局的ROC面积最高值为0.688,这表明有可能使用连续心电图监测波形作为OHCA患者的预后预测因子,为预测神经功能预后提供了一个新的方向。
需要注意的是,以上研究均为单独使用图像进行机器学习或深度学习建模,未结合心脏骤停相关的其他数据,如病因、ROSC时间,实验室检查结果,GCS评分等,未来的人工智能的研究方向可能会转为提取和融合不同模态之间的互补信息,通过高级特征融合技术,如多模态特征联合学习、注意力机制等,来提高预测的准确性。
4.3.2 临床数据建模Haford等[45]研发的EFCN模型,通过采集人口学资料(年龄,性别等),OHCA院前数据(初始心律,CPR时间,自动体外除颤器(automated external defibrillator, AED)使用等)可以一定程度上预测神经功能预后。Hirano等[46]通过收集19个院前变量,比较了几种机器学习模型,包括logistic回归、支持向量机、随机森林等,进行神经功能结局预测,ROC面积均 > 0.8。Mayampurath等[47]使用梯度提升机器算法,收集人口学资料、心脏骤停时数据、心脏骤停前的并发症及干预措施等数据,预测2019冠状病毒疾病(coronavirus disease 2019, COVID-19)患者心肺复苏后的神经功能结局,发现在非COVID-19患者中构建的梯度提升机器学习模型在COVID-19复苏幸存者中也有很高的准确性。最新的一些研究表明,人工智能在针对不同地区人群[48],不同急救时间[49]对OHCA患者神经功能结局方面都具有很高的预测效能。Pey等[48]使用一个大小约为30个特征和600名患者的小数据集来构建局部优化的机器学习模型,但其存在泛化能力不足和过拟合的风险。Rawshani等[50]基于XGBoost开发的模型,利用入院时的信息来预测OHCA后的神经功能结局,并可以通过SHAP算法(shapley additive explanations)进行的可解释性分析,得出“到达医院时的ROSC”对模型结果的影响最大。人工智能的可解释性是近年来研究的热点之一,特别是在机器学习模型广泛应用于关键决策领域的背景下。SHAP是一种用于解释模型预测的机器学习算法,它基于博弈论中的Shapley值来解释任何模型的输出。许多复杂的机器学习模型,如深度神经网络,被认为是“黑箱”,因为它们的内部工作原理难以理解。即使使用了一些解释工具,如SHAP或模型无关的局部解释算法(local interpretable model-agnostic explanations,LIME),也只能提供部分解释,而不能完全揭示模型的所有决策逻辑。
还有研究[51]通过使用生成式预训练模型-4(chat generative pre-trained transformer-4,ChatGPT-4)进行前瞻性队列研究,预测重症监护室心脏骤停患者的生存率及神经功能结局,结果显示 ChatGPT-4在预测死亡率和不良神经功能结局方面具有良好的表现。但是,该研究[51]结果表明,没有经过训练的ChatGPT-4会生成不合逻辑的答案,约14%的结果中出现了不良神经功能结局的概率大于死亡概率。因此,尽管人工智能技术不断进步,但人类监督仍然是确保AI可靠性和安全性的重要组成部分。通过人机协作,可以充分发挥人工智能的潜力,同时避免其潜在的风险和局限性。
Chou等[52]则使用人工神经网络(artificial neural network,ANN)算法来提升CASPRI评分预测效能,在他们的研究中CASPRI评分的ROC面积为0.811,使用CASPRI评分中的10个特征进行ANN建模后,ROC面积提升至了0.921。使用机器学习或深度学习算法虽然可以进行预测建模,但是建立的模型往往较复杂,且可解释性存在一定的问题,如果将其用于提升现有预后预测评分的预测效能,在简便性和可解释性方面都将有不同的提升。
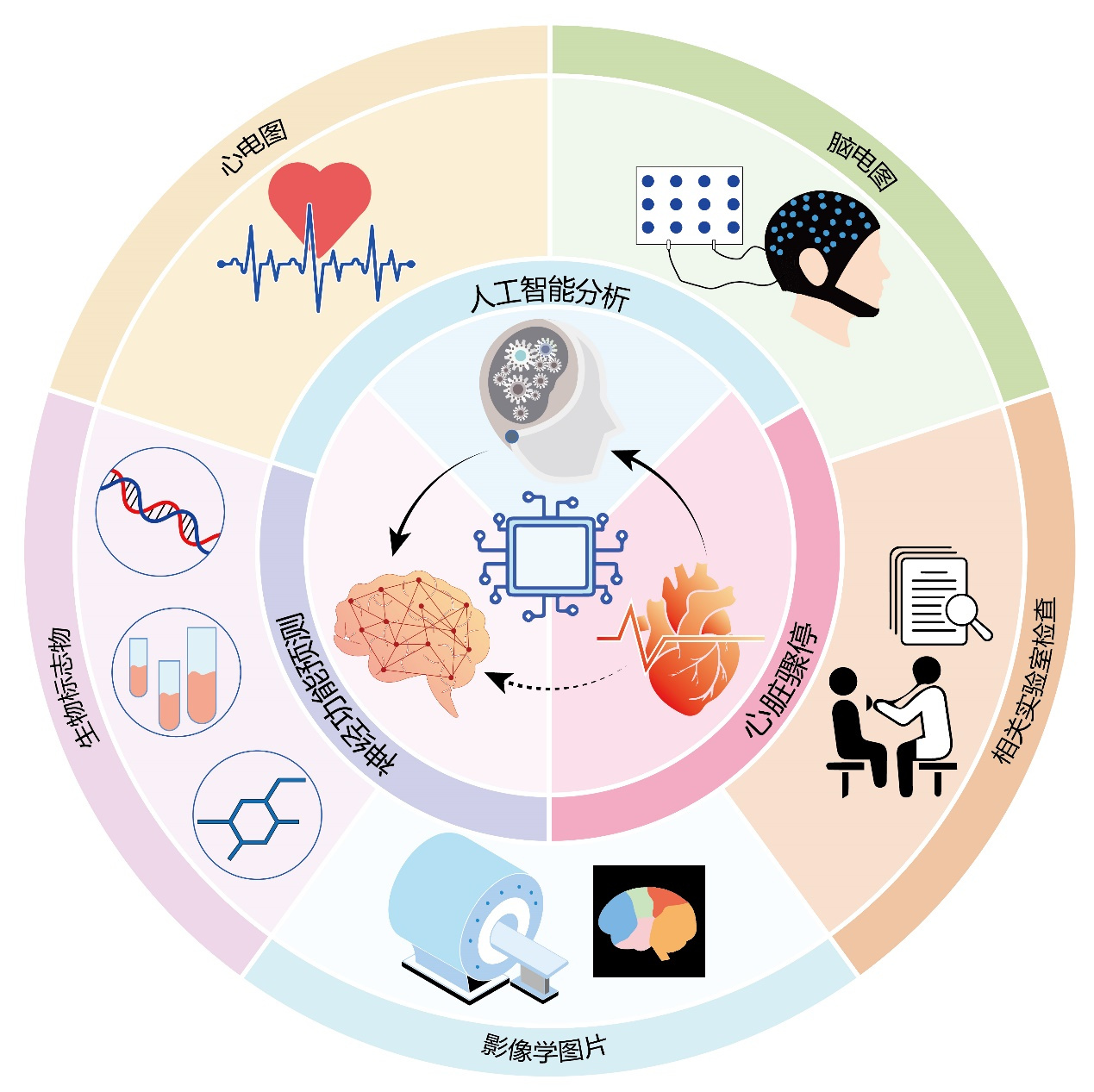
人工智能模式下对神经功能预后多模态综合评估模式示意图见图 1。
|
| 图 1 人工智能模式下多模态神经功能预后评估模式图 |
|
|
相较传统的神经功能预后预测方法,AI预测无疑拥有着更高的预测效能,可以通过文本(实验室检查结果、临床数据),图像(影像学图片),视频(影像学动图),生物信号(脑电图、连续心电图)等多模态的数据进行学习,提高模型的感知与理解能力,实现跨模态的信息交互与融合。临床医生可以通过导入相关数据,准确的预测预后信息,从而做出合理的临床决策。尽管AI在评估心肺复苏后神经功能预后方面展现出巨大的潜力,但仍需要克服数据获取与处理、模型泛化与稳定性、过拟合以及伦理隐私等多方面的挑战。
利益冲突 所有作者声明无利益冲突
| [1] | Dragancea I, Wise MP, Al-Subaie N, et al. Protocol-driven neurological prognostication and withdrawal of life-sustaining therapy after cardiac arrest and targeted temperature management[J]. Resuscitation, 2017, 117: 50-57. DOI:10.1016/j.resuscitation.2017.05.014 |
| [2] | Lim C, Alexander MP, LaFleche G, et al. The neurological and cognitive sequelae of cardiac arrest[J]. Neurology, 2004, 63(10): 1774-1778. DOI:10.1212/01.wnl.0000144189.83077.8e |
| [3] | Sandroni C, D'Arrigo S, Callaway CW, et al. The rate of brain death and organ donation in patients resuscitated from cardiac arrest: a systematic review and meta-analysis[J]. Intensive Care Med, 2016, 42(11): 1661-1671. DOI:10.1007/s00134-016-4549-3 |
| [4] | Mansour A, Fuhrman JD, Ammar FE, et al. Machine learning for early detection of hypoxic-ischemic brain injury after cardiac arrest[J]. Neurocrit Care, 2022, 36(3): 974-982. DOI:10.1007/s12028-021-01405-y |
| [5] | Ngiam KY, Khor IW. Big data and machine learning algorithms for health-care delivery[J]. Lancet Oncol, 2019, 20(5): e262-e273. DOI:10.1016/S1470-2045(19)30149-4 |
| [6] | Schoenthal T, Hoiland R, Griesdale DE, et al. Cerebral hemodynamics after cardiac arrest: implications for clinical management[J]. Minerva Anestesiol, 2023, 89(9): 824-833. DOI:10.23736/S0375-9393.23.17268-3 |
| [7] | DiLibero J, Misto K. Outcomes of In-hospital cardiac arrest: a review of the evidence[J]. Crit Care Nurs Clin North Am, 2021, 33(3): 343-356. DOI:10.1016/j.cnc.2021.05.009 |
| [8] | Zheng JQ, Lv CZ, Zheng W, et al. Incidence, process of care, and outcomes of out-of-hospital cardiac arrest in China: a prospective study of the BASIC-OHCA registry[J]. Lancet Public Health, 2023, 8(12): e923-e932. DOI:10.1016/S2468-2667(23)00173-1 |
| [9] | Thomassen A, Wernberg M. Prevalence and prognostic significance of coma after cardiac arrest outside intensive care and coronary units[J]. Acta Anaesthesiol Scand, 1979, 23(2): 143-148. DOI:10.1111/j.1399-6576.1979.tb01434.x |
| [10] | Laver S, Farrow C, Turner D, et al. Mode of death after admission to an intensive care unit following cardiac arrest[J]. Intensive Care Med, 2004, 30(11): 2126-2128. DOI:10.1007/s00134-004-2425-z |
| [11] | Geocadin RG, Callaway CW, Fink EL, et al. Standards for studies of neurological prognostication in comatose survivors of cardiac arrest: a scientific statement from the American heart association[J]. Circulation, 2019, 140(9): e517-e542. DOI:10.1161/CIR.0000000000000702 |
| [12] | Haywood K, Whitehead L, Nadkarni VM, et al. COSCA (core outcome set for cardiac arrest) in adults: an advisory statement from the international liaison committee on resuscitation[J]. Circulation, 2018, 137(22): e783-e801. DOI:10.1161/CIR.0000000000000562 |
| [13] | Sandroni C, Nolan JP. Neuroprognostication after cardiac arrest in Europe: new timings and standards[J]. Resuscitation, 2015, 90: A4-A5. DOI:10.1016/j.resuscitation.2015.02.020 |
| [14] | Sandroni C, D'Arrigo S, Nolan JP. Prognostication after cardiac arrest[J]. Crit Care, 2018, 22(1): 150. DOI:10.1186/s13054-018-2060-7 |
| [15] | Hoiland RL, Rikhraj KJK, Thiara S, et al. Neurologic prognostication after cardiac arrest using brain biomarkers: a systematic review and meta-analysis[J]. JAMA Neurol, 2022, 79(4): 390-398. DOI:10.1001/jamaneurol.2021.5598 |
| [16] | Stammet P, Collignon O, Hassager C, et al. Neuron-specific enolase as a predictor of death or poor neurological outcome after out-of-hospital cardiac arrest and targeted temperature management at 33℃ and 36℃[J]. J Am Coll Cardiol, 2015, 65(19): 2104-2114. DOI:10.1016/j.jacc.2015.03.538 |
| [17] | Wiberg S, Hassager C, Stammet P, et al. Single versus serial measurements of neuron-specific enolase and prediction of poor neurological outcome in persistently unconscious patients after out-of-hospital cardiac arrest - A TTM-trial substudy[J]. PLoS One, 2017, 12(1): e0168894. DOI:10.1371/journal.pone.0168894 |
| [18] | Nolan JP, Neumar RW, Adrie C, et al. Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication: a scientific statement from the International Liaison Committee on Resuscitation; the American Heart Association Emergency Cardiovascular Care Committee; the Council on Cardiovascular Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative, and Critical Care; the Council on Clinical Cardiology; the Council on Stroke (Part II)[J]. Int Emerg Nurs, 2010, 18(1): 8-28. DOI:10.1016/j.ienj.2009.07.001 |
| [19] | Genbrugge C, Eertmans W, Meex I, et al. What is the value of regional cerebral saturation in post-cardiac arrest patients? A prospective observational study[J]. Crit Care, 2016, 20(1): 327. DOI:10.1186/s13054-016-1509-9 |
| [20] | Scarpino M, Lanzo G, Lolli F, et al. Neurophysiological and neuroradiological multimodal approach for early poor outcome prediction after cardiac arrest[J]. Resuscitation, 2018, 129: 114-120. DOI:10.1016/j.resuscitation.2018.04.016 |
| [21] | Scheel M, Storm C, Gentsch A, et al. The prognostic value of gray-white-matter ratio in cardiac arrest patients treated with hypothermia[J]. Scand J Trauma Resusc Emerg Med, 2013, 21: 23. DOI:10.1186/1757-7241-21-23 |
| [22] | Wu O, Sorensen AG, Benner T, et al. Comatose patients with cardiac arrest: predicting clinical outcome with diffusion-weighted MR imaging[J]. Radiology, 2009, 252(1): 173-181. DOI:10.1148/radiol.2521081232 |
| [23] | Wijman CA, Mlynash M, Caulfield AF, et al. Prognostic value of brain diffusion-weighted imaging after cardiac arrest[J]. Ann Neurol, 2009, 65(4): 394-402. DOI:10.1002/ana.21632 |
| [24] | Rundgren M, Rosén I, Friberg H. Amplitude-integrated EEG (aEEG) predicts outcome after cardiac arrest and induced hypothermia[J]. Intensive Care Med, 2006, 32(6): 836-842. DOI:10.1007/s00134-006-0178-6 |
| [25] | Hirsch LJ, LaRoche SM, Gaspard N, et al. American Clinical Neurophysiology Society's Standardized Critical Care EEG Terminology: 2012 version[J]. J Clin Neurophysiol, 2013, 30(1): 1-27. DOI:10.1097/wnp.0b013e3182784729 |
| [26] | Cloostermans MC, van Meulen FB, Eertman CJ, et al. Continuous electroencephalography monitoring for early prediction of neurological outcome in postanoxic patients after cardiac arrest: a prospective cohort study[J]. Crit Care Med, 2012, 40(10): 2867-2875. DOI:10.1097/CCM.0b013e31825b94f0 |
| [27] | Westhall E, Rosén I, Rundgren M, et al. Time to epileptiform activity and EEG background recovery are independent predictors after cardiac arrest[J]. Clin Neurophysiol, 2018, 129(8): 1660-1668. DOI:10.1016/j.clinph.2018.05.016 |
| [28] | Rossetti AO, Rabinstein AA, Oddo M. Neurological prognostication of outcome in patients in coma after cardiac arrest[J]. Lancet Neurol, 2016, 15(6): 597-609. DOI:10.1016/S1474-4422(16)00015-6 |
| [29] | Shah A, Ahirrao S, Pandya S, et al. Smart cardiac framework for an early detection of cardiac arrest condition and risk[J]. Front Public Health, 2021, 9: 762303. DOI:10.3389/fpubh.2021.762303 |
| [30] | Khan AA, Laghari AA, Awan SA, et al. Machine learning in computer vision: a review[J]. EAI Endorsed Trans S, 2021, 8(32): 1-11. DOI:10.4108/eai.21-4-2021.169418 |
| [31] | Qayyum A, Qadir J, Bilal M, et al. Secure and robust machine learning for healthcare: a survey[J]. IEEE Rev Biomed Eng, 2021, 14: 156-180. DOI:10.1109/RBME.2020.3013489 |
| [32] | Moffat LM, Xu DJ. Accuracy of machine learning models to predict In-hospital cardiac arrest: a systematic review[J]. Clin Nurse Spec, 2022, 36(1): 29-44. DOI:10.1097/NUR.0000000000000644 |
| [33] | Lee Y, Kwon JM, Lee YH, et al. Deep learning in the medical domain: predicting cardiac arrest using deep learning[J]. Acute Crit Care, 2018, 33(3): 117-120. DOI:10.4266/acc.2018.00290 |
| [34] | Erickson BJ. Basic artificial intelligence techniques: machine learning and deep learning[J]. Radiol Clin North Am, 2021, 59(6): 933-940. DOI:10.1016/j.rcl.2021.06.004 |
| [35] | Currie G, Hawk KE, Rohren E, et al. Machine learning and deep learning in medical imaging: intelligent imaging[J]. J Med Imaging Radiat Sci, 2019, 50(4): 477-487. DOI:10.1016/j.jmir.2019.09.005 |
| [36] | Reel PS, Reel S, Pearson E, et al. Using machine learning approaches for multi-omics data analysis: a review[J]. Biotechnol Adv, 2021, 49: 107739. DOI:10.1016/j.biotechadv.2021.107739 |
| [37] | Mayampurath A, Hagopian R, Venable L, et al. Comparison of machine learning methods for predicting outcomes after In-hospital cardiac arrest[J]. Crit Care Med, 2022, 50(2): e162-e172. DOI:10.1097/CCM.0000000000005286 |
| [38] | Harford S, Darabi H, Del Rios M, et al. A machine learning based model for Out of Hospital cardiac arrest outcome classification and sensitivity analysis[J]. Resuscitation, 2019, 138: 134-140. DOI:10.1016/j.resuscitation.2019.03.012 |
| [39] | Kawai Y, Kogeichi Y, Yamamoto K, et al. Explainable artificial intelligence-based prediction of poor neurological outcome from head computed tomography in the immediate post-resuscitation phase[J]. Sci Rep, 2023, 13(1): 5759. DOI:10.1038/s41598-023-32899-5 |
| [40] | Zheng WL, Amorim E, Jing J, et al. Predicting neurological outcome from electroencephalogram dynamics in comatose patients after cardiac arrest with deep learning[J]. IEEE Trans Biomed Eng, 2022, 69(5): 1813-1825. DOI:10.1109/TBME.2021.3139007 |
| [41] | Jonas S, Rossetti AO, Oddo M, et al. EEG-based outcome prediction after cardiac arrest with convolutional neural networks: performance and visualization of discriminative features[J]. Hum Brain Mapp, 2019, 40(16): 4606-4617. DOI:10.1002/hbm.24724 |
| [42] | Zubler F, Tzovara A. Deep learning for EEG-based prognostication after cardiac arrest: from current research to future clinical applications[J]. Front Neurol, 2023, 14: 1183810. DOI:10.3389/fneur.2023.1183810 |
| [43] | Chen CC, Massey SL, Kirschen MP, et al. Electroencephalogram-based machine learning models to predict neurologic outcome after cardiac arrest: a systematic review[J]. Resuscitation, 2024, 194: 110049. DOI:10.1016/j.resuscitation.2023.110049 |
| [44] | Takahashi M, Ogura K, Goto T, et al. Electrocardiogram monitoring as a predictor of neurological and survival outcomes in patients with out-of-hospital cardiac arrest: a single-center retrospective observational study[J]. Front Neurol, 2023, 14: 1210491. DOI:10.3389/fneur.2023.1210491 |
| [45] | Harford S, Del Rios M, Heinert S, et al. A machine learning approach for modeling decisions in the out of hospital cardiac arrest care workflow[J]. BMC Med Inform Decis Mak, 2022, 22(1): 21. DOI:10.1186/s12911-021-01730-4 |
| [46] | Hirano Y, Kondo Y, Sueyoshi K, et al. Early outcome prediction for out-of-hospital cardiac arrest with initial shockable rhythm using machine learning models[J]. Resuscitation, 2021, 158: 49-56. DOI:10.1016/j.resuscitation.2020.11.020 |
| [47] | Mayampurath A, Bashiri F, Hagopian R, et al. Predicting neurological outcomes after in-hospital cardiac arrests for patients with Coronavirus Disease 2019[J]. Resuscitation, 2022, 178: 55-62. DOI:10.1016/j.resuscitation.2022.07.018 |
| [48] | Pey V, Doumard E, Komorowski M, et al. A locally optimised machine learning approach to early prognostication of long-term neurological outcomes after out-of-hospital cardiac arrest[J]. Digit Health, 2024, 10: 20552076241234746. DOI:10.1177/20552076241234746 |
| [49] | Kawai Y, Yamamoto K, Miyazaki K, et al. Machine learning-based analysis of regional differences in out-of-hospital cardiopulmonary arrest outcomes and resuscitation interventions in Japan[J]. Sci Rep, 2023, 13(1): 15884. DOI:10.1038/s41598-023-43210-x |
| [50] | Rawshani A, Hessulf F, Deminger J, et al. Prediction of neurologic outcome after out-of-hospital cardiac arrest: an interpretable approach with machine learning[J]. Resuscitation, 2024, 202: 110359. DOI:10.1016/j.resuscitation.2024.110359 |
| [51] | Amacher SA, Arpagaus A, Sahmer C, et al. Prediction of outcomes after cardiac arrest by a generative artificial intelligence model[J]. Resusc Plus, 2024, 18: 100587. DOI:10.1016/j.resplu.2024.100587 |
| [52] | Chou SY, Bamodu OA, Chiu WT, et al. Artificial neural network-boosted Cardiac Arrest Survival Post-Resuscitation In-hospital (CASPRI) score accurately predicts outcome in cardiac arrest patients treated with targeted temperature management[J]. Sci Rep, 2022, 12: 7254. DOI:10.1038/s41598-022-11201-z |
 2024, Vol. 33
2024, Vol. 33