2. 南京医科大学附属常州第二人民医院重症医学科, 常州 213000
2. Department of Critical Care Medicine, The Affiliated Changzhou No.2 People's Hospital of Nanjing Medical University, Changzhou 213000, China
脓毒症是一种由病原微生物及其产物引起的复杂的炎症紊乱综合征,是一个重要的全球健康问题。与无脓毒症的患者相比,脓毒症的幸存者显示出更高的再住院率和更严重的病理过程[1]。肝脏作为人体生物转化和能量代谢的重要器官,不仅是产生细胞因子的重要场所,也是脓毒症发生发展过程中炎症反应最剧烈的脏器之一。研究表明,脓毒症引起的肝损伤是多器官功能障碍的独立危险因素[2-3],肝功能障碍或衰竭的脓毒症患者的病死率高达54%~68%[4-6]。由于脓毒症相关性肝损伤(sepsis-associated liver injury, SALI)的发病机制错综复杂,导致治疗较为困难,目前临床上除了进行肝移植和人工肝外,可用于指导治疗的有效方案极少[7-8]。尽管血清总胆红素(total bilirubin, TBIL)或丙氨酸转氨酶(alanine transaminase, ALT)增加可以诊断SALI[9],但由于肝脏的生理功能复杂,且具有较强的代偿和再生能力,这些指标在肝损伤的早期阶段可以保持在正常范围。因此,有必要对临床或实验室指标进行筛选,以制定敏感、准确、方便的预测指标,用于早期识别SALI。
1 资料与方法 1.1 研究对象回顾性分析2020年3月至2023年4月重症监护室(intensive care unit, ICU)收治脓毒症患者的病历资料。如果患者曾多次入住ICU,则只包括第一次入住ICU的临床资料。纳入标准:符合脓毒症3.0诊断标准[10];ICU住院时间≥4 d。排除标准:急性肝功能不全、肝脏肿瘤、胆囊结石、病毒性肝炎、肝硬化、药物性肝损伤以及缺乏完整的实验室结果。该研究得到了医院伦理委员会的批准([2023]KY116-01)。
1.2 分组根据住院期间脓毒症患者是否发生肝损伤,将脓毒症患者分为肝损伤组和无肝损伤组。肝损伤定义为TBIL≥34.1 μmol/L和(或)ALT≥80 U/L[9]。
1.3 观察指标收集患者的基本资料,包括年龄、性别、吸烟史、嗜酒史、基础疾病史(高血压、糖尿病、心功能不全、神经系统疾病、呼吸系统疾病、风湿免疫性疾病和肾功能不全)、急性生理学与慢性健康状况评分Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)、休克概率、机械通气时间、ICU住院时间、病死率和实验室指标。实验室指标从入住ICU后第一次检测中收集。
1.4 统计学方法使用SPSS 22.0软件处理数据。符合正态分布的计量资料以均数±标准差表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料以中位数(四分位数)[M(Q1, Q3)]表示,两组间比较采用非参数秩和检验。计数资料采用卡方检验。结合单变量和多变量Logistic回归分析来探讨SALI的危险因素。为了评估危险因素对SALI的预测效能,绘制ROC曲线,并采用最佳截断值进行亚组分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 人口统计学和一般资料在530例符合条件的患者中,有急性肝功能不全(13例)、肝脏肿瘤(6例)、胆囊结石(35例)、病毒性肝炎(7例)、肝硬化(11例)、药物性肝损伤(7例)以及缺乏完整的实验室结果(48例)的患者被排除,剩下403名患者可供分析。肝损伤患者的中位数年龄为74(67, 83)岁,无肝损伤患者的中位数年龄为75(66.3,82.8)岁。在肝损伤组和无肝损伤组中,大多数患者都是男性(68.55% vs. 61.89%)。肝损伤的发生率为39.45%(159/403)。肝损伤患者的ICU住院时间的中位数为14(8,18)d,无肝损伤患者为11(7,16)d(P=0.001)。肝损伤患者的住院死亡率为54.71%(87/159),明显高于无肝损伤患者的25.40%(62/244)(P < 0.001)。与无肝损伤组相比,肝损伤组入院时APACHE Ⅱ评分和休克概率明显增加,机械通气时间也明显延长(均P < 0.001)。在年龄、性别、吸烟史、嗜酒史和基础疾病史方面差异无统计学意义(均P > 0.05)。见表 1。
| 指标 | 肝损伤组(n=159) | 无肝损伤组(n=244) | χ2/Z值 | P值 |
| 年龄(岁)a | 74.0(67.0, 83.0) | 75.0(66.3, 82.8) | -0.444 | 0.657 |
| 性别b | ||||
| 男性 | 109(68.55) | 151(61.89) | 1.870 | 0.171 |
| 女性 | 50(31.45) | 93(38.11) | 1.870 | 0.171 |
| 吸烟史b | 47(29.56) | 55(22.54) | 2.509 | 0.113 |
| 嗜酒史b | 25(15.72) | 35(14.34) | 0.144 | 0.704 |
| 基础疾病史b | ||||
| 高血压 | 102(64.15) | 157(64.34) | 0.045 | 0.832 |
| 糖尿病 | 62(38.99) | 99(40.57) | 0.100 | 0.752 |
| 心功能不全 | 24(15.09) | 39(15.98) | 0.058 | 0.810 |
| 神经系统疾病 | 66(41.51) | 116(47.54) | 1.414 | 0.234 |
| 呼吸系统疾病 | 32(20.13) | 50(20.49) | 0.008 | 0.929 |
| 风湿免疫性疾病 | 7(4.40) | 21(8.61) | 2.632 | 0.105 |
| 肾功能不全 | 17(10.69) | 35(14.34) | 1.143 | 0.285 |
| APACHE Ⅱ(分)a | 24.0(18.0, 30.0) | 20.0(16.0, 25.0) | -4.416 | < 0.001 |
| 休克b | 124(77.99) | 131(53.69) | 24.460 | < 0.001 |
| 机械通气时间(d)a | 11.0(6.0, 16.0) | 7.0(0, 13.0) | -4.708 | < 0.001 |
| ICU住院时间(d)a | 14.0(8.0, 18.0) | 11.0(7.0, 16.0) | -3.260 | 0.001 |
| 病死率b | 87(54.71) | 62(25.40) | 35.483 | < 0.001 |
| 注:APACHE Ⅱ为急性生理学与慢性健康状况评分,ICU为重症监护病房;a为M(Q1, Q3),b为(例,%) | ||||
肝损伤组C反应蛋白(C-reactive protein, CRP)、降钙素原(procalcitonin, PCT)、平均血小板体积(mean platelet volume, MPV)、凝血酶原时间(prothrombin time, PT)、国际标准化比值(international normalized ratio, INR)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT)、乳酸脱氢酶(lactic dehydrogenase,LDH)、肌酸激酶(creatine kinase, CK)、肌酸激酶-同工酶(creatine kinase isoenzyme, CK-MB)和乳酸(lactate, Lac)均较无肝损伤组明显增高,而白蛋白(albumin, ALB)、前白蛋白(prealbumin, PA)、总胆固醇(total cholesterol, TC)、补体C3(complement C3, C3)和补体C4(complement C4, C4)则均较无肝损伤组明显降低,差异均有统计学意义(均P < 0.05)。见表 2。
| 指标 | 肝损伤组(n=159) | 无肝损伤组(n=244) | χ2/Z值 | P值 |
| WBC(×109/L)a | 11.82 (8.31, 15.14) | 12.57 (8.84, 16.82) | -1.915 | 0.056 |
| N(%)a | 0.89 (0.82, 0.92) | 0.87 (0.81, 0.92) | -1.571 | 0.116 |
| CRP(mg/L)a | 108.28 (54.51, 177.37) | 67.83 (24.68, 135.38) | -4.244 | < 0.001 |
| PCT(ng/mL)a | 2.67 (0.60, 13.94) | 1.04 (0.27, 3.86) | -4.674 | < 0.001 |
| PaO2 (KPa)a | 12.9 (9.5, 16.9) | 13.0 (9.7, 17.7) | -0.826 | 0.409 |
| PaCO2 (KPa)a | 5.2 (4.5, 6.1) | 5.6 (4.7, 6.5) | -1.645 | 0.100 |
| PLT(×109/L)a | 183 (110, 244) | 189 (141, 264) | -1.596 | 0.110 |
| MPV(fL)a | 11.0 (10.1, 11.9) | 10.7 (9.9, 11.6) | -2.186 | 0.029 |
| PT(s)a | 14.7 (13.1, 16.2) | 13.1 (12.4, 14.2) | -6.556 | < 0.001 |
| INR a | 1.31 (1.16, 1.44) | 1.16 (1.09, 1.26) | -6.645 | < 0.001 |
| APTT(s)a | 31.20 (28.30, 36.10) | 29.30 (26.82, 33.27) | -4.129 | < 0.001 |
| FIB(g/L)a | 4.85 (3.51, 6.61) | 4.67 (3.70, 5.81) | -0.888 | 0.375 |
| ALB(g/L)b | 28.76±6.20 | 31.07±5.78 | -3.813 | < 0.001 |
| PA(mg/dL)a | 6.70 (3.70, 11.20) | 12.60 (8.04, 16.66) | -8.541 | < 0.001 |
| AKP(U/L)a | 86.0 (66.0, 128.0) | 88.0 (68.0, 116.7) | -0.193 | 0.847 |
| γ-GGT(U/L)a | 34.0 (21.0, 78.1) | 31.0 (20.0, 53.7) | -1.468 | 0.142 |
| LDH(U/L)a | 331.5 (252.1, 513.1) | 252.4 (196.3, 372.8) | -5.580 | < 0.001 |
| CK(U/L)a | 148.0 (60.0, 447.0) | 83.0 (39.0, 252.5) | -3.539 | < 0.001 |
| CK-MB(U/L)a | 11.90 (6.90, 21.10) | 9.95 (5.12, 18.00) | -2.158 | 0.031 |
| BUN(mmol/L)a | 11.9 (8.3, 18.8) | 10.6 (7.32, 16.6) | -1.379 | 0.168 |
| SCr(umol/L)a | 113.1 (72.6, 172.9) | 94.3 (62.1, 165.95) | -1.735 | 0.083 |
| TC(mmol/L)a | 2.66 (2.02, 3.59) | 3.07 (2.45, 3.81) | -3.776 | < 0.001 |
| TG(mmol/L)a | 1.09 (0.73, 1.56) | 1.17 (0.82, 1.58) | -1.274 | 0.203 |
| P(mmol/L)a | 1.19 (0.97, 1.51) | 1.225 (0.99, 1.59) | -0.578 | 0.563 |
| C3(g/L)a | 0.827±0.272 | 0.982±0.246 | -5.891 | < 0.001 |
| C4(g/L)a | 0.216±0.095 | 0.266±0.103 | -4.882 | < 0.001 |
| Lac(mmol/L)a | 2.60 (1.90, 3.50) | 1.85 (1.40, 2.60) | -6.094 | < 0.001 |
| 注:WBC为白细胞,N为中性粒细胞比率,CRP为C反应蛋白,PCT为降钙素原,PaO2为动脉血氧分压,PaCO2为动脉血二氧化碳分压,PLT为血小板,MPV为平均血小板体积,PT为凝血酶原时间,INR为国际标准化比值,APTT为活化部分凝血活酶时间,FIB为纤维蛋白原,ALB为白蛋白,PA为前白蛋白,AKP为碱性磷酸酶,γ-GGT为γ-谷氨酰基转移酶,LDH为乳酸脱氢酶,CK为肌酸激酶,CK-MB为肌酸激酶-同工酶,BUN为血尿素氮,SCr为血肌酐,TC为总胆固醇,TG为甘油三酯,P为血磷,C3为补体C3,C4为补体C4,Lac为乳酸;a为M(Q1, Q3),b为(x±s) | ||||
将单因素分析中差异有统计学意义的指标,包括CRP、PCT、MPV、PT、INR、APTT、ALB、PA、LDH、CK、CK-MB、TC、C3、C4、Lac作为自变量,以肝损伤为因变量,采用多变量logistic回归分析,显示PA降低、Lac和LDH增高是SALI的独立高危因素(均P < 0.05)。见表 3。
| 变量 | β值 | 标准误 | χ2值 | df | P值 | OR值 | 95%CI |
| CRP | -0.002 | 0.002 | 1.101 | 1 | 0.294 | 0.998 | 0.995~1.002 |
| PCT | 0.002 | 0.005 | 0.122 | 1 | 0.727 | 1.002 | 0.992~1.012 |
| MPV | -0.049 | 0.085 | 0.333 | 1 | 0.564 | 0.952 | 0.805~1.125 |
| PT | 0.005 | 0.329 | 0.000 | 1 | 0.988 | 1.005 | 0.527~1.916 |
| INR | -0.680 | 3.595 | 0.036 | 1 | 0.850 | 0.507 | 0.000~582.431 |
| APTT | -0.004 | 0.021 | 0.040 | 1 | 0.842 | 1.004 | 0.963~1.047 |
| ALB | -0.024 | 0.027 | 0.803 | 1 | 0.370 | 0.976 | 0.925~1.029 |
| PA | 0.151 | 0.030 | 25.477 | 1 | < 0.001 | 1.163 | 1.097~1.233 |
| LDH | -0.001 | 0.001 | 6.109 | 1 | 0.013 | 0.999 | 0.998~1.000 |
| CK | 0.000 | 0.000 | 0.975 | 1 | 0.324 | 1.000 | 1.000~1.000 |
| CK-MB | 0.000 | 0.006 | 0.008 | 1 | 0.930 | 1.000 | 0.990~1.011 |
| TC | 0.075 | 0.143 | 0.277 | 1 | 0.599 | 1.078 | 0.814~1.428 |
| C3 | 0.658 | 0.668 | 0.970 | 1 | 0.325 | 1.931 | 0.522~7.146 |
| C4 | 3.105 | 1.712 | 3.291 | 1 | 0.070 | 22.320 | 0.779~639.348 |
| Lac | -0.307 | 0.087 | 12.593 | 1 | < 0.001 | 0.735 | 0.620~0.871 |
| 注:CRP为C反应蛋白,PCT为降钙素原,MPV为平均血小板体积,PT为凝血酶原时间,INR为国际标准化比值,APTT为活化部分凝血活酶时间,ALB为白蛋白,PA为前白蛋白,LDH为乳酸脱氢酶,CK为肌酸激酶,CK-MB为肌酸激酶-同工酶,TC为总胆固醇,C3为补体C3,C4为补体C4,Lac为乳酸 | |||||||
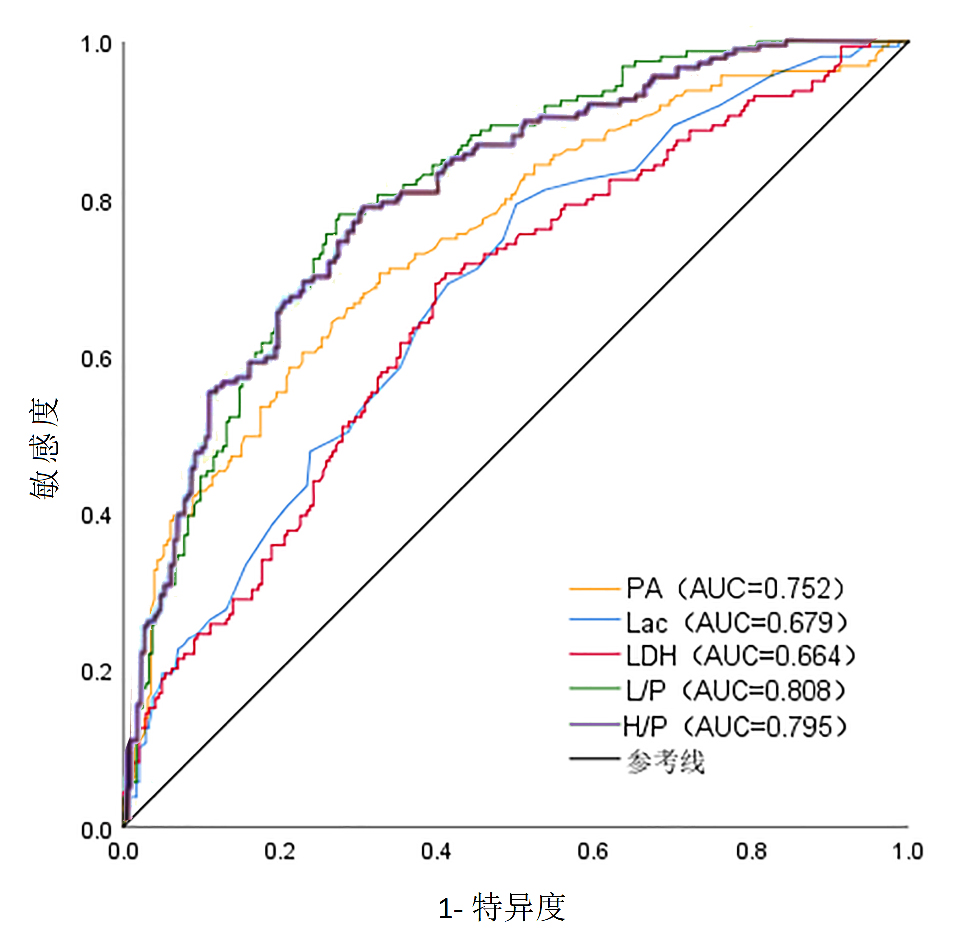
PA、Lac和LDH预测SALI的ROC曲线下面积(AUC)分别为0.752(95%CI:0.703~0.801)、0.679(95%CI:0.627~0.732)和0.664(95%CI:0.611~0.718),L/P和H/P的AUC分别为0.808(95%CI:0.766~0.850)、0.795(95%CI:0.750~0.840)。PA的最佳截断值为8.56 mg/dL,预测SALI的敏感度为64.2%,特异度为73.8%。Lac在1.85 mmol/L或LDH在284.5 U/L时预测SALI的敏感度分别为79.2%和69.2%,预测SALI的特异度分别为50.0%和60.2%。L/P的最佳截断值为0.23,预测SALI的敏感度为78.0%,特异度为72.5%。H/P的最佳截断值为32.16,预测SALI的敏感度为76.7%,特异度为70.5%。L/P的AUC高于其他任何指标(P < 0.001),预测SALI的效能最佳(见图 1、表 4)。
|
| PA为前白蛋白,Lac为乳酸,LDH为乳酸脱氢酶,L/P为乳酸/前白蛋白比值,H/P为乳酸脱氢酶/前白蛋白比值 图 1 危险因素预测脓毒症相关性肝损伤的ROC曲线 Fig 1 ROC curves for risk factors predicting sepsis-associated liver injury |
|
|
| 变量 | 曲线下面积(95%CI) | 最佳截断值 | 敏感度(%) | 特异度(%) | P值 |
| PA | 0.752 (0.703~0.801) | 8.56 | 64.2 | 73.8 | < 0.001 |
| Lac | 0.679 (0.627~0.732) | 1.85 | 79.2 | 50.0 | < 0.001 |
| LDH | 0.664 (0.611~0.718) | 284.5 | 69.2 | 60.2 | < 0.001 |
| L/P | 0.808 (0.766~0.850) | 0.23 | 78.0 | 72.5 | < 0.001 |
| H/P | 0.795 (0.750~0.840) | 32.16 | 76.7 | 70.5 | < 0.001 |
根据L/P的最佳截断值,将403例脓毒症患者分为两组,结果显示L/P≥0.23组脓毒症患者肝损伤发生率显著高于L/P < 0.23组(64.92% vs. 16.51%),同时L/P≥0.23组脓毒症患者的APACHE Ⅱ评分、休克概率和住院死亡率均较L/P < 0.23组高,差异均有统计学意义(均P < 0.05),见表 5。
| 指标 | L/P≥0.23组(n=191) | L/P < 0.23组(n=212) | χ2/Z值 | P值 |
| 肝损伤a | 124 (64.92) | 35 (16.51) | 98.581 | < 0.001 |
| APACHE Ⅱ(分)b | 22.0 (18.0, 29.0) | 20.0 (15.25, 25.0) | -3.133 | 0.002 |
| 休克a | 145 (75.92) | 110 (51.89) | 24.967 | < 0.001 |
| 病死率a | 102 (53.40) | 47 (22.17) | 42.062 | < 0.001 |
| 注:APACHE Ⅱ为急性生理学与慢性健康状况评分;a为(例,%),b为M(Q1, Q3) | ||||
早期识别SALI对于及时处理脓毒症患者以防止其发展为多器官功能障碍至关重要,这在ICU中仍是一个挑战。一些报告指出,SALI的发生率为34.7%[9]。在本研究中,SALI发生率为39.45%,高于文献报道,这可能与诱发脓毒症的原发感染疾病、性别构成以及不同国家诊断标准的差异有关。肝损伤组患者的APACHE Ⅱ评分较无肝损伤组明显增高,表明肝损伤组患者病情更严重。另外,本研究发现,肝损伤的脓毒症患者死亡率高达54.71%,提示SALI与脓毒症的不良预后有关,这与以前的研究一致[4-6]。
脓毒症的特点是宿主对感染的反应失调导致严重的炎症和器官功能紊乱。脓毒症时外周血中升高的脂多糖可以激活肝脏中的单核吞噬细胞系统,从而产生大量的炎症因子(如TNF-α、IL-1和IL-6),随后诱导凝血、激肽和其他系统的激活,并上调内皮细胞中E-选择素和ICAM-1等粘附分子的表达,诱导中性粒细胞和淋巴细胞在肝内迁移,造成持续而广泛的肝损伤[11-12]。此外,严重的炎症反应可消耗大量凝血因子并损伤肝脏,导致肝脏的凝血因子合成功能障碍,凝血与炎症之间的相互作用被认为是脓毒症发病机制中的关键因素[13-15]。本研究中肝损伤组的感染指标CRP、PCT和凝血指标PT、INR、APTT均较无肝损伤组恶化的情况也支持这些观点。然而,在多变量Logistic回归分析中,只有前白蛋白、乳酸、LDH是SALI发生的早期独立危险因素。
前白蛋白是一种急性期反应性蛋白,主要存在于血液和脑脊液中,血浆中的前白蛋白仅由肝脏合成,半衰期短(1.9 d),使其成为影响其合成和分解的任何变化的敏感指标[16-17]。白蛋白也在肝脏中合成,所以当肝脏合成功能受损时,白蛋白会发生质和量的变化。尽管在临床实践中,白蛋白比前白蛋白更常用,但由于白蛋白的半衰期较长(17~21 d),而且临床上经常使用外源性白蛋白补充剂,导致白蛋白不能真正在早期阶段敏感地反映肝脏损害。Hutchinson等[18]评估了一名因为服用过量对乙酰氨基酚和右丙氧芬导致肝损伤的妇女,发现血浆中的天门冬氨酸氨基转移酶在3天后恢复到正常水平,AKP的活性增加缓慢,血清白蛋白浓度一直处于正常范围,PT虽然最初很高,但由于输注了血浆,几乎恢复到正常,而血清前白蛋白浓度在36 h后明显下降,并持续下降,显示了肝功能的衰退过程,直到患者在发病后15 d死亡。同样,Yasmin等[19]在评估急性肝病的肝功能障碍时,发现血清前白蛋白比白蛋白更敏感。本研究的多变量Logistic回归分析也表明,前白蛋白水平而不是白蛋白水平是SALI的早期高危因素。因此,与广泛使用的血清白蛋白水平相比,血清前白蛋白可能是评估肝功能的更好指标。
乳酸是体内葡萄糖无氧细胞代谢的副产品,也是器官灌注减少和末梢器官损伤的标志,可以用来检测灌注不足的重症患者和指导液体复苏治疗[20-21]。脓毒症患者体内存在不同程度的组织低灌注和氧合障碍,导致全身组织缺氧,无氧酵解增加,继而乳酸产生增多,甚至发生乳酸性酸中毒。Sterling等[22]对187名接受早期复苏治疗的脓毒症患者进行了一项多中心随机临床试验,结果显示肝功能障碍与较高的基线乳酸水平明显相关。本研究表明早期乳酸增高是SALI的独立高危因素,提示SALI患者早期就存在肝脏微循环障碍,肝组织缺血缺氧。另一方面,乳酸主要由肝脏(约60%)代谢,肝脏的乳酸清除率高于其他任何器官,肝功能受损时乳酸清除率下降,导致血清乳酸水平升高[23]。因此,早期监测血清乳酸水平,有助于及时了解脓毒症患者的肝功能状态。
然而,临床上对血清乳酸水平的解释往往比较复杂,除了肝功能不全,肾功能障碍导致的乳酸排出减少(约30%)以及糖酵解加速导致的乳酸产生增多也会引起血清乳酸水平增高[24-26]。此外,虽然前白蛋白被认为是肝脏合成功能受损的一个敏感指标,但前白蛋白会受到炎症、营养不良等因素的影响[27]。因此,脓毒症期间仅根据乳酸或前白蛋白水平预测肝损伤存在局限性,而L/P比值在综合了多种因素的基础上可能更准确的预测SALI。在本研究中,L/P比值预测肝损伤的AUC为0.808,高于乳酸的0.679和前白蛋白的0.752。亚组分析显示,L/P≥0.23组脓毒症患者肝损伤发生率显著高于L/P < 0.23组,同时APACHE Ⅱ评分、休克概率和住院死亡率也相应增高(均P < 0.05),表明L/P可作为SALI的早期预警生物标志物,并且能直接反映患者的预后。
LDH作为糖无氧酵解及糖异生的重要酶系之一,其可催化丙酸与乳酸之间的还原与氧化反应,也可催化相关的α-酮酸。已有文献报道LDH可以预测对乙酰氨基酚诱发的急性肝衰竭的不良后果,其性能与终末期肝病模型评分大致相当[28]。张锦鑫等[29]基于288例脓毒症患者开展的研究发现,LDH升高是脓毒症合并肝损伤的独立危险因素。本研究也表明,脓毒症期间血清高水平的LDH可预示肝损伤,可能原因在于被破坏的肝细胞释放LDH增多以及血清中LDH的清除率下降。但血清LDH水平可受到多种因素的影响,心肌梗死、恶性肿瘤、骨骼肌损伤等也可导致LDH升高[30-31]。尽管H/P预测SALI的效能(AUC:0.795)优于前白蛋白和乳酸,但低于L/P,无论灵敏度或特异度,L/P都较H/P更高。综合考虑下,L/P更适合预测SALI。
本研究存在局限性:首先,本研究纳入的脓毒症患者有些合并营养不良、糖尿病和肾脏损伤等疾病,这些疾病会影响血清前白蛋白、乳酸和LDH的水平;其次,本研究只记录了脓毒症患者入住ICU后的第一次检测数据,如果能记录后面更多次的检测数据以观察其动态变化对SALI的影响可能会得出更有意义的结论;此外,回顾性的研究设计限制了在其他环境下的推广。
本研究表明,L/P可作为SALI的早期独立危险因素。对于血清L/P≥0.23的脓毒症患者,临床医生应该警惕肝损伤的发生,在积极治疗脓毒症的同时早期采取干预措施包括护肝、避免肝毒性药物的使用以及改善肝脏微循环有助于改善患者的预后。
利益冲突 所有作者声明无利益冲突
作者贡献声明 陈文胜:研究构思、数据收集、论文撰写;杨巧云、俞建峰:数据统计分析;周杰、许峂嵘:数据审核、论文修改;刘文明:对论文整体质量进行控制与审校
| [1] | Andries O, De Filette M, De Smedt SC, et al. Innate immune response and programmed cell death following carrier-mediated delivery of unmodified mRNA to respiratory cells[J]. J Control Release, 2013, 167(2): 157-166. DOI:10.1016/j.jconrel.2013.01.033 |
| [2] | Yan J, Li S, Li S. The role of the liver in sepsis[J]. Int Rev Immunol, 2014, 33(6): 498-510. DOI:10.3109/08830185.2014.889129 |
| [3] | Kramer L, Jordan B, Druml W, et al. Incidence and prognosis of early hepatic dysfunction in critically ill patients--a prospective multicenter study[J]. Crit Care Med, 2007, 35(4): 1099-104. DOI:10.1097/01.CCM.0000259462.97164.A0 |
| [4] | Cheng B, Xie G, Yao S, et al. Epidemiology of severe sepsis in critically ill surgical patients in ten university hospitals in China[J]. Crit Care Med, 2007, 35(11): 2538-2546. DOI:10.1097/01.CCM.0000284492.30800.00 |
| [5] | Brun-Buisson C, Meshaka P, Pinton P, et al. EPISEPSIS: a reappraisal of the epidemiology and outcome of severe sepsis in French intensive care units[J]. Intensive Care Med, 2004, 30(4): 580-588. DOI:10.1007/s00134-003-2121-4 |
| [6] | Blanco J, Muriel-Bombín A, Sagredo V, et al. Incidence, organ dysfunction and mortality in severe sepsis: a Spanish multicentre study[J]. Crit Care, 2008, 12(6): R158. DOI:10.1186/cc7157 |
| [7] | 陈文胜, 刘文明. 脓毒症诱发肝损伤的发病机制研究进展[J]. 江苏大学学报(医学版), 2023, 33(2): 112-117. DOI:10.13312/J.issn.1671-7783.y220157 |
| [8] | 陈文胜, 刘文明. 肠道菌群在脓毒症相关性肝损伤发病与治疗中的作用研究进展[J]. 中国全科医学, 2024, 27(21): 2665-2671. DOI:10.12114/j.issn.1007-9572.2023.0069 |
| [9] | Kobashi H, Toshimori J, Yamamoto K. Sepsis-associated liver injury: incidence, classification and the clinical significance[J]. Hepatol Res, 2013, 43(3): 255-266. DOI:10.1111/j.1872-034X.2012.01069.x |
| [10] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-10. DOI:10.1001/jama.2016.0287 |
| [11] | Minter RM, Bi X, Ben-Josef G, et al. LPS-binding protein mediates LPS-induced liver injury and mortality in the setting of biliary obstruction[J]. Am J Physiol Gastrointest Liver Physiol, 2009, 296(1): G45-G54. DOI:10.1152/ajpgi.00041.2008 |
| [12] | Wang YY, Ryg U, Dahle MK, et al. Liver X receptor protects against liver injury in sepsis caused by rodent cecal ligation and puncture[J]. Surg Infect (Larchmt), 2011, 12(4): 283-289. DOI:10.1089/sur.2010.066 |
| [13] | Zhang Y, Khalid S, Jiang L. Diagnostic and predictive performance of biomarkers in patients with sepsis in an intensive care unit[J]. J Int Med Res, 2019, 47(1): 44-58. DOI:10.1177/0300060518793791 |
| [14] | Lendak D, Mihajlovic D, Mitic G, et al. Complement component consumption in sepsis correlates better with hemostatic system parameters than with inflammatory biomarkers[J]. Thromb Res, 201, 170: 126-132. DOI:10.1016/j.thromres.2018.08.013 |
| [15] | Li L, Chen L, Lin F, et al. Study of the Expression of Inflammatory Factors IL-4, IL-6, IL-10, and IL-17 in Liver Failure Complicated by Coagulation Dysfunction and Sepsis[J]. J Inflamm Res, 2021, 14: 1447-1453. DOI:10.2147/JIR.S302975 |
| [16] | Hou M, Sun S, Jiang Z. A new and selective and sensitive nanogold-labeled immunoresoance scattering spectral assay for trace prealbumin[J]. Talanta, 2007, 72(2): 463-467. DOI:10.1016/j.talanta.2006.11.016 |
| [17] | Li JD, Xu XF, Han J, et al. Preoperative prealbumin level as an independent predictor of long-term prognosis after liver resection for hepatocellular carcinoma: a multi-institutional study[J]. HPB (Oxford), 2019, 21(2): 157-166. DOI:10.1016/j.hpb.2018.06.1803 |
| [18] | Hutchinson DR, Smith MG, Parke DV. Prealbumin as an index of liver function after acute paracetamol poisoning[J]. Lancet, 1980, 2(8186): 121-123. DOI:10.1016/s0140-6736(80)90006-9 |
| [19] | Yasmin MY, Aziz B, Nazim M, et al. Prealbumin rather than albumin is a more sensitive indicator of acute liver disease[J]. Malays J Pathol, 1993, 15(2): 147-150. |
| [20] | Casserly B, Phillips GS, Schorr C, et al. Lactate measurements in sepsis-induced tissue hypoperfusion: results from the Surviving Sepsis Campaign database[J]. Crit Care Med, 2015, 43(3): 567-573. DOI:10.1097/CCM.0000000000000742 |
| [21] | Lee SM, An WS. New clinical criteria for septic shock: serum lactate level as new emerging vital sign[J]. J Thorac Dis, 2016, 8(7): 1388-1390. DOI:10.21037/jtd.2016.05.55 |
| [22] | Sterling SA, Puskarich MA, Jones AE. The effect of liver disease on lactate normalization in severe sepsis and septic shock: a cohort study[J]. Clin Exp Emerg Med, 2015, 2(4): 197-202. DOI:10.15441/ceem.15.025 |
| [23] | Levy B. Lactate and shock state: the metabolic view[J]. Curr Opin Crit Care, 2006, 12(4): 315-321. DOI:10.1097/01.ccx.0000235208.77450.15 |
| [24] | Shin TG, Jo IJ, Hwang SY, et al. Comprehensive Interpretation of Central Venous Oxygen Saturation and Blood Lactate Levels During Resuscitation of Patients With Severe Sepsis and Septic Shock in the Emergency Department[J]. Shock, 2016, 45(1): 4-9. DOI:10.1097/SHK.0000000000000466 |
| [25] | Park J, Hwang SY, Jo IJ, et al. Impact of Metformin Use on Lactate Kinetics in Patients with Severe Sepsis and Septic Shock[J]. Shock, 2017, 47(5): 582-587. DOI:10.1097/SHK.0000000000000782 |
| [26] | Haas SA, Lange T, Saugel B, et al. Severe hyperlactatemia, lactate clearance and mortality in unselected critically ill patients[J]. Intensive Care Med, 2016, 42(2): 202-210. DOI:10.1007/s00134-015-4127-0 |
| [27] | Lavrentieva A, Kontakiotis T, Bitzani M. Enteral nutrition intolerance in critically ill septic burn patients[J]. J Burn Care Res, 2014, 35(4): 313-8. DOI:10.1097/BCR.0b013e3182a22403 |
| [28] | Vazquez JH, Kennon-McGill S, Byrum SD, et al. Proteomics Indicates Lactate Dehydrogenase Is Prognostic in Acetaminophen-Induced Acute Liver Failure Patients and Reveals Altered Signaling Pathways[J]. Toxicol Sci, 2022, 187(1): 25-34. DOI:10.1093/toxsci/kfac015 |
| [29] | 张锦鑫, 沈括, 李俊杰, 等. 脓毒症相关性急性肝损伤的流行病学特点及致病因素分析[J]. 中华急诊医学杂志, 2022, 31(2): 203-209. DOI:10.3760/cma.j.issn.1671-0282.2022.02.012 |
| [30] | Van Wilpe S, Koornstra R, Den Brok M, et al. Lactate dehydrogenase: a marker of diminished antitumor immunity[J]. Oncoimmunology, 2020, 9(1): 1731942. DOI:10.1080/2162402X.2020.1731942 |
| [31] | Klein R, Nagy O, Tóthová C, et al. Clinical and diagnostic significance of lactate dehydrogenase and its isoenzymes in animals[J]. Vet Med Int, 2020: 5346483. DOI:10.1155/2020/5346483 |
| [32] | Altman DG, Machin D, Bryant TN, et al. Statistics withconfidence[M]. 2nd edn.London: BMJ Books, 2000. |
 2024, Vol. 33
2024, Vol. 33