雷暴哮喘(thunderstorm asthma, TA)最早是由Packe和Ayres首次报道[1],是指在雷雨天气期间或雷雨天气过后不久出现的哮喘症状突然发作或加重的现象[2],急诊多见。1983年7月6日至7日,在英国伯明翰地区发生了一次严重的雷暴天气,36 h内英国东伯明翰医院急诊科接诊了26例哮喘发作的患者,而既往同时期、同时段内该医院因哮喘发作就诊的患者平均仅为2~3例。此后,在全球范围内陆续有雷暴哮喘的相关报道[3]。迄今为止,最大规模的一场灾难性雷暴哮喘事件发生于2016年的澳大利亚墨尔本,该地区急救中心共接到2 954次电话呼叫,比历史同期平均多1 014次,超过3 000例患者因急性呼吸系统症状就诊于急诊科,其中476例哮喘患者收住入院,此次事件中疑似因雷暴哮喘致死病例10例[4]。雷暴哮喘发病机制尚不完全明确,目前认为可能与多种因素有关,包括气象条件的变化、空气中的过敏原浓度增加以及个体的易感性等。2022年9月8日18时及2022年9月19日6时,宁夏地区先后出现两次大范围雷暴天气,急诊因急性呼吸系统症状就诊的患者数量剧增。本研究通过回顾性分析雷暴哮喘患者的病历资料与雷暴天气相关数据,探讨雷暴哮喘的临床特征及与雷暴天气的相关性,旨在为雷暴哮喘的预防及诊疗提供参考信息。
1 资料与方法 1.1 一般资料 1.1.1 研究对象收集2022年9月8日及2022年9月19日宁夏地区两次雷暴天气发生前后因急性呼吸系统症状就诊于宁夏医科大学总医院急诊科患者的临床资料。根据雷暴发生时间 [5],将患者分为三组,其中雷暴发生前4 d为未发生组,第一次雷暴发生后的4 d为组1,第二次雷暴发生后的4 d为组2。
1.1.2 纳入标准① 因喘息、咳嗽、胸闷、气短、呼吸困难等呼吸系统症状就诊于宁夏医科大学总医院的急诊患者。②初步诊断为哮喘。
1.1.3 排除标准① 明确有其他疾病引起的呼吸系统症状患者,如急性肺栓塞、急性心肌梗死、胸部外伤等。②资料不完整的患者。
1.1.4 诊断标准哮喘的诊断符合《支气管哮喘防治指南(2020版)》中的诊断标准[6]。
1.2 资料收集方法 1.2.1 雷暴哮喘患者资料收集所有符合纳入和排除标准患者的性别、年龄、体温、心率、呼吸、平均动脉压、主诉、诊断、既往史(含过敏史)等相关临床资料。所有资料均为患者进入急诊时采集的数据。
1.2.2 气象资料收集2022年9月1日至2022年9月26日的天气状况,包括温度、湿度、相对湿度、风级、气压、降水量、空气质量指数(air quality index, AQI)、细颗粒物(fine particulate matter, PM2.5)、可吸入颗粒物(inhalable particulate matter, PM10)、二氧化硫(sulfur dioxide, SO2)、二氧化氮(nitrogen dioxide, NO2)、一氧化碳(carbon monoxide, CO)、臭氧(ozone, O3)等相关资料。
1.3 伦理学本研究符合医学伦理学标准,并通过宁夏医科大学总医院伦理委员会审查(审批号:KYLL-2023-0273),由于数据为匿名,因此免除知情同意。
1.4 统计学方法用Excel建立数据库,用R语言(Ver 4.2.2)统计分析并绘图。正态分布的计数资料采用均数±标准差表示,多组间比较采用方差分析,事后多重比较采用Bonferroni校正;非正态分布的计数资料采用中位数(四分位数)[M(Q1, Q3)]表示,多组间比较采用Kruskal Wallis检验,事后多重比较采用Nemenyi检验。计量资料以例(百分比)表示,组间比较采用卡方检验或Fisher确切概率法,事后多重比较采用Bonferroni校正。通过spearman相关分析分析气象数据与呼吸道症状和哮喘患者就诊人数间的相关性。以P < 0.05为差异有统计学意义。
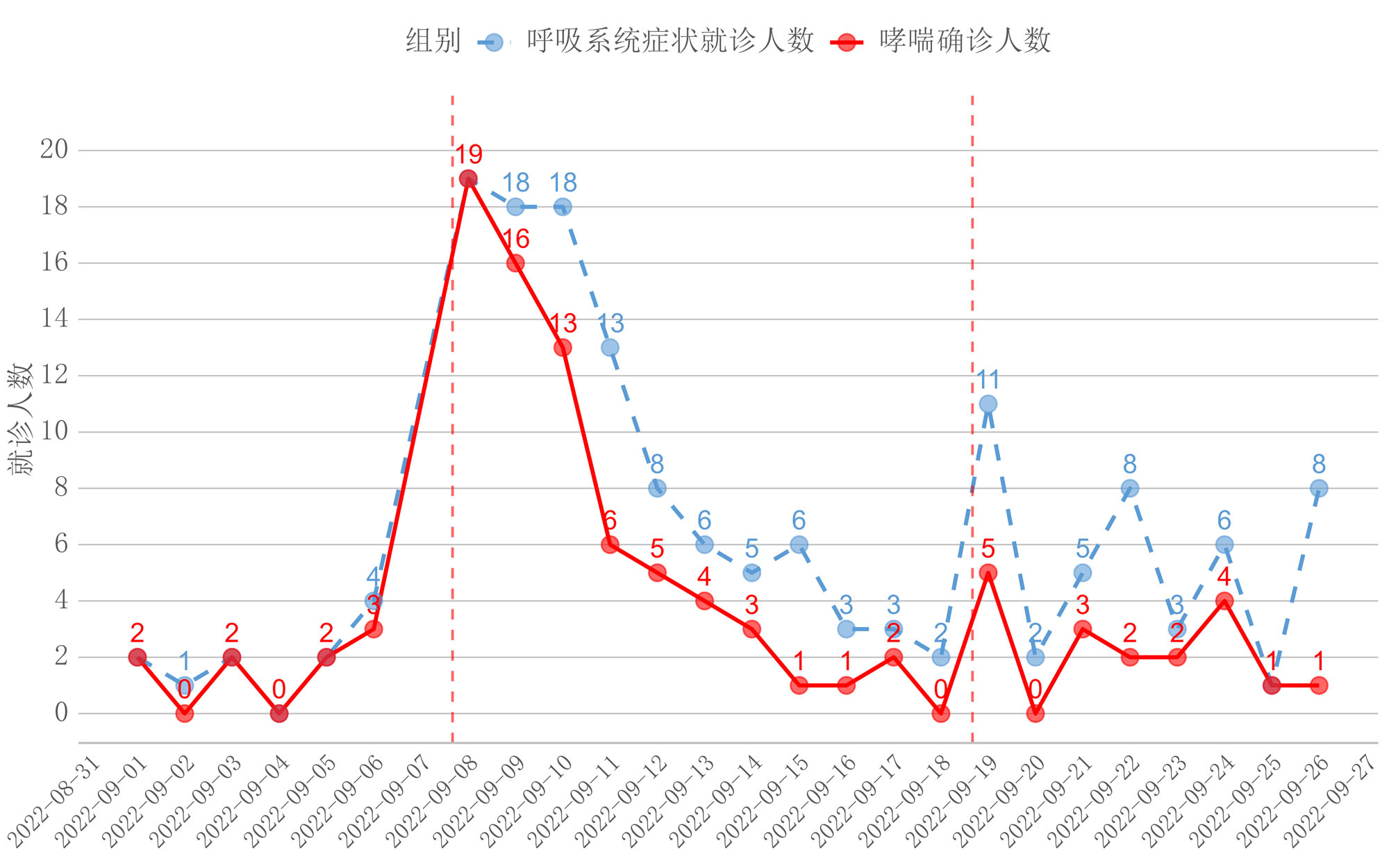
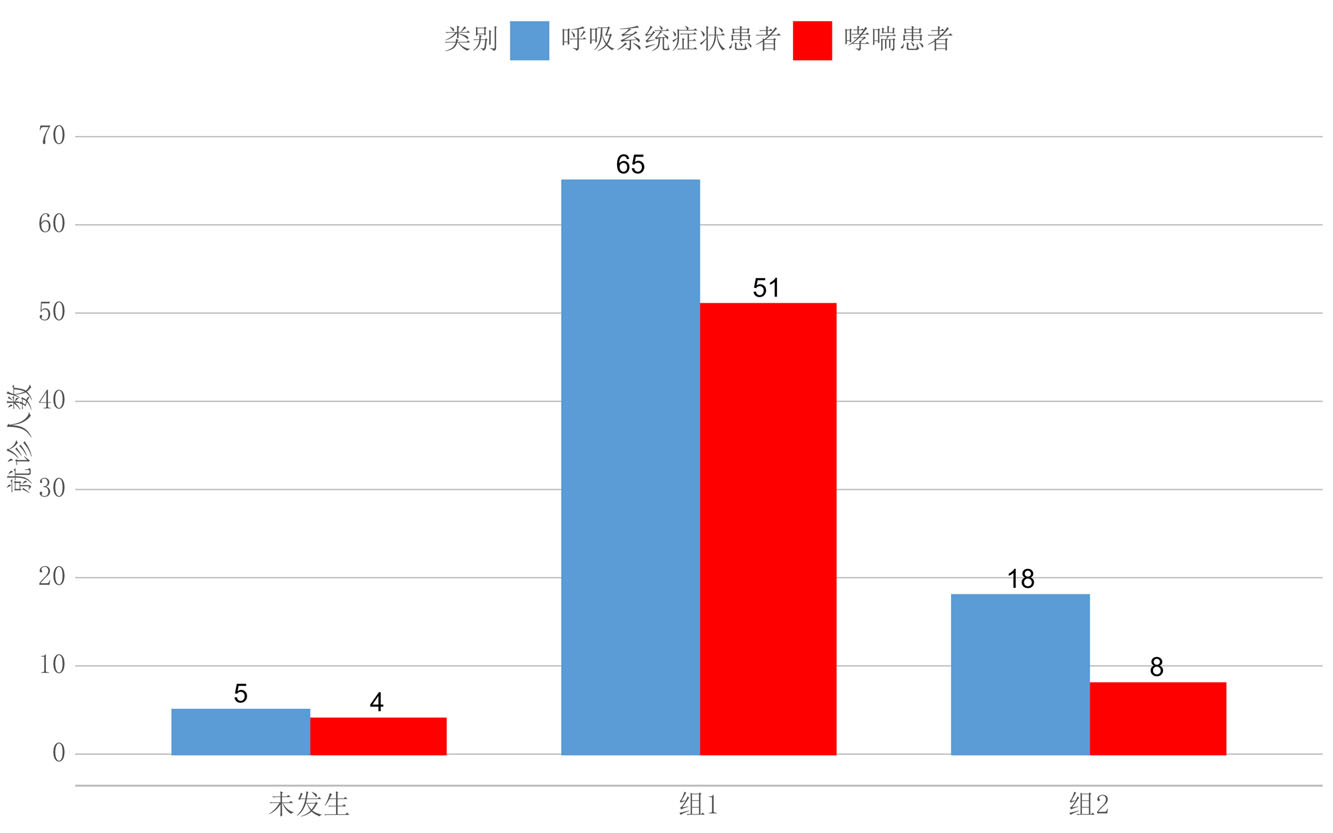
2 结果 2.1 不同时间段急性呼吸系统症状就诊患者情况2022年9月8日和2022年9月19日前后7 d时间共有156例因呼吸系统症状就诊于宁夏医科大学总医院的患者,其中最终明确诊断为哮喘的患者97例。雷暴发生后4 d内为呼吸系统症状患者就诊的高峰,第二次雷暴发生后以呼吸系统症状就诊的患者持续时间较长。而最终诊断为哮喘的患者则在雷暴发生后的3 d内,第二次雷暴发生后哮喘患者就诊的数量也存在平台期,持续时间约为5 d(图 1)。分别对雷暴发生前4 d(未发生)、第一次和第二次雷暴发生后的4 d(组1、组2)进行统计分析,结果发现雷暴未发生时以急性呼吸系统症状就诊的就患者共计有5例,明确诊断为哮喘的患者为4例;第一次雷暴发生后的4 d共计有65例因呼吸系统症状就诊的患者,明确诊断为哮喘的患者为51例;第二次雷暴发生后的4 d共计有18例因呼吸系统症状就诊的患者,而明确诊断为哮喘的患者仅为8例(图 2)。
|
| 图 1 不同时间段就诊患者趋势图 |
|
|
|
| 图 2 不同时间段患者就诊总数 |
|
|
雷暴出现前后,以呼吸系统症状就诊的患者在年龄上组2大于组1,两者差异具有统计学意义(P < 0.05),余组间差异并无统计学意义(P > 0.05),所有以呼吸系统症状就诊患者在性别、就诊时的体温、心率、呼吸、平均动脉压、血氧饱和度上的差异均无统计学意义(P > 0.05,见表 1)。最终诊断为哮喘的患者在雷暴发生前后其年龄、性别、体温、心率、呼吸、平均动脉压、血氧饱和度差异无论是在组内还是组间均差异无统计学意义(P > 0.05,见表 2)。
| 一般资料 | 未发生(n=5) | 组1(n=65) | 组2(n=18) | H/F值 | P值 |
| 年龄(岁)a | 39.00(38.00, 42.00) | 31.00(27.00, 44.00) | 43.00(34.25, 64.00) | 5.73 | 0.057 |
| 体温(℃)a | 36.55(36.50, 36.70) | 36.50(36.50, 36.70) | 36.50(36.50, 36.82) | 0.28 | 0.870 |
| 心率(次/min)a | 93.50(75.25, 113.00) | 96.00(85.00, 111.00) | 89.00(84.00, 98.25) | 3.29 | 0.193 |
| 呼吸(次/min)a | 21.00(20.75, 21.25) | 20.00(18.00, 20.00) | 20.00(19.00, 20.25) | 4.33 | 0.115 |
| 血氧饱和度(%)a | 96.50(95.75, 97.50) | 96.00(95.00, 98.00) | 97.00(92.25, 98.00) | 0.27 | 0.874 |
| 平均动脉压(mmHg)b | 96.75±2.46 | 97.46±13.51 | 91.77 ± 9.34 | 2.10 | 0.146 |
| 性别(n, %) | 0.062 | ||||
| 男 | 4(80.00) | 19(29.23) | 7(38.89) | ||
| 女 | 1(20.00) | 46(70.77) | 11(61.11) | ||
| 注:a为M(Q1, Q3),b为(x±s);与组1比较,aP < 0.05 | |||||
| 一般资料 | 未发生(n=4) | 组1(n=51) | 组2(n=8) | H/F值 | P值 |
| 年龄(岁)a | 38.50(32.25, 39.75) | 31.00(27.00, 39.50) | 40.50(34.75, 50.50) | 3.17 | 0.205 |
| 体温(℃)a | 36.55(36.50, 36.70) | 36.50(36.50, 36.60) | 36.50(36.50, 37.12) | 0.57 | 0.752 |
| 心率(次/min)a | 93.50(75.25, 113.00) | 95.00(84.00, 108.00) | 97.50(82.75, 101.00) | 0.70 | 0.705 |
| 呼吸(次/min)a | 21.00(20.75, 21.25) | 20.00(19.00, 20.00) | 19.50(19.00, 20.00) | 4.52 | 0.104 |
| 血氧饱和度(%)a | 96.50(95.75, 97.50) | 96.00(95.00, 98.00) | 96.50(93.75, 98.00) | 0.30 | 0.863 |
| 平均动脉压(mmHg)b | 95.83(95.25, 97.33) | 96.67(88.00, 108.67) | 97.00(90.92, 99.17) | 0.06 | 0.969 |
| 性别(n, %) | 0.192 | ||||
| 男 | 3(75.00) | 15(29.41) | 3(37.50) | ||
| 女 | 1(25.00) | 36(70.59) | 5(62.50) | ||
| 注:a为M(Q1, Q3),b为(x±s) | |||||
在以呼吸系统就诊的患者中,常见的主诉依次为气短(44.87%)、咳嗽(36.54%)、胸闷(26.92%)、喘息(25.00%)以及呼吸困难(7.05%)。在治疗用药方面,30.77%的患者未使用任何药物自行缓解,其余患者在使用一种或两种以上药物后缓解。所有患者经过治疗后均好转离院,无死亡病例。常见的药物依次是吸入性糖皮质激素(inhaled corticosteroid, ICS)、短效β2受体激动剂(short-acting beta-agonist, SABA)、静脉激素以及长效β2受体激动剂(long-acting beta-agonist,LABA)等,见表 3。在以呼吸系统症状就诊的患者中,过敏性鼻炎、支气管炎及糖尿病在三组内差异具有统计学意义(P < 0.01),其中组1和组2过敏性鼻炎患者的比例均低于未发生组,组间差异均具有统计学意义(P < 0.01);在哮喘确诊病例上,组2低于组1,二者差异具有统计学意义(P < 0.05);组1和组2支气管炎患者的比例低于未发生组,组间差异均具有统计学意义(P < 0.01);组2糖尿病患者的比例高于组1,组间差异具有统计学意义(P < 0.05)。各组间情况见表 4。最终诊断为哮喘的患者中,过敏性鼻炎及糖尿病在三组内差异具有统计学意义(P < 0.05),其中组1和组2过敏性鼻炎患者的比例均低于未发生组,组间差异均具有统计学意义(P < 0.05)。各组间情况见表 5。
| 临床资料 | 例数(%) |
| 主诉 | |
| 胸闷 | 42(26.92) |
| 气短 | 70(44.87) |
| 咳嗽 | 57(36.54) |
| 喘息 | 39(25.00) |
| 呼吸困难 | 11(7.05) |
| 其他 | 21(13.46) |
| 治疗用药 | |
| 自行缓解 | 48(30.77) |
| SABA | 48(30.77) |
| ICS | 82(52.56) |
| LABA | 12(7.69) |
| 静脉激素 | 21(15.38) |
| 注:SABA为短效β2受体激动剂,ICS为吸入性糖皮质激素,LABA为长效β2受体激动剂 | |
| 临床指征 | 未发生(n=5) | 组1(n=65) | 组2(n=18) | P值 |
| 过敏性鼻炎(n,%) | < 0.01 | |||
| 无 | 0(0.00) | 46(70.77) | 15(83.33) | |
| 有 | 5(100.00) | 19(29.23)a | 3(16.67)b | |
| 哮喘(n,%) | 0.017 | |||
| 无 | 1(20.00) | 14(21.54) | 10(55.56) | |
| 有 | 4(80.00) | 51(78.46) | 8(44.44)c | |
| 支气管炎(n,%) | < 0.01 | |||
| 无 | 2(40.00) | 61(93.85) | 18(100.00) | |
| 有 | 3(60.00) | 4(6.15)a | 0(0.00)b | |
| COPD(n,%) | 1.000 | |||
| 无 | 5(100.00) | 61(93.85) | 17(94.44) | |
| 有 | 0(0.00) | 4(6.15) | 1(5.56) | |
| 支气管扩(n,%) | 1.000 | |||
| 无 | 5(100.00) | 64(98.46) | 18(100.00) | |
| 有 | 0(0.00) | 1(1.54) | 0(0.00) | |
| 高血压(n,%) | 0.166 | |||
| 无 | 5(100.00) | 64(98.46) | 16(88.89) | |
| 有 | 0(0.00) | 1(1.54) | 2(11.11) | |
| 冠心病(n,%) | 0.457 | |||
| 无 | 5(100.00) | 64(98.46) | 17(94.44) | |
| 有 | 0(0.00) | 1(1.54) | 1(5.56) | |
| 糖尿病(n,%) | < 0.001 | |||
| 无 | 4(80.00) | 65(100.00) | 15(83.33) | |
| 有 | 1(20.00) | 0(0.00) | 3(16.67)c | |
| 药物过敏史(n,%) | 0.261 | |||
| 无 | 4(80.00) | 63(96.92) | 18(100.00) | |
| 有 | 1(20.00) | 2(3.08) | 0(0.00) | |
| 注:与未发生组比较aP < 0.01;与未发生组比较bP < 0.01;与组1比较cP < 0.05 | ||||
| 临床资料 | 未发生(n=4) | 组1(n=51) | 组2(n=8) | P值 |
| 过敏性鼻炎(n,%) | 0.012 | |||
| 无 | 0(0.00) | 33(64.71) | 7(87.50) | |
| 有 | 4(100.00) | 18(35.29)a | 1(12.50)b | |
| 哮喘(n,%) | 0.109 | |||
| 无 | 2(50.00) | 35(68.63) | 8(100.00) | |
| 有 | 2(50.00) | 16(31.37) | 0(0.00) | |
| 支气管炎(n,%) | 0.065 | |||
| 无 | 2(50.00) | 47(92.16) | 8(100.00) | |
| 有 | 2(50.00) | 4(7.84) | 0(0.00) | |
| COPD(n,%) | 1.000 | |||
| 无 | 4(100.00) | 49(96.08) | 8(100.00) | |
| 有 | 0(0.00) | 2(3.92) | 0(0.00) | |
| 支气管扩(n,%) | 1.000 | |||
| 无 | 4(100.00) | 50(98.04) | 8(100.00) | |
| 有 | 0(0.00) | 1(1.96) | 0(0.00) | |
| 高血压(n,%) | 0.347 | |||
| 无 | 4(100.00) | 50(98.04) | 7(87.50) | |
| 有 | 0(0.00) | 1(1.96) | 1(12.50) | |
| 冠心病(n,%) | 1.000 | |||
| 无 | 4(100.00) | 50(98.04) | 8(100.00) | |
| 有 | 0(0.00) | 1(1.96) | 0(0.00) | |
| 糖尿病(n,%) | 0.034 | |||
| 无 | 3(75.00) | 51(100.00) | 7(87.50) | |
| 有 | 1(25.00) | 0(0.00) | 1(12.50) | |
| 药物过敏史(n,%) | 0.138 | |||
| 无 | 3(75.00) | 50(98.04) | 8(100.00) | |
| 有 | 1(25.00) | 1(1.96) | 0(0.00) | |
| 注:与未发生组比较aP < 0.01;与未发生组比较bP < 0.01 | ||||
不同气象数据与呼吸系统症状和确诊哮喘患者就诊人数上未见明显相关趋势(附图 1~13)。相关性分析结果显示,大气压与呼吸系统和哮喘患者就诊人数均具有弱相(r值分别为0.31和0.34),余气象指标和呼吸系统症状就诊人数及哮喘患者就诊人数之间并未见明显相关性(表 6)。
| 气象数据 | 呼吸系统症状就诊患者人数 | 哮喘患者人数 |
| AQI | -0.14 | -0.29 |
| PM2.5 | -0.03 | -0.24 |
| PM10 | -0.17 | -0.32 |
| SO2 | -0.04 | -0.01 |
| NO2 | -0.16 | -0.14 |
| CO | -0.18 | -0.17 |
| O3 | 0.15 | 0.10 |
| 温度 | -0.02 | 0.03 |
| 湿度 | 0.10 | 0.02 |
| 风级 | 0.09 | 0.16 |
| 大气压 | 0.31 | 0.34 |
| 降水量 | 0.13 | 0.11 |
| 地面2 m处的相对湿度 | 0.10 | 0.00 |
| 注:AQI为空气质量指数,PM2.5为细颗粒物,PM10为可吸入颗粒物,SO2为二氧化硫,NO2为二氧化氮,CO为一氧化碳,O3为臭氧 | ||
在过去的30余年里,全球范围内关于雷暴哮喘爆发事件的报道逐年增加,主要集中于澳大利亚、英国,此外北美、沙特阿拉伯、伊朗、中国和意大利等国家也有类似报道[7]。雷暴哮喘的发生机制目前尚未完全明确,国内外大部分研究报道中认为花粉是引起雷暴哮喘大爆发的重要诱发因素[8],其中主要为草花粉,也有树木花粉[9]。几乎所有的雷暴哮喘均发生于花粉高峰季节,Marks等[10]发现春末及夏季时,医院哮喘患者就诊人数显著增加,伴随雷暴发生时,空气中的花粉粒密度也大量增多。目前主要被广泛接受的假说认为雷暴天气可以在短时间内使空气中花粉浓度迅速、显著增高,从而使花粉过敏症患者突然暴露于极高浓度的吸入性变应原中而导致哮喘的急性发作[11]。一般完整的花粉颗粒体积较大,吸入鼻腔后,由于鼻腔内纤毛的阻隔作用,使其不能到达下呼吸道引起哮喘反应,当雷暴发生时,干燥的上升气流会将植物上未脱落的花粉及悬浮在空气中的花粉卷入湿度更大的云层中,花粉颗粒因渗透压改变而吸水、溶胀、崩裂,从而释放出大量体积更小、可直接被吸入下呼吸道的花粉颗粒或碎片[12],接着由下沉的气流或雨滴带回地面,使过敏患者在短时间内暴露于高浓度的过敏原中而诱发哮喘[13]。Pulimood等[14]研究表明雷暴哮喘的发生与环境空气中的链格孢属有关,雷暴发生时,真菌孢子破裂成易吸入的致敏片段,从而引起气道高反应性,进而导致更严重的哮喘发作,死亡风险增加。雷暴天气伴随出现的温度降低、湿度增高、降雨以及其他气象变化如气压改变、空气粒子化等均可能引起气道高反应患者哮喘的加重[15]。目前尚不清楚雷暴哮喘是由哪种类型的雷暴所引起,同一地区、同一时间段也并不会每年都会发生大规模哮喘[16],因此,雷暴哮喘的发生可能与易感人群、空气过敏原、环境因素等多种因素综合作用相关。
2022年9月8日18时及2022年9月19日6时,宁夏地区大范围出现雷暴天气后,因急性呼吸系统症状就诊的患者与哮喘患者就诊人数明显增加,第一次雷暴哮喘确诊人数大于第二次雷暴哮喘确诊人数,而第二次雷暴发生时则以呼吸系统症状就诊的患者比例更高。这提示雷暴与呼吸系统疾病及哮喘的发作具有相关性,在特定条件下,雷暴天气可增加急性哮喘患者的发病率,并且哮喘的发生可能存在一定平台期。而若遭遇连续的雷暴天气,后续的雷暴天气所诱发的哮喘患者虽然也较平时明显增多,但相较于首次雷暴天气所诱发的雷暴哮喘,无论是在数量还是在持续时间上,似乎均有所减小。有研究表明[15],在雷暴哮喘期间,定期使用吸入性糖皮质激素可以有效地预防哮喘的发作。故而猜测此现象出现的原因可能与前后两次雷暴发生时间较近,部分已出现症状的患者提前治疗和预防有关。本研究中两次雷暴哮喘患者年龄中位数分别为31岁和36岁,提示中青年可能为雷暴哮喘的高发人群。国外相关研究显示雷暴哮喘的好发人群多在20~40岁[17],平均年龄为32岁,儿童患者比例为13%左右[18],且女性患者略多于男性[19],与本研究结果相似。与非雷暴天气相比,本研究中大部分患者为哮喘初次发作,仅有31.37%的患者既往确诊过支气管哮喘,35.29%的患者既往患有过敏性鼻炎。而第二次雷暴哮喘的患者既往均未确诊支气管哮喘,仅1例患有过敏鼻炎。而在雷暴天气时,急诊就诊的患者多为哮喘急性发作,既往多有哮喘病史。出现此现象的原因可能与雷暴天气时,过敏原种类的增加相关。与本研究相似的是在2016年墨尔本雷暴哮喘大爆发中,研究人员发现超过一半的雷暴哮喘患者未被诊断过支气管哮喘[20]。Rangamuwa等[21]结果发现60%~90%的雷暴哮喘患者患有过敏性鼻炎,且大多数为中度或重度过敏性鼻炎。而本研究人群中患有过敏性鼻炎的人群比例最高仅为35.29%,提示过敏性鼻炎虽为雷暴哮喘发生的高危因素,但尚存其他导致雷暴哮喘的因素存在。
本研究结果显示,雷暴天气相关气象与雷暴哮喘的发生并无明显的相关性,仅大气压与呼吸系统症状就诊患者及哮喘患者之间存在弱相关。国外相关研究结果显示[22],NO2与雷暴哮喘之间存在协同作用,CO2与温度可影响吸入性过敏原浓度[19],加大雷暴哮喘发生的风险。在雷暴形成过程中,O3可能会增加闪电的活动[23],导致地面带电的呼吸性生物气溶胶浓度更高,且O3还可导致肺功能的急性下降、气道损伤、炎症和全身氧化应激反应增加[24],SO2浓度升高与哮喘症状增多之间存在显著关联[25]。Erbas等[18]研究认为NO2和O3与雷暴哮喘患者的急诊就诊量无显著关系。Zou等[26]研究认为大气颗粒物(PM2.5、PM10)增加和温度升高可能是美国老年人发生雷暴哮喘的主要机制。
除本次雷暴哮喘外,在2019年9月11日宁夏地区也发生过一次雷暴哮喘[27],经对其中13例患者进行过敏原检测结果发现,其均对蒿草过敏,而宁夏地区蒿草种植范围较广,花期在7~9月,故而蒿草可能为宁夏地区雷暴哮喘发生的“罪魁祸首”,国外也有研究发现花草是雷暴哮喘的重要诱发因素[28]。然而不能解释的是在相同季节、相同时间、大风、沙尘等天气为何并未出现哮喘爆发流行。故而猜测,雷暴天气时,雷暴、温度、湿度、电离等综合气象特点,在一定条件下可能诱发过敏原种类及量的增加,进而诱导了雷暴哮喘的发生。
目前国外关于雷暴哮喘群体性事件报道相对较多,但国内较少。本研究通过对比雷暴天气与雷暴哮喘患者之间的相关性来探讨雷暴哮喘的发病机制,但也存在一些不足之处:①本研究样本量相对较小,可能还存在一些未测量及未调节的混杂因素;②本研究为回顾性研究,未能对雷暴发生时空气中的致敏原种类及浓度进行检测,也未对哮喘患者行过敏原检测。故而尚需更多前瞻性队列研究来进一步探讨雷暴天气与雷暴哮喘发生的相关性及雷暴哮喘的发病机制。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张瑶:研究设计、数据收集、统计分析、论文撰写;雷菁:数据收集;蒋珊珊:数据收集;罗清鹏:数据收集;汪伟:数据收集、数据清洗;马江艳:数据收集、数据清洗;蒋庆辉:数据核对;吴嘉荔:研究设计、论文批判性审查、论文修订
本文有附录,可登录中华急诊网 www.cem.org.cn查看
| [1] | Packe GE, Ayres JG. Asthma outbreak during a thunderstorm[J]. Lancet, 1985, 2(8448): 199-204. DOI:10.1016/s0140-6736(85)91510-7 |
| [2] | Davidson AC, Emberlin J, Cook AD, et al. A major outbreak of asthma associated with a thunderstorm: experience of accident and emergency departments and patients' characteristics. Thames Regions Accident and Emergency Trainees Association[J]. BMJ, 1996, 312(7031): 601-604. DOI:10.1136/bmj.312.7031.601 |
| [3] | D'Amato G, Annesi-Maesano I, Urrutia-Pereira M, et al. Thunderstorm allergy and asthma: state of the art[J]. Multidiscip Respir Med, 2021, 16(1): 806. DOI:10.4081/mrm.2021.806 |
| [4] | Andrew E, Nehme Z, Bernard S, et al. Stormy weather: a retrospective analysis of demand for emergency medical services during epidemic thunderstorm asthma[J]. BMJ, 2017, 359: j5636. DOI:10.1136/bmj.j5636 |
| [5] | Xu YY, Xue T, Li HR, et al. Retrospective analysis of epidemic thunderstorm asthma in children in Yulin, Northwest China[J]. Pediatr Res, 2021, 89(4): 958-961. DOI:10.1038/s41390-020-0980-9 |
| [6] | 中华医学会呼吸病学分会哮喘学组. 支气管哮喘防治指南(2020年版)[J]. 中华结核和呼吸杂志, 2020, 43(12): 1023-1048. DOI:10.3760/cma.j.cn112147-20200618-00721 |
| [7] | Venkatesan P. Epidemic thunderstorm asthma[J]. Lancet Respir Med, 2022, 10(4): 325-326. DOI:10.1016/S2213-2600(22)00083-2 |
| [8] | Suphioglu C. Thunderstorm asthma due to grass pollen[J]. Int Arch Allergy Immunol, 1998, 116(4): 253-260. DOI:10.1159/000023953 |
| [9] | Losappio L, Heffler E, Contento F, et al. Thunderstorm-related asthma epidemic owing to Olea Europaea pollen sensitization[J]. Allergy, 2011, 66(11): 1510-1511. DOI:10.1111/j.1398-9995.2011.02699.x |
| [10] | Marks GB, Colquhoun JR, Girgis ST, et al. Thunderstorm outflows preceding epidemics of asthma during spring and summer[J]. Thorax, 2001, 56(6): 468-471. DOI:10.1136/thorax.56.6.468 |
| [11] | D'Amato G, Annesi-Maesano I, Cecchi L, et al. Latest news on relationship between thunderstorms and respiratory allergy, severe asthma, and deaths for asthma[J]. Allergy, 2019, 74(1): 9-11. DOI:10.1111/all.13616 |
| [12] | 徐迎阳, 李丽莎, 关凯. 雷暴哮喘[J]. 中华临床免疫和变态反应杂志, 2020, 14(1): 67-70. DOI:10.3969/j.issn.1673-8705.2020.01.013 |
| [13] | Taylor PE, Jonsson H. Thunderstorm asthma[J]. Curr Allergy Asthma Rep, 2004, 4(5): 409-413. DOI:10.1007/s11882-004-0092-3 |
| [14] | Pulimood TB, Corden JM, Bryden C, et al. Epidemic asthma and the role of the fungal mold Alternaria alternata[J]. J Allergy Clin Immunol, 2007, 120(3): 610-617. DOI:10.1016/j.jaci.2007.04.045 |
| [15] | Girgis ST, Marks GB, Downs SH, et al. Thunderstorm-associated asthma in an inland town in south-eastern Australia. Who is at risk?[J]. Eur Respir J, 2000, 16(1): 3-8. DOI:10.1034/j.1399-3003.2000.16a02.x |
| [16] | Idani E, Dastoorpoor M, Goudarzi G, et al. Three consecutive episodes of thunderstorm asthma in Ahvaz, Iran: the possible role of Conocarpus pollen[J]. Tanaffos, 2021, 20(3): 261-267. |
| [17] | Forouzan A, Masoumi K, Haddadzadeh Shoushtari M, et al. An overview of thunderstorm-associated asthma outbreak in southwest of Iran[J]. J Environ Public Health, 2014, 2014: 504017. DOI:10.1155/2014/504017 |
| [18] | Erbas B, Akram M, Dharmage SC, et al. The role of seasonal grass pollen on childhood asthma emergency department presentations[J]. Clin Exp Allergy, 2012, 42(5): 799-805. DOI:10.1111/j.1365-2222.2012.03995.x |
| [19] | Thien F, Beggs PJ, Csutoros D, et al. The Melbourne epidemic thunderstorm asthma event 2016: an investigation of environmental triggers, effect on health services, and patient risk factors[J]. Lancet Planet Health, 2018, 2(6): e255-e263. DOI:10.1016/S2542-5196(18)30120-7 |
| [20] | Bellomo R, Gigliotti P, Treloar A, et al. Two consecutive thunderstorm associated epidemics of asthma in the city of Melbourne. The possible role of rye grass pollen[J]. Med J Aust, 1992, 156(12): 834-837. DOI:10.5694/j.1326-5377.1992.tb136994.x |
| [21] | Rangamuwa KB, Young AC, Thien F. An epidemic of thunderstorm asthma in Melbourne 2016: asthma, rhinitis, and other previous allergies[J]. Asia Pac Allergy, 2017, 7(4): 193-198. DOI:10.5415/apallergy.2017.7.4.193 |
| [22] | Wardman AE, Stefani D, MacDonald JC. Thunderstorm-associated asthma or shortness of breath epidemic: a Canadian case report[J]. Can Respir J, 2002, 9(4): 267-270. DOI:10.1155/2002/728257 |
| [23] | Park JH, Lee E, Fechter-Leggett ED, et al. Associations of emergency department visits for asthma with precipitation and temperature on thunderstorm days: a time-series analysis of data from Louisiana, USA, 2010-2012[J]. Environ Health Perspect, 2022, 130(8): 87003. DOI:10.1289/EHP10440 |
| [24] | D'Amato G, Chong-Neto HJ, Monge Ortega OP, et al. The effects of climate change on respiratory allergy and asthma induced by pollen and mold allergens[J]. Allergy, 2020, 75(9): 2219-2228. DOI:10.1111/all.14476 |
| [25] | Dabrera G, Murray V, Emberlin J, et al. Thunderstorm asthma: an overview of the evidence base and implications for public health advice[J]. QJM, 2013, 106(3): 207-217. DOI:10.1093/qjmed/hcs234 |
| [26] | Zou E, Worsham C, Miller NH, et al. Emergency visits for thunderstorm-related respiratory illnesses among older adults[J]. JAMA Intern Med, 2020, 180(9): 1248-1250. DOI:10.1001/jamainternmed.2020.1672 |
| [27] | 孙伟, 龚瑞, 高洁, 等. 宁夏过敏性哮喘暴发事件调查分析[J]. 职业卫生与应急救援, 2021, 39(6): 693-695. DOI:10.16369/j.oher.issn.1007-1326.2021.06.019 |
| [28] | Smith ML, MacLehose RF, Chandler JW, et al. Thunderstorms, pollen, and severe asthma in a Midwestern, USA, urban environment, 2007-2018[J]. Epidemiology, 2022, 33(5): 624-632. DOI:10.1097/EDE.0000000000001506 |
 2024, Vol. 33
2024, Vol. 33