脑缺血再灌注损伤(cerebral ischemia-reperfusion injury, CIRI)是脑卒中、心脏骤停等急诊常见高危疾病的主要病理生理过程,其神经功能损害严重,发病机制复杂。CIRI涉及自由基生成、氧化应激、细胞内钙稳态失衡、能量代谢障碍等诸多过程,最终导致神经元损伤坏死。线粒体是一种高度动态的双层膜细胞器,生理状态下通过持续的裂变及融合改变自身形态及功能,维持正常线粒体网络和机体能量平衡。CIRI后线粒体裂变与融合的平衡被打破,即发生线粒体动力学失衡,线粒体功能发生障碍,加重脑组织损伤。本研究将基于线粒体动力学失衡综述CIRI神经损伤的机制,以期为CIRI后神经功能障碍治疗提供新的策略。
1 线粒体动力学线粒体是一种高度动态的双层膜细胞器,线粒体动力学是指通过持续的裂变及融合改变自身形态及功能,维持正常线粒体网络,以满足细胞能量代谢需求[1]。线粒体裂变是指完整的线粒体分裂为两个或者更多的过程,而线粒体融合是两个独立存在的线粒体由内膜和外膜密切接触而合并为一个细胞器的过程[2]。动力蛋白家族是线粒体裂变和融合中的主要蛋白质,其中动力相关蛋白1(Dynamin-related protein 1, DRP1)、线粒体分裂蛋白1(Mitochondrial fission protein 1, FIS1)、线粒体分裂因子(Mitochondrial fission factor, MFF)、线粒体动力学蛋白49 kDa和51 kDa(mitochondrial dynamics proteins of 49 kDa and 51 kDa, MiD49/51)主要介导线粒体的裂变,而线粒体融合蛋白1(mitofusin-1, MFN1)和线粒体融合蛋白2(mitofusin-2, MFN2)和视神经萎缩1蛋白(opticatrophy type1, OPA1)主要介导线粒体的融合[3]。
1.1 线粒体裂变线粒体裂变是将完整的线粒体分裂为两个或者更多的过程,在线粒体裂变时,相关蛋白FIS1、MFF以及MID49/51在线粒体膜上充当DRP1的受体,为裂变发挥作用,并且存在于线粒体外膜[4],DRP1是裂变过程中的关键调节蛋白,它由四个不同的结构域组成:GTP结合域、中间结构域、插入物B以及GTPase效应器[5],受到刺激后,DRP1被募集到线粒体,并通过与位于线粒体外膜的受体FIS1、MFF和MID49/51相互作用促进裂变,使DRP1形成环状低聚物,收缩和分裂线粒体,这一过程伴随着GTP水解[6]。
1.2 线粒体融合线粒体融合是两个独立存在的线粒体由内膜和外膜密切接触而合并为一个细胞器的过程。线粒体融合主要由Mfn1和Mfn2和OPA1介导,其中,线粒体内膜的融合由OPA1介导,外膜由MFN1和MFN2介导,融合过程中由OPA1的蛋白水解酶作用调节[7-8]。线粒体融合时,MFN位于线粒体外膜上,当两个相邻线粒体的GTP酶结构发生构象变化时,使得其相齐聚,让两个线粒体有了彼此的栓系,为下一步融合作了铺垫[9-10]。线粒体OPA1的融合机制目前并不十分明确,当线粒体外膜借助MFN合二为一之后,其内膜的OPA1也在与线粒体内膜上特定的脂质相互作用,介导两个线粒体的内膜融合[11-12]。但是近年来有学者提出了新的融合机制,MFN1和MFN2都具有单个跨膜结构域,MFN由GTP酶结构域、跨膜结构域和螺旋重复1(HR1)结构域组成,而GTP酶结构域又称螺旋重复2(HR2)结构域,其内部有两个氨酸残基可以被谷胱甘肽氧化,使得两个MFN分子之间形成二硫键,从而让线粒体外膜互相融合[13]。Patten等[14]利用高效液相色谱定量谷胱甘肽,也发现了缺乏OPA1的细胞更有利于谷胱甘肽的合成。同样,Smith等[15]通过测试果蝇的谷胱甘肽转移酶量的增多来促进线粒体融合从而证明谷胱甘肽是线粒体融合的关键体内调节因子。以上证据表明,线粒体融合时谷胱甘肽与MFN中的氨酸残基发生氧化反应,促进融合。
MFN1和MFN2都存在于线粒体外膜上,但MFN2也存在于内质网膜上,故而MFN1和MFN2都支持线粒体融合,而MFN2也在为内质网和线粒体提供联系[16-17]。
2 脑缺血再灌注损伤CIRI是指由于缺血脑组织梗死区域的血管重新恢复血液循环所继发的脑细胞损伤[18]。脑缺血再灌注可以分为两个基本过程,即首先的大脑供血受限,继而血供恢复灌注后脑组织遭受的二次伤害。其机制可能是缺血缺氧时组织细胞不能进行有氧糖酵解和缺乏营养,导致ATP耗尽以及酸性代谢物产生,pH值降低;血流及氧气的恢复,使大量的Na2+和Ca2+涌入细胞,细胞膜通透性改变,细胞发生钙超载刺激活性氧(reactive oxygen species, ROS)的生成,这些过程互为因果,又相互联系形成恶性循环,最终导致神经元水肿、损伤、坏死和缺失[19],严重影响脑卒中、心肺复苏等患者的神经功能预后。
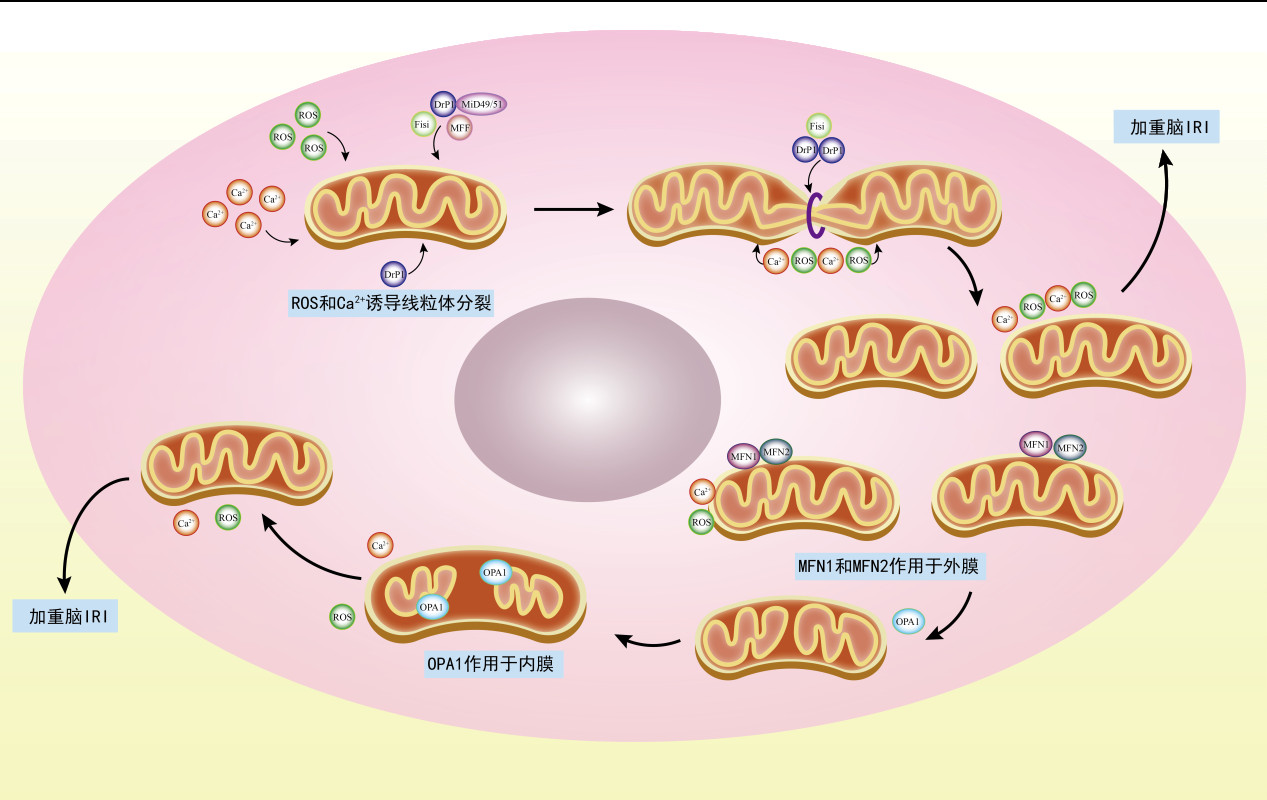
3 线粒体动力学参与CIRI的作用CIRI时线粒体裂变与融合平衡被打破,线粒体动力学失衡,线粒体功能发生障碍,导致脑组织损伤;研究发现线粒体动力学失衡参与CIRI时的氧化应激、钙超载、线粒体通透性转换孔开放以及线粒体自噬等多种病理生理过程,具体如下。
3.1 线粒体裂变与CIRIDRP1是线粒体裂变的关键蛋白,其活性受到多种激酶介导的磷酸化严格的调节[20],在线粒体动力学中发挥重要作用。在参与氧化应激方面,Liu等[21]认为,预防线粒体裂变可以减少氧化应激产生的ROS,可治疗CIRI。有研究指出,CIRI引起氧化应激,并使DRP1发生磷酸化诱导线粒体裂变,加重脑损伤[22]。Midivi-1是一种线粒体裂变相关蛋白1(Drp1)的选择性抑制剂,通过选择性的抑制线粒体裂变动力学来抑制线粒体裂变[23],Wang等[24]证明了在缺血缺氧损伤中使用mdivi-1,可通过抑制线粒体分裂,来降低ROS的生成,从而使大脑避免了缺血再灌注损伤。因此,线粒体裂变的减弱对脑缺血再灌注后损伤后的脑组织有保护作用,并且此作用是可能通过降低ROS来完成。
钙超载后将激活DRP1的表达,但是,线粒体裂变是如何诱导CIRI后神经元的不可逆损伤尚不明了。有研究指出,促使细胞中的Ca2+进入线粒体,将导致线粒体钙超载,接着钙超载激活DRP1,导致海马神经细胞线粒体动力学紊乱,打破线粒体质量控制,引起脑细胞功能障碍[25]。Wang等[26]研究发现,可能通过抑制钙超载可以抑制线粒体裂变途径,从而保护大脑神经元。脑缺血再灌注损伤后的线粒体动力学与钙超载有密不可分的联系,二者互相影响,当减少钙超载时,线粒体动力学的平衡可以得到维持,有利于脑细胞的功能恢复。
在CIRI时,线粒体氧化应激导致ROS的爆发以及钙超载还促进了线粒体通透性转换孔(Mitochondrial permeability transition pore, MPTP)的开放,使线粒体通透性增加,诱导脑细胞死亡。Duan等[27]发现在缺氧后Drp1可能会通过Bcl-2相关X蛋白(BAX)和磷酸盐载体蛋白(PiC)来识别并促进粒体通透性过渡孔的过度打开,从而加剧线粒体及细胞的功能障碍。相反,Filichia等[28]使用DRP1抑制剂后也发现,抑制剂通过减少MPTP的开放,抑制了线粒体的裂变,保护了神经功能。可见,缺血再灌注时将通过线粒体膜通透性孔开放来诱导裂变,促使所有脑组织损伤。
CIRI时,大量的ROS生成引发线粒体去极化,从而启动了线粒体自噬。研究发现,Drp1抑制剂可能通过诱导线粒体自噬的积累以及激活线粒体自噬,从而减轻血脑屏障破坏及脑细胞的死亡[29]。研究认为,丰富的环境刺激可以促进Drp1的招募,进一步诱导线粒体自噬,消除功能障碍的线粒体,保障线粒体质量,改善神经元的损伤[30]。上述研究提示,在CIRI后,线粒体的自噬功能是有益的,将会改善脑神经预后。然而相反,另有研究认为线粒体自噬在缺血再灌注损伤时将会加重疾病进程。Zeng等[31]认为CIRI条件下将会使Drp1活化,加速P62诱导的自噬体形成,并通过使未降解的自噬体在细胞外分泌,产生炎症反应,进一步加重线粒体功能障碍,导致ROS生成过多和自噬体降解受阻,引发恶性循环。另外,AlI等[32]认为CIRI时,抑制Drp-1介导的线粒体裂变可以减少线粒体自噬,由此可改善线粒体功能障碍。Zhang等[33]通过使Drp1易位到线粒体的过程中断,以便减弱线粒体自噬功能,从而保护CIRI。综上,线粒体裂变参与CIRI后线粒体自噬的过程,但加重还是减轻CIRI后脑损伤尚有争议,需进一步研究明确。
3.2 线粒体融合与CIRI线粒体的融合由MFN1、MFN2以及OPA1介导,在CIRI时,MFN1和MFN2的表达量下降,线粒体的融合中断[34],导致线粒体过度分裂,从而线粒体功能障碍,加重脑细胞死亡。Li等[35]提出OPA1切割后将加重神经元线粒体裂变和损伤,并上调神经元缺血再灌注损伤。通过恢复L-OPA1的功能,可抑制神经元损伤和保留线粒体功能[36]。另外,Chen等[37]发现,抑制线粒体氧化应激对CIRI起着至关重要的作用,并提出这种作用是通过Nrf2/HO-1信号通路的激活有关。增强OPA1的表达,降低ROS的生成,将促进线粒体融合,为缺血再灌注损伤提供重要保护作用。
|
| 图 1 线粒体动力学与CIRI |
|
|
关于融合与钙超载,Guan等[38]发现,在缺血再灌注期间,线粒体钙单转运体通过上调诱导钙蛋白酶激活,以此下调OPA1,进而导致线粒体动力学发生失衡。当钙超载时,过多的Ca2+通过使MFN异位表达来阻碍两线粒体外膜的栓系形成,抑制了线粒体融合,加重了CIRI[39]。Kulkarni等[40]提出脑损伤使Mfn2发生高DNA甲基化,将降低Mfn2表达,引发线粒体功能障碍。Vevea等[41]发现通过敲低Mfn2使得钙离子的稳态失调,降低了线粒体融合的效率,诱导神经元损伤。综上所述,推测可通过增强线粒体融合减轻CIRI。
在线粒体融合中,OPA1表达增加,阻止了线粒体通透性转换孔过度开放,下调了钙离子的内流,缓解了脑缺血再灌注损伤[42]。Whelan等[43]认为通过抑制裂变来驱动线粒体融合,可以降低MPTP开放,恢复组织细胞功能。Zhao等[44]发现使Mfn2的表达量上调,将使受损的线粒体动力学恢复,可以防止因MPTP大量开放的神经元损伤。以上说明,线粒体融合将通过控制线粒体通透性转换孔的开放程度来保护脑细胞。
如前文所述,线粒体自噬存在有益与有害之争,但大多数学者均认为自噬途径通过PINK1/Parkin、FUNDC1、Bcl-2/腺病毒E1B19000相互作用蛋白3和BNIP3样蛋白途径[45]来完成。在线粒体融合与自噬方面,近来学者也有了一些发现,例如,通过增加Mfn2在CIRI中的蛋白水平,可增加线粒体融合和减少线粒体自噬的发生来改善脑细胞损伤,相反,减少Mfn2的水平,可减少线粒体融合和增加线粒体自噬而加重CIRI[46],并提出这种自噬通过PINK1/Parkin途径来完成。此外,Mfn2的表达也可以通过BNIP3样蛋白通路,调节线粒体融合,诱导神经保护作用[47]。可见,通过线粒体融合功能可抑制线粒体自噬,进而保护脑功能,尽管存在争议,至少可以说明改善脑细胞功能可通过线粒体融合减少线粒体自噬来完成。
4 结论与展望CIRI的发生给患者及家属带来生理及心理有形及无形的创伤,也给国家和临床医生带来了巨大的压力,对于CIRI的预防及治疗应该被广泛重视。线粒体动力学是线粒体质量控制的关键环节,线粒体动力学的平衡在CIRI中发挥重要作用。因此,明确线粒体动力失衡参与CIRI的具体机制,有望为CIRI的治疗提供新的干预靶点。
利益冲突 所有作者声明无利益冲突
| [1] | Ni HM, Williams JA, Ding WX. Mitochondrial dynamics and mitochondrial quality control[J]. Redox Biol, 2015, 4: 6-13. DOI:10.1016/j.redox.2014.11.006 |
| [2] | Giacomello M, Pyakurel A, Glytsou C, et al. The cell biology of mitochondrial membrane dynamics[J]. Nat Rev Mol Cell Biol, 2020(4): 204-224. DOI:10.1038/s41580-020-0210-7 |
| [3] | Wolf C, López Del Amo V, Arndt S, et al. Redox modifications of proteins of the mitochondrial fusion and fission machinery[J]. Cells, 2020, 9(4): 815. DOI:10.3390/cells9040815 |
| [4] | Qin LY, Xi SH. The role of mitochondrial fission proteins in mitochondrial dynamics in kidney disease[J]. Int J Mol Sci, 2022, 23(23): 14725. DOI:10.3390/ijms232314725 |
| [5] | Wenger JL, Klinglmayr E, Fröhlich C, et al. Functional mapping of human dynamin-1-like GTPase domain based on X-ray structure analyses[J]. PLoS One, 2013, 8(8): e71835. DOI:10.1371/journal.pone.0071835 |
| [6] | Osellame LD, Singh AP, Stroud DA, et al. Cooperative and independent roles of the Drp1 adaptors Mff, MiD49 and MiD51 in mitochondrial fission[J]. J Cell Sci, 2016, 129(11): 2170-2181. DOI:10.1242/jcs.185165 |
| [7] | Cho DH, Nakamura T, Lipton SA. Mitochondrial dynamics in cell death and neurodegeneration[J]. Cell Mol Life Sci, 2010, 67(20): 3435-3447. DOI:10.1007/s00018-010-0435-2 |
| [8] | Chandhok G, Lazarou M, Neumann B. Structure, function, and regulation of mitofusin-2 in health and disease[J]. Biol Rev Camb Philos Soc, 2018, 93(2): 933-949. DOI:10.1111/brv.12378 |
| [9] | Qi YB, Yan LM, Yu CT, et al. Structures of human mitofusin 1 provide insight into mitochondrial tethering[J]. J Cell Biol, 2016, 215(5): 621-629. DOI:10.1083/jcb.201609019 |
| [10] | Cao YL, Meng SX, Chen Y, et al. MFN1 structures reveal nucleotide-triggered dimerization critical for mitochondrial fusion[J]. Nature, 2017, 542: 372-376. DOI:10.1038/nature21077 |
| [11] | Ban T, Kohno H, Ishihara T, et al. Relationship between OPA1 and cardiolipin in mitochondrial inner-membrane fusion[J]. Biochim Biophys Acta Bioenerg, 2018, 1859(9): 951-957. DOI:10.1016/j.bbabio.2018.05.016 |
| [12] | Ge YF, Boopathy S, Nguyen TH, et al. Absence of cardiolipin from the outer leaflet of a mitochondrial inner membrane mimic restricts Opa1-mediated fusion[J]. Front Mol Biosci, 2021, 8: 769135. DOI:10.3389/fmolb.2021.769135 |
| [13] | Mattie S, Riemer J, Wideman JG, et al. A new mitofusin topology places the redox-regulated C terminus in the mitochondrial intermembrane space[J]. J Cell Biol, 2018, 217(2): 507-515. DOI:10.1083/jcb.201611194 |
| [14] | Patten DA, McGuirk S, Anilkumar U, et al. Altered mitochondrial fusion drives defensive glutathione synthesis in cells able to switch to glycolytic ATP production[J]. Biochim Biophys Acta Mol Cell Res, 2021, 1868(1): 118854. DOI:10.1016/j.bbamcr.2020.118854 |
| [15] | Smith GA, Lin TH, Sheehan AE, et al. Glutathione S-transferase regulates mitochondrial populations in axons through increased glutathione oxidation[J]. Neuron, 2019, 103(1): 52-65.e6. DOI:10.1016/j.neuron.2019.04.017 |
| [16] | de Meis L, Ketzer LA, da Costa RM, et al. Fusion of the endoplasmic reticulum and mitochondrial outer membrane in rats brown adipose tissue: activation of thermogenesis by Ca2+[J]. PLoS One, 2010, 5(3): e9439. DOI:10.1371/journal.pone.0009439 |
| [17] | Muñoz JP, Ivanova S, Sánchez-Wandelmer J, et al. Mfn2 modulates the UPR and mitochondrial function via repression of PERK[J]. EMBO J, 2013, 32(17): 2348-2361. DOI:10.1038/emboj.2013.168 |
| [18] | Jurcau A, Simion A. Neuroinflammation in cerebral ischemia and ischemia/reperfusion injuries: from pathophysiology to therapeutic strategies[J]. Int J Mol Sci, 2021, 23(1): 14. DOI:10.3390/ijms23010014 |
| [19] | Wu MY, Yiang GT, Liao WT, et al. Current mechanistic concepts in ischemia and reperfusion injury[J]. Cell Physiol Biochem, 2018, 46(4): 1650-1667. DOI:10.1159/000489241 |
| [20] | Vyas S, Zaganjor E, Haigis MC. Mitochondria and cancer[J]. Cell, 2016, 166(3): 555-566. DOI:10.1016/j.cell.2016.07.002 |
| [21] | Liu JF, Su G, Chen LX, et al. Irisin attenuates apoptosis following ischemia-reperfusion injury through improved mitochondria dynamics and ROS suppression mediated through the PI3K/akt/mTOR axis[J]. Mol Neurobiol, 2023, 60(8): 4261-4272. DOI:10.1007/s12035-023-03336-5 |
| [22] | Sun W, Li XY, Chu ZH, et al. Euxanthone improves cognitive impairment by attenuating mitochondrial fragmentation and suppressing oxidative stress[J]. Cent Eur J Immunol, 2021, 46(4): 446-455. DOI:10.5114/ceji.2021.111444 |
| [23] | Cassidy-Stone A, Chipuk JE, Ingerman E, et al. Chemical inhibition of the mitochondrial division dynamin reveals its role in Bax/Bak-dependent mitochondrial outer membrane permeabilization[J]. Dev Cell, 2008, 14(2): 193-204. DOI:10.1016/j.devcel.2007.11.019 |
| [24] | Wang JY, Wang P, Li SH, et al. Mdivi-1 prevents apoptosis induced by ischemia-reperfusion injury in primary hippocampal cells via inhibition of reactive oxygen species-activated mitochondrial pathway[J]. J Stroke Cerebrovasc Dis, 2014, 23(6): 1491-1499. DOI:10.1016/j.jstrokecerebrovasdis.2013.12.021 |
| [25] | Yu M, Yang JH, Gao X, et al. Lanthanum chloride impairs spatial learning and memory by inducing[Ca2+]m overload, mitochondrial fission–fusion disorder and excessive mitophagy in hippocampal nerve cells of rats[J]. Metallomics, 2020, 12(4): 592-606. DOI:10.1039/c9mt00291j |
| [26] | Wang HB, Zheng SF, Liu MD, et al. The effect of propofol on mitochondrial fission during oxygen-glucose deprivation and reperfusion injury in rat hippocampal neurons[J]. PLoS One, 2016, 11(10): e0165052. DOI:10.1371/journal.pone.0165052 |
| [27] | Duan CY, Kuang L, Hong C, et al. Mitochondrial Drp1 recognizes and induces excessive mPTP opening after hypoxia through BAX-PiC and LRRK2-HK2[J]. Cell Death Dis, 2021, 12: 1050. DOI:10.1038/s41419-021-04343-x |
| [28] | Filichia E, Hoffer B, Qi X, et al. Inhibition of Drp1 mitochondrial translocation provides neural protection in dopaminergic system in a Parkinson's disease model induced by MPTP[J]. Sci Rep, 2016, 6: 32656. DOI:10.1038/srep32656 |
| [29] | Wu Q, Gao C, Wang HC, et al. Mdivi-1 alleviates blood-brain barrier disruption and cell death in experimental traumatic brain injury by mitigating autophagy dysfunction and mitophagy activation[J]. Int J Biochem Cell Biol, 2018, 94: 44-55. DOI:10.1016/j.biocel.2017.11.007 |
| [30] | Zhang QQ, Luo L, Liu MX, et al. Enriched environment-induced neuroprotection against cerebral ischemia-reperfusion injury might be mediated via enhancing autophagy flux and mitophagy flux[J]. Mediators Inflamm, 2022, 2022: 2396487. DOI:10.1155/2022/2396487 |
| [31] | Zeng X, Zhang YD, Ma RY, et al. Activated Drp1 regulates p62-mediated autophagic flux and aggravates inflammation in cerebral ischemia-reperfusion via the ROS-RIP1/RIP3-exosome axis[J]. Mil Med Res, 2022, 9(1): 25. DOI:10.1186/s40779-022-00383-2 |
| [32] | Ali M, Tabassum H, Alam MM, et al. N-acetyl-L-cysteine ameliorates mitochondrial dysfunction in ischemia/reperfusion injury via attenuating Drp-1 mediated mitochondrial autophagy[J]. Life Sci, 2022, 293: 120338. DOI:10.1016/j.lfs.2022.120338 |
| [33] | Zhang YF, He YC, Wu ML, et al. Rehmapicroside ameliorates cerebral ischemia-reperfusion injury via attenuating peroxynitrite-mediated mitophagy activation[J]. Free Radic Biol Med, 2020, 160: 526-539. DOI:10.1016/j.freeradbiomed.2020.06.034 |
| [34] | Gao JB, Wang HJ, Li YJ, et al. Resveratrol attenuates cerebral ischaemia reperfusion injury via modulating mitochondrial dynamics homeostasis and activating AMPK-Mfn1 pathway[J]. Int J Exp Pathol, 2019, 100(5/6): 337-349. DOI:10.1111/iep.12336 |
| [35] | Li X, Li HY, Xu ZM, et al. Ischemia-induced cleavage of OPA1 at S1 site aggravates mitochondrial fragmentation and reperfusion injury in neurons[J]. Cell Death Dis, 2022, 13(4): 321. DOI:10.1038/s41419-022-04782-0 |
| [36] | Lai YX, Lin PQ, Chen ML, et al. Restoration of L-OPA1 alleviates acute ischemic stroke injury in rats via inhibiting neuronal apoptosis and preserving mitochondrial function[J]. Redox Biol, 2020, 34: 101503. DOI:10.1016/j.redox.2020.101503 |
| [37] | Chen D, Duan H, Zou C, et al. 20(R)-ginsenoside Rg3 attenuates cerebral ischemia-reperfusion injury by mitigating mitochondrial oxidative stress via the Nrf2/HO-1 signaling pathway. Phytother Res[J]. 2024, 38(3): 1462-1477. DOI: 10.1002/ptr.8118. |
| [38] | Guan LC, Che ZM, Meng XD, et al. MCU Up-regulation contributes to myocardial ischemia-reperfusion Injury through calpain/OPA-1-mediated mitochondrial fusion/mitophagy Inhibition[J]. J Cell Mol Med, 2019, 23(11): 7830-7843. DOI:10.1111/jcmm.14662 |
| [39] | Fatiga FF, Wang LJ, Hsu T, et al. Miro1 functions as an inhibitory regulator of MFN at elevated mitochondrial Ca2+ levels[J]. J Cell Biochem, 2021, 122(12): 1848-1862. DOI:10.1002/jcb.30138 |
| [40] | Kulkarni PG, Balasubramanian N, Manjrekar R, et al. DNA methylation-mediated Mfn2 gene regulation in the brain: a role in brain trauma-induced mitochondrial dysfunction and memory deficits[J]. Cell Mol Neurobiol, 2023, 43(7): 3479-3495. DOI:10.1007/s10571-023-01358-0 |
| [41] | Vevea JD, Chapman ER. Mitofusin 2 sustains the axonal mitochondrial network to support presynaptic Ca2+ homeostasis and the synaptic vesicle cycle in rat hippocampal axons[J]. J Neurosci, 2023, 43(19): 3421-3438. DOI:10.1523/JNEUROSCI.1356-22.2023 |
| [42] | Jang S, Javadov S. OPA1 regulates respiratory super complexes assembly: the role of mitochondrial swelling[J]. Mitochondrion, 2020, 51: 30-39. DOI:10.1016/j.mito.2019.11.006 |
| [43] | Whelan RS, Konstantinidis K, Wei AC, et al. Bax regulates primary necrosis through mitochondrial dynamics[J]. Proc Natl Acad Sci USA, 2012, 109(17): 6566-6571. DOI:10.1073/pnas.1201608109 |
| [44] | Zhao FP, Austria Q, Wang WZ, et al. Mfn2 overexpression attenuates MPTP neurotoxicity in vivo[J]. Int J Mol Sci, 2021, 22(2): 601. DOI:10.3390/ijms22020601 |
| [45] | Wei X, Liu JY, Zhang WL, et al. Research advances in prevention and treatment of cerebral ischemia-reperfusion injury by targeting mitochondrial quality control[J]. China J Chin Mater Med, 2022, 47(16): 4305-4313. DOI:10.19540/j.cnki.cjcmm.20220217.702 |
| [46] | Huang QX, Li J, Chen JJ, et al. Ginsenoside compound K protects against cerebral ischemia/reperfusion injury via Mul1/Mfn2-mediated mitochondrial dynamics and bioenergy[J]. J Ginseng Res, 2023, 47(3): 408-419. DOI:10.1016/j.jgr.2022.10.004 |
| [47] | Qin YY, Pan SY, Dai JR, et al. Alleviation of ischemic brain injury by exercise preconditioning is associated with modulation of autophagy and mitochondrial dynamics in cerebral cortex of female aged mice[J]. Exp Gerontol, 2023, 178: 112226. DOI:10.1016/j.exger.2023.112226 |
 2024, Vol. 33
2024, Vol. 33