体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)作为一种高级生命支持技术,与常规心肺复苏(conventional cardiopulmonary resuscitation, CCPR)相结合,目前已越来越多地应用于心脏骤停(cardiac arrest, CA)患者的抢救,并显著地提高了复苏成功率和神经功能预后良好患者的比例[1]。然而,脑损伤仍然是影响体外心肺复苏(extracorporeal cardiopulmonary resuscitation, ECPR)患者住院存活率和神经功能预后的重要因素。其病理生理学机制复杂多样,主要包括ECMO建立前无灌注和低灌注状态导致的缺血缺氧性脑损伤、ECMO建立后缺血-再灌注引起的脑损伤以及ECMO支持过程中脑血流改变、全身抗凝相关性脑损伤等[2]。脑功能监测目前已成为CA后管理的重要组成部分,对患者后续治疗方案的决策具有重要的临床意义。
脑损伤生物标志物是脑组织在受到损伤时释放的细胞成分,其释放水平与细胞损伤的严重程度呈正相关[3]。常用于CA后脑功能监测的生物标志物有神经元特异性烯醇化酶(neuron-specific enolase, NSE)和S-100钙结合蛋白(S-100b)等[4]。NSE和S-100b分别因神经元和星形胶质细胞损伤后释放入血,既往研究报道了其血清水平可反映CA后脑损伤严重程度,且与CCPR患者神经功能预后密切相关[5-6]。然而,最新指南并未推荐生物标志物的任何特定阈值用于CA后神经功能预后评估[7]。此外,因为溶血是ECMO治疗的重要并发症之一,而NSE同时存在于血细胞中,ECPR患者若出现溶血,也可导致NSE水平升高[8]。因此,生物标志物对ECPR患者神经功能预后判断的准确性和可靠性仍有待进一步研究,且国内鲜有文献报道。本研究旨在探讨NSE和S-100b水平对成人ECPR患者神经功能预后的预测价值。
1 资料与方法 1.1 研究对象本研究采用单中心、观察性、回顾性研究设计,以2021年4月至2024年4月于南京医科大学第一附属医院急诊科接受ECPR治疗的CA患者为研究对象。排除标准为:年龄 < 18岁,ECMO转机时间 < 24 h,自主循环恢复(return of spontaneous circulation, ROSC)后格拉斯哥昏迷评分(Glasgow coma scale, GCS) > 8分,存在创伤、恶性肿瘤及神经功能缺损性疾病等。排除转机时间 < 24 h 6例,临床资料不完整5例,最终纳入110例患者。本研究符合医学伦理学标准,经本院伦理委员会批准(伦审号:2020-SR-226),并按原则豁免知情同意。
1.2 研究方法所有ECPR患者均于ECMO建立后立即行动脉血气分析,记录初始pH和乳酸值。分别采集患者ECMO建立后24 h、48 h和72 h的外周静脉血,采用德国罗氏Cobas e602型全自动电化学发光免疫分析仪检测血清NSE和S-100b水平,并记录72 h内峰值进行分析。同时,收集所有ECPR患者一般临床资料和围CA期相关信息,包括:基础疾病史、CA地点、有无旁观者CPR、CA病因、初始心律、CCPR时间、ECMO转机时间及住院时间等。ECMO建立后即刻对所有患者行神经系统查体,评估对疼痛刺激的运动反应[格拉斯哥昏迷量表-运动反应评分(Glasgow coma scale-motor response, GCS-M)]和脑干反射(瞳孔对光反射和角膜反射)。GCS-M ≤ 2分表示对疼痛刺激无反应(1分)或异常伸肌运动(2分)。所有患者ECMO建立后24 h内行头颅CT检查,并计算基底节区脑灰质/白质比例(gray-white matter ratio, GWR),具体方法参见本课题组既往研究[9]。以患者出院时存活状态,分为存活组和死亡组。通过住院病历信息采集或出院电话随访,以患者CA后30 d格拉斯哥-匹兹堡脑功能表现分级(cerebral performance category, CPC)评分评价神经功能预后,CPC 1~2分为神经功能预后良好,CPC 3~5分为神经功能预后不良(CPC 3分为严重脑功能残疾,CPC 4分为昏迷及植物状态,CPC 5分为死亡)。
1.3 统计学方法采用SPSS 23.0软件对所有数据进行统计分析。计量资料采用Kolmogorov-Smirnov法进行正态性检验,符合正态分布变量以均数±标准差(x ± s)表示,采用成组t检验;非正态分布数据以中位数(四分位数)[M (Q1, Q3)]表示,采用Mann-Whitney U检验。计数资料以构成比(率)表示,采用χ2检验。将单因素分析中P < 0.10的变量纳入多因素Logistic回归模型,计算比值比(odds ratio, OR)及95%可信区间(confidence interval, CI),以确定ECPR患者神经功能预后不良的独立危险因素。采用受试者工作特征(receiver operating characteristic, ROC)曲线评价NSE和S-100b对ECPR患者神经功能预后的判断价值,计算曲线下面积(area under the curve, AUC)并得出最佳阈值。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料比较本研究共121例CA患者接受ECPR治疗,最终纳入110例患者。以患者出院时存活状态分组,存活组43例,死亡组67例,出院病死率为60.9%。以患者CA后30 d CPC评分分组,预后良好组有29例(26.4%),年龄(52.14±13.41)岁,男性22例;预后不良组有81例(73.6%),年龄(51.06±16.60)岁,男性63例。两组在年龄、性别、基础疾病史、院外CA、旁观者CPR、心源性病因及初始可除颤心律比例等方面差异无统计学意义(均P > 0.05)。与预后良好组比较,预后不良组CCPR时间明显延长,ECMO转机时间及住院时间明显缩短(均P < 0.05)。见表 1。
| 指标 | 死亡组(67例) | 存活组(43例) | P值 | 预后不良组(81例) | 预后良好组(29例) | P值 |
| 年龄(岁,x ± s) | 52.25 ± 16.07 | 49.93 ± 15.37 | 0.449 | 51.06 ± 16.60 | 52.14 ± 13.41 | 0.754 |
| 男性(n,%) | 51 (76.1) | 34 (79.1) | 0.719 | 63 (77.8) | 22 (75.9) | 0.833 |
| 基础疾病史(n,%) | ||||||
| 高血压 | 25 (37.3) | 16 (37.2) | 0.991 | 30 (37.0) | 11 (37.9) | 0.932 |
| 糖尿病 | 16 (23.9) | 9 (20.9) | 0.719 | 19 (23.5) | 6 (20.7) | 0.760 |
| 冠心病 | 6 (9.0) | 4 (9.3) | 0.951 | 8 (9.9) | 2 (6.9) | 0.918 |
| 脑卒中 | 5 (7.5) | 1 (2.3) | 0.467 | 5 (6.2) | 1 (3.4) | 0.938 |
| 院外CA(n,%) | 21 (31.3) | 8 (18.6) | 0.139 | 25 (30.9) | 4 (13.8) | 0.073 |
| 旁观者CPR(n,%) | 60 (89.6) | 42 (97.7) | 0.221 | 73 (90.1) | 29 (100) | 0.180 |
| 心源性病因(n,%) | 50 (74.6) | 32 (74.4) | 0.980 | 60 (74.1) | 22 (75.9) | 0.850 |
| 初始可除颤心律(n,%) | 32 (47.8) | 24 (55.8) | 0.410 | 38 (46.9) | 18 (62.1) | 0.161 |
| CCPR时间[min]a | 50.0 (32.0, 76.0) | 34.0 (20.0, 50.0) | 0.002 | 48.0 (30.0, 75.0) | 31.0 (19.0, 55.0) | 0.015 |
| ECMO转机时间[h]a | 76.8 (29.5, 129.5) | 143.0 (102.8, 184.3) | < 0.001 | 94.3 (36.8, 158.8) | 139.5 (92.8, 156.8) | 0.015 |
| 住院时间[d]a | 5.0 (2.0, 7.0) | 19.0 (15.0, 26.0) | < 0.001 | 6.0 (3.0, 13.5) | 19.0 (15.5, 26.5) | < 0.001 |
| GCS-M ≤ 2(n,%) | 66 (98.5) | 15 (34.9) | < 0.001 | 77 (95.1) | 4 (13.8) | < 0.001 |
| 脑干反射消失(n,%) | 40 (59.7) | 2 (4.7) | < 0.001 | 42 (51.9) | 0 (0) | < 0.001 |
| 基底节区GWRa | 1.15 (1.08, 1.21) | 1.22 (1.16, 1.26) | < 0.001 | 1.16 (1.10, 1.19) | 1.24 (1.19, 1.26) | < 0.001 |
| pH a | 7.18 (6.97, 7.33) | 7.34 (7.27, 7.44) | < 0.001 | 7.20 (6.98, 7.36) | 7.39 (7.30, 7.46) | < 0.001 |
| 乳酸[mmol/L]a | 10.25 (4.33, 15.26) | 2.43 (1.08, 9.78) | 0.001 | 9.89 (3.36, 15.71) | 1.81 (0.89, 6.63) | < 0.001 |
| NSE [μg/L]a | 112.80 (69.09, 289.05) | 49.10 (35.10, 63.10) | < 0.001 | 103.00 (60.48, 246.00) | 44.93 (35.05, 55.16) | < 0.001 |
| S-100b [μg/L]a | 4.310 (0.654, 17.870) | 0.221 (0.090, 0.741) | < 0.001 | 3.690 (0.324, 11.085) | 0.148 (0.085, 0.716) | < 0.001 |
| 注:a为M (Q1, Q3);CA为心脏骤停,CPR为心肺复苏,CCPR为常规心肺复苏,ECMO为体外膜肺氧合,GCS-M为格拉斯哥昏迷量表-运动反应,GWR为脑灰质/白质比例,NSE为神经元特异性烯醇化酶 | ||||||
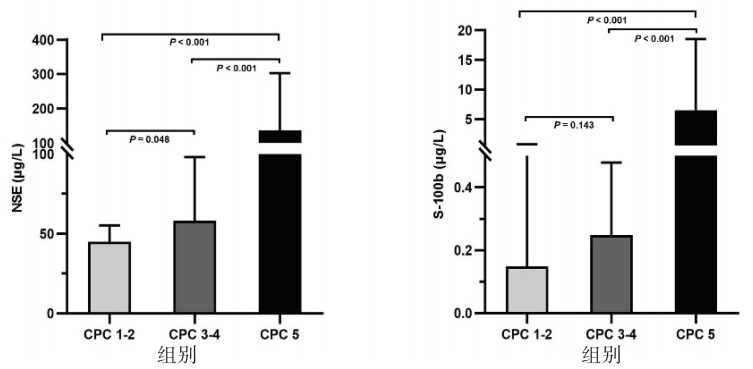
与预后良好组比较,预后不良组72 h内血清NSE、S-100b峰值水平以及初始乳酸值显著升高,初始pH和头颅CT基底节区GWR显著降低(均P < 0.05)。预后不良组GCS-M ≤ 2分及脑干反射消失比例明显高于预后良好组(均P < 0.05)。见表 1。进一步将预后不良组分为CPC 3~4及CPC 5两组。结果显示,CPC 5组NSE、S-100b水平均显著高于其他两组,差异有统计学意义(P < 0.05)。CPC 1~2组NSE水平明显低于CPC 3~4组(P = 0.048),而S-100b水平在两组间差异无统计学意义(P = 0.143)。见图 1。
|
| 图 1 不同预后组间血清NSE和S-100b水平比较 Fig 1 Comparisons of serum NSE and S-100b levels in different outcome groups |
|
|
将临床已知和有意义的预后相关指标(年龄、性别、院外CA、旁观者CPR、心源性病因、初始可除颤心律、CCPR时间、初始pH、乳酸、NSE和S-100b等)纳入二分类多因素Logistic回归模型,逐步排除后,初始可除颤心律、初始pH、NSE和S-100b进入预后不良组回归方程。结果显示,初始pH(OR = 0.005,95% CI:0.001~0.305,P = 0.012)和NSE(OR = 1.047,95% CI:1.018~1.077,P = 0.001)是ECPR患者神经功能预后不良的独立危险因素。见表 2。
| 指标 | 回归系数 | OR | 95% CI | P值 |
| 初始可除颤心律 | 1.222 | 3.394 | 0.854~13.490 | 0.083 |
| pH | -5.367 | 0.005 | 0.001~0.305 | 0.012 |
| NSE | 0.046 | 1.047 | 1.018~1.077 | 0.001 |
| S-100b | 0.043 | 1.044 | 0.773~1.412 | 0.778 |
| 注:OR为比值比,CI为可信区间,NSE为神经元特异性烯醇化酶 | ||||
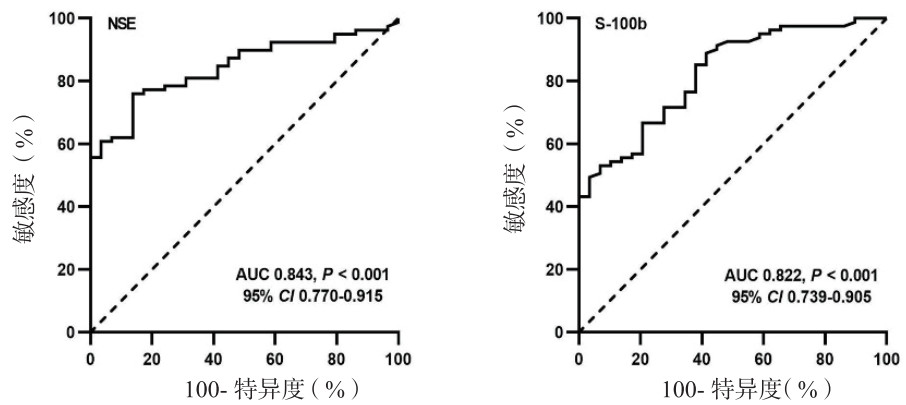
ROC曲线分析结果显示,72 h内NSE(AUC = 0.843,95% CI:0.770~0.915,P < 0.001)和S-100b(AUC = 0.822,95% CI:0.739~0.905,P < 0.001)峰值水平均对ECPR患者神经功能不良预后具有预测价值。NSE预测神经功能不良预后的最佳阈值为60.14 μg/L,其敏感度和特异度分别为75.9%和86.2%;而特异度为100%时,其判断阈值为93.54 μg/L,敏感度为55.7%。同时,S-100b > 0.195 μg/L时,其预测不良预后的敏感度为88.6%,特异度为58.6%。见图 2。
|
| 图 2 NSE和S-100b预测神经功能不良预后的ROC曲线分析 Fig 2 ROC curves for NSE and S-100b in predicting poor neurological outcomes |
|
|
ECPR患者早期神经功能预后评估至关重要,其能够为临床治疗决策和家属治疗意愿提供客观依据,因此应尽可能准确可靠。CA后神经功能预后评估方法主要包括神经系统查体、神经电生理监测、神经影像学和生物标志物等。其中,脑损伤生物标志物评估的优势在于其不受镇静和肌松药物的影响,并且可在CA后早期常规检测[10]。
NSE是目前研究最广泛且指南唯一推荐的用于CA后神经功能预后评估的脑损伤生物标志物[11]。CA后脑损伤患者由于细胞毒性水肿和血管性水肿共同影响,导致神经元受损和血脑屏障破坏,NSE从神经元胞浆释放,并通过血脑屏障到达外周血液[12]。神经功能预后不良患者,NSE水平升高并在CA后48~72 h达到峰值[13]。既往研究表明,血清NSE在CA后72 h内显著升高可预测神经功能预后不良。然而,NSE对CA后患者预后评估的特定阈值仍无法确定[14]。随着ECPR技术的广泛开展,ECMO治疗会不可避免地引起一定程度的溶血,因NSE也存在于红细胞和血小板中,溶血也可导致NSE水平升高[15]。因此,NSE对ECPR患者预后的判断价值需要深入研究。本研究结果表明,预后不良组72 h内血清NSE峰值水平显著升高,是ECPR患者神经功能预后不良的独立危险因素。
迄今为止,因相关研究无法明确预测不良预后的假阳性率为0%(即特异度为100%)的NSE阈值,指南推荐NSE不单独用于CCPR患者预后判断,应与其他指标联合评估[7, 11]。Floerchinger等[16]报道了134例ECPR患者48 h内NSE水平与神经功能预后的相关性。结果显示,24 h内NSE水平越高,血清游离血红蛋白水平也越高,提示溶血。尽管如此,48 h NSE水平可用于判断是否存在CA后脑损伤,最佳阈值为100 μg/L。Schrage等[8]研究表明,CA后48 h NSE > 70 μg/L预测ECPR患者神经功能不良预后的敏感度为76.5%,特异度为86.5%。然而其不同于本研究的是,神经功能预后不良定义为CPC 4~5分。此外,Petermichl等[17]研究发现,ECPR患者NSE水平在48 h达到峰值,CA后72 h NSE水平在CPC 1~2和CPC 3~4组之间差异最大(P < 0.001)。另有一项研究结果显示ECPR患者CA后72 h NSE > 53.2 μg/L预测不良预后的价值最高(AUC 0.897,P < 0.01)[18]。本研究中,CA后72 h内NSE > 60.14 μg/L预测神经功能不良预后的敏感度和特异度分别为75.9%和86.2%;而特异度为100%时,其判断阈值为93.54 μg/L。该结果与指南推荐的可靠预测不良预后的最佳阈值一致,为CA后48~72 h内NSE > 60 μg/L[11]。本研究表明NSE仍可作为ECPR患者神经功能预后评估的可靠指标。
目前认为,连续监测CA后24~72 h NSE变化趋势比绝对值更有价值,NSE水平持续升高多提示预后不良[12]。此外,如连续监测NSE水平发现,其测得水平较高但下降明显(24~48 h内降低50%或更多),应视为溶血征象。需要注意的是,因游离血红蛋白的半衰期(2~4 h)远小于NSE(24~30 h),当血液中无法测得游离血红蛋白浓度的情况下,仍应考虑溶血因素的存在[19]。
S-100b是神经元损伤后神经胶质细胞释放的一种蛋白,其水平升高与CA后早期神经元凋亡过程有关[20]。既往研究报道CA后24 h S-100b > 0.12 μg /L预测神经功能不良预后的价值最高(敏感度68%,特异度77%)[21]。然而,S-100b评估预后的假阳性率较高,准确性不如NSE,限制其临床应用[11]。本研究中,CA后72 h内S-100b > 0.195 μg/L预测不良预后的敏感度和特异度分别为88.6%和58.6%,研究结论与既往研究类似。此外,本研究发现72 h内S-100b峰值水平在CPC 1~2和CPC 3~4两组间差异无统计学意义。究其原因可能是CA后脑损伤患者血清S-100b达峰时间早于NSE,也早于本研究设定的首次检测时间点(CA后24 h)[22]。既往研究表明,神经功能预后良好和预后不良的患者S-100b水平在24 h后随时间推移出现相似的下降趋势[21]。因S-100b半衰期较短(0.5~2 h),且相对分子质量较小(21 000),可快速通过血脑屏障,其早期释放和随后水平下降的特点完全不同于NSE[6, 23]。因此,CA后即刻至24 h S-100b水平和48~72 h NSE水平监测在预后判断中的价值可以是互补的,需要进一步研究探讨。
本研究为单中心、回顾性研究,前瞻性研究设计的结论仍需多中心、更大样本量进行验证。此外,本研究仅收集脑损伤生物标志物在CA后24 h、48 h和72 h三个时间点的数据,并取峰值进行比较,更多时间点、连续性指标的变化趋势和差异分析等未纳入本研究范围,后续研究可进一步全面评估CA后生物标志物对神经功能预后的影响。最后,本研究随访终点为CA后30 d,需进一步延长随访时间,以评价其对远期预后的预测价值。
综上所述,ECPR患者ECMO建立后72 h内血清NSE、S-100b峰值水平与神经功能不良预后具有相关性。NSE可作为ECPR患者神经功能预后评估的可靠指标,并与其他指标联合应用。
利益冲突 所有作者声明无利益冲突。
作者贡献声明 王淦楠:直接参与研究设计、数据收集与分析、论文撰写;陈旭锋、梅勇:研究设计、文章审阅与指导;张忠满、张华忠:数据收集与分析、论文修改
| [1] | Lunz D, Calabrò L, Belliato M, et al. Extracorporeal membrane oxygenation for refractory cardiac arrest: a retrospective multicenter study[J]. Intensive Care Med, 2020, 46(5): 973-982. DOI:10.1007/s00134-020-05926-6 |
| [2] | Yukawa T, Kashiura M, Sugiyama K, et al. Neurological outcomes and duration from cardiac arrest to the initiation of extracorporeal membrane oxygenation in patients with out-of-hospital cardiac arrest: a retrospective study[J]. Scand J Trauma Resusc Emerg Med, 2017, 25(1): 95. DOI:10.1186/s13049-017-0440-7 |
| [3] | Akin M, Garcheva V, Sieweke JT, et al. Neuromarkers and neurological outcome in out-of-hospital cardiac arrest patients treated with therapeutic hypothermia-experience from the HAnnover COoling REgistry (HACORE)[J]. PLoS One, 2021, 16(1): e0245210. DOI:10.1371/journal.pone.0245210 |
| [4] | Moseby-Knappe M, Cronberg T. Blood biomarkers of brain injury after cardiac arrest - A dynamic field[J]. Resuscitation, 2020, 156: 273-276. DOI:10.1016/j.resuscitation.2020.09.004 |
| [5] | Moseby-Knappe M, Mattsson-Carlgren N, Stammet P, et al. Serum markers of brain injury can predict good neurological outcome after out-of-hospital cardiac arrest[J]. Intensive Care Med, 2021, 47(9): 984-994. DOI:10.1007/s00134-021-06481-4 |
| [6] | Deye N, Nguyen P, Vodovar N, et al. Protein S100B as a reliable tool for early prognostication after cardiac arrest[J]. Resuscitation, 2020, 156: 251-259. DOI:10.1016/j.resuscitation.2020.08.010 |
| [7] | Panchal AR, Bartos JA, Cabañas JG, et al. Part 3: adult basic and advanced life support: 2020 American heart association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care[J]. Circulation, 2020, 142(16_suppl_2): S366-S468. DOI:10.1161/CIR.0000000000000916 |
| [8] | Schrage B, Rübsamen N, Becher PM, et al. Neuron-specific-enolase as a predictor of the neurologic outcome after cardiopulmonary resuscitation in patients on ECMO[J]. Resuscitation, 2019, 136: 14-20. DOI:10.1016/j.resuscitation.2019.01.011 |
| [9] | 王淦楠, 陈旭锋, 梅勇, 等. 头颅CT灰质/白质比例对成人心搏骤停后昏迷患者预后的判断价值[J]. 中华急诊医学杂志, 2017, 26(6): 659-663. DOI:10.3760/cma.j.issn.1671-0282.2017.06.012 |
| [10] | 王淦楠, 张劲松. 心搏骤停后昏迷患者神经功能预后评估的研究进展[J]. 中华急诊医学杂志, 2016, 25(5): 687-690. DOI:10.3760/cma.j.issn.1671-0282.2016.05.031 |
| [11] | Nolan JP, Sandroni C, Böttiger BW, et al. European resuscitation council and European society of intensive care medicine guidelines 2021: post-resuscitation care[J]. Intensive Care Med, 2021, 47(4): 369-421. DOI:10.1007/s00134-021-06368-4 |
| [12] | Ryczek R, Kwasiborski PJ, Dymus J, et al. Neuron-specific enolase concentrations for the prediction of poor prognosis of comatose patients after out-of-hospital cardiac arrest: an observational cohort study[J]. Kardiol Pol, 2021, 79(5): 546-553. DOI:10.33963/KP.15917 |
| [13] | Sandroni C, Skrifvars MB, Taccone FS. Brain monitoring after cardiac arrest[J]. Curr Opin Crit Care, 2023, 29(2): 68-74. DOI:10.1097/MCC.0000000000001023 |
| [14] | Sharma K, John M, Zhang S, et al. Serum neuron-specific enolase thresholds for predicting postcardiac arrest outcome: a systematic review and meta-analysis[J]. Neurology, 2022, 98(1): e62-e72. DOI:10.1212/WNL.0000000000012967 |
| [15] | Johnsson P, Blomquist S, Lührs C, et al. Neuron-specific enolase increases in plasma during and immediately after extracorporeal circulation[J]. Ann Thorac Surg, 2000, 69(3): 750-754. DOI:10.1016/s0003-4975(99)01393-4 |
| [16] | Floerchinger B, Philipp A, Camboni D, et al. NSE serum levels in extracorporeal life support patients-Relevance for neurological outcome?[J]. Resuscitation, 2017, 121: 166-171. DOI:10.1016/j.resuscitation.2017.09.001 |
| [17] | Petermichl W, Philipp A, Hiller KA, et al. Reliability of prognostic biomarkers after prehospital extracorporeal cardiopulmonary resuscitation with target temperature management[J]. Scand J Trauma Resusc Emerg Med, 2021, 29(1): 147. DOI:10.1186/s13049-021-00961-8 |
| [18] | Kim HB, Yang JH, Lee YH. Are serial neuron-specific enolase levels associated with neurologic outcome of ECPR patients: a retrospective multicenter observational study[J]. Am J Emerg Med, 2023, 69: 58-64. DOI:10.1016/j.ajem.2023.03.047 |
| [19] | Rundgren M, Cronberg T, Friberg H, et al. Serum neuron specific enolase - impact of storage and measuring method[J]. BMC Res Notes, 2014, 7: 726. DOI:10.1186/1756-0500-7-726 |
| [20] | Wang CH, Chang WT, Su KI, et al. Neuroprognostic accuracy of blood biomarkers for post-cardiac arrest patients: a systematic review and meta-analysis[J]. Resuscitation, 2020, 148: 108-117. DOI:10.1016/j.resuscitation.2020.01.006 |
| [21] | Stammet P, Dankiewicz J, Nielsen N, et al. Protein S100 as outcome predictor after out-of-hospital cardiac arrest and targeted temperature management at 33 ℃ and 36 ℃[J]. Crit Care, 2017, 21(1): 153. DOI:10.1186/s13054-017-1729-7 |
| [22] | Shinozaki K, Oda S, Sadahiro T, et al. Serum S-100B is superior to neuron-specific enolase as an early prognostic biomarker for neurological outcome following cardiopulmonary resuscitation[J]. Resuscitation, 2009, 80(8): 870-875. DOI:10.1016/j.resuscitation.2009.05.005 |
| [23] | Yun GS, In YN, Kang C, et al. Development of a strategy for assessing blood-brain barrier disruption using serum S100 calcium-binding protein B and neuron-specific enolase in early stage of neuroemergencies: a preliminary study[J]. Medicine, 2022, 101(28): e29644. DOI:10.1097/MD.0000000000029644 |
 2024, Vol. 33
2024, Vol. 33