肾综合征出血热(hemorrhagic fever with renal syndrome, HFRS)是汉坦病毒引起的一种全球分布的自然疫源性疾病,鼠类啮齿动物为主要传染源[1]。中国是HFRS流行最活跃的地区[2],自1950年至2020年底,已累计确诊HFRS患者超过168万例,其中病死率达2.86%,每年病死率波动于0.60%~13.97%[3]。早期准确识别并治疗有病情恶化趋势的HFRS患者,可以显著改善患者预后及生活质量。HFRS主要病理特征包括血管通透性增加,血小板减少及过度活跃的免疫反应[4-6]。近年来,国内外学者对HFRS的免疫机制进行了广泛研究[7-8],如Lee等[8]研究指出suPAR、IL-10、CXCL10和TGF-β3可作为评估HFRS病情的预测因子。然而,在实际临床工作中,免疫功能相关蛋白的指标并不作为常规检查。因此,本研究旨在探究常规实验室指标在预测HFRS病情进展的价值并建立模型。
1 资料与方法 1.1 研究对象本研究对2020年10月至2024年5月就诊空军军医大学第二附属医院急诊科的HFRS患者进行回顾性分析。纳入标准:以《肾综合征出血热防治专家共识》(2021)[9]中的临床诊断病例和确诊病例为标准。排除标准:自身免疫性疾病、血液系统疾病、严重心肝肾功能不全及关键指标缺失的病例。根据《肾综合征出血热防治专家共识》中临床分型将患者出、入院时病情分为轻、中、重、危重型,轻、中型设为轻症组,重、危重型设为重症组,然后将入院时所有轻症患者筛选出来,根据住院期间病情是否进展为重症分为病情进展组(n=101)和病情平稳组(n=185)。本研究通过空军军医大学唐都医院伦理委员会审批(批号:TDLL-第202410-09号)。
1.2 资料收集收集HFRS患者入院时临床资料,包括一般资料(体温、呼吸、血压、心率、性别、年龄)和实验室指标[白细胞计数(WBC)、血红蛋白(HB)、中性粒细胞百分比(NEU%)、血小板计数(PLT)、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、白蛋白(ALB)、肌酐(CR)、尿素氮(BUN)、钙离子(Ca2+)、凝血酶原时间(PT)、凝血酶原活动度(PTA)、活化部分凝血活酶时间(APTT)、肌钙蛋白(cTnI)、肌红蛋白(MYO)、N末端脑钠肽前体(NT-proBNP)、降钙素原(PCT)、C反应蛋白(CRP)],均以患者入院时第1次检测结果为统计信息。
1.3 统计学方法采用Excel进行数据录入,采用SPSS 25.0进行统计学分析。连续性资料呈正态分布的计量资料以均数±标准差(x±s)表示,两组间比较采用样本t检验;对不符合正态分布的计量资料用中位数(上下四分位数)[M(Q1, Q3)]表示,两组间比较采用秩和检验。计数资料以例数和百分数(%)表示,组间比较采用χ2检验。应用二分类多因素Logistic回归分析,筛选出病情进展的独立危险因素并建立模型,绘制受试者工作特征曲线(ROC曲线),评估该模型对病情进展的预测价值。
2 结果 2.1 两组间临床资料的比较共纳入286例轻症HFRS患者,其中病情进展组101例(35.31%),男性77例(76.20%),病情平稳组185例(64.69%),男性146例(78.90%)。病情进展组呼吸、心率、年龄、WBC、AST、Cr、BUN、cTnI、MYO、NT-proBNP、PT、PTA、APTT、PCT水平均高于病情平稳组;收缩压、ALB、PLT水平低于病情平稳组,差异均有统计学意义(P<0.050),体温、舒张压、性别、HB、NEU、Ca2+、CRP水平差异均无统计学意义(P>0.05),见表 1。
| 指标 | 平稳组(n=185) | 进展组(n=101) | χ2/Z | P值 |
| 体温(℃)V | 36.80(36.40, 37.65) | 36.70(36.45, 37.65) | -0.944 | 0.345 |
| 呼吸(次/min)a | 20(18, 20) | 20(20, 22) | -2.953 | 0.003 |
| 心率(次/min)a | 90(80, 101) | 98(80, 113) | -2.754 | 0.003 |
| 收缩压(mmHg)a | 120(110, 130) | 120(101, 127) | -2.524 | 0.012 |
| 舒张压(mmHg)a | 80(70, 84) | 76(70, 84) | -1.185 | 0.236 |
| 男(n,%) | 146(78.90%) | 77(76.20%) | 0.273 | 0.601 |
| 年龄(岁)a | 44.0(32.00, 55.50) | 49.00(36.00,64.00) | -2.057 | 0.040 |
| WBC(×109/L)a | 9.72(6.66, 14.21) | 20.20(12.29, 33.84) | -8.904 | 0.000 |
| NEU(%)a | 63.80(51.40, 77.00) | 65.90(56.05, 77.00) | -1.544 | 0.123 |
| PLT(×109/L)a | 61.00(39.00, 82.50) | 31.00(18.00, 55.00) | -6.203 | 0.000 |
| HB(g/L)b | 148.85±26.24 | 153.27±28.43 | 1.975 | 0.161 |
| ALB (g/L)a | 35.50(31.65, 39.55) | 29.40(25.80, 32.25) | -8.766 | 0.000 |
| AST(U/L)a | 68.00(45.00, 104.00) | 150.0(76.50, 241.0) | -6.674 | 0.000 |
| Cr (μmol/L)a | 140.40(86.40, 309.35) | 438.05(223.6, 607.96) | -3.718 | 0.000 |
| BUN(mmol/L)a | 9.05(5.74, 17.97) | 15.68(8.76, 20.01) | -3.635 | 0.000 |
| Ca2+(mmol/L)b | 2.016±0.19 | 1.87±0.19 | 0.149 | 0.700 |
| cTnIa | 0.012(0.012, 0.062) | 0.02(0.012, 0.063) | -2.529 | 0.011 |
| MYO(ng/mL)a | 44.0(53.38, 187.29) | 187.29(80.20, 270.20) | -3.862 | 0.000 |
| NT-proBNP (pg/mL)a | 836.0(200.50, 2066.39) | 1260.0 (415.00, 2128.19) | -2.218 | 0.027 |
| PT (sec)a | 11.70(11.05, 12.45) | 12.10(11.15, 13.2) | -2.586 | 0.010 |
| PTA (%)a | 86.6(78.2, 96.85) | 82.0(69.65, 96.70) | -2.088 | 0.037 |
| APTT(s)a | 36.50(30.55, 46.35) | 45.00(37.15, 60.90) | -4.973 | 0.000 |
| PCT (ng/mL)a | 1.11(0.55, 3.31) | 3.36(1.76, 8.07) | -5.921 | 0.000 |
| CRP (ng/mL)a | 22.16(13.94, 30.74) | 26.04(16.84, 38.18) | -1.196 | 0.232 |
| 注:WBC为白细胞计数,NEU%为中性粒细胞百分比,PLT为血小板计数,HB为血红蛋白,ALB为白蛋白,AST为天冬氨酸氨基酸转移酶,Cr为肌酐,BUN为尿素氮,Ca2+为钙离子,cTnI为肌钙蛋白,MYO为肌红蛋白,NT-proBNP为N末端脑钠肽前体,PT为凝血酶原时间,PTA为凝血酶原活动度,APTT为活化部分凝血活酶时间,PCT为降钙素原,CRP为C反应蛋白;a为M(Q1, Q3),b为x±s | ||||
以HFRS病情进展为因变量,以各项实验室检查指标为自变量,根据单因素分析结果进行二元多因素Logistic回归分析,筛查出WBC、ALB是病情进展的独立危险因素(均P<0.05)。基于WBC、ALB建立预测模型为:logit(P)=2.857+0.114×WBC(×109/L)-0.198×ALB(g/L)。见表 2。
| 指标 | B | SE | Wald值 | P值 | OR | 95%CI | |
| 上限 | 下限 | ||||||
| 年龄 | -0.005 | 0.012 | 0.199 | 0.656 | 0.995 | 0.972 | 1.018 |
| 呼吸 | 0.130 | 0.117 | 1.242 | 0.265 | 1.139 | 0.906 | 1.431 |
| 心率 | 0.012 | 0.011 | 1.164 | 0.281 | 1.012 | 0.990 | 1.034 |
| 收缩压 | -0.010 | 0.011 | 0.779 | 0.377 | 0.990 | 0.969 | 1.012 |
| WBC | 0.114 | 0.023 | 23.584 | 0.000 | 1.120 | 1.070 | 1.173 |
| PLT | 0.000 | 0.005 | 0.000 | 0.998 | 1.000 | 0.989 | 1.011 |
| AST | 0.000 | 0.000 | 0.007 | 0.935 | 1.000 | 1.000 | 1.000 |
| ALB | -0.198 | 0.042 | 21.898 | 0.000 | .8020 | 0.755 | 0.891 |
| CR | 0.000 | 0.000 | 0.041 | 0.840 | 1.000 | 1.000 | 1.000 |
| BUN | 0.000 | 0.007 | 0.000 | 0.998 | 1.000 | 0.986 | 1.014 |
| cTnI | 1.580 | 1.071 | 2.178 | 0.140 | 4.856 | 0.596 | 39.605 |
| MYO | -0.001 | 0.001 | 0.861 | 0.354 | 0.999 | 0.997 | 1.001 |
| NT-proBNP | 0.000 | 0.000 | 3.944 | 0.057 | 1.000 | 1.000 | 1.000 |
| PT | 0.009 | 0.158 | 0.003 | 0.955 | 1.009 | 0.741 | 1.374 |
| PTA | -0.016 | 0.017 | 0.851 | 0.356 | 0.984 | 0.952 | 1.018 |
| APTT | -0.002 | 0.007 | 0.093 | 0.760 | 0.998 | 0.984 | 1.012 |
| PCT | 0.009 | 0.015 | 0.413 | 0.521 | 1.009 | 0.981 | 1.039 |
| 常量 | 2.857 | 4.486 | 0.405 | 0.524 | 17.402 | ||
| 注:WBC为白细胞计数,PLT为血小板计数,ALB为白蛋白,AST为天冬氨酸氨基酸转移酶,Cr为肌酐,BUN为尿素氮,cTnI为肌钙蛋白,MYO为肌红蛋白,NT-proBNP为N末端脑钠肽前体,PT为凝血酶原时间,PTA为凝血酶原活动度,APTT为活化部分凝血活酶时间,PCT为降钙素原。B为回归系数,SE为标准误,Wald值为瓦尔登指数,OR为优势比,95%CI为95%可信区间 | |||||||
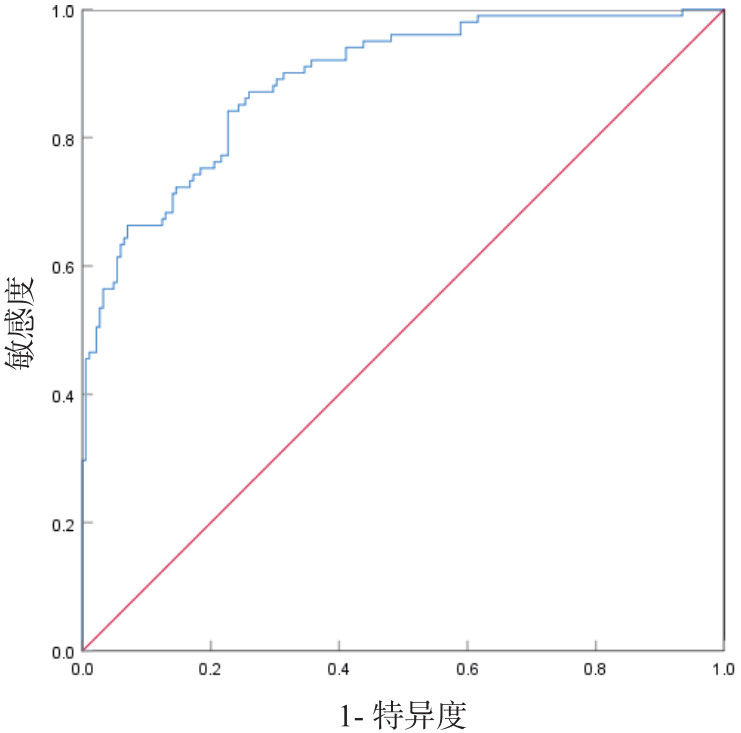
该模型对HFRS病情进展的曲线下面积(AUC)为0.890,95%CI为(0.851~0.929),约登指数为0.499,敏感度为84.2%,特异度为77.3 %。见图 1。
|
| HFRS病情进展预测模型包括WBC、ALB两个指标,ROC曲线为受试者工作特征曲线,AUC为ROC曲线下面积 图 1 HFRS预测模型预测HFRS病情进展的ROC曲线 |
|
|
HFRS是由汉坦病毒感染引起的人畜共患疾病,其发病机制复杂,主要与血管内皮细胞损伤、炎症细胞因子风暴、血小板减少和凝血功能障碍有关 [4-6]。严重的HFRS患者可能出现多器官衰竭甚至死亡,这使得HFRS备受关注[10]。实验室指标作为诊断、治疗和预后评估的重要依据,在HFRS患者病情进展中发挥着关键作用。本研究通过分析入院时患者一般资料及血常规、生化、凝血、炎症指标中部分指标,筛选出影响HFRS患者病情进展的独立危险因素并建立模型,使临床工作者可以早期识别患者病情变化趋势,及时为患者提供更好的医疗措施。
HFRS患患者群以男性、青壮年为主[9],本研究显示HFRS病情进展组与平稳组年龄分别为[49.00(36.00,64.00),42.00(32.00, 55.50),]男女比分别为3.2:1和3.7:1,发病年龄有增加趋势,但均以男性为主。HFRS是一种全身炎症反应性疾病,炎症风暴可破坏各脏器细胞的结构与功能,致使多脏器功能衰竭[11]。不少研究显示WBC、PCT水平与HFRS患者病情严重程度有关 [12-13],本研究中病情进展组WBC、PCT水平高于平稳组,这与既往研究一致,WBC水平为病情进展的独立危险因素,提示早期严重的炎症因子风暴在致病过程中起到重要作用[9]。既往研究表明HFRS患者常伴有肝功能损伤 [12, 14],AST、ALT水平高与预后相关[15]。一项纳140 295例HFRS患者的临床荟萃分析[16]指出:死亡组患者与存活组患者相比,更有可能表现出ALT和AST水平升高,ALB水平降低。血清白蛋白的最低水平与代表疾病严重程度和病死率的临床参数密切相关[17],本研究结果与其相符,且ALB为HFRS病情进展的独立危险因素,考虑与汉坦病毒感染致内皮细胞损伤、血管通透性增加有关[4]。血小板减少及凝血功能障碍是HFRS患者常见病理特征,临床上主要表现为出血。此外,在凝血系统与炎症相互作用下,炎症因子可以通过多种机制促进血栓形成,最终导致DIC和多器官功能衰竭[18-19]。Chen等[15]通过分析395例HFRS患者PLT及凝血指标,发现生存组与死亡组间PLT、APTT、PT水平差异有统计学意义,其中PT可以作为死亡的预测因子。本研究结果也显示病情进展组PT、APTT水平均高于平稳组,PLT水平低于平稳组,差异有统计学意义,但PLT不是HFRS病情进展的独立危险因素,可能与样本量小有关,后期需进一步收集多中心大样本数据研究来验证。急性肾损伤(acute kidney injury,AKI)和血管通透性增加是HFRS的主要特征,发生AKI的病理改变主要是由于有效循环血量减少、肾血容量不足,导致肾小球滤过率下降所致;此外,肾素-血管紧张素水平升高、肾小球微血栓形成以及抗原抗体复合物引起的基底膜损伤和肾小管损伤也是AKI发生的重要原因[6]。本研究中发现病情进展组的肾损伤指标(血肌酐、尿素氮)明显升高。与Yang等[10]研究结果一致。一项调查[20]显示,6 643例HFRS患者在HFRS后21 d内发生急性心肌梗死事件的发生率比分别为5.53[95%可信区间(CI):2.6~11.8]和6.02 (95% CI:2.95~12.3),表明心肌损伤标记物升高可预测疾病进展风险。本研究中病情进展组cTnI、MYO、NT-proBNP水平均高于平稳组,差异有统计学意义。
将上述指标进行多因素Logistic回归分析筛查出WBC、ALB是HFRS患者病情进展的独立影响因子(均P<0.050),并建立预测模型:logit(P)=2.857+0.114×WBC(×109/L)-0.198×ALB(g/L)。ROC曲线证实了该模型对HFRS病情进展有良好的预测价值(AUC分别为0.890,约登指数为0.499,敏感度为84.2%,特异度为77.3%)。WBC、ALB水平与病情进展有关,早期监测,能帮助临床医生尽早识别有病情恶化的患者,从而引起足够重视,改善患者预后。
然而本研究也有一定的局限性。首先,研究样本量较少且数据均来自单中心,这可能会消减当前预测模型的准确性及广泛适用性;其次,HFRS病理过程复杂,实验室指标的变动可能受到多种因素的影响,本研究未能涵盖所有潜在的预测指标,这也可能限制了模型的全面性和精确度。针对上述问题,未来研究应当致力于多中心合作收集数据,扩大研究样本量,探索其他可能影响HFRS病情进展的因素,来完善和优化预测模型。
利益冲突 所有作者声明无利益冲突
作者贡献声明 杨琴琴、段小霞、马志琴:数据收集及整理、统计分析;杨琴琴、任彬:研究设计、论文撰写;姚家久、任彬:论文指导、论文修改
| [1] | Jiang H, Zheng XY, Wang LM, et al. Hantavirus infection: a global zoonotic challenge[J]. Virol Sin, 2017, 32(1): 32-43. DOI:10.1007/s12250-016-3899-x |
| [2] | Zhao HD, Li YP, Zhao WW, et al. Correlation of CD38 expression with the progression of hemorrhagic fever with renal syndrome[J]. Arch Virol, 2021, 166(9): 2399-2406. DOI:10.1007/s00705-021-05136-5 |
| [3] | Jiang H, Du H, Wang LM, et al. Hemorrhagic fever with renal syndrome: pathogenesis and clinical picture[J]. Front Cell Infect Microbiol, 2016, 6: 1. DOI:10.3389/fcimb.2016.00001 |
| [4] | Koehler FC, Di Cristanziano V, Späth MR, et al. The kidney in hantavirus infection-epidemiology, virology, pathophysiology, clinical presentation, diagnosis and management[J]. Clin Kidney J, 2022, 15(7): 1231-1252. DOI:10.1093/ckj/sfac008 |
| [5] | Gorbunova EE, Gavrilovskaya IN, Pepini T, et al. VEGFR2 and Src kinase inhibitors suppress Andes virus-induced endothelial cell permeability[J]. J Virol, 2011, 85(5): 2296-2303. DOI:10.1128/JVI.02319-10 |
| [6] | Vaheri A, Strandin T, Hepojoki J, et al. Uncovering the mysteries of hantavirus infections[J]. Nat Rev Microbiol, 2013, 11(8): 539-550. DOI:10.1038/nrmicro3066 |
| [7] | 张春梅, 唐康, 张宇丝, 等. 肾综合征出血热患者血浆中可溶型Axl及Mer与疾病严重程度的相关性[J/OL]. 空军军医大学学报. |
| [8] | Lee GY, Kim WK, No JS, et al. Clinical and Immunological Predictors of Hemorrhagic Fever with Renal Syndrome Outcome during the Early Phase[J]. Viruses, 2022, 14(3): 595. DOI:10.3390/v14030595 |
| [9] | 中华预防医学会感染性疾病防控分会, 中华医学会感染病学分会. 肾综合征出血热防治专家共识[J]. 中华传染病杂志, 2021, 39(5): 257-265. DOI:10.3760/cma.j.cn311365-20210224-00067 |
| [10] | Yang Z, Hu QM, Feng ZP, et al. Development and validation of a nomogram for predicting severity in patients with hemorrhagic fever with renal syndrome: a retrospective study[J]. Open Med (Wars), 2021, 16(1): 944-954. DOI:10.1515/med-2021-0307 |
| [11] | Gavrilovskaya IN, Gorbunova EE, Mackow NA, et al. Hantaviruses direct endothelial cell permeability by sensitizing cells to the vascular permeability factor VEGF, while angiopoietin 1 and sphingosine 1-phosphate inhibit hantavirus-directed permeability[J]. J Virol, 2008, 82(12): 5797-5806. DOI:10.1128/JVI.02397-07 |
| [12] | 段小霞, 刘军芳, 杨琴琴, 等. 肾综合征出血热患者实验室指标对重症患者的预警价值及模型构建[J]. 中华急诊医学杂志, 2024, 33(7): 1006-1010. DOI:10.3760/cma.j.issn.1671-0282.2024.07.020 |
| [13] | Fan XD, Liu ZT, Fu SQ, et al. Platelet distribution width at first day of hospital admission in patients with hemorrhagic fever with renal syndrome caused by hantaan virus may predict disease severity and critical patients' survival[J]. Dis Markers, 2018, 2018: 9701619. DOI:10.1155/2018/9701619 |
| [14] | Guo Q, Xu J, Shi Q, Du B. Acute pancreatitis associated with hemorrhagic fever with renal syndrome: a cohort study of 346 patients[J]. BMC Infect Dis, 2021, 21(1): 267. DOI:10.1186/s12879-021-05964-5 |
| [15] | Chen WJ, Du H, Hu HF, et al. Levels ofperipheral bloodroutine, biochemical and coagulation parameters in patients with hemorrhagic fever with renal syndrome and their relationship with prognosis: an observational cohort study[J]. BMC Infect Dis, 2024, 24(1): 75. DOI:10.1186/s12879-023-08777-w |
| [16] | Lu W, Kuang L, Hu Y, et al. Epidemiological and clinical characteristics of death from hemorrhagic fever with renal syndrome: a meta-analysis[J]. Front Microbiol, 2024, 15: 1329683. DOI:10.3389/fmicb.2024.1329683.eCollection2024 |
| [17] | Kim YO, Yoon SA, Ku YM, et al. Serum albumin level correlates with disease severity in patients with Hemorrhagic Fever with Renal Syndrome[J]. J Korean Med Sci, 2003, 18(5): 696-700. DOI:10.3346/jkms.2003.18.5.696 |
| [18] | Laine OK, Koskela SM, Outinen TK, et al. Plasma pentraxin-3 and coagulation and fibrinolysis variables during acute Puumala hantavirus infection and associated thrombocytopenia[J]. Blood Coagul Fibrinolysis, 2014, 25(6): 612-617. DOI:10.1097/MBC.0000000000000117 |
| [19] | Stark K, Massberg S. Interplay between inflammation and thrombosis in cardiovascular pathology[J]. Nat Rev Cardiol, 2021, 18(9): 666-682. DOI:10.1038/s41569-021-00552-1 |
| [20] | Connolly-Andersen AM, Hammargren E, Whitaker H, et al. Increased risk of acute myocardial infarction and stroke during hemorrhagic fever with renal syndrome: a self-controlled case series study[J]. Circulation, 2014, 129(12): 1295-1302. DOI:10.1161/CIRCULATIONAHA.113.001870 |
 2024, Vol. 33
2024, Vol. 33