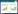心脏骤停(cardiac arrest, CA)致残致死率高,是目前世界范围内重大公共卫生问题之一[1]。《中国心脏骤停与心肺复苏报告:2022年版》指出我国院外心脏骤停(out-of-hospital cardiac arrest, OHCA)和院内心脏骤停自主循环恢复(resuscitation of spontaneous circulation,ROSC)率分别为6.0%和41.1%,而存活出院/30 d存活率仅为1.2%[2]。CA患者经心肺复苏(cardiopulmonary resuscitation, CPR)后出现系统性缺血-再灌注损伤,从而引起多器官功能障碍,即CA后综合征,是导致ROSC后低存活率的重要原因[3]。其中急性肾损伤(acute kidney injury, AKI)是CA后综合征主要表现之一,其发病率约为12%~81%[4]。临床上通常采取血清肌酐和尿量来评估肾损伤,但两种指标的敏感度和特异度较低[5]。目前机器学习算法已广泛应用于临床疾病预测,关于AKI预测模型主要集中于脓毒症、心脏手术及急性冠脉综合征等领域,而CA复苏后有关AKI的预测模型并不多见。本研究基于列线图构建CA复苏后早期发生AKI的预测模型,以提高早期识别AKI能力并尽早有效干预,从而降低AKI发病率并改善CA患者预后。
1 资料与方法 1.1 研究对象本研究回顾性收集2016年2月至2023年9月在天津医科大学总医院收治的CA复苏后住院患者的临床资料。AKI诊断参照改善全球肾脏预后组织诊断标准[6]:48 h内血清肌酐(serum creatinine, Scr)水平升高≥0.3 mg/dL;或肾功能损害发生在7 d以内,Scr上升≥基础值1.5倍。纳入标准:(1)年龄≥18岁;(2)CA经复苏后住院患者。排除标准:(1)既往有慢性肾功能不全、肾衰竭、透析等肾脏相关病史;(2)临床资料不完整。
本研究符合医学伦理学标准,并经天津医科大学总医院伦理委员会批准(审批号:IRB2021-KY-300)。本研究为病历资料回顾性分析且未涉及隐私知情同意等事项,免于患者知情同意。
1.2 数据收集本研究收集(1)人口统计学信息:性别、年龄、体重指数;(2)基础疾病及个人家族史:吸烟史、饮酒史、CA家族史、冠心病、高血压、糖尿病;(3) CPR相关指标:CA至CPR时间、达到ROSC时间、初始可除颤心律、机械通气、肾上腺素用量;(4)复苏后首次实验室检测结果:白细胞、血红蛋白、血小板、血钠、血钾、血钙、基线肌酐(复苏后首次血清肌酐用作基线值[7])、尿素氮、尿酸、乳酸、白蛋白、球蛋白、谷丙转氨酶、谷草转氨酶、乳酸脱氢酶、总胆固醇、甘油三酯、C-反应蛋白、活化部分凝血活酶时间、脑钠肽、肌钙蛋白、D-二聚体、神经元特异性烯醇化酶;(5)评分:各项指标选取复苏后24 h内最差值(最高值或最低值)计算急性生理与慢性健康状况(acute physiology and chronic health evaluation, APACHE)-Ⅱ评分。上述检测结果均为患者入抢救室24 h内首次检测结果。
1.3 统计学方法采用SPSS 26.0、R软件(version 4.2.0)和GraphPad Prism(version 9.0)软件进行数据分析与绘图。正态分布计量资料以均数±标准差(x±s)形式表示,两组间比较采用两独立样本t检验;非正态分布计量资料以中位数(四分位数)[M(Q1, Q3)]表示,两组间比较采用Mann-Whitney U检验。计数资料以例数和(或)百分比表示,两组间比较采用χ2检验。本研究将纳入患者以7∶3比例随机分为训练组和验证组。先通过单因素分析筛选P < 0.05的变量纳入多因素Logistic回归模型(backward法)得出独立影响因素,并使用方差膨胀因子(variance infl ation factor, VIF)评估影响因素的相互作用,VIF > 5被认为具有多重共线性。通过受试者工作特征曲线(receiver operating characteristic, ROC)分析,得出各影响因素诊断效能与最佳Cut-off值。基于各影响因素构建列线图预测模型,同时将验证组数据纳入列线图模型进行验证。分别通过ROC曲线下面积(area under the ROC curve, AUC)评价列线图的预测效能;通过1 000次Bootstrap法构建校准曲线,采用Hosmer-Lemeshow检验评价模型拟合程度;通过5折交叉验证法构建临床决策曲线(decision curve analysis, DCA)评价模型临床有效性;通过临床影响曲线评价预测模型临床应用价值。以P < 0.05为差异有统计学意义。
2 结果 2.1 临床基线资料2016年2月1日至2023年9月30日共有563例CA后复苏成功患者。本研究根据纳排标准共纳入527例CA患者(图 1),其中AKI患者230例,占所有患者的43.6%。按7∶3随机分为训练组(n=368)及验证组(n=159)例。其中训练组AKI患者164例,验证组AKI患者66例。见图 1。训练组与验证组特征对比,各变量指标差异无统计学意义(均P > 0.05),说明两组数据同质性较好。见表 1。
|
| 注:CA为心脏骤停,AKI为急性肾损伤 图 1 训练和验证预测模型的流程图 Fig 1 The flow diagram of training and validating the prediction model |
|
|
| 指标 | 合计(n=527) | 训练组(n=368) | 验证组(n=159) | 统计值 | P值 |
| 性别(例,%) | 0.242 | 0.623 | |||
| 男 | 236 (44.8) | 167 (45.4) | 69 (43.4) | ||
| 女 | 291 (55.2) | 201 (54.6) | 90 (56.6) | ||
| 年龄(岁)a | 66 (62, 69) | 66 (62, 70) | 65 (62, 68) | 1.603 | 0.109 |
| BMI(kg/m2)a | 24.6 (23.3, 25.5) | 24.6 (23.4, 25.5) | 24.6 (22.8, 25.5) | 0.418 | 0.676 |
| CA家族史(例,%) | 92 (17.5) | 61 (16.6) | 31 (19.5) | 0.484 | 0.487 |
| 饮酒史(例,%) | 215 (40.8) | 149 (40.5) | 66 (41.5) | 0.069 | 0.792 |
| 吸烟史(例,%) | 254 (48.2) | 183 (49.7) | 71 (44.7) | 1.096 | 0.295 |
| 高血压(例,%) | 187 (35.5) | 125 (34.0) | 62 (39.0) | 0.858 | 0.354 |
| 糖尿病(例,%) | 238 (45.2) | 168 (45.7) | 70 (44.0) | 0.221 | 0.638 |
| 冠心病(例,%) | 219 (41.6) | 154 (41.8) | 65 (40.9) | 0.026 | 0.873 |
| CA至CPR时间(min)a | 4.5 (3.5, 5.5) | 4.5 (4.0, 5.5) | 4.0 (3.5, 5.5) | 0.143 | 0.886 |
| 初始可除颤心律(例,%) | 104 (19.7) | 71 (19.3) | 33 (20.7) | 0.085 | 0.771 |
| 肾上腺素用量(mg)a | 3 (3, 5) | 3 (2, 5) | 4 (3, 5) | 0.320 | 0.749 |
| 达到ROSC时间(min)a | 19.5 (8.5, 27.0) | 19.5 (8.0, 27.5) | 20.0 (8.5, 27.0) | 1.103 | 0.527 |
| 机械通气(例,%) | 333 (63.2) | 235 (63.9) | 98 (61.6) | 0.097 | 0.756 |
| WBC(×109/L)a | 8.3 (7.2, 9.7) | 8.3 (7.2, 9.6) | 8.3 (7.3, 9.8) | 0.069 | 0.945 |
| 血红蛋白(g/L)a | 114 (109, 119) | 115 (109, 119) | 114 (109, 119) | 0.666 | 0.506 |
| PLT(×109/L)a | 225 (203, 255) | 222 (203, 255) | 226 (207, 252) | 0.602 | 0.547 |
| 总胆固醇(mmol/L)a | 4.3 (4.1, 4.7) | 4.3 (4.1, 4.7) | 4.4 (4.0, 4.7) | 0.559 | 0.577 |
| 甘油三酯(mmol/L)a | 1.6 (1.5, 1.9) | 1.7 (1.5, 2.0) | 1.6 (1.4, 1.9) | 0.017 | 0.987 |
| 白蛋白(g/L)a | 48 (43, 50) | 47 (43, 50) | 48 (43, 51) | 0.734 | 0.463 |
| 球蛋白(g/L)a | 33 (30, 36) | 33 (30, 36) | 32 (29, 36) | 0.727 | 0.467 |
| ALT(U/L)a | 40 (33, 49) | 38 (32, 50) | 40 (33, 49) | 0.146 | 0.884 |
| AST(U/L)a | 31 (28, 33) | 31 (28, 33) | 30 (28, 33) | 1.283 | 0.200 |
| LDH(U/L)a | 199 (169, 217) | 199 (169, 215) | 199 (170, 218) | 0.459 | 0.646 |
| 肌酐(µmol/L)a | 95 (88, 104) | 96 (87, 103) | 95 (88, 104) | 0.906 | 0.365 |
| BUN(mmol/L)a | 8.8 (7.9, 11.1) | 8.8 (7.9, 11.2) | 8.8 (7.9, 11.1) | 1.195 | 0.232 |
| 尿酸(µmol/L)a | 312 (288, 345) | 312 (288, 345) | 311 (277, 343) | 1.111 | 0.267 |
| 血钾(mmol/L)a | 4.8 (4.4, 5.2) | 4.8 (4.4, 5.2) | 4.7 (4.5, 5.2) | 0.692 | 0.489 |
| 血钠(mmol/L)a | 144 (139, 150) | 144 (139, 150) | 144 (140, 150) | 1.204 | 0.229 |
| 血钙(mmol/L)a | 2.33 (2.23, 2.37) | 2.31 (2.23, 2.37) | 2.33 (2.21, 2.37) | 1.264 | 0.206 |
| LAC(mmol/L)a | 5.1 (4.4, 6.3) | 5.1 (4.4, 6.2) | 5.2 (4.6, 6.4) | 0.867 | 0.386 |
| BNP(ng/L)a | 141 (131, 212) | 141 (131, 212) | 140 (129, 214) | 0.474 | 0.636 |
| TNT(ng/mL)a | 0.26 (0.18, 0.44) | 0.27 (0.18, 0.44) | 0.25 (0.18, 0.43) | 0.385 | 0.700 |
| NSE(ng/mL)a | 18.4 (16.6, 21.9) | 18.4 (16.6, 22.7) | 18.4 (16.5, 20.7) | 0.011 | 0.991 |
| APTT(s)a | 36.1 (34.9, 37.5) | 35.9 (34.9, 37.3) | 36.2 (35.1, 37.7) | 0.688 | 0.492 |
| D-Dimer(ng/mL)a | 804 (643, 1 158) | 804 (662, 1 154) | 803 (638, 1 158) | 0.771 | 0.441 |
| CRP(mg/L)a | 7.3 (6.3, 10.3) | 7.4 (6.4, 10.3) | 7.3 (6.2, 10.2) | 1.107 | 0.268 |
| APACHEⅡ评分(分)a | 20 (18, 24) | 20 (18, 23) | 21 (18, 24) | 0.422 | 0.673 |
| 注:BMI为体重指数,CA为心脏骤停,CPR为心肺复苏,ROSC为自主循环恢复,WBC为白细胞计数,PLT为血小板计数,ALT为谷丙转氨酶,AST为天门冬氨酸氨基转移酶,LDH为乳酸脱氢酶,BUN为尿素氮,LAC为乳酸,BNP为B型脑钠肽,TNT为肌钙蛋白,NSE为神经元特异性烯醇化酶,APTT为活化部分凝血活酶时间,D-Dimer为D-二聚体,CRP为C-反应蛋白,APACHE Ⅱ评分为急性生理学和慢性健康状况评分Ⅱ;a为M(Q1, Q3) | |||||
多因素Logistic回归分析显示,年龄(OR=1.346,95%CI: 1.197~1.543,P < 0.001)、CA至CPR时间(OR=2.214,95%CI: 1.512~3.409,P=0.016)、肾上腺素用量(OR=1.921,95%CI: 1.383~2.783,P=0.004)、APACHE-Ⅱ评分(OR=1.531,95%CI: 1.316~1.820,P < 0.001)、基线肌酐(OR=1.137,95%CI: 1.090~1.196,P < 0.001)、乳酸(OR=2.558,95%CI: 1.680~4.167,P < 0.001)是发生AKI的独立危险因素,初始可除颤心律(OR=0.214,95%CI: 0.051~0.759,P=0.023)是发生AKI的保护性因素(表 2)。此外,各自变量之间未表现出多重共线性(均VIF < 5)。
| 变量 | 单因素Logistic分析 | 多因素Logistic分析 | |||||
| β值 | OR值(95%CI) | P值 | β值 | OR值(95%CI) | P值 | ||
| 年龄 | 0.299 | 1.348(1.264~1.448) | < 0.001 | 0.297 | 1.346(1.197~1.543) | < 0.001 | |
| CA至CPR时间 | 0.767 | 2.153(1.787~2.633) | < 0.001 | 0.795 | 2.214(1.512~3.409) | 0.016 | |
| 达到ROSC时间 | 0.101 | 1.106(1.085~1.135) | 0.002 | 0.095 | 1.099(0.995~1.204) | 0.063 | |
| 初始可除颤心律 | -1.869 | 0.154(0.072~0.300) | < 0.001 | -1.541 | 0.214(0.051~0.759) | 0.023 | |
| 机械通气 | 0.786 | 2.194(1.407~3.461) | 0.015 | 0.720 | 2.054(0.938~4.499) | 0.072 | |
| 肾上腺素用量 | 0.759 | 2.135(1.789~2.581) | < 0.001 | 0.653 | 1.921(1.383~2.783) | 0.004 | |
| BUN | 1.309 | 3.701(2.757~5.295) | 0.006 | 1.200 | 3.321(0.962~11.463) | 0.058 | |
| 基线肌酐 | 0.118 | 1.125(1.097~1.157) | < 0.001 | 0.129 | 1.137(1.090~1.196) | < 0.001 | |
| LAC | 0.878 | 2.406(1.962~3.004) | < 0.001 | 0.939 | 2.558(1.680~4.167) | < 0.001 | |
| D-Dimer | 0.835 | 2.305(1.401~3.847) | 0.007 | 0.600 | 1.822(0.827~4.014) | 0.137 | |
| APACHEⅡ评分 | 0.461 | 1.586(1.448~1.753) | < 0.001 | 0.426 | 1.531(1.316~1.820) | < 0.001 | |
| 注:CA为心脏骤停,CPR为心肺复苏,ROSC为自主循环恢复,BUN为尿素氮,LAC为乳酸,D-Dimer为D-二聚体,APACHEⅡ评分为急性生理学和慢性健康状况评分Ⅱ | |||||||
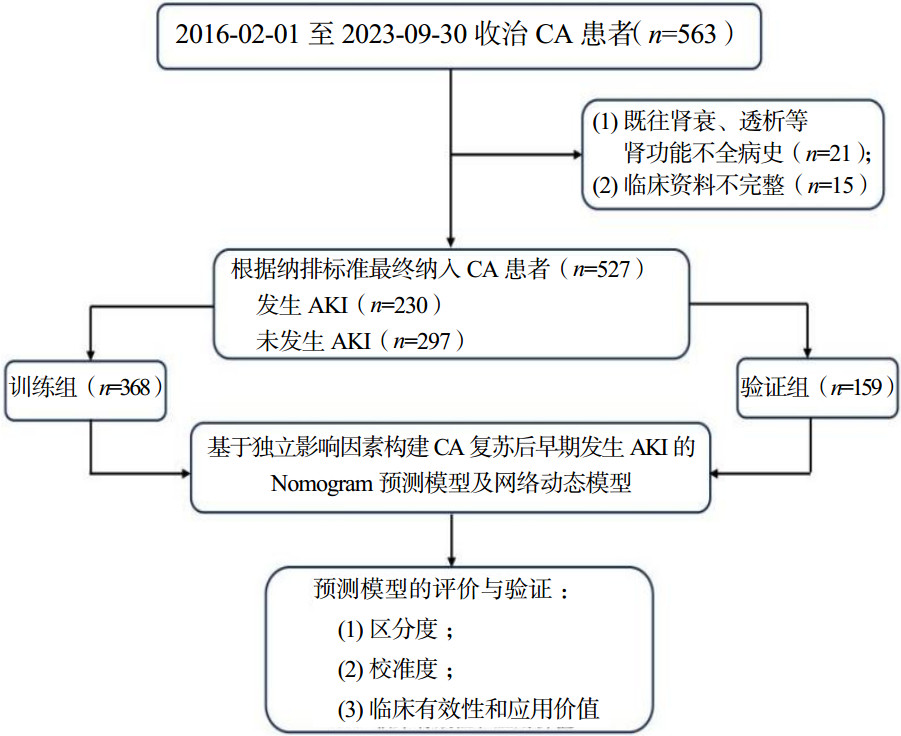
通过对年龄、CA至CPR时间、初始可除颤心律、肾上腺素用量、APACHE -Ⅱ评分、基线肌酐及血乳酸预测CA复苏后AKI的发生建立ROC曲线,得出各指标诊断效能与最佳Cut-off值。其中APACHE Ⅱ评分AUC值为0.838(95%CI:0.798~0.878,P < 0.001),优于其他因素,其预测发生AKI最佳Cut-off值为21分,敏感度为0.627,特异度为0.876。见表 3及图 2。
| 因素 | AUC | 95%CI | 最佳Cut-off值 | 约登指数 | 敏感度 | 特异度 | |
| 年龄 | 0.770 | 0.720~0.821 | 67 | 0.493 | 0.683 | 0.810 | |
| CA至CPR时间 | 0.739 | 0.689~0.788 | 4.5 | 0.390 | 0.776 | 0.614 | |
| 初始可除颤心律 | 0.617 | 0.560~0.673 | - | 0.337 | 0.615 | 0.722 | |
| 肾上腺素用量 | 0.765 | 0.714~0.816 | 3 | 0.463 | 0.758 | 0.705 | |
| 基线肌酐 | 0.788 | 0.741~0.834 | 97 | 0.439 | 0.596 | 0.843 | |
| LAC | 0.776 | 0.732~0.825 | 7.4 | 0.455 | 0.565 | 0890 | |
| APACHEⅡ评分 | 0.838 | 0.798~0.878 | 21 | 0.503 | 0.627 | 0.876 | |
| 注:CA为心脏骤停,CPR为心肺复苏,LAC为乳酸,APACHEⅡ评分为急性生理学和慢性健康状况评分Ⅱ,-表示无相关数据 | |||||||
|
| 注:APACHEⅡ评分为急性生理学和慢性健康状况评分Ⅱ,LAC为乳酸,CA为心脏骤停,CPR为心肺复苏 图 2 预测CA患者发生AKI的单个指标的ROC曲线 |
|
|
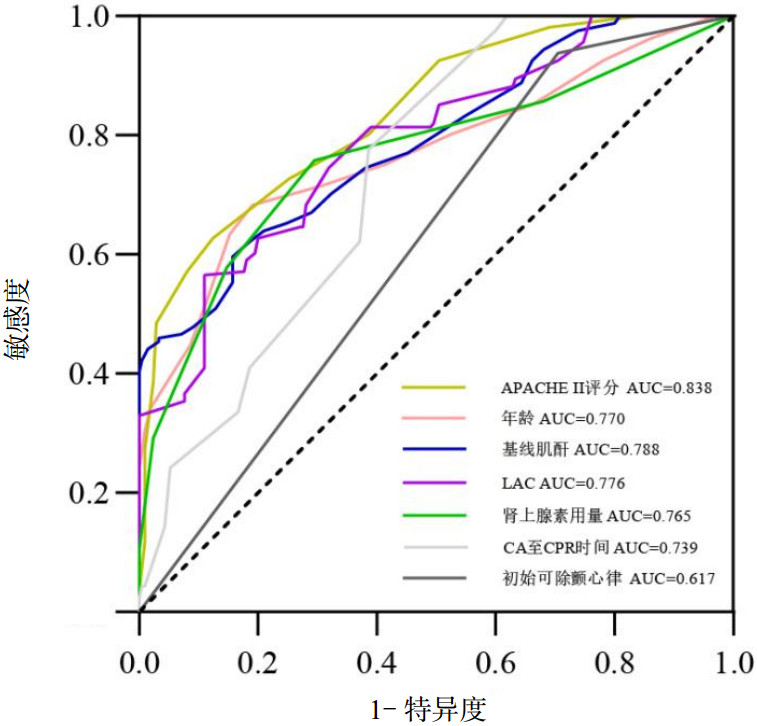
基于上述多因素Logistic回归分析结果构建列线图,见图 3。根据每一项指标,垂直画一条线到评分轴上,从而得到分值,最后将分值相加得到总分,总分向下的垂直线对应CA患者复苏后发生AKI概率。另本预测模型通过R软件DynNom包动态列线图,在shinyapps.io主页面加载reconnect包,将预测模型映射到网页(https://cpr-aki.shinyapps.io/wangjinxiang/),在预测网页界面选定各影响因素数值后,点击“Data”即可预测CA患者发生AKI概率。见图 4。该网络版动态列线图预测模型已申请国家发明专利(专利号:ZL2024108806096)。
|
| 注:CA为心脏骤停,CPR为心肺复苏,APACHEⅡ评分为急性生理学和慢性健康状况评分Ⅱ,LAC为乳酸 图 3 注:APACHEⅡ评分为急性生理学和慢性健康状况评分Ⅱ,LAC为乳酸,CA为心脏骤停,CPR为心肺复苏 Fig 3 Nomogram prediction model of AKI in patients with cardiac arrest |
|
|
|
| 图 4 CA患者发生AKI的网络版动态列线图预测模型 Fig 4 Network version dynamic nomogram prediction model of AKI in patients with cardiac arrest |
|
|
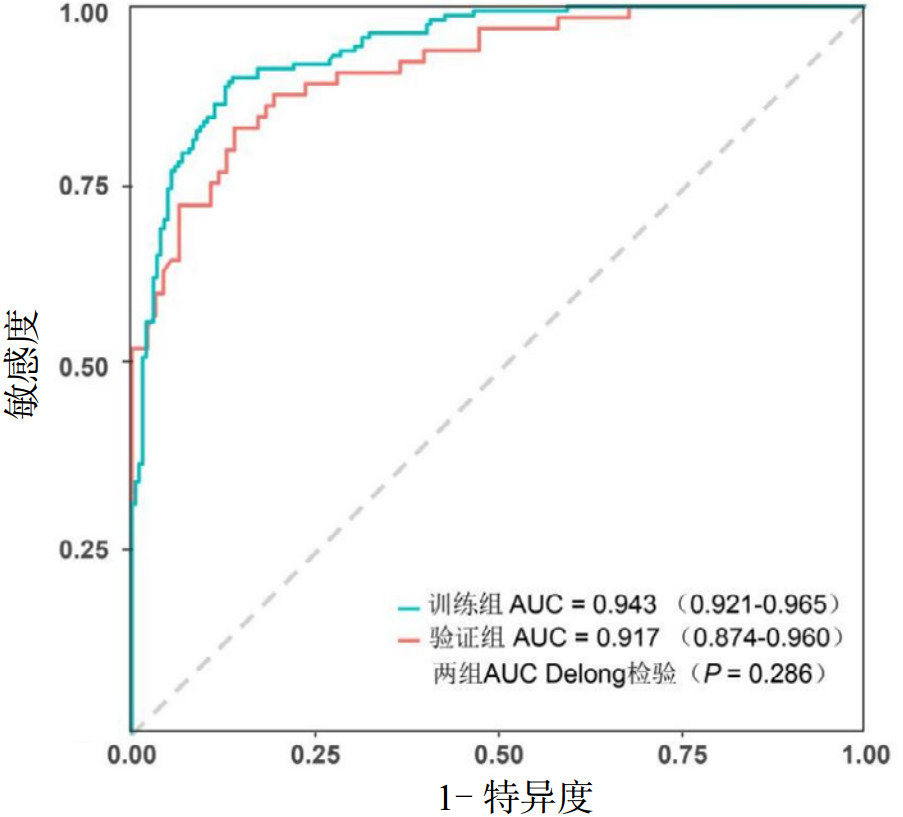
ROC曲线分析显示,训练组AUC值为0.943(95%CI:0.921~0.965),敏感度为0.902,特异度为0.863,表明列线图具有表良好预测效能,且优于其他独立影响因素(均P < 0.001)。将验证集数据带入构建的列线图,其对CA复苏后发生AKI预测AUC值为0.917(95%CI: 0.874~0.960),敏感度为0.879,特异度为0.796。训练组AUC和验证组AUC行Delong非参数检验,差异无统计学意义(P=0.286),表明分组数据同质性较好。见图 5。
|
| 图 5 训练组和验证组的ROC曲线比较 Fig 5 Comparison of the ROC curves of the training and validation groups |
|
|
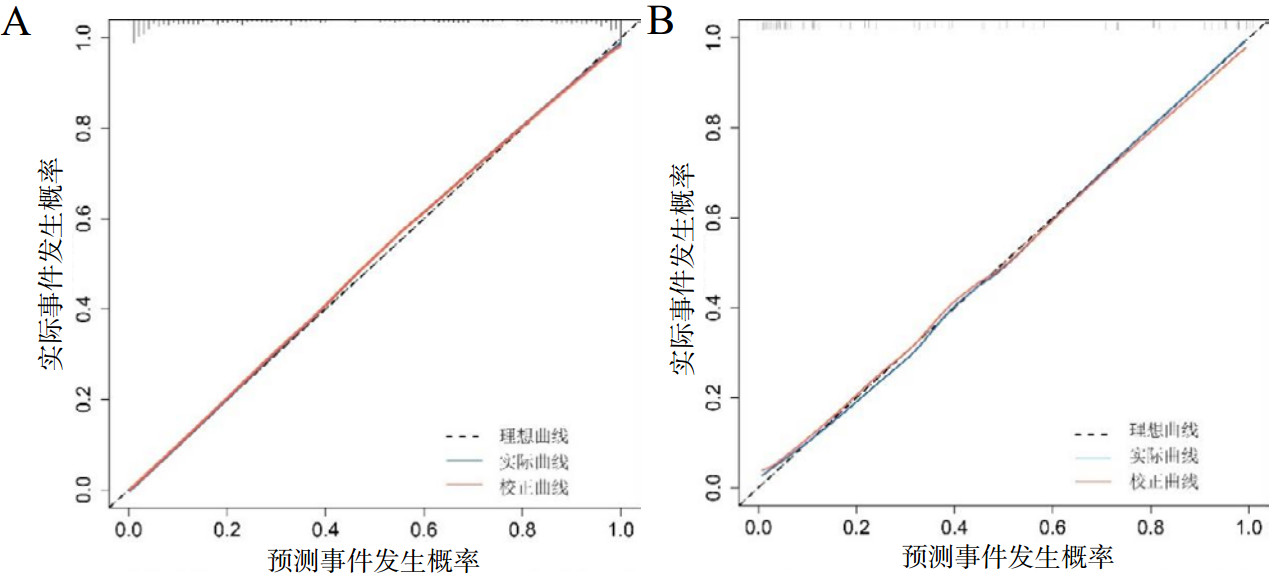
训练组实际曲线和校准曲线一致性表现良好,校准曲线经1 000次Bootstrap抽样验证,平均绝对误差(mean absolute error, MAE)为0.006,Hosmer-Lemeshow检验(χ2=4.499,P=0.809)结果差异无统计学意义,说明模型预测概率与实际概率结果基本一致,提示该模型的拟合度较好(图 6A);验证组实际曲线和校准曲线一致性表现良好,校准曲线经1 000次Bootstrap抽样验证,MAE为0.011,Hosmer-Lemeshow检验(χ2=9.345,P=0.314)结果差异无统计学意义,说明模型预测概率与实际概率结果基本一致,提示该模型的拟合度较好(图 6B)。
|
| 注:A为训练组中的校准曲线;B为验证组中的校准曲线 图 6 CA患者发生AKI的训练组与验证组中校准曲线比较 Fig 6 Comparison of calibration curves for the training and validation group for AKI in patients with cardiac arrest |
|
|
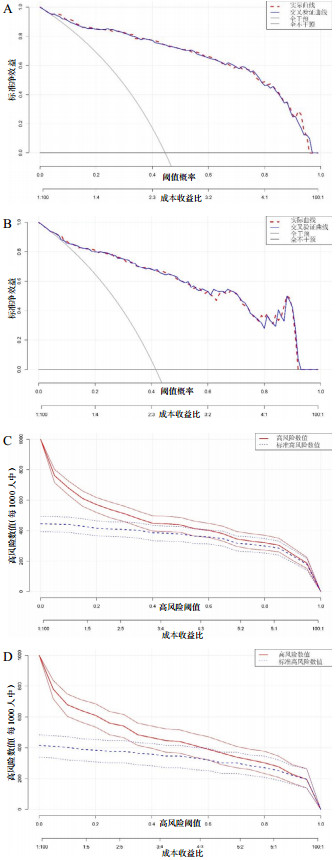
DCA曲线显示,训练组和验证组实际曲线与交叉验证曲线重合度高,均表现出良好的临床净获益,表明模型具有显著的临床有效性(图 7A、7B);训练组和验证组临床影响曲线提示,发生AKI的高风险人数和实际发生人数趋向于接近风险阈值,表明模型具有显著的预测能力和良好的临床应用价值(图 7C、7D)。
|
| 注:A为训练组中的决策曲线;B为验证组中的决策曲线;C为训练组中的临床影响曲线;D为验证组中的临床影响曲线 图 7 CA患者发生AKI的训练组与验证组中决策曲线和临床影响曲线比较 Fig 7 Comparison of decision curves and clinical impact curves for the training and validation group for AKI in patients with cardiac arrest |
|
|
本研究共纳入527例CA复苏患者,其中AKI患者230例,AKI发生率为43.6%,与相关文献报道概率相一致[4]。本研究通过单因素和多因素Logistic回归分析发现年龄、CA至CPR时间、肾上腺素用量、APACHE-Ⅱ评分、基线肌酐、乳酸是发生AKI的独立危险因素,初始可除颤心律是发生AKI的保护性因素。基于以上变量构建列线图预测模型,其AUC值为0.943(95%CI: 0.921~0.965)明显高于单一变量,同时该模型具有良好的区分度、校准度、临床有效性和应用价值。欧洲一项580例CA患者参与的前瞻性研究发现:年龄、公众场所CA、CA至CPR时间、CPR至ROSC时间、复苏时肾上腺素用量是发生AKI的独立危险因素;ICU首日肌酐清除率、男性及可除颤心律是发生AKI的保护性因素[8]。这一发现与本研究结果基本一致。
本研究发现CA复苏后发生AKI的独立影响因素主要集中于3个阶段: (1) CA前:年龄;(2)CA至ROSC:CA至CPR时间、初始可除颤心律及复苏时肾上腺素用量;(3) ROSC后:复苏后24 h内APACHE-Ⅱ评分、基线肌酐及乳酸。因此,针对不同阶段制定有效的防治措施,可有效降低AKI的发生风险。有研究显示,CA至开始CPR时间越短,在急救人员目击下发生CA第一时间为可除颤心律概率更高[9]。北美地区报道OHCA初始可除颤心律占比达26.3%[10]。来自亚洲的研究报道OHCA初始可除颤心律比例为4.1%至19.8%[11]。吴金山等[12]研究报道缩短CPR时间并早期快速识别室颤,可显著减轻肾脏不可逆损伤。CA患者通常需要血管活性药物来维持循环功能[13]。Dupont等[14]研究报道肾上腺素用量提示CPR的复杂程度及预后,并影响AKI的发生风险。本研究结果显示肾上腺素最佳Cut-off值为3 mg,表明超过该使用剂量可能会增加AKI的发生风险。乳酸主要反映机体无氧代谢和器官灌注状态,常用来预测CPR患者的预后[15-16]。而肾脏对低灌注极为敏感[17],本研究显示乳酸值高于7.4 mmol/L可能显著增加AKI发生风险,这一结果与有关报道一致:高乳酸血症是AKI发生的独立危险因素[18]。同时本研究发现基线肌酐Cut-off值为97 µmol/L,表明对于基线肌酐高于97 µmol/L的患者而言,可能存在更高的AKI风险。另外本研究结果显示年龄大于67岁可能会增加AKI的发生风险,该结果与Zhang等[19]研究报道一致:年龄因素是AKI的独立危险因素。
本研究发现各独立影响因素中APACHE-Ⅱ评分AUC值最大为0.838(95%CI:0.798~0.878,P < 0.001),最佳Cut-off值为21分,其预测AKI风险能力优于其他指标。APACHE-Ⅱ评分常用于评估急危重症患者疾病严重程度[20]。本研究中APACHE-II评分选取复苏后24 h内最差值,表明复苏后ROSC阶段的严重状态对AKI发生风险影响较大。Chua等[21]研究发现复苏后休克状态及时间是CA后发生AKI的危险因素,且关联强度较高,提示除CA本身外,复苏后疾病状态对于CA后AKI发生的重要意义,休克可能造成持续性缺血,加重肾损伤。郭治国和马青变[22]发现CA后肾脏损伤的病理生理机制有缺血-再灌注和持续的循环衰竭休克状态,而后者对肾脏的影响可能更大。因此,及时有效地CPR,尤其在ROCS后改善复苏后休克状态和时间,可有效降低CA复苏后AKI的发生概率。综上,本研究基于7种独立影响因素构建列线图预测模型,同时采用网络版动态列线图可以更加方便快捷地预测CA复苏后早期发生AKI的概率,为早期识别AKI与精准干预提供新的策略。
本研究存在一定的局限性。首先,此研究是单中心数据资料,样本量较少,缺少外部验证,后续需大样本、多中心的数据资料进行外部验证;其次,本研究为一项回顾性研究,可能存在选择偏倚,研究纳入的肌酐值并非评估AKI的敏感指标,今后需开展前瞻性研究,并选用早期肾损伤的敏感标志物检测,如中性粒细胞明胶酶相关载脂蛋白、肾损伤分子-1等,进一步优化并完善预测模型。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王晋祥:研究设计、数据收集及论文撰写;华罗刚:研究实施、数据收集整理;王力军、余慕明、靳衡:研究设计及论文修改;续国武:论文修改、统计学分析
| [1] | 兰超, 张强, 雷如意, 等. 心脏骤停救治现状及2023年研究热点[J]. 中华急诊医学杂志, 2024, 33(1): 6-10. DOI:10.3760/cma.j.issn.1671-0282.2024.01.002 |
| [2] | 陈玉国, 徐峰. 中国心脏骤停与心肺复苏报告: 2022年版[M]. 北京: 人民卫生出版社, 2023. |
| [3] | 金晓红, 徐杰丰, 张茂. 心脏骤停复苏后急性肾损伤的研究进展[J]. 中国急救医学, 2019, 39(7): 704-709. DOI:10.3969/j.issn.1002-1949.2019.07.019 |
| [4] | Rundgren M, Ullén S, Morgan MPG, et al. Renal function after out-of-hospital cardiac arrest; the influence of temperature management and coronary angiography, a post hoc study of the target temperature management trial[J]. Crit Care, 2019, 23(1): 163. DOI:10.1186/s13054-019-2390-0 |
| [5] | 孙昀. 急性肾损伤: 当前研究热点与进展[J]. 中华急诊医学杂志, 2023, 32(9): 1147-1151. DOI:10.3760/cma.j.issn.1671-0282.2023.09.001 |
| [6] | Disease K. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group[J]. Kidney International, 2012, 2: 1-138. |
| [7] | Ad-hoc working group of ERBP, Fliser D, Laville M, et al. A European renal best practice (ERBP) position statement on the kidney disease improving global outcomes (KDIGO) clinical practice guidelines on acute kidney injury: part 1: definitions, conservative management and contrast-induced nephropathy[J]. Nephrol Dial Transplant, 2012, 27(12): 4263-4272. DOI:10.1093/ndt/gfs375 |
| [8] | Geri G, Guillemet L, Dumas F, et al. Acute kidney injury after out-of-hospital cardiac arrest: risk factors and prognosis in a large cohort[J]. Intensive Care Med, 2015, 41(7): 1273-1280. DOI:10.1007/s00134-015-3848-4 |
| [9] | Virani SS, Alonso A, Benjamin EJ, et al. Heart disease and stroke statistics-2020 update: a report from the American heart association[J]. Circulation, 2020, 141(9): e139-e596. DOI:10.1161/CIR.0000000000000757 |
| [10] | 黄燕梅, 张婉婉, 张永恕, 等. 院外心脏骤停初始可除颤心律的流行病学预测因素分析[J]. 中华急诊医学杂志, 2019, 28(10): 1296-1300. DOI:10.3760/cma.j.issn.1671-0282.2019.10.022 |
| [11] | Ong MEH, Do Shin S, De Souza NNA, et al. Outcomes for out-of-hospital cardiac arrests across 7 countries in Asia: the pan Asian resuscitation outcomes study (PAROS)[J]. Resuscitation, 2015, 96: 100-108. DOI:10.1016/j.resuscitation.2015.07.026 |
| [12] | 吴金山, 张晓凡, 姜琳. 院外心脏骤停复苏后实现心肺脑复苏患者特征分析探讨[J]. 中华急诊医学杂志, 2024, 33(1): 33-38. DOI:10.3760/cma.j.issn.1671-0282.2024.01.006 |
| [13] | Singh A, Heeney M, Montgomery ME. The pharmacologic management of cardiac arrest[J]. Emerg Med Clin North Am, 2023, 41(3): 559-572. DOI:10.1016/j.emc.2023.03.010 |
| [14] | Dupont V, Bonnet-Lebrun AS, Boileve A, et al. Impact of early mean arterial pressure level on severe acute kidney injury occurrence after out-of-hospital cardiac arrest[J]. Ann Intensive Care, 2022, 12(1): 69. DOI:10.1186/s13613-022-01045-1 |
| [15] | Prachanukool T, Sanguanwit P, Yuksen KSC, et al. Initial venous lactate levels as a predictor of mortality in severe sepsis: a single-center retrospective cohort study[J]. World J Emerg Med, 2022, 13(5): 396-399. DOI:10.5847/wjem.j.1920-8642.2022.078 |
| [16] | Issa MS, Grossestreuer AV, Patel H, et al. Lactate and hypotension as predictors of mortality after in-hospital cardiac arrest[J]. Resuscitation, 2021, 158: 208-214. DOI:10.1016/j.resuscitation.2020.10.018 |
| [17] | 丁新焕, 彭耀军, 黄晶晶, 等. 急诊科脓毒症患者心脏骤停风险预测模型构建[J]. 中华急诊医学杂志, 2023, 32(12): 1693-1698. DOI:10.3760/cma.j.issn.1671-0282.2023.12.020 |
| [18] | García AF, Manzano-Nunez R, Bayona JG, et al. Acute kidney injury in severely injured patients admitted to the intensive care unit[J]. Mil Med Res, 2020, 7(1): 47. DOI:10.1186/s40779-020-00277-1 |
| [19] | Zhang ZH, Ho KM, Hong YC. Machine learning for the prediction of volume responsiveness in patients with oliguric acute kidney injury in critical care[J]. Crit Care, 2019, 23(1): 112. DOI:10.1186/s13054-019-2411-z |
| [20] | Tujjar O, Mineo G, Dell'Anna A, et al. Acute kidney injury after cardiac arrest[J]. Crit Care, 2015, 19(1): 169. DOI:10.1186/s13054-015-0900-2 |
| [21] | Chua HR, Glassford N, Bellomo R. Acute kidney injury after cardiac arrest[J]. Resuscitation, 2012, 83(6): 721-727. DOI:10.1016/j.resuscitation.2011.11.030 |
| [22] | 郭治国, 马青变. 心搏骤停后急性肾损伤的研究进展[J]. 中国全科医学, 2015, 18(32): 3901-3905. DOI:10.3969/j.issn.1007-9572.2015.32.002 |
 2025, Vol. 34
2025, Vol. 34