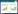2. 宜昌市中心人民医院心血管内科,宜昌 443003;
3. 缺血性心血管病湖北省重点实验室,宜昌 443003;
4. 湖北省缺血性心血管疾病临床医学研究中心,宜昌 443003
2. Department of Cardiology, Yichang Central People's Hospital, Yichang 443003, China;
3. Hubei Key Laboratory of Ischemic Cardiovascular Disease, Yichang 443003, China;
4. HuBei Clinical Research Center for Ischemic Cardiovascular Disease, Yichang 443003, China
急性心肌梗死(acute myocardial infarction, AMI)是世界范围内致死率和致残率较高的急危重症心血管疾病,其发病率在中国近几十年呈显著上升趋势[1]。随着治疗技术的进步,使AMI患者早期有效地接受血运重建技术,可挽救部分缺血心肌,从而改善患者预后[2]。然而,在恢复血液再灌注的过程中可导致部分缺血心肌的损伤进一步加重,出现心律失常、心肌顿抑和微血管功能障碍等一系列病理事件,这一过程为心肌缺血-再灌注损伤(myocardial ischemia-reperfusion injury, MI/RI),导致再灌注治疗的临床净获益被严重削弱[3]。因此,深入探索MI/RI的病理机制并寻找减轻MI/RI的有效措施具有重要的临床意义。
MI/RI的病理生理机制涉及程序性细胞死亡、氧化应激、钙超载、免疫反应、炎症反应等[4]。其中氧化应激是MI/RI的重要发病机制之一。核转录因子红系2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/血红素加氧酶1(heme oxygenase-1,HO-1)信号通路作为氧化应激反应中的关键信号通路,通过参与了炎症反应、氧化应激、程序性细胞死亡等过程,在MI/RI的发生发展过程中发挥重要作用[5]。因此,通过调节Nrf2/HO-1信号通路抑制氧化应激可能是减轻MI/RI的有效策略。
细胞FLICE样抑制蛋白(cellular FLICE-like inhibitory protein, cFLIP)是抑制caspase-8活性的一种天然蛋白,cFLIP包括一个长cFLIP亚型和两个短cFLIP亚型,分别命名为cFLIPL、cFLIPS和cFLIPR,在大多数生命过程中作为凋亡抑制因子发挥作用[6]。此外相关研究表明cFLIP在调节细胞自噬、程序性坏死、内质网应激以及氧化应激等病理生理过程中发挥重要作用[7-10]。然而,关于cFLIP是否对MI/RI中的氧化应激是否具有调控作用仍未有研究。本研究拟通过构建重组腺病毒过表达心肌细胞中cFLIP蛋白,研究cFLIP在大鼠MI/RI中的作用,并进一步探讨cFLIP对MI/RI诱导氧化应激的调节机制,为防治MI/RI寻找新的有效靶点。
1 材料与方法 1.1 构建cFLIP重组腺病毒本研究所用重组腺病毒载体cFLIPL(Ad-cFLIPL)和病毒对照组(Ad-NC)由上海吉凯基因医学科技股份有限公司构建和纯化。利用限制性内切酶消化获得线性化载体。PCR扩增制备目的基因片段。使用该引物扩增目的基因片段,扩增产物5’和3’最末端的序列分别与线性化克隆载体两末端序列完全一致。对阳性克隆进行测序及结果分析获得高纯度的质粒,经HEK293细胞包装后,扩增、浓缩,从而获得一定滴度的Ad-cFLIPL[5]。
1.2 动物分组48只雄性无特定病原体级SD大鼠均在三峡大学实验动物中心购买,体重为180~200 g。所有动物实验根据“三峡大学实验动物护理和使用指南”进行,并经动物实验伦理委员会批准,批准号为2023060U。采用随机数字抽签法将SD大鼠随机分为以下4组:(1)假手术组(sham组):开胸后只穿线,不结扎冠状动脉左前降支(left anterior descending, LAD);(2)缺血-再灌注组(ischemia-reperfusion,I/R组):开胸后结扎LAD 30 min,再灌注3 h;(3) I/R+Ad-NC组:预先3 d感染Ad-NC后,开胸后结扎LAD 30 min,再灌注3 h;(4) I/R+Ad-cFLIPL组:预先3 d感染Ad-cFLIPL后,开胸后结扎LAD 30 min,再灌注3 h。
1.3 腺病毒感染大鼠心肌组织使用电子天平对大鼠进行称重,按照1 mL/kg的标准腹腔注射3%的戊巴比妥钠麻醉大鼠,待大鼠麻醉后剃毛,充分暴露颈部和胸部,沿胸骨上缘和颈前正中线位置剪开皮肤,使用钝性弯镊逐层分离皮下组织暴露气管,行气管插管。沿胸部中线偏左侧剪开皮肤,逐层分离皮下肌肉组织并于4~5肋间打开胸腔,撕开心包膜,用胰岛素针在心前区及心尖部多点注射滴度为5×109 pfu的重组腺病毒悬液,注射完成后逐层缝合伤口。
1.4 I/R模型建立重组腺病毒转染3 d后,建立大鼠I/R模型。按照上述步骤再次麻醉、插管并打开胸腔暴露心脏,于心尖搏动最明显处剪开肋骨,轻柔挑起左心耳,找到肺动脉圆锥部与左心耳根部之间的LAD,于左心耳下缘约2 mm处进针用6-0丝线将凹槽乳胶管与LAD结扎,见心尖部由于缺血变白后快速关闭胸腔。连接小动物心电图机,见ST段抬高提示缺血成功,并记录缺血时间。缺血30 min后,于乳胶管凹槽处剪断丝线,取出乳胶管,再灌注3 h。收集心脏组织及血液标本[5]。
1.5 超声心动图评估大鼠心脏功能按动物实验分组经相应处理并构建I/R模型后,再次腹腔注射戊巴比妥钠麻醉大鼠,固定于小动物解剖台上,采用M型高频超声探头,取大鼠的心脏长轴切面,通过计算机软件计算连续5个心动周期的平均值来评估左心室射血分数(left ventricular ejection fraction, LVEF)和左心室短轴缩短率(left ventricular fractional shortening, LVFS)。
1.6 2, 3, 5- 氯化三苯基四氮唑(2, 3, 5- Triphenyl tetrazolium chloride, TTC)染色检测心肌梗死面积再灌注结束后,再次麻醉大鼠并固定于解剖台上,沿原切口打开胸腔充分暴露心脏,取出完整心脏后于-20 ℃冰冻30 min。心脏冻硬后取出,使用刀片自心尖部沿着与左心室长轴垂直的方向均匀的将心脏切成1~2 mm的薄片。将心脏切片浸泡于1.5%的TTC(Sigma公司)溶液中,置于37℃的避光条件下孵育15 min。染色结束后,将心脏切片取出置于装有多聚甲醛的5 mL EP管中浸泡过夜。将心脏切片按大小顺序排列后,用数码相机进行拍照,白色区域为发生缺血并梗死的心肌组织,图片进一步经电脑软件(Image-Pro Plus)分析处理。
1.7 大鼠心肌组织HE染色再灌注结束后,取出心脏并固定于多聚甲醛中24 h。随后依次进行脱水、包埋、切片、脱蜡以及染色,最后将切片放在通风橱里晾干后,放在显微镜下拍照。
1.8 大鼠血清心肌酶的生化检测再灌注完成后,使用5 mL注射器从下腔静脉缓慢抽取3 mL静脉血液于采血管中,置于4 ℃冰箱中保存,将采集的血液标本用2 000 r/min离心15 min后收集上清液。使用全自动化分析仪(德国西门子)检测乳酸脱氢酶(lactate dehydrogenase, LDH)和肌酸激酶同工酶(creatine Kinase-MB, CK-MB)水平。
1.9 大鼠血清氧化应激标志物检测称取100 mg大鼠心肌组织,用磷酸缓冲液(PBS)洗涤后制备成组织匀浆液,将组织匀浆液用4 ℃低温离心机以3 500 r/min离心15 min,收集上清液。严格按照试剂盒(中国碧云天)使用说明书分别检测超氧化物酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(Glutathione Peroxidase, GSH-px)以及丙二醛(Malondialdehyde, MDA)。
1.10 大鼠心肌组织活性氧检测将心肌组织用PBS清洗后,立即进行冷冻切片。随后将浓度为10 µmol/L的DHE(Sigma公司)溶液均匀滴于组织切片上,避光条件下37 ℃孵育20 min后用PBS清洗2次,于共聚焦显微镜下拍照观察。
1.11 Western blot检测蛋白表达取心肌组织提取蛋白后,用紫外分光光度计检测各组蛋白浓度。按上清液体积按比例加入5×蛋白上样缓冲液后,在95 ℃金属锅中加热5 min,使蛋白变性。将配制好的10% SDS-PAGE凝胶固定于电泳槽中,设置恒压80 V的电压进行电泳,转膜仪设置恒流200 mA的湿转法将蛋白转膜至PVDF膜上。用5%的脱脂牛奶封闭3 h,加入一抗Nrf2(1∶1 000,三鹰公司)、HO-1(1∶1 000,三鹰公司)、LaminB1(1∶5 000,三鹰公司)、GAPDH(1∶5 000,三鹰公司)于4 ℃孵育过夜。次日回收一抗,TBST洗膜3次,在室温下条件下加入二抗孵育2 h,TBST洗膜3次,将PVDF膜置入ECL显影液中,于显影仪中显像并保存图片,用Image J软件对条带进行蛋白定量分析。
1.12 统计学方法实验结果使用SPSS 25.0进行分析,所有计量数据均以均数±标准差(x±s)表示,多组数据间比较采用单因素方差分析,组间的进一步两两比较使用最小显著性差异法(least significance difference, LSD)。采用GraphPad Prism 7软件绘制直方图,以P < 0.05为差异有统计学意义。
2 结果 2.1 成功感染重组腺病毒至大鼠心肌组织重组腺病毒cFLIPL注射至大鼠心肌组织3 d后,分别取各组大鼠心肌组织进行切片,置于荧光显微镜下观察,结果显示sham组与I/R组心肌组织无绿色荧光,而I/R+Ad-NC组和I/R+Ad-cFLIPL组心肌组织绿色荧光表达明显(图 1A)。进一步使用Western blot检测各组大鼠心肌细胞间cFLIPL的蛋白表达,发现与sham组相比,I/R组和I/R+Ad-NC组可显著下调cFLIPL的表达,而与I/R+Ad-NC组相比,I/R+Ad-cFLIPL组显著上调了cFLIPL的表达(图 1B、C)。以上结果提示重组腺病毒cFLIPL已成功感染至大鼠心肌组织。
|
| 注:A为荧光显微镜观察腺病毒感染心肌组织情况(×100);B为各组大鼠心肌组织cFLIPL蛋白表达比较;C为以GAPDH为内参统计的cFLIPL的量化分析;与sham组相比,aP < 0.05;与I/R+Ad-NC组相比,bP < 0.05 图 1 重组腺病毒成功感染大鼠心肌组织 Fig 1 Successful infection of rat myocardial tissue with recombinant adenovirus |
|
|
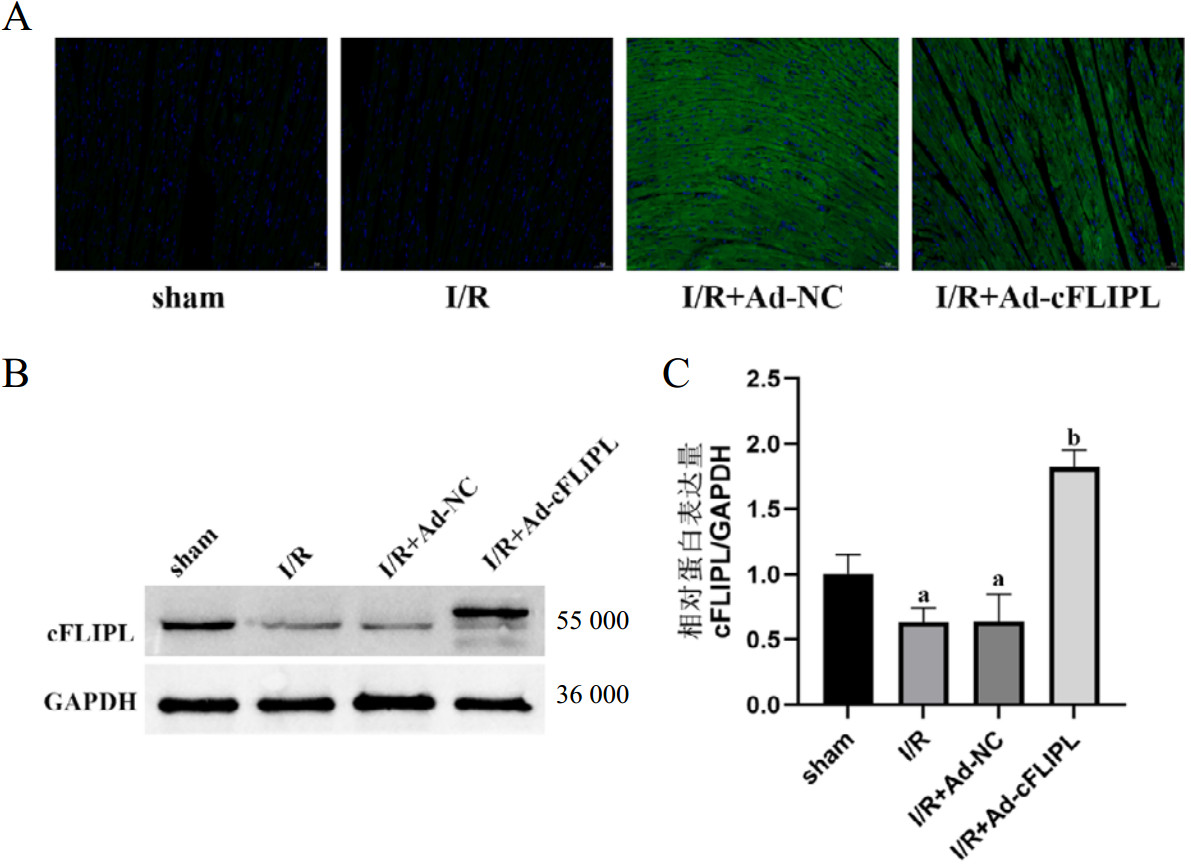
使用超声心动图评估I/R后大鼠心脏功能发现,与sham组相比,I/R组和I/R+Ad-NC组大鼠LVEF和LVFS值均显著降低(均P < 0.05),而与I/R+Ad-NC组相比,I/R+Ad-cFLIPL组LVEF和LVFS值均显著上升,差异具有统计学意义(图 2)。
|
| 注:A为各组大鼠心脏超声心动图;B为各组大鼠LVEF的量化分析;C为各组大鼠LVFS的量化分析;与sham组相比,aP < 0.05;与I/R+Ad-NC组相比,bP < 0.05 图 2 各组大鼠心功能的比较 Fig 2 Comparison of cardiac function of rats in each group |
|
|
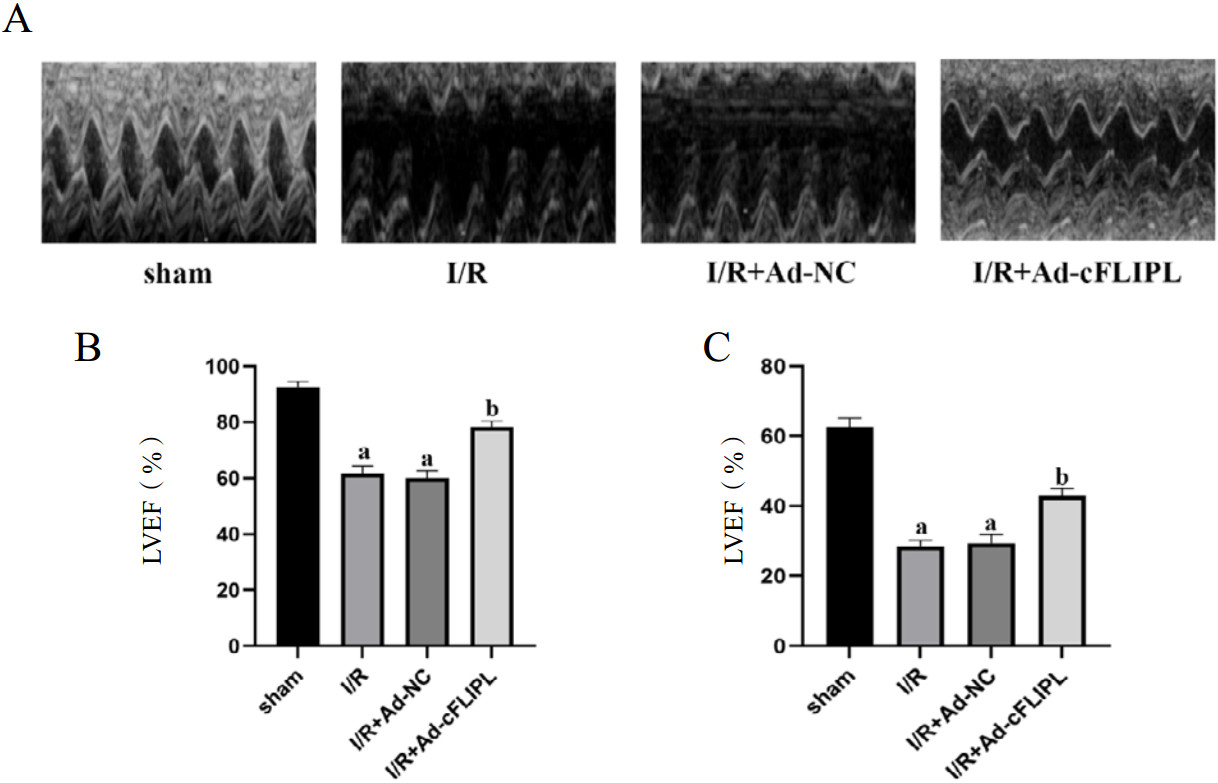
使用TTC染色检测各组大鼠心肌梗死面积,其中正常心肌区域为红色,梗死区域为白色。与sham组相比,I/R组和I/R+Ad-NC组大鼠心肌梗死面积显著增加(均P < 0.05)。而与I/R+Ad-NC组相比,I/R+Ad-cFLIPL组心肌梗死面积显著降低(P < 0.05)。见图 3。
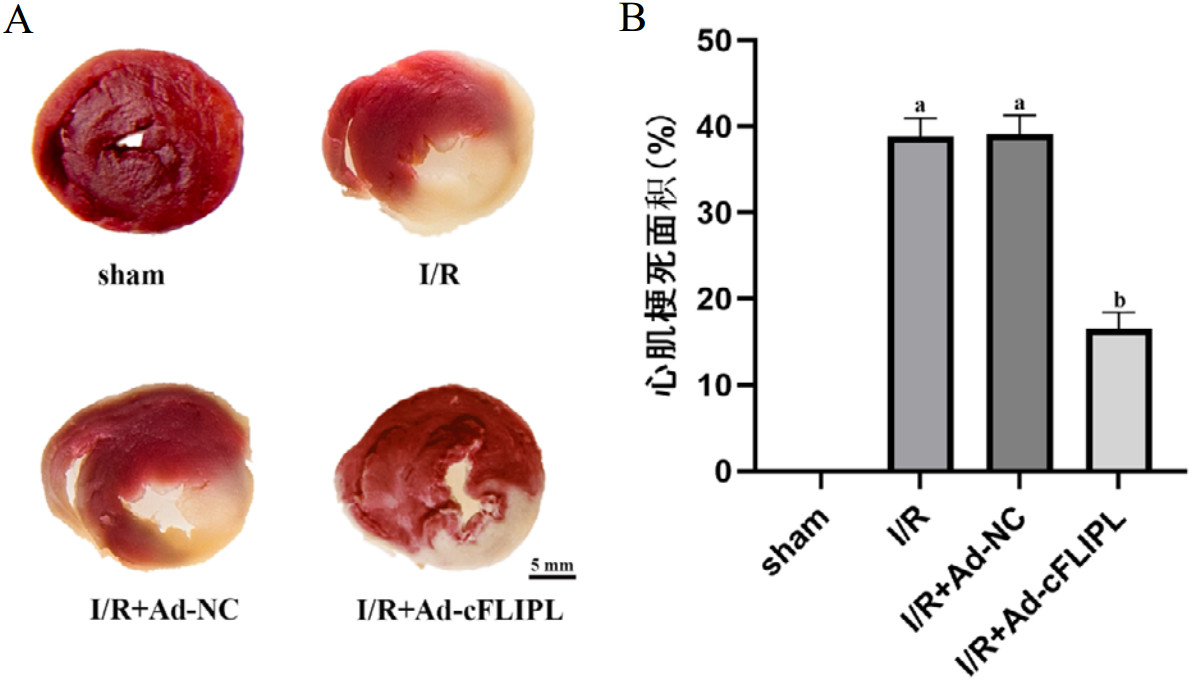
|
| 注:A为各组心肌组织的TTC染色结果;B为TTC染色结果的量化分析;与sham组相比,aP < < 0.05;与I/R+Ad-NC组相比,bP < 0.05 图 3 各组大鼠心肌梗死面积的比较 Fig 3 Comparison of myocardial infarct size in each group of rats |
|
|
使用HE染色评估各组心肌组织状态,如图 4A所示,sham组心肌细胞排列整齐,无心肌纤维断裂,I/R组和I/R+Ad-NC组心肌细胞排列紊乱,出现心肌细胞坏死、肿胀和心肌纤维断裂,而I/R+ Ad-cFLIPL组心肌细胞的损伤明显减轻。进一步检测各组血清心肌酶发现,与sham组相比,I/R组和I/R+Ad-NC组的LDH和CK-MB水平显著升高(均P < 0.05),而与I/R+Ad-NC组相比,I/R+Ad-cFLIPL组LDH和CK-MB水平显著降低(P < 0.05)(图 4B、C)。
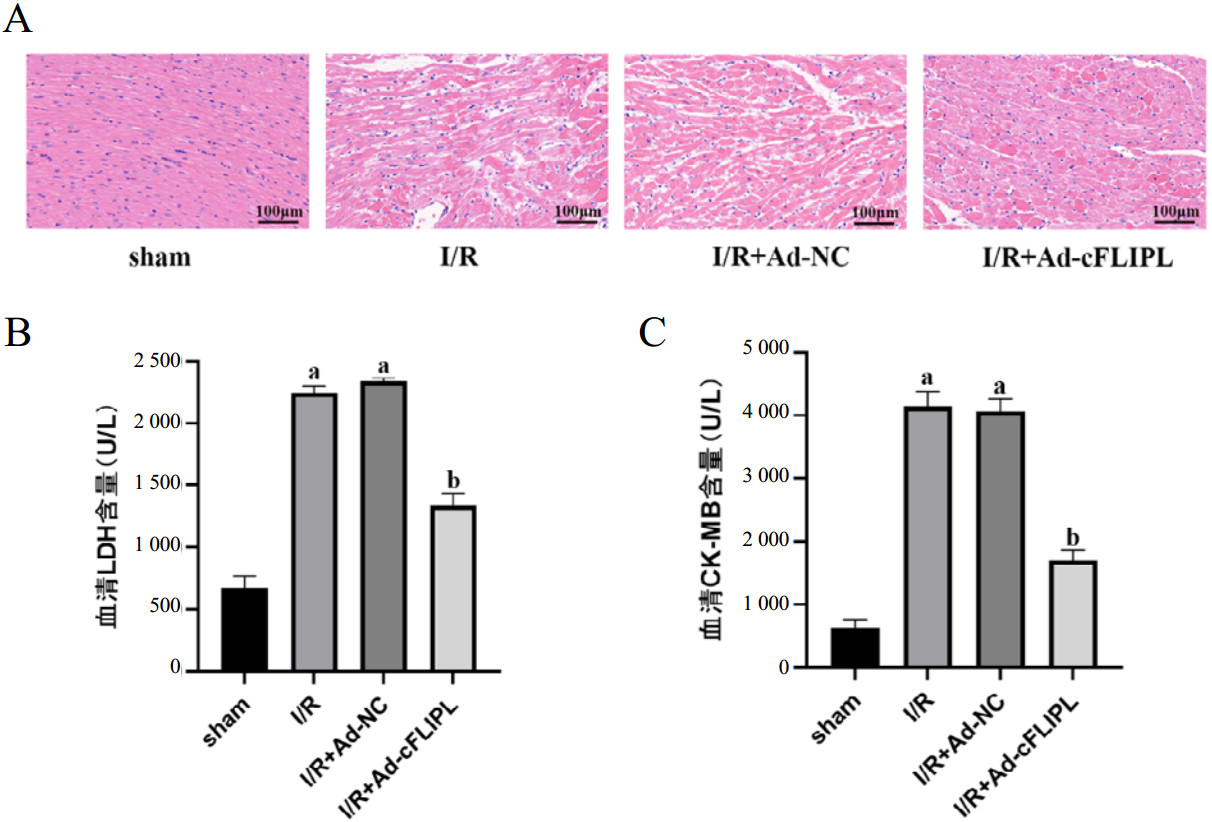
|
| 注:A为各组大鼠的HE染色结果;B为各组大鼠血清中LDH的量化分析;C为各组大鼠血清中CK-MB的量化分析;与sham组相比,aP < < 0.05;与I/R+Ad-NC组相比,bP < 0.05 图 4 各组大鼠心肌组织损伤形态及心肌损伤标志物的比较(×100) Fig 4 Comparison of myocardial tissue injury morphology and myocardial injury markers in each group (×100) |
|
|
使用ELISA法检测氧化应激相关指标发现,与sham组相比,I/R组和I/R+Ad-NC组的SOD和GSH-Px活力显著降低,MDA浓度升高(均P < 0.05)。而与I/R+Ad-NC组相比,I/R+Ad-cFLIPL组SOD和GSH-Px活力显著升高,MDA浓度降低(均P < 0.05)(图 5A~C)。同时,使用DHE染色检测各组大鼠心肌组织ROS水平,与sham组相比,I/R组和I/R+Ad-NC组ROS阳性细胞比例显著增加(均P < 0.05),而与I/R+Ad-NC组相比,I/R+Ad-cFLIPL组ROS阳性细胞比例显著降低(P < 0.05)(图 5D、E)。
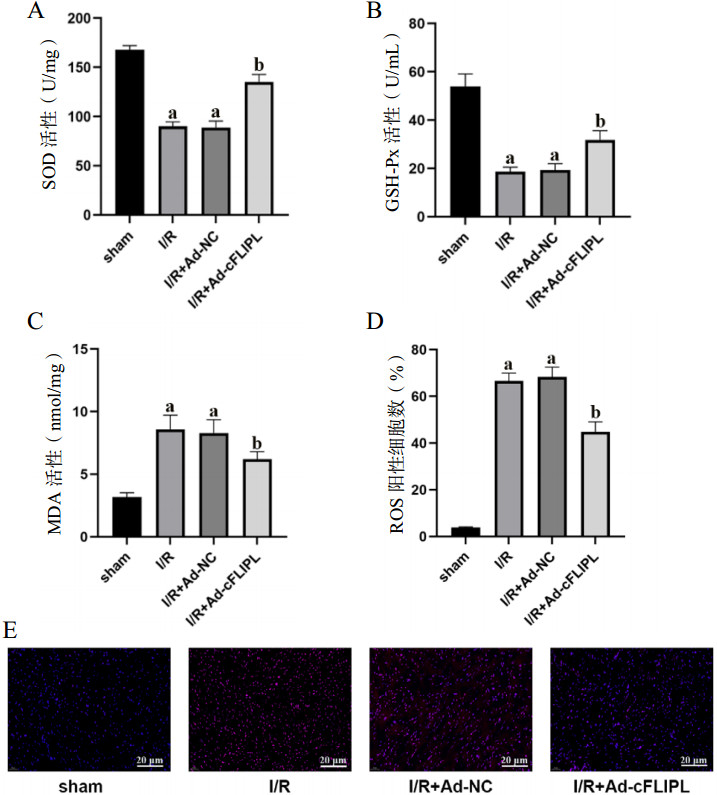
|
| 注:A为各组大鼠血清中SOD的量化分析;B为各组大鼠血清中GSH-Px的量化分析;C为各组大鼠血清中MDA的量化分析;D为各组心肌组织中ROS荧光强度的量化分析;E各组心肌组织中ROS染色的荧光图;与sham组相比,aP < < 0.05;与I/R+Ad-NC组相比,bP < 0.05 图 5 各组大鼠心肌组织氧化应激相关指标的比较(×100) Fig 5 Comparison of oxidative stress related indexes in myocardial tissue of rats in each group(×100) |
|
|
使用Western blot检测氧化应激相关蛋白的表达变化,与sham组相比,I/R组和I/R+Ad-NC组的p-Nrf2、Nrf2和HO-1蛋白表达显著增加(P < 0.05),且与I/R+Ad-NC组相比,I/R+Ad-cFLIPL组p-Nrf2、Nrf2和HO-1的蛋白表达进一步增加(P < 0.05)。见图 6。
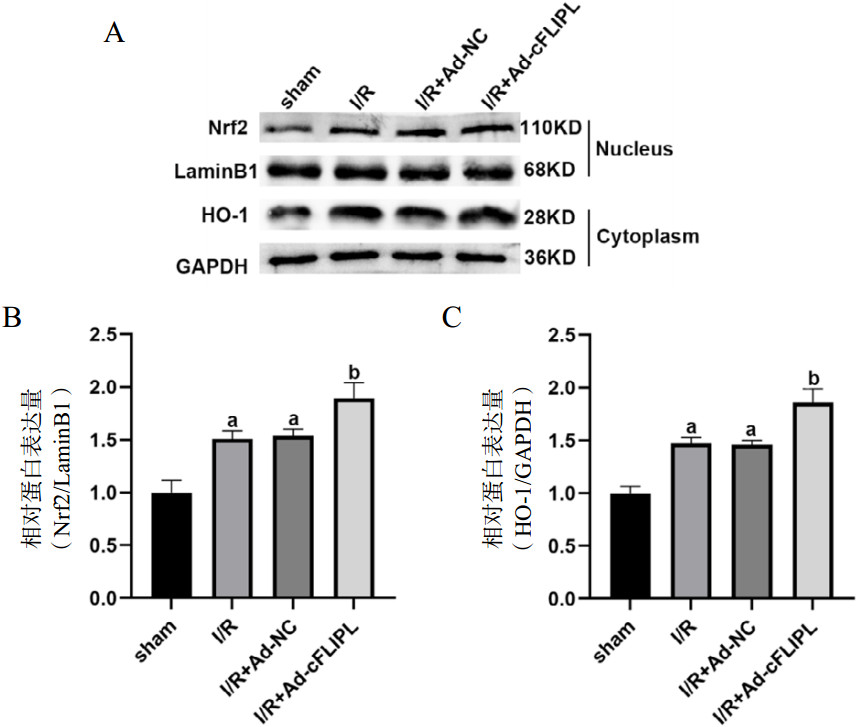
|
| 注:A为各组大鼠心肌组织Nrf2和HO-1的蛋白表达比较;B以LaminB1为内参统计的Nrf的量化分析;C以GAPDH为内参统计的HO-1的量化分析;与sham组相比,aP < < 0.05;与I/R+Ad-NC组相比,bP < 0.05 图 6 各组大鼠心肌组织Nrf2和HO-1蛋白表达的比较 Fig 6 Comparison of protein expression of Nrf2 and HO-1 in myocardial tissue of rats in each group |
|
|
MI/RI的发病机制十分复杂,包括钙超载、氧化应激、线粒体损伤、内质网应激、凋亡和自噬等[11]。课题组前期研究表明,过表达cFLIP可分别通过抑制心肌细胞凋亡、自噬、程序性坏死以及内质网应激,从而发挥心肌保护作用[7-10]。本研究中I/R组大鼠较sham组相比LVEF、LVFS值显著降低,血清心肌损伤标志物LDH、CK-MB含量显著升高,心肌梗死面积显著增加,而过表达cFLIPL后,LVEF、LVFS值升高,血清LDH、CK-MB含量显著降低,心肌梗死面积显著降低。过表达cFLIPL可以减轻I/R大鼠的心肌组织损伤,改善心功能并缩小心肌梗死面积,进一步证实cFLIPL是治疗MI/RI的潜在有效新靶点。并首次发现在大鼠MI/RI过程中过表达cFLIPL可显著抑制氧化应激,其部分机制可能与激活Nrf2/HO-1信号通路密切相关。
近年来,越来越多的证据表明氧化应激是导致MI/RI发生的主要病理机制[12]。一般来说,生理状态下活性氧(reactive oxygen species, ROS)的产生和抗氧化系统之间处于平衡状态,而当ROS过量产生,超过机体清除过氧化物的能力时,氧化还原平衡状态被破坏,导致氧化应激的发生[13]。SOD是抗氧化系统中最主要的抗氧化酶,能够清除细胞内产生的超氧自由基,反映细胞的抗氧化防御系统的功能状态[14]。GSH-px是在心肌细胞中广泛分布的一种谷胱甘肽过氧化物酶,可通过清除氧自由基和减少脂质过氧化物的形成,从而保护细胞免受氧化应激的损伤[15]。MDA是氧化应激过程中的中间产物,可以间接反映脂质过氧化程度,是临床中用来评估氧化应激程度的常用指标[16]。本研究结果显示,I/R组大鼠心肌组织较sham组相比,MDA和ROS水平显著增加,SOD和GSH-px的水平显著降低,而过表达cFLIPL后可降低MDA和ROS水平,并同时提高SOD和GSH-px水平。以上研究结果表明大鼠心肌组织I/R损伤引起氧化还原平衡系统紊乱,导致了氧化应激的发生。而过表达cFLIPL可通过提高抗氧化酶活性,清除过量ROS的产生,从而发挥心肌保护作用。然而过表达cFLIPL在大鼠MI/RI过程中抑制氧化应激的确切机制尚不清楚。
Nrf2/HO-1是机体抵抗氧化应激的重要信号通路,其中Nrf2在心脏中广泛表达,氧化应激发生时Nrf2-Keap1复合体解离,导致Nrf2基因被激活并转移至细胞核中进而增加下游抗氧化基因的表达。HO-1是Nrf2的主要下游靶基因之一,具有抗氧化损伤、调节细胞凋亡、减轻炎症的作用[17]。近年来,大量研究发现调节Nrf2/HO-1信号通路可以减轻MI/RI。例如,Huang等[18]研究发现巴多酮甲基可通过激活Nrf2/HO-1通路抑制氧化应激和心肌细胞凋亡,从而改善MI/RI。与之一致的是,Ge等[19]研究证实梓醇通过激活Nrf2/HO-1通路抑制了MI/RI过程中的氧化应激和炎症,发挥了显著的心脏保护作用。因此,激活Nrf2/HO-1通路是减轻MI/RI的有效策略。此外,有研究表明卡铂和硫利达嗪联合治疗可通过蛋白酶体降解cFLIP蛋白的表达,从而调控依赖Nrf2的蛋白酶体亚基α5,最终诱导人头颈癌细胞调亡[20]。然而,CFLIPL是否可通过调控Nrf2/HO-1信号通路减轻MI/RI尚未被研究。本研究结果显示,大鼠心肌组织I/R组较sham组相比,Nrf2和HO-1的蛋白表达明显升高,而过表达cFLIPL后,Nrf2和HO-1的蛋白表达水平在I/R组的基础上进一步增加。以上研究结果表明大鼠心肌I/R后,机体自身发生防御反应激活Nrf2/HO-1信号通路发挥心肌保护作用,而过表达cFLIPL可进一步激活Nrf2/HO-1信号通路抑制氧化应激,从而减轻大鼠MI/RI。
综上所述,本研究证明了在MI/RI过程中cFLIPL的蛋白表达下调与氧化应激密切相关,过表达cFLIPL可能通过激活Nrf2/HO-1信号通路,提高抗氧化应激基因HO-1的表达抑制氧化应激,从而减轻大鼠MI/RI。
利益冲突 所有作者声明无利益冲突
作者贡献声明 周刚、李云曌:研究设计、实验操作、论文撰写;吴辉、刘滴:论文审阅及修改;张栋、杨青卓:数据整理;刘艳芳、李异:实验操作
| [1] | Chang J, Liu X, Sun Y. Mortality due to acute myocardial infarction in China from 1987 to 2014: secular trends and age-period-cohort effects[J]. Int J Cardiol, 2017, 227: 229-238. DOI:10.1016/j.ijcard.2016.11.130 |
| [2] | Zhang JH, Guo YS, Bai Y, et al. Application of biomedical materials in the diagnosis and treatment of myocardial infarction[J]. J Nanobiotechnology, 2023, 21(1): 298. DOI:10.1186/s12951-023-02063-2 |
| [3] | Algoet M, Janssens S, Himmelreich U, et al. Myocardial ischemia-reperfusion injury and the influence of inflammation[J]. Trends Cardiovasc Med, 2023, 33(6): 357-366. DOI:10.1016/j.tcm.2022.02.005 |
| [4] | Xiang Q, Yi X, Zhu XH, et al. Regulated cell death in myocardial ischemia-reperfusion injury[J]. Trends Endocrinol Metab, 2024, 35(3): 219-234. DOI:10.1016/j.tem.2023.10.010 |
| [5] | Zhang Q, Liu J, Duan H, et al. Activation of Nrf2/HO-1 signaling: an important molecular mechanism of herbal medicine in the treatment of atherosclerosis via the protection of vascular endothelial cells from oxidative stress[J]. J Adv Res, 2021, 34: 43-63. DOI:10.1016/j.jare.2021.06.023 |
| [6] | Um HJ, Chauhan AK, Min KJ, et al. Differential expression patterns of the short and long isoform of cFLIP on FasL-mediated apoptosis[J]. Oncol Rep, 2018, 39(5): 2443-2449. DOI:10.3892/or.2018.6317 |
| [7] | Liu D, Wu H, Li YZ, et al. Cellular FADD-like IL-1β-converting enzyme-inhibitory protein attenuates myocardial ischemia/reperfusion injury via suppressing apoptosis and autophagy simultaneously[J]. Nutr Metab Cardiovasc Dis, 2021, 31(6): 1916-1928. DOI:10.1016/j.numecd.2021.02.026 |
| [8] | 刘滴, 吴辉, 杨俊, 等. 细胞FLICE样抑制蛋白通过抑制程序性坏死减轻心肌缺血-再灌注损伤[J]. 中华急诊医学杂志, 2022, 31(3): 349-355. DOI:10.3760/cma.j.issn.1671-0282.2022.03.016 |
| [9] | Li YZ, Wu H, Liu D, et al. cFLIPL alleviates myocardial ischemia-reperfusion injury by inhibiting endoplasmic reticulum stress[J]. Cardiovasc Drugs Ther, 2023, 37(2): 225-238. DOI:10.1007/s10557-021-07280-1 |
| [10] | Ranjan K, Pathak C. Expression of FADD and cFLIPL balances mitochondrial integrity and redox signaling to substantiate apoptotic cell death[J]. Mol Cell Biochem, 2016, 422(1/2): 135-150. DOI:10.1007/s11010-016-2813-z |
| [11] | Hu Y, Zhang CM, Zhu H, et al. Luteolin modulates SERCA2a via Sp1 upregulation to attenuate myocardial ischemia/reperfusion injury in mice[J]. Sci Rep, 2020, 10(1): 15407. DOI:10.1038/s41598-020-72325-8 |
| [12] | Xiang M, Lu YD, Xin LY, et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments[J]. Oxid Med Cell Longev, 2021, 2021: 6614009. DOI:10.1155/2021/6614009 |
| [13] | van der Pol A, van Gilst WH, Voors AA, et al. Treating oxidative stress in heart failure: past, present and future[J]. Eur J Heart Fail, 2019, 21(4): 425-435. DOI:10.1002/ejhf.1320 |
| [14] | Liu JY, Li ZG, Ghanizadeh H, et al. Comparative genomic and physiological analyses of a superoxide dismutase mimetic (SODm-123) for its ability to respond to oxidative stress in tomato plants[J]. J Agric Food Chem, 2020, 68(47): 13608-13619. DOI:10.1021/acs.jafc.0c04618 |
| [15] | Min YN, Niu ZY, Sun TT, et al. Vitamin E and vitamin C supplementation improves antioxidant status and immune function in oxidative-stressed breeder roosters by up-regulating expression of GSH-Px gene[J]. Poult Sci, 2018, 97(4): 1238-1244. DOI:10.3382/ps/pex417 |
| [16] | Zhang J, Yang ZH, Zhang SS, et al. Investigation of endogenous malondialdehyde through fluorescent probe MDA-6 during oxidative stress[J]. Anal Chim Acta, 2020, 1116: 9-15. DOI:10.1016/j.aca.2020.04.030 |
| [17] | Zhang XY, Yu YH, Lei HY, et al. The nrf-2/HO-1 signaling axis: a ray of hope in cardiovascular diseases[J]. Cardiol Res Pract, 2020, 2020: 5695723. DOI:10.1155/2020/5695723 |
| [18] | Huang AW, Wang ZL, Tang H, et al. Bardoxolone methyl ameliorates myocardial ischemia/reperfusion injury by activating the Nrf2/HO-1 signaling pathway[J]. Cardiovasc Ther, 2023, 2023: 5693732. DOI:10.1155/2023/5693732 |
| [19] | Ge HW, Lin W, Lou ZL, et al. Catalpol alleviates myocardial ischemia reperfusion injury by activating the Nrf2/HO-1 signaling pathway[J]. Microvasc Res, 2022, 140: 104302. DOI:10.1016/j.mvr.2021.104302 |
| [20] | Seo SU, Cho HK, Min KJ, et al. Thioridazine enhances sensitivity to carboplatin in human head and neck cancer cells through downregulation of c-FLIP and Mcl-1 expression[J]. Cell Death Dis, 2017, 8(2): e2599. DOI:10.1038/cddis.2017.8 |
 2025, Vol. 34
2025, Vol. 34