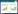创伤是全球范围内导致死亡的主要原因之一,约占总死亡人数的8% [1],创伤大出血、创伤性凝血病(trauma-induced coagulopathy, TIC)是严重创伤患者死亡的关键因素[2]。研究表明,约1/4~1/3创伤患者在入院时已经出现TIC,TIC患者病死率高达30%~40%[3],比非TIC患者高4~6倍[4-5]。因此,在严重创伤早期救治中,高效复苏显得尤为重要。但是,严重组织损伤、凝血因子消耗以及大量输血等因素均可影响严重创伤患者凝血功能障碍的纠正效果[6-8]。既往研究发现,严重创伤大出血患者输注凝血酶原复合物(prothrombin complex concentrate, PCC)等凝血因子有利于减少血制品用量[9],但是经验性输注PCC也存在增加血栓并发症风险[10]。目前,关于严重创伤大出血尤其是合并TIC患者救治过程中使用PCC纠正凝血功能、改善患者临床预后的效果尚不明确。本研究将通过多中心、回顾性研究,分析PCC对TIC患者的治疗效果及TIC患者的风险因素筛查,以期为TIC患者早期高效诊疗提供参考。
1 资料与方法 1.1 研究对象本研究采用回顾性研究,筛选2021年1月至12月期间在11家医院急诊复苏单元/抢救室救治的创伤患者,参与医院包括浙江大学医学院附属第二医院、温州医科大学附属第二医院、嘉兴市第一医院、嘉兴市第二医院、丽水市人民医院、丽水市中心医院、瑞安市人民医院、湖州市第一人民医院、绍兴市中心医院、绍兴市人民医院、金华市人民医院。根据以下纳排标准,收集并分析患者的临床资料。
纳入标准:(1)急诊预检分诊1~2级;(2)损伤严重度评分(injury severity score, ISS评分)≥16分;(3)国际标准化比值(international normalized ratio, INR) > 1.2;(4)年龄≥18岁;(5)伤后24 h内入院,且在入院后采用血制品(红细胞、血浆)复苏。
排除标准:(1)既往长期口服抗凝、抗血小板药物,包括新型抗凝药物(利伐沙班,达比加群等)和传统药物(如华法林,阿司匹林,硫酸氢氯吡格雷等);(2)既往患有血液病、恶性肿瘤放化疗患者、肝硬化失代偿期以及其他影响患者凝血功能的基础疾病;(3)入院前已经出现心脏骤停;(4)孕妇、哺乳期妇女、儿童;(5)入院前已经使用血制品;(6)临床资料不全。
TIC诊断参考指标,即有明确创伤病史且INR > 1.2[11]。
本研究根据患者是否接受PCC治疗,分为常规组和PCC组;并按照倾向性1∶1匹配的方法进行筛选。常规组接受有效止血措施和血制品输注等复苏措施但未使用PCC;PCC组在常规治疗基础上接受PCC治疗。
1.2 观察指标基本信息:人口学特征信息(年龄、性别)、基础疾病(高血压、糖尿病)、院前时间、急性生理学与慢性健康状况(acute physiology and chronic health evaluation, APACHE-Ⅱ)。
伤情特征:损伤类型、损伤部位、格拉斯哥昏迷评分(Glasgow coma scale, GCS)、ISS评分。
伤后诊治措施:损害控制性手术/措施、血管活性药物、钙剂、氨甲环酸、血制品输注(红细胞、血浆、PCC)。
入院时及入院24 h实验室检查:血常规(白细胞计数、血红蛋白、血小板等)、血气分析(pH值、乳酸)、肝肾功能(谷丙转氨酶、谷草转氨酶、白蛋白、肌酐)、生化钙、凝血功能[凝血酶原时间(prothrombin time, PT),活化部分凝血活酶时间(activited partial thomboplastin time, APTT)、INR、血浆纤维蛋白原(fibrinogen, FIB)]。
临床预后:出院好转、住院时间;出院好转是指患者经过治疗后病情改善、出院。
1.3 统计学方法采用SPSS 25.0软件进行统计学处理。对服从正态分布的计量资料用均数±标准差(x±s)表示,采用独立样本t检验分析;服从偏态分布的计量资料用中位数(四分位数)[M(Q1, Q3)]表示,采用Wilcoxon秩和检验分析。计数资料用例(%)表示,采用卡方检验或Fisher精确检验分析。对基本信息、基础疾病、院前时间、损伤类型、损伤部位、治疗措施、入院时血液学检查等按照1∶1进行倾向性匹配。采用单因素Logistic回归模型分析危险因素,对于P < 0.05的临床指标纳入多因素Logistic回归模型,用OR值及95%可信区间(CI)表示,采用受试者工作特征曲线(receiver operating characteristic curve, ROC)进一步确定截断值。以P < 0.05为差异具有统计学意义。
2 结果 2.1 一般资料本研究共纳入349例TIC患者,见图 1。根据患者的基础信息、基础疾病、院前时间、损伤类型、损伤部位、损害控制性手术与治疗、GCS评分、ISS评分、APACHEⅡ评分及入院时血液学检查进行1∶1倾向性匹配(差异均无统计学意义),其中PCC组103例,常规组103例(见表 1)。
|
| 图 1 研究对象筛选流程图 Fig 1 Flowchart of participants inclusion |
|
|
| 指标 | 常规组 (n=103) |
PCC组 (n=103) |
统计值 | P值 |
| 基础信息 | ||||
| 年龄(岁)a | 54(38, 66) | 54(41, 67) | -0.345 | 0.730 |
| 女性b | 35(34.0) | 38(36.9) | 0.191 | 0.662 |
| 基础疾病b | ||||
| 高血压 | 9(8.7) | 11(10.6) | 0.222 | 0.638 |
| 糖尿病 | 10(9.7) | 6(5.7) | 1.084 | 0.298 |
| 其他 | 7(6.8) | 4(3.8) | 0.864 | 0.353 |
| 院前时间(h)a | 2(1, 4) | 2(1, 4) | -0.800 | 0.424 |
| 损伤类型b | ||||
| 交通伤 | 49(47.6) | 43(41.7) | 0.707 | 0.400 |
| 坠落伤 | 31(30.1) | 25(24.3) | 0.883 | 0.347 |
| 跌倒 | 11(10.7) | 17(16.5) | 1.488 | 0.223 |
| 其他 | 12(11.6) | 18(17.5) | 1.405 | 0.236 |
| 损伤部位b | ||||
| 头部 | 23(22.3) | 18(17.5) | 0.761 | 0.383 |
| 胸部 | 15(14.6) | 10(9.7) | 1.138 | 0.286 |
| 腹部 | 22(21.4) | 21(20.4) | 0.029 | 0.864 |
| 脊髓 | 13(12.6) | 20(19.4) | 1.768 | 0.184 |
| 四肢 | 17(16.5) | 16(15.5) | 0.036 | 0.849 |
| 其他 | 13(12.6) | 18(17.5) | 0.949 | 0.330 |
| 损害控制性手术治疗b | 33(32.0) | 35(34.0) | 0.088 | 0.767 |
| 评分a | ||||
| ISS评分 | 29(25, 41) | 29(25, 34) | -0.833 | 0.405 |
| GCS评分 | 6(3, 10) | 7(4, 10.5) | -1.548 | 0.122 |
| APACHE Ⅱ评分 | 20(14, 26) | 20(14, 27) | -0.305 | 0.761 |
| 血制品治疗a | ||||
| 血浆(mL) | 1 060(600, 1 970) | 1 180(700, 1 675) | -0.295 | 0.768 |
| 红细胞(U) | 4.50(3.00, 8.00) | 5.00(3.75, 7.00) | -0.269 | 0.788 |
| 药物治疗b | ||||
| 血管活性药物 | 84(81.6) | 90(87.4) | 1.332 | 0.248 |
| 氨甲环酸 | 92(89.3) | 89(86.4) | 0.410 | 0.522 |
| 钙剂 | 85(82.5) | 88(85.4) | 0.325 | 0.569 |
| 入院后首次化验a | ||||
| 白细胞计数(×109/L) | 14.8(11.2, 20.2) | 17.3(12.4, 21.5) | -1.424 | 0.185 |
| 血红蛋白(g/L) | 106(85, 124) | 112(78, 134) | -0.786 | 0.432 |
| 血小板(×109/L) | 143(103, 206) | 152(109, 197) | -0.199 | 0.842 |
| 谷丙转氨酶(U/L) | 47.0(26.5, 68.5) | 38.0(26.0, 89.0) | -0.385 | 0.701 |
| 谷草转氨酶(U/L) | 72.0(48.5, 168.0) | 66.0(44.5, 151.5) | -0.739 | 0.460 |
| 生化钙(mmol/L) | 2.07(1.98, 2.16) | 2.05(1.96, 2.17) | -0.312 | 0.755 |
| 肌酐(μmol/L) | 82.0(64.5, 99.5) | 84.0(63.0, 107.0) | -0.625 | 0.532 |
| pH | 7.29(7.24, 7.36) | 7.29(7.24, 7.33) | -0.380 | 0.704 |
| 乳酸(mmol/L) | 2.9(2.3, 6.2) | 3.4(2.6, 5.2) | -0.982 | 0.326 |
| PT(s) | 18.1(16.6, 19.6) | 18.7(17.1, 21.5) | -1.496 | 0.135 |
| APTT(s) | 52.5(43.9, 63.3) | 55.2(49.8, 59.4) | -1.252 | 0.211 |
| INR | 1.52(1.40, 1.66) | 1.51(1.44, 1.91) | -1.341 | 0.180 |
| FIB(g/L) | 1.48(1.01, 1.91) | 1.54(1.02, 2.00) | -0.014 | 0.989 |
| 注:PCC为凝血酶原复合物,ISS为创伤严重程度评分,GCS为格拉斯哥昏迷评分,pH为酸碱度,PT为凝血酶原时间,APTT为活化部分凝血活酶时间,INR为国际标准化比值,FIB为纤维蛋白原水平;a为M(Q1, Q3),b为(例,%) | ||||
与常规组相比,入院24 h后PCC组患者白细胞计数、乳酸、PT、INR均较低;而血红蛋白,pH均较高,差异均具有统计学意义(均P < 0.05)。两组之间的出院好转率差异无统计学意义(68.0% vs. 61.2%,P=0.308);但PCC治疗组住院时间较短,差异有统计学意义(P=0.037)。见表 2。
| 指标 | 常规组 (n=103) |
PCC组 (n=103) |
统计值 | P值 |
| 入院24 h后血化验a | ||||
| 白细胞计数(×109/L) | 11.00(7.65, 14.95) | 9.40(6.90, 12.30) | -2.320 | 0.020 |
| 血红蛋白(g/L) | 69(57, 85) | 80 (64, 97) | -2.495 | 0.013 |
| 血小板(×109/L) | 70(60, 82) | 77(63, 91) | -0.838 | 0.402 |
| 谷丙转氨酶(U/L) | 41(30, 85) | 43(26, 112) | -0.229 | 0.819 |
| 谷草转氨酶(U/L) | 73(60, 149) | 92(55, 183) | -1.063 | 0.288 |
| 生化钙(mmol/L) | 2.08(1.82, 2.15) | 2.06(1.96, 2.18) | -0.884 | 0.377 |
| 肌酐(μmol/L) | 77(67, 119) | 82(66, 146) | -1.540 | 0.124 |
| pH | 7.35(7.26, 7.42) | 7.39(7.36, 7.45) | -3.918 | < 0.001 |
| 乳酸(mmol/L) | 3.80(2.05, 6.50) | 2.00(1.37, 3.52) | -4.111 | < 0.001 |
| PT(s) | 16.8(15.4, 22.5) | 15.4(14.6, 17.2) | -4.357 | < 0.001 |
| APTT(s) | 48.30(41.55, 73.55) | 46.30(43.45, 49.70) | -1.690 | 0.091 |
| INR | 1.43(1.21, 1.85) | 1.21(1.12, 1.44) | -4.384 | < 0.001 |
| FIB(g/L) | 2.69(1.84, 3.45) | 2.68(2.40, 3.19) | -0.767 | 0.443 |
| 预后 | ||||
| 出院好转率b | 63(61.2) | 70(68.0) | 1.040 | 0.308 |
| 住院时间(d)a | 15.0(7.5, 30.0) | 13.0(4.5, 30.0) | -2.085 | 0.037 |
| 注:PCC为凝血酶原复合物,pH为酸碱度,PT为凝血酶原时间,APTT为活化部分凝血活酶时间,INR为国际标准化比值,FIB为纤维蛋白原水平;a为M(Q1, Q3),b为(例,%) | ||||
根据出院好转情况,将经倾向性评分匹配后的206例患者分为两组,其中出院好转组(n=133)、未好转组(n=73)(见表 3)。出院好转组年龄低于未好转组,差异具有统计学意义(P=0.011);出院好转组ISS评分和APACHE Ⅱ评分较低,GCS评分较高,差异均具有统计学意义(均P < 0.001)。而在血制品治疗方面,出院好转组血浆输注量少于未好转组,差异具有统计学意义(P=0.018);而红细胞、PCC输注量、基础疾病、损伤类型及部位等之间差异均无统计学意义(均P > 0.05)。
| 指标 | 出院好转组 (n=133) |
出院未好转组 (n=73) |
统计值 | P值 |
| 基本信息 | ||||
| 年龄(岁)a | 50.0±18.3 | 57.1±20.1 | 2.578 | 0.011 |
| 女性b | 42(31.6) | 31(42.5) | 2.442 | 0.118 |
| 基础疾病b | ||||
| 高血压 | 13(9.8) | 7(9.6) | 0.002 | 0.966 |
| 糖尿病 | 10(7.5) | 6(8.2) | 0.032 | 0.857 |
| 其他 | 4(3.0) | 7(9.6) | 4.039 | 0.044 |
| 院前时间(h)c | 2(1, 4) | 2(1, 3) | -0.099 | 0.921 |
| 损伤类型b | ||||
| 交通伤 | 55(41.4) | 37(50.7) | 1.661 | 0.198 |
| 坠落伤 | 42(31.6) | 14(19.2) | 3.662 | 0.056 |
| 跌倒 | 17(12.8) | 11(15.1) | 0.210 | 0.647 |
| 其他 | 18(13.5) | 12(16.4) | 0.320 | 0.572 |
| 损伤部位b | ||||
| 头部 | 27(20.3) | 14(19.2) | 0.037 | 0.847 |
| 胸部 | 14(10.5) | 11(15.1) | 0.912 | 0.340 |
| 腹部 | 30(22.6) | 13(17.8) | 0.643 | 0.423 |
| 脊髓 | 22(16.5) | 11(15.1) | 0.076 | 0.783 |
| 四肢 | 20(15.0) | 13(17.8) | 0.269 | 0.604 |
| 其他 | 18(13.5) | 13(17.8) | 0.674 | 0.412 |
| 损害控制性手术b | 44(33.1) | 24(32.9) | 0.001 | 0.976 |
| 入院时评分c | ||||
| ISS评分 | 29(23, 34) | 33(26, 50) | -4.295 | < 0.001 |
| GCS评分 | 7(5, 12) | 4(3, 7) | -4.845 | < 0.001 |
| APACHE Ⅱ评分 | 18(13, 22) | 28(20, 32) | -6.806 | < 0.001 |
| 血液制品治疗 | ||||
| 血浆(mL)c | 1 090(610, 1 590) | 1 500(670, 2 650) | -2.360 | 0.018 |
| 红细胞(U)c | 4.0(3.5, 7.5) | 5.0(3.5, 10.5) | -1.555 | 0.120 |
| PCC b | 70(52.6) | 33(45.2) | 1.040 | 0.308 |
| 其他治疗措施b | ||||
| 血管活性药物 | 113(85.0) | 61(83.6) | 0.070 | 0.791 |
| 氨甲环酸 | 117(88.0) | 64(87.7) | 0.004 | 0.950 |
| 钙剂 | 111(83.5) | 62(84.9) | 0.076 | 0.783 |
| 注:ISS为创伤严重程度评分,GCS为格拉斯哥昏迷评分,PCC为凝血酶原复合物;a为x ± s,b为(例,%),c为M(Q1, Q3) | ||||
为了进一步研究影响TIC患者预后(出院好转情况)的危险因素,多因素Logistic回归分析发现年龄、GCS评分、INR(24 h后)、FIB(24 h后)与TIC患者的预后显著相关(均P < 0.05)(见表 4)。
| 项目 | 单因素 | 多因素 | |||||
| OR值 | 95%CI | P值 | OR值 | 95%CI | P值 | ||
| 年龄(岁) | 0.980 | 0.964~0.996 | 0.012 | 0.951 | 0.926~0.977 | < 0.001 | |
| GCS评分 | 1.239 | 1.132~1.357 | < 0.001 | 1.149 | 1.018~1.298 | 0.025 | |
| 肌酐(µmol/L) | 0.995 | 0.991~1 | 0.037 | 0.998 | 0.993~1.003 | 0.434 | |
| 乳酸(mmol/L) | 0.807 | 0.732~0.888 | < 0.001 | 0.862 | 0.738~1.007 | 0.061 | |
| 入院时 | |||||||
| PT(s) | 0.848 | 0.779~0.924 | < 0.001 | 0.925 | 0.728~1.176 | 0.526 | |
| APTT(s) | 0.965 | 0.949~0.982 | < 0.001 | 0.991 | 0.961~1.021 | 0.553 | |
| INR | 0.211 | 0.101~0.442 | < 0.001 | 0.723 | 0.089~5.844 | 0.761 | |
| 24 h后化验指标 | |||||||
| 血红蛋白(g/L) | 1.024 | 1.010~1.039 | 0.001 | 1.011 | 0.989~1.034 | 0.342 | |
| 血小板(109/L) | 1.007 | 1.002~1.013 | 0.010 | 1.002 | 0.993~1.010 | 0.710 | |
| 谷丙转氨酶(U/L) | 0.999 | 0.998~0.999 | 0.004 | 0.999 | 0.998~1.001 | 0.500 | |
| 生化钙(mmol/L) | 15.809 | 4.286~58.317 | < 0.001 | 1.349 | 0.146~12.442 | 1.349 | |
| pH | 67.295 | 6.105~741.793 | 0.001 | 0.833 | 0.010~72.116 | 0.936 | |
| PT(s) | 0.903 | 0.857~0.951 | < 0.001 | 1.022 | 0.975~1.070 | 0.369 | |
| APTT(s) | 0.975 | 0.966~0.985 | < 0.001 | 1.009 | 0.991~1.028 | 0.335 | |
| INR | 0.150 | 0.073~0.308 | < 0.001 | 0.230 | 0.056~0.946 | 0.042 | |
| FIB(g/L) | 2.630 | 1.857~3.725 | < 0.001 | 2.098 | 1.197~3.678 | 0.010 | |
| 注:GCS为格拉斯哥昏迷评分,PT为凝血酶原时间,APTT为活化部分凝血活酶时间,INR为国际标准化比值,pH为酸碱度,FIB为纤维蛋白原水平 | |||||||
年龄、GCS评分、FIB(24 h后)、INR(24 h后)纳入ROC曲线进一步分析(见图 2)的AUC值分别为0.632、0.702、0.733、0.752。年龄的最佳截断值为68岁,其敏感度及特异度分别为15.0%、60.3%;GCS评分的最佳截断值为5分,其敏感度及特异度分别为79.7%、53.4%;FIB(24 h后)的最佳截断值为2.04 g/L,其敏感度及特异度分别为94.0%、47.9%;INR(24 h后)的最佳截断值为1.455,其敏感度及特异度分别为18.0%、38.4%。
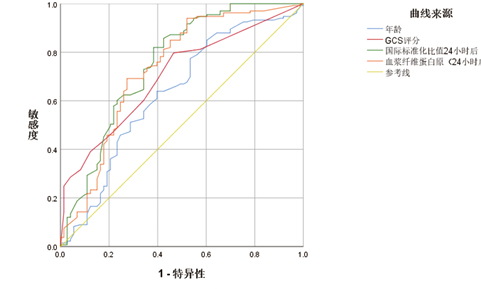
|
| 图 2 年龄、GCS评分、INR(24 h后)及FIB(24 h后)与TIC患者预后的ROC曲线分析 Fig 2 ROC curve analysis of age, GCS score, INR (after 24 h), FIB (after 24 h) and prognosis of TIC patients |
|
|
目前,创伤已成为25~49岁人群中影响生命健康的首要因素[1, 12];48%创伤患者在伤后3~6 h内死亡,24 h主要死亡原因为创伤大出血[13-14]。创伤后大出血和TIC仍然是严重创伤患者多器官功能衰竭、甚至死亡的主要原因[1, 15]。既往研究发现,对于合并凝血功能障碍,院前抢救时间 > 20 min的严重创伤患者,院前使用血制品、进行积极复苏可能使严重创伤患者受益[16];及时纠正凝血功能障碍,尽早有效止血是抢救严重创伤患者生命的关键。PCC作为凝血底物,既往主要应用于逆转华法林或新型口服抗凝药导致的出血、心脏手术出血、肝功能衰竭等相关凝血功能障碍[17]。近年来,部分研究发现创伤患者输注PCC后可减少血制品使用量,改善患者凝血功能,并且可以使患者的死亡率及住院费用相对降低[18]。但另外研究发现,使用PCC会增加严重创伤患者血栓形成风险;因此,严重创伤大出血合并TIC患者使用PCC治疗存在一定的争议。本研究通过多中心、回顾性研究评估PCC在TIC救治中的临床疗效及其风险因素,为严重创伤大出血合并TIC患者的高效救治提供一定的参考依据。
既往研究表明,在严重创伤大出血患者临床预后的危险因素中,乳酸水平可在一定程度上反应组织灌注水平,连续监测乳酸水平变化在预测创伤大出血患者生存率方面具有一定的价值[19-20];而严重创伤患者在白细胞计数 > 20×109/L时,更易发生休克等并发症[21]。在本研究中,PCC治疗组可降低24 h后的乳酸水平与白细胞水平,在一定程度上减轻了严重创伤患者严重程度、改善患者预后。此外,既往研究发现,快速纠正凝血功能障碍是临床治疗TIC的重中之重;而既往新鲜冰冻血浆FFP输注后凝血因子恢复有限,凝血酶恢复效率低下[17]。但在本研究发现,PCC治疗组较常规治疗组在24 h后能够有效缩短创伤患者的PT及降低INR,在一定程度上减轻出血[22-23],这就为严重创伤患者改善临床预后提供了一定的参考依据。此外,本研究还发现,PCC组在伤后24 h维持较高的血红蛋白水平、患者住院床日缩短;此研究结果与严重创伤大出血患者需要维持血红蛋白水平维持在70~90 g/L以上改善患者的临床预后的结论相一致。但是,本研究中PCC治疗对于TIC患者的出院好转率未见明显提高;可能是由于本研究属于回顾性研究,各个分中心纳入的严重创伤患者的基础治疗、血制品使用以及PCC治疗等措施难以均质化有关。而且在严重创伤大出血患者大量输血基础上,给予PCC后血栓栓塞事件也具有一定的风险[24],会影响患者的临床预后[25],因此,PCC治疗对于严重创伤大出血合并TIC患者临床预后影响仍需要进一步采用多中心、前瞻性临床研究进一步探索。
本研究通过多因素Logistic分析还发现年龄 > 68岁是TIC患者预后的独立危险因素。老年严重创伤患者随着年龄增长凝血功能发生生理性改变,伴发复杂基础疾病的老年创伤诊治更加复杂[26],其并发症多,比年轻人更容易发生TIC,并且导致病死率较高,因此对于老年严重创伤患者进行高质量的救治措施对改善老年创伤患者预后至关重要[27]。此外,严重创伤合并严重创伤性脑损伤(traumatic brain injury, TBI)是出现并发症和死亡的独立危险因素[28],在急性TBI患者中,脑组织内大量组织因子释放,会造成凝血系统和抗凝系统的失衡[29-30]。本研究也发现,严重创伤合并严重脑损伤(GCS评分 < 5分)也会导致不良预后。对于严重创伤患者而言,住院时INR升高(尤其是大于1.5时)是严重创伤后病死率和并发症的危险因素,有研究表明INR > 1.5的患者调整混杂因素后经历了更多的不良结局[31]。本研究同样发现,INR > 1.455(24 h后)是影响TIC患者预后的独立危险因素,需要尽早纠正凝血功能、改善患者临床预后。同时,需要关注TIC患者的FIB水平,FIB水平(24 h后) < 2.04 g/L是影响TIC患者临床预后的独立危险因素。在严重出血事件中,FIB是第一个达到极低水平的凝血因子,原因包括血液稀释、失血、血凝块形成、低温使其合成减少,以及酸中毒导致的降解增加[32]。在TIC救治中,在抗纤溶基础上,积极治疗、维持FIB水平、改善凝血功能,最终改善患者临床预后[33]。总之,影响严重创伤大出血合并TIC患者临床预后的因素之间相互作用;需要尽快纠正与改善患者病情、不断提高救治效果。
本研究也存在一定的局限性:首先,研究中虽然两组间输血量差异无统计学意义,但两组输注FFP以及RBC的比例可能存在差异,不同比例的输血方案可能对改善患者的凝血指标水平存在一定的影响[34]。另外,本研究属于回顾性研究、纳入患者有限,需要通过多中心、前瞻性研究进一步评价PCC在严重TIC患者早期救治过程中的临床效能,最终为严重创伤大出血患者高效救治提供坚实的理论基础与临床支撑。
综上所述,TIC患者经PCC治疗可纠正凝血功能、缩短住院时间,当TIC患者年龄 > 68岁、GCS评分 < 5分、24 h后的INR > 1.455,FIB < 2.04 g/L时,需要警惕其造成不良预后风险,及时纠正,不断提升严重创伤合并TIC患者的临床预后。
利益冲突 所有作者声明无利益冲突
作者贡献声明 麻贤辉:研究设计、数据收集、分析/解释数据、论文撰写;康洋波、杨琦、丁洪波、沈嘉生:数据收集及整理;许永安:研究设计、论文修改
| [1] | Rossaint R, Bouillon B, Cerny V, et al. The European guideline on management of major bleeding and coagulopathy following trauma: fourth edition[J]. Crit Care, 2016, 20: 100. DOI:10.1186/s13054-016-1265-x |
| [2] | 赵小纲, 何晓娣. 严重创伤初始救治: 从多学科合作到多医院协同[J]. 中华急诊医学杂志, 2021, 30(5): 517-519. DOI:10.3760/cma.j.issn.1671-0282.2021.05.001 |
| [3] | 陈国芬, 彭国璇, 任廷果, 等. 创伤凝血病的诊疗进展[J]. 创伤外科杂志, 2021, 23(9) 714-717, 721. DOI:10.3969/j.issn.1009-4237.2021.09.018 |
| [4] | Li BQ, Sun HC. Research progress of acute coagulopathy of trauma-shock[J]. Chin J Traumatol, 2015, 18(2): 95-97. DOI:10.1016/j.cjtee.2015.01.003 |
| [5] | Kim SJ, Lee SW, Han GS, et al. Acute traumatic coagulopathy decreased actual survival rate when compared with predicted survival rate in severe trauma[J]. Emerg Med J, 2012, 29(11): 906-910. DOI:10.1136/emermed-2011-200630 |
| [6] | 袁玉荣, 潘修银. 创伤性凝血病与大量输血的研究进展[J]. 医学综述, 2015, 21(13): 2400-2402. DOI:10.3969/j.issn.1006-2084.2015.13.037 |
| [7] | Roback JD, Caldwell S, Carson J, et al. Evidence-based practice guidelines for plasma transfusion[J]. Transfusion, 2010, 50(6): 1227-1239. DOI:10.1111/j.1537-2995.2010.02632.x |
| [8] | Murad MH, Stubbs JR, Gandhi MJ, et al. The effect of plasma transfusion on morbidity and mortality: a systematic review and meta-analysis[J]. Transfusion, 2010, 50(6): 1370-1383. DOI:10.1111/j.1537-2995.2010.02630.x |
| [9] | 高明, 魏晴. 人凝血酶原复合物的临床应用新进展[J]. 临床输血与检验, 2022, 24(5): 11. DOI:10.3969/j.issn.1671-2587.2022.05.021 |
| [10] | Schöchl H, Voelckel W, Maegele M, et al. Endogenous thrombin potential following hemostatic therapy with 4-factor prothrombin complex concentrate: a 7-day observational study of trauma patients[J]. Crit Care, 2014, 18(4). DOI:10.1186/cc13982 |
| [11] | 康洋波, 周佳圻, 胡雨峰, 等. 低钙血症在老年创伤性凝血病早期诊断中的效价研究[J]. 中华急诊医学杂志, 2022, 31(5): 603-607. DOI:10.3760/cma.j.issn.1671-0282.2022.05.006 |
| [12] | GBD Diseases and Injuries Collaborators. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: a systematic analysis for the global burden of disease study 2019[J]. Lancet, 2020, 396(10258): 1204-1222. DOI:10.1016/S0140-6736(20)30925-9 |
| [13] | Maegele M, Schöchl H, Cohen MJ. An update on the coagulopathy of trauma[J]. Shock, 2014, 41(Suppl 1): 21-25. DOI:10.1097/SHK.0000000000000088 |
| [14] | Tisherman SA, Schmicker RH, Brasel KJ, et al. Detailed description of all deaths in both the shock and traumatic brain injury hypertonic saline trials of the Resuscitation Outcomes Consortium[J]. Ann Surg, 2015, 261(3): 586-590. DOI:10.1097/SLA.0000000000000837 |
| [15] | Cole E, Weaver A, Gall L, et al. A decade of damage control resuscitation: new transfusion practice, new survivors, new directions[J]. Ann Surg, 2021, 273(6): 1215-1220. DOI:10.1097/SLA.0000000000003657 |
| [16] | Pusateri AE, Moore EE, Moore HB, et al. Association of prehospital plasma transfusion with survival in trauma patients with hemorrhagic shock when transport times are longer than 20 minutes: a post hoc analysis of the PAMPer and COMBAT clinical trials[J]. JAMA Surg, 2020, 155(2): e195085. DOI:10.1001/jamasurg.2019.5085 |
| [17] | Tanaka KA, Shettar S, Vandyck K, et al. Roles of four-factor prothrombin complex concentrate in the management of critical bleeding[J]. Transfus Med Rev, 2021, 35(4): 96-103. DOI:10.1016/j.tmrv.2021.06.007 |
| [18] | 翁海蓉, 杨雪妹, 唐宁. 急性创伤性凝血病的研究进展[J]. 现代医学与健康研究电子杂志, 2022, 6(21): 131-135. |
| [19] | Caputo N, Fraser R, Paliga A, et al. Triage vital signs do not correlate with serum lactate or base deficit, and are less predictive of operative intervention in penetrating trauma patients: a prospective cohort study[J]. Emerg Med J, 2013, 30(7): 546-550. DOI:10.1136/emermed-2012-201343 |
| [20] | Vincent JL, Quintairos E Silva A, Couto L Jr, et al. The value of blood lactate kinetics in critically ill patients: a systematic review[J]. Crit Care, 2016, 20(1): 257. DOI:10.1186/s13054-016-1403-5 |
| [21] | 孙余省, 陶礼钧, 吴作株, 等. 多发伤早期血糖值和白细胞计数与损伤严重度的相关性研究[J]. 浙江创伤外科, 2009, 14(5): 434-436. |
| [22] | Nesek Adam V, Bošan-Kilibarda I. Prothrombin complex concentrate?in emergency department[J]. Acta Clin Croat, 2022, 61(Suppl 1): 53-58. DOI:10.20471/acc.2022.61.s1.09 |
| [23] | Schöchl H, Forster L, Woidke R, et al. Use of rotation thromboelastometry (ROTEM) to achieve successful treatment of polytrauma with fibrinogen concentrate and prothrombin complex concentrate[J]. Anaesthesia, 2010, 65(2): 199-203. DOI:10.1111/j.1365-2044.2009.06188.x |
| [24] | Bouzat P, Charbit J, Abback PS, et al. Efficacy and safety of early administration of 4-factor prothrombin complex concentrate in patients with trauma at risk of massive transfusion: the PROCOAG randomized clinical trial[J]. JAMA, 2023, 329(16): 1367-1375. DOI:10.1001/jama.2023.4080 |
| [25] | Makhoul T, Kelly G, Kersten B, et al. Incidence of thromboembolic events following administration of four-factor prothrombin complex concentrate (4F-PCC) for oral anticoagulation reversal[J]. Thromb Res, 2020, 194: 158-164. DOI:10.1016/j.thromres.2020.06.028 |
| [26] | Iba T, Levy JH, Thachil J, et al. The progression from coagulopathy to disseminated intravascular coagulation in representative underlying diseases[J]. Thromb Res, 2019, 179: 11-14. DOI:10.1016/j.thromres.2019.04.030 |
| [27] | Verhoeff K, Glen P, Taheri A, et al. Implementation and adoption of advanced care planning in the elderly trauma patient[J]. World J Emerg Surg, 2018, 13(1): 40. DOI:10.1186/s13017-018-0201-6 |
| [28] | Thompson HJ, McCormick WC, Kagan SH. Traumatic brain injury in older adults: epidemiology, outcomes, and future implications[J]. J Am Geriatr Soc, 2006, 54(10): 1590-1595. DOI:10.1111/j.1532-5415.2006.00894.x |
| [29] | 李力卓, 何松柏, 赵格晶娃. 中老年人群急性单发性创伤性颅脑损伤相关性凝血病的临床分析[J]. 首都医科大学学报, 2018, 39(4): 537-540. DOI:10.3969/j.issn.1006-7795.2018.04.011 |
| [30] | Dixon J, Comstock G, Whitfield J, et al. Emergency department management of traumatic brain injuries: a resource tiered review[J]. Afr J Emerg Med, 2020, 10(3): 159-166. DOI:10.1016/j.afjem.2020.05.006 |
| [31] | Peltan ID, Vande Vusse LK, Maier RV, et al. An international normalized ratio-based definition of acute traumatic coagulopathy is associated with mortality, venous thromboembolism, and multiple organ failure after injury[J]. Crit Care Med, 2015, 43(7): 1429-1438. DOI:10.1097/CCM.0000000000000981 |
| [32] | Ohmori T, Kitamura T, Tanaka K, et al. Admission fibrinogen levels in severe trauma patients: a comparison of elderly and younger patients[J]. Injury, 2015, 46(9): 1779-1783. DOI:10.1016/j.injury.2015.04.007 |
| [33] | Spahn DR, Bouillon B, Cerny V, et al. The European guideline on management of major bleeding and coagulopathy following trauma: fifth edition[J]. Crit Care, 2019, 23(1): 98. DOI:10.1186/s13054-019-2347-3 |
| [34] | Holcomb JB, Tilley BC, Baraniuk S, et al. Transfusion of plasma, platelets, and red blood cells in a 1: 1: 1 vs.a 1: 1: 2 ratio and mortality in patients with severe trauma: the PROPPR randomized clinical trial[J]. JAMA, 2015, 313(5): 471-482. DOI:10.1001/jama.2015.12 |
 2025, Vol. 34
2025, Vol. 34