2. 南京医科大学附属南京医院(南京市第一医院)急诊医学科,南京 210006
2. Department of Emergency Medicine, Nanjing First Hospital, Nanjing Medical University, Nanjing 210006, China
脓毒症是指因感染引起的宿主反应失调导致的危及生命的器官功能障碍[1]。作为气体交换的主要器官和病原体的储存库,肺脏往往是最先受累的靶器官之一,严重时可导致急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)[2]。研究发现,脓毒症约占ARDS发病原因的32%[3],且脓毒症相关的ARDS死亡率高达40%~50%,严重影响脓毒症患者的预后[4-5]。因此,如何寻找一个可靠的临床指标,便于判断脓毒症ARDS患者重症监护室(intensive care unit, ICU)住院期间的预后,从而提高救治成功率,仍是危重症学科研究领域的热点和难点。骨髓相关蛋白8和14(myeloid-related proteins 8 and 14, Mrp 8/14)主要分布在中性粒细胞中,与脓毒症的关系较为密切[6-7],但其在不同病因脓毒症所致ARDS患者中的作用,却鲜有报道。因此,本研究通过观察血Mrp 8/14在肺源性及肺外源性脓毒症致ARDS患者中的变化,分析其在不同病因所致脓毒症ARDS患者预后中的作用,旨在探索其对不同病因脓毒症所致的ARDS患者ICU住院期间预后的预测价值,为临床合理干预提供理论依据。
1 资料与方法 1.1 一般资料采用回顾性队列研究方法,选择2021年8月至2024年2月在南京医科大学附属南京医院ICU住院的脓毒症合并ARDS患者作为研究对象。所入选患者均符合脓毒症3.0的诊断标准[1]。ARDS柏林定义诊断标准[8]:(1)急性起病,1周内新发或加重的呼吸系统症状,且呼吸衰竭无法完全用心力衰竭或液体过负荷解释;(2)PaO2/FiO2 ≤300 mmHg(1 mmHg=0.133 kPa);(3)胸部CT示双肺模糊影,不能完全由渗出、肺塌陷或结节来解释。排除标准:(1)ICU住院小于24 h或超过30 d;(2)放弃治疗及临床资料不完整患者;(3)年龄 < 18岁;(4)怀孕、存在恶性肿瘤或自身免疫性疾病;(5)存在哮喘、慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD)或间质性肺疾病等基础病史。
根据脓毒症合并ARDS患者在ICU住院期间是否死亡,将肺源性及肺外源性ARDS患者分别分为存活组与死亡组。本研究经南京医科大学附属南京医院伦理委员会批准,且所有临床检测指标均获得患者同意或其直系亲属的授权(伦理审批号:KY20201102-03)。
1.2 研究方法 1.2.1 数据收集记录患者的性别、年龄、基础疾病(高血压、糖尿病、冠心病、脑血管病)、ICU住院时间、ICU住院费用、机械通气时间、急性生理学与慢性健康状况评分Ⅱ(acute physiology and chronic health status score Ⅱ, APACHE Ⅱ)。记录入院24 h内白细胞总数、C-反应蛋白、白细胞介素-6、降钙素原、凝血酶原时间(prothrombin time, PT)、活化部分凝血酶原时间(activated partial thromboplastin time, APTT)、谷丙转氨酶、血小板、白蛋白及肌酐的极值,记录确诊ARDS当天的PaO2/FiO2比值。
1.2.2 Mrp 8/14的检测所有脓毒症患者诊断为ARDS当日采集外周静脉血,室温下静置2 h后以3 000 r/m离心20 min,留取上清液保存在-80℃冰箱。采用酶联免疫吸附测定法(enzyme-linked immunosorbent assay, ELISA)检测血清Mrp 8/14的水平,ELISA试剂盒购于武汉华美生物科技有限公司(批号:CSB-E12149h),所有实验步骤严格按照试剂盒说明书进行操作。以标准品浓度作为横坐标,各孔的吸光度值作为纵坐标,绘制标准曲线,根据各待测样品的吸光度值带入标准曲线方程计算获得相应的浓度,计算出血清Mrp 8/14的水平。
1.3 统计学方法使用SPSS 22.0统计软件进行统计学分析。采用Kolmogorov-Smirnov法对计量资料进行正态性检验,符合正态分布的计量资料用均值±标准差(x±s)表示,采用独立样本t检验,非正态分布的计量资料以中位数(四分位数)[M(Q1, Q3)]表示,采用Mann-Whitney U检验。计数资料采用以例(%)表示,采用χ2检验。采用多因素Logistic回归分析法分析影响脓毒性ARDS患者ICU住院期间预后的危险因素,并绘制受试者工作特征(receiver operating characteristic, ROC)曲线,分析Mrp 8/14对脓毒症ARDS患者预后的预测能力。以P < 0.05为差异有统计学意义。
2 结果 2.1 患者的一般临床资料根据脓毒症3.0及ARDS柏林定义的诊断标准,共入选180例脓毒症致ARDS患者,其中放弃治疗及资料不全者12例,年龄小于18岁者3例,住院时间小于24 h或超过30 d者15例,存在间质性肺疾病或COPD患者12例,最终138例患者纳入分析,其中肺源性ARDS者79例,肺外源性脓毒症ARDS者59例。
根据患者在ICU住院期间的预后分为存活组和死亡组。肺源性ARDS存活组40例,男性25例,女性15例,(70.13±9.55)岁;死亡组39例,男性26例,女性13例,(69.64±7.57)岁。
肺外源性脓毒症ARDS患者中,泌尿系感染18例,血流感染7例,腹部感染(包括腹腔感染、腹膜炎、胆系感染)28例,其他感染(皮肤软组织、椎旁脓肿及未明确部位的)6例。其中存活组37例,男性19例,女性18例,(72.35±9.19)岁;死亡组22例,男性10例,女性12例,(70.78±6.82)岁。
两组患者性别、年龄、机械通气时间及基础疾病等基线资料均差异无统计学意义(均P > 0.05)。与存活组相比,肺源性及肺外源性脓毒症ARDS死亡组患者的APACHEⅡ评分、PT及APTT均较高(均P < 0.05)。肺源性ARDS存活组患者与死亡组相比,ICU住院时间、ICU住院费用、血小板、白蛋白、肌酐及Mrp 8/14均差异有统计学意义(均P < 0.05)。见表 1、2。
| 指标 | 肺源性脓毒症ARDS | χ2/Z/t值 | P值 | |
| 存活组(n=40) | 死亡组(n=39) | |||
| 年龄(岁)a | 70.13 ± 9.55 | 69.64 ± 7.57 | 0.249 | 0.804 |
| 男性b | 25(62.50) | 26(66.67) | 0.150 | 0.699 |
| 机械通气时间(d)c | 6.00(3.00, 7.75) | 6.00(4.00, 11.00) | -1.040 | 0.298 |
| ICU住院时间(d)c | 8.00(5.52, 11.00) | 11.00(8.00, 19.00) | -2.851 | 0.004 |
| ICU住院费用(万元)c | 7.21(6.25, 9.83) | 11.82(7.53, 21.02) | -2.089 | 0.037 |
| APACHE Ⅱ(分)c | 22.00(18.00, 29.00) | 31.00(25.00, 39.00) | -3.097 | 0.002 |
| 基础疾病b | ||||
| 冠心病 | 13 (32.50) | 14 (35.90) | 0.101 | 0.750 |
| 高血压 | 27 (67.50) | 26 (66.67) | 0.006 | 0.937 |
| 糖尿病 | 14 (35.00) | 15 (38.46) | 0.102 | 0.750 |
| 脑血管病 | 13(32.50) | 11 (28.21) | 0.172 | 0.678 |
| WBC(×109/L)a | 12.63 ± 6.25 | 12.00 ± 6.77 | 0.432 | 0.667 |
| CRP(mg/L)c | 137.12(57.10, 190.53) | 128.71(44.66, 221.94) | -0.054 | 0.957 |
| PCT(ng/mL)c | 3.63(0.44, 13.19) | 3.48(0.50, 16.81) | -0.044 | 0.965 |
| IL-6(pg/mL)c | 216.96(18.79, 344.68) | 220.00(38.43, 1 600.82) | -0.947 | 0.344 |
| 血小板(×109/L)c | 199.00(147.75, 241.00) | 150.00(120.00, 182.00) | -2.581 | 0.010 |
| PT(s)c | 13.50(11.67, 16.45) | 20.35(19.32, 23.45) | -5.223 | < 0.001 |
| APPT(s)c | 38.19(33.51, 40.37) | 43.53(40.30, 50.09) | -4.625 | < 0.001 |
| 白蛋白(g/L)a | 31.49 ± 3.46 | 29.62 ± 4.62 | 2.043 | 0.044 |
| 肌酐(µmol/L)c | 81.85(63.20, 131.28) | 145.40(69.30, 393.90) | -1.987 | 0.047 |
| ALT(U/L)c | 25.00 (10.65, 51.00) | 20.00(10.00, 38.80) | -0.511 | 0.609 |
| PaO2/FiO2(mmHg)a | 158.67 ± 53.95 | 161.73 ± 54.00 | -0.252 | 0.801 |
| Mrp 8/14(µg/mL)c | 10.73(7.15, 17.20) | 22.90(17.91, 30.88) | -5.439 | < 0.001 |
| 注:ARDS为急性呼吸窘迫综合征,ICU为重症监护室,APACHEⅡ评分为急性生理与慢性健康状况评分系统Ⅱ,WBC为白细胞总数,CRP为C反应蛋白,PCT为降钙素原,IL-6为白介素6,PT为凝血酶原时间,APTT为活化部分凝血酶原时间,ALT为谷丙转氨酶,Mrp8/14为骨髓相关蛋白8和14;a为x ± s,b为(例,%),c为M(Q1, Q3) | ||||
| 指标 | 肺源性脓毒症ARDS | χ2/Z/t值 | P值 | |
| 存活组(n=40) | 死亡组(n=39) | |||
| 年龄(岁)a | 72.35±9.19 | 70.78±6.82 | 0.698 | 0.488 |
| 男性b | 19 (51.35) | 10 (45.45) | 0.192 | 0.661 |
| 机械通气时间(d)c | 4.00(2.00, 5.50) | 3.50(2.75, 5.25) | -0.269 | 0.788 |
| ICU住院时间(d)c | 8.00(7.00, 11.00) | 6.50(4.75, 11.25) | -1.159 | 0.247 |
| ICU住院费用(万元)c | 8.05(5.99, 11.12) | 10.85(7.21, 15.28) | -2.038 | 0.042 |
| APACHE II(分)c | 25.00(17.50, 31.00) | 31.00(24.75, 35.00) | -2.900 | 0.004 |
| 基础疾病b | ||||
| 冠心病 | 10 (27.03) | 9 (40.91) | 1.218 | 0.270 |
| 高血压 | 21 (56.76) | 15 (68.18) | 0.757 | 0.384 |
| 糖尿病 | 24 (64.86) | 10 (45.45) | 2.129 | 0.145 |
| 脑血管病 | 11 (29.73) | 8 (36.36) | 0.278 | 0.598 |
| WBC(×109/L)a | 14.70±7.03 | 11.86±7.48 | 1.464 | 0.149 |
| CRP(mg/L)c | 115.98(54.06, 168.58) | 105.19(41.36, 160.63) | -0.518 | 0.605 |
| PCT(ng/mL)c | 11.54(1.99, 44.45) | 31.00(4.52, 48.42) | -1.004 | 0.315 |
| IL-6(pg/mL)c | 1 156.02(117.32, 8 177.38) | 210.70(143.52, 3 808.20) | -1.427 | 0.154 |
| 血小板(×109/L)c | 120.00(96.00, 154.50) | 136.00(82.50, 239.25) | -0.784 | 0.433 |
| PT(s)c | 18.28(13.44, 21.45) | 25.54(21.63, 32.39) | -4.484 | < 0.001 |
| APPT(s)c | 47.70(40.81, 50.90) | 58.81(49.50, 68.26) | -4.079 | < 0.001 |
| 白蛋白(g/L)a | 28.90±4.97 | 29.67±5.09 | -0.572 | 0.569 |
| 肌酐(µmol/L)c | 138.10(99.40, 230.25) | 135.97(96.90, 375.50) | -0.259 | 0.796 |
| ALT(U/L)c | 45.00(22.50, 89.00) | 38.00(19.75, 62.25) | -0.808 | 0.419 |
| PaO2/FiO2(mmHg)a | 201.34±43.21 | 193.49±45.02 | 0.664 | 0.509 |
| Mrp 8/14(µg/mL)c | 8.64(4.18, 17.42) | 12.16(4.81, 22.33) | -0.980 | 0.327 |
| 注:ARDS为急性呼吸窘迫综合征,ICU为重症监护室,APACHEⅡ评分为急性生理与慢性健康状况评分系统Ⅱ,WBC为白细胞总数,CRP为C反应蛋白,PCT为降钙素原,IL-6为白介素6,PT为凝血酶原时间,APTT为活化部分凝血酶原时间,ALT为谷丙转氨酶,Mrp8/14为骨髓相关蛋白8和14;a为x ± s,b为(例,%),c为M(Q1, Q3) | ||||
以肺源性脓毒症ARDS患者在ICU住院期间是否死亡作为因变量(是=1,否=0),以APACHE Ⅱ评分、血小板、PT、APTT、肌酐、白蛋白、Mrp 8/14、ICU住院时间及ICU住院费用作为自变量,进行Logistic回归分析模型统计。结果显示:Mrp 8/14是影响肺源性脓毒症ARDS患者ICU住院期间预后的独立危险因素(OR=1.253, 95%CI: 1.110~1.414,P < 0.001)。见表 3。
| 指标 | β值 | S.E. | Wald | P | OR | 95%CI |
| APACHE Ⅱ | 0.020 | 0.044 | 0.200 | 0.655 | 1.020 | 0.936~1.111 |
| 血小板 | -0.004 | 0.005 | 0.628 | 0.428 | 0.996 | 0.986~1.006 |
| PT | 0.163 | 0.185 | 0.780 | 0.377 | 1.177 | 0.820~1.691 |
| APTT | 0.129 | 0.159 | 0.655 | 0.418 | 1.138 | 0.832~1.555 |
| 肌酐 | 0.002 | 0.003 | 0.585 | 0.444 | 1.002 | 0.997~1.007 |
| 白蛋白 | -0.303 | 0.171 | 3.129 | 0.077 | 0.738 | 0.528~1.033 |
| Mrp 8/14 | 0.225 | 0.062 | 13.345 | < 0.001 | 1.253 | 1.110~1.414 |
| ICU住院时间 | 0.176 | 0.149 | 1.383 | 0.240 | 1.192 | 0.890~1.597 |
| ICU住院费用 | 0.000 | 0.000 | 0.245 | 0.621 | 1.000 | 1.000~1.000 |
| 注:ARDS为急性呼吸窘迫综合征,ICU为重症监护室,APACHEⅡ评分为急性生理与慢性健康状况评分系统Ⅱ,PT为凝血酶原时间,APTT为活化部分凝血酶原时间,Mrp8/14为骨髓相关蛋白8和14 | ||||||
以肺外源性脓毒症ARDS患者在ICU住院期间是否死亡作为因变量(是=1,否=0),以APACHE Ⅱ评分、PT及APTT作为自变量,进行Logistic回归分析模型统计,结果显示:APACHE Ⅱ评分、PT及APTT均不是影响肺外源性脓毒症ARDS患者ICU住院期间预后的独立危险因素。见表 4。
| 指标 | β值 | S.E. | Wald | P | OR | 95%CI |
| APACHEⅡ | 0.041 | 0.049 | 0.704 | 0.402 | 1.042 | 0.946~1.148 |
| PT | 0.139 | 0.072 | 3.750 | 0.053 | 1.149 | 0.998~1.322 |
| APTT | 0.057 | 0.044 | 1.633 | 0.201 | 1.058 | 0.970~1.155 |
| 注:ARDS为急性呼吸窘迫综合征,APACHE Ⅱ评分为急性生理与慢性健康状况评分系统Ⅱ,PT为凝血酶原时间,APTT为活化部分凝血酶原时间 | ||||||
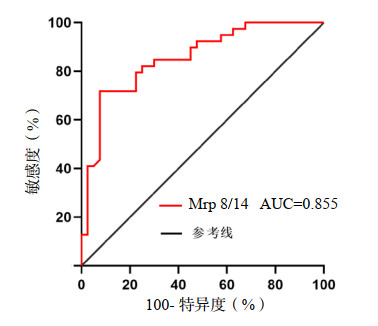
ROC曲线分析显示,Mrp 8/14对肺源性脓毒症ARDS患者ICU住院期间预后具有一定的预测价值(AUC=0.855,95%CI: 0.773~0.938,P < 0.001)。取约登指数最大切点为最佳截断值,当约登指数为0.643时,Mrp 8/14预测肺源性脓毒症ARDS患者ICU住院期间预后的最佳截断值为19.230 µg/mL,对应的敏感度为0.718,特异度为0.925(表 5、图 1)。
| 指标 | AUC | 95% CI | 截断值 | 敏感度 | 特异度 | 约登指数 | P值 |
| Mrp 8/14 | 0.855 | 0.773~0.938 | 19.230 | 0.718 | 0.925 | 0.643 | < 0.001 |
| 注:ARDS为急性呼吸窘迫综合征,Mrp8/14为骨髓相关蛋白8和14 | |||||||
|
| 注:Mrp8/14为骨髓相关蛋白8和14 图 1 血清Mrp 8/14预测肺源性脓毒症ARDS患者ICU住院期间预后的ROC曲线 Fig 1 ROC curve of serum Mrp 8/14 predicted the mortality of ARDS patients with pulmonary sepsis in ICU |
|
|
众所周知,肺源性及肺外源性脓毒症是ICU内ARDS患者最常见的致病因素,而不同病因脓毒症所致的ARDS在流行病学、病理生理、临床表现及治疗策略等方面均存在一定的差异。Mrp 8/14又称为钙卫蛋白或S100钙结合蛋白A8和A9(S100 calcium binding protein A8 and A9, S100 A8/A9)[9],广泛分布在人体细胞、组织及体液中。当脓毒症发生时,机体释放大量的Mrp 8/14并促进中性粒细胞富集和和细胞因子的释放,加剧组织损伤,抑制Mrp 8/14可有效减轻炎症反应和脓毒症诱导的急性肺损伤[6, 10]。本研究通过对纳入的138例脓毒症ARDS患者进行分析,结果发现,血清Mrp 8/14在肺源性脓毒症致ARDS死亡患者中的表达水平明显高于存活患者,在肺外源性ARDS存活及死亡患者中的表达则差异无统计学意义,提示不同感染部位所致的脓毒症ARDS对血清Mrp 8/14含量的影响不同。进一步多因素Logistic回归分析显示,Mrp 8/14是影响肺源性脓毒症ARDS患者ICU住院期间预后的独立危险因素,其对肺源性脓毒症ARDS患者ICU住院期间预后具有良好的预测价值(AUC:0.855,95%CI: 0.773~0.938),但该指标在肺外源性脓毒症致ARDS患者ICU住院期间不同预后患者的血清中并未见表达差异,提示可能与不同感染部位脓毒症所致ARDS的病理生理机制不同有关。此外,本研究还发现,肺源性脓毒症ARDS患者在ICU治疗期间的病死率高于肺外源性脓毒症ARDS患者[49.37% (39/79) vs. 37.29% (22/59)],但差异无统计学意义(P > 0.05),这与Agarwal等[11]的研究结果一致,但本研究并未进一步分析亚组内特定病因所致的肺外源性脓毒症ARDS患者病死率的发生情况。
既往研究发现,凝血功能活化在脓毒症ARDS的发生发展过程中起重要作用,与患者预后密切相关[12-13]。本研究也发现,肺源性及肺外源性脓毒症ARDS患者的凝血指标PT及APTT均出现不同程度的延长,且死亡患者的PT和APTT较存活者明显升高,可能与脓毒症时大量炎症因子进入血循环启动外源性凝血途径及炎症因子活化内皮细胞导致促凝物质生成增多有关。但进一步分析发现,PT及APTT对不同感染部位脓毒症致ARDS患者的预后,均未见良好的预测价值,考虑本研究纳入的患者病情严重程度、感染部位及病原体不同均会影响PT及APTT的变化。此外,血小板在脓毒症患者存活及死亡患者中的表达存在差异[14],但本研究在肺外源性ARDS患者中并未发现这一现象,可能与以下原因有关:(1)本研究纳入的研究对象不同,且样本量较小;(2) Mrp 8/14对感染相关的炎症具有促炎及抗炎的双向调控效应,对研究结果可能也有一定的影响[15]。
值得注意的是,本研究中肺源性脓毒症ARDS患者机械通气时间高于肺外源性脓毒症ARDS患者,可能与不同感染部位导致的脓毒症ARDS患者的病理生理特征不同有关,即前者主要打击肺泡上皮细胞导致肺水肿、纤维化等进而并发肺不张,而后者主要是全身炎症反应打击肺毛细血管内皮细胞、导致肺间质性肺水肿和压迫性肺不张[16]。但进一步分析并未发现机械通气时间在肺源性及肺外源性脓毒症ARDS患者不同预后中存在差异,可能与本研究中机械通气时间包括有创机及无创通气时间有关。此外,由于部分存活者反复感染导致无法成功撤机拔管、病情不稳定无法专科治疗清除感染灶等因素,导致部分存活者机械通气时间更长。
本研究尚存在一定的局限性:(1)本研究为单中心、回顾性研究,纳入研究的样本量较小,可能存在一定的偏倚;(2)仅纳入诊断脓毒症ARDS时的Mrp 8/14水平,并未监测Mrp 8/14的动态变化对不同感染部位脓毒症ARDS患者的预后,需临床上进一步深入研究。
综上所述,血清Mrp 8/14在肺源性脓毒症致ARDS不同预后患者中存在明显差异,是肺源性脓毒症ARDS患者ICU住院期间病死率的有效预测指标。
致谢: 感谢南京医科大学附属南京医院神经内科邓齐文副教授,对本研究中医学统计部分的悉心指导
利益冲突 所有作者声明无利益冲突
作者贡献声明 孙才智:实验操作、统计学分析及论文撰写;谢永鹏:实验操作指导;朱晨晨:数据采集及整理;秦海东:研究设计指导;李小民:研究设计、论文修改及经费支持
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Hwang JS, Kim KH, Park J, et al. Glucosamine improves survival in a mouse model of sepsis and attenuates sepsis-induced lung injury and inflammation[J]. J Biol Chem, 2019, 294(2): 608-622. DOI:10.1074/jbc.RA118.004638 |
| [3] | Hu QH, Hao CP, Tang SJ. From sepsis to acute respiratory distress syndrome (ARDS): emerging preventive strategies based on molecular and genetic researches[J]. Biosci Rep, 2020, 40(5): BSR20200830. DOI:10.1042/BSR20200830 |
| [4] | Wick KD, Ware LB, Matthay MA. Acute respiratory distress syndrome[J]. BMJ, 2024, 387: e076612. DOI:10.1136/bmj-2023-076612 |
| [5] | Auriemma CL, Zhuo HJ, Delucchi K, et al. Acute respiratory distress syndrome-attributable mortality in critically ill patients with sepsis[J]. Intensive Care Med, 2020, 46(6): 1222-1231. DOI:10.1007/s00134-020-06010-9 |
| [6] | Ding ZY, Du FF, Richard Averitt V, et al. Targeting S100A9 reduces neutrophil recruitment, inflammation and lung damage in abdominal sepsis[J]. Int J Mol Sci, 2021, 22(23): 12923. DOI:10.3390/ijms222312923 |
| [7] | 李俊玉, 刘慧珍, 王娜, 等. 钙卫蛋白对脓毒症患者急性肾损伤的预测价值[J]. 中华急诊医学杂志, 2023, 32(2): 174-179. DOI:10.3760/cma.j.issn.1671-0282.2023.02.008 |
| [8] | Definition Task Force ARDS, Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. DOI:10.1001/jama.2012.5669 |
| [9] | 高榕悦, 韩玉珍, 李文雄, 等. 钙卫蛋白与脓毒症关系研究进展[J]. 中国急救医学, 2022, 42(1): 87-91. DOI:10.3969/j.issn.1002-1949.2022.01.018 |
| [10] | Revenstorff J, Ludwig N, Hilger A, et al. Role of S100A8/A9 in platelet-neutrophil complex formation during acute inflammation[J]. Cells, 2022, 11(23): 3944. DOI:10.3390/cells11233944 |
| [11] | Agarwal R, Srinivas R, Nath A, et al. Is the mortality higher in the pulmonary vs the extrapulmonary ARDS? A meta analysis[J]. Chest, 2008, 133(6): 1463-1473. DOI:10.1378/chest.07-2182 |
| [12] | Fan E, Brodie D, Slutsky AS. Acute respiratory distress syndrome: advances in diagnosis and treatment[J]. JAMA, 2018, 319(7): 698-710. DOI:10.1001/jama.2017.21907 |
| [13] | 喻思涵, 马宇腾, 李旭. 非肺源性脓毒症和肺部感染致急性呼吸窘迫综合征患者凝血指标差异及与预后的相关性[J]. 中华内科杂志, 2021, 60(7): 650-655. DOI:10.3760/cma.j.cn112138-20201217-01017 |
| [14] | 陈晨松, 方俊杰, 陈乾峰, 等. 早期血小板计数动态变化对脓毒症患者预后的预测价值[J]. 中华急诊医学杂志, 2022, 31(5): 665-671. DOI:10.3760/cma.j.issn.1671-0282.2022.05.017 |
| [15] | Yang JX, Anholts J, Kolbe U, et al. Calcium-binding proteins S100A8 and S100A9: investigation of their immune regulatory effect in myeloid cells[J]. Int J Mol Sci, 2018, 19(7): 1833. DOI:10.3390/ijms19071833 |
| [16] | 喻文亮. 肺源性与肺外源性急性呼吸窘迫综合征呼吸力学的异同及机械通气策略[J]. 中国小儿急救医学, 2010, 17(3): 196-199. DOI:10.3760/cma.j.issn.1673-4912.2010.03.003 |
 2025, Vol. 34
2025, Vol. 34