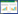2. 天津医科大学第二医院急诊医学科,天津 300211;
3. 天津市人民医院心脏科,天津 300121
2. Department of Emergency Medicine, the Second Hospital of Tianjin Medical University, Tianjin 300211, China;
3. Department of Cardiology, Tianjin Union Medical Center, Nankai University Affiliated Hospital, Tianjin 300121, China
脓毒症(sepsis)一直以来都是重症医学医师面临的重大挑战,其发病率和病死率在全球范围内持续处于较高水平[1]。脓毒症心肌病(septic cardiomyopathy, SC)是脓毒症休克的常见并发症之一,与其不良预后直接相关。SC的病理生理学机制尚不完全明确,所涉及通路机制十分复杂[2–5]:包括循环心肌抑制物质的释放、肾上腺素能通路的下调、一氧化氮和活性氧的释放、钙处理异常、线粒体功能障碍、冠状动脉微血管扰动、细胞凋亡、编码肌节线粒体蛋白的基因下调等。
血管生成素样蛋白家族(angiopoietin-like proteins,ANGPTLs)是一类新发现的血管相关蛋白调节因子,ANGPTL4是此家族中的一种蛋白因子,过去的研究主要聚焦在其脂质代谢、血糖调节、血管再生等方面[6]。然而,近年来一些实验结论表明,在一些感染及炎症模型中,ANGPTL4基因显著上调,促进炎症进展,加重了组织损伤[7-8]。但目前有关ANGPTL4在LPS诱导的脓毒症心肌损伤中的确切作用尚不明确。本研究应用脓毒症小鼠心肌组织及细胞模型,明确ANGPTL4在LPS诱导的脓毒症心肌组织以及心肌细胞中的表达情况,并尝试探究ANGPTL4在脓毒症心肌损伤中的作用机制。
1 材料与方法 1.1 脓毒症心肌病小鼠模型的建立将50只C57BL/6小鼠(8周龄)随机(随机数字法)分为脂多糖(LPS)治疗组和对照组(每组n=25)。治疗组小鼠腹腔内注射细菌LPS(10 mg/kg) (L3012, Sigma-Aldrich, USA)以建立脓毒症小鼠模型。对照组接受等体积的0.9%生理盐水溶液。注射后24 h,收取造模成功小鼠的左心室组织,并将其混合到一个处理(TRE)样品中,将健康小鼠的左心室组织混合到一个对照(CON)样品中。制备TRE和CON样品用于RNA测序(RNA-seq)。本研究经天津医科大学动物伦理与福利委员会批准,审查编号TMUaMEC 2023002。
1.2 RNA-seq不同组的左心室组织样本送至广州锐博生物技术有限公司(GuangZhou, China)进行转录组测序。测序程序由Ribo Bio在具有对端150 bp的Illumina测序平台(Illumina, USA)上进行,对于RNA-Seq,使用Magzol试剂(Magen, China)提取总RNA。使用Illumina HiSeq仪器进行文库测序,具有150 bp的配对末端读数。对原始数据进行了预处理使用Trimmomatic,一种常用的软件用于高通量测序数据分析,包括读取数字统计的质量控制和生成。映射的读数是使用袖扣组装的,并且不完全组装的转录本由参考基因注释。
1.3 实时荧光定量PCR用1 mL Trizol试剂(Invitrogen, USA)处理小鼠的左心室组织或者心室肌细胞并裂解30 min。提取的RNA样品溶解在无菌水中。采用NanoDrop ND-2000仪器检测RNA纯度,OD260/OD280值在1.8 ~ 2.1之间,说明RNA纯度足够。使用FastQuant RT Kit (with gD-Nase) (KR106, Tiangen, China)将RNA反转录为cDNA。cDNA产物使用SYBR Premix E-x Taq Ⅱ试剂盒(Takara, Japan)在Applied BiosystemsTM 7500 Fast Dx Real-Time PCR (Thermo Fisher, Waltham, MA, USA)上作为PCR模板。ANGPTL4的引物序列为Forward:CAGCTCATTGGCTTGACTCCC; Reverse: CAGGCGTCTCTGAATCACTGTC。GAPDH的引物序列为Forward:TGTGTCCGTCGTGGATCTGA;Reverse:TTGCTGTTGAAGTCGCA-GGAG。以GAPDH为内参计算ANGPTL4的相对表达量。
1.4 Western blot使用RIPA裂解缓冲液从小鼠的左心室组织或者心室肌细胞中分离出总蛋白,用BCA试剂盒测定总蛋白的浓度。随后,将蛋白样品置于10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中进行分离,之后转移到PVDF膜上,并用5%脱脂奶粉在室温中封闭30 min。TBST清洗后,4℃一抗[Rabbit anti-Bax (ab104156),浓度1:1 000;Mouse anti-Bcl2 (ab692),浓度1:1 000;Rabbit anti-Caspase3 (ab13874),浓度1:500;Mouse anti-β-actin (ab8226),浓度1:5000]孵育过夜,然后在室温下二抗[Goat anti-rabbit IgG-HRP (ab7090), Goat anti-mouse IgG-HRP (ab97040)]孵育1 h。洗涤后,蛋白条带使用电化学发光(ECL)试剂盒进行可视化测定,并使用Image Pro软件进行定量。
1.5 心室肌细胞的培养取小鼠乳鼠的左心室组织,切成1 mm×1 mm×1 mm小块。用0.25% Trypsin-EDTA,37℃水浴消化,并分散细胞。当观察不到明显组织时,加入含有10% FBS的DMEM培养基,停止消化。100 μm滤网过滤细胞悬液,300 r/min离心5 min,抽吸上清液。加入红细胞溶解液,去除红细胞。孵育3~5 min后,300 r/min,离心5 min,抽吸上清液。采用梯度沉降法分离原代心肌细胞,之后将心肌细胞置于含有10% FBS的DMEM培养皿中,37℃,5% CO2,培养90 min,去除附着的杂质,收获主要含有心肌细胞的细胞悬液,然后将心肌细胞置于细胞培养箱中进行培养。
1.6 细胞转染细胞接种于6孔板,密度为2 × 106个/孔,每孔加入1 mL基本培养基(不含青霉素-链霉素和血清)。当细胞生长到约80%的浓度时,每孔加入200 pmol siRNA或4 µg pcDNA3.1+质粒和10 µl lipofectamineTM3000 (Invitrogen, Carlsbad, CA, USA)。将六孔板置于细胞培养箱中,37℃下培养6~8 h,然后更换完全培养基。转染24 h后,收集细胞进行后续检测。
1.7 CCK8法检测细胞活性以5×103个/孔的密度取对数生长期的小鼠乳鼠心室肌细胞接种于96孔板。细胞贴附后,使用不同浓度的LPS进行处理,同时加入药物,随后在37 ℃、5% CO2条件下培养24 h。去除培养基,每孔加入10 μL的CCK-8溶液,继续孵育30 min,最终在450 nm处测量吸光度以确定细胞活力。
1.8 细胞凋亡检测使用胰蛋白酶消化心肌细胞,在3 000 r/min下离心10 min,弃上清液。加入预冷的PBS,再在3 000 r/min下离心10 min,弃上清液。然后将Annexin V-FITC/PI凋亡检测试剂盒(BD Sciences, Franklin Lake, NJ, USA)中的结合缓冲液重悬细胞,之后加入Annexin V-FITC和PI染料,并在4℃避光孵育15 min。1 h内用流式细胞仪(BD FACSverse, BD Sciences, Franklin Lake, USA)检测细胞凋亡情况。
1.9 统计学方法所有数据均采用GraphPad Prism 8.0软件进行分析。计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析(LSD-t检验)。以P < 0.05为差异有统计学意义。
2 结果 2.1 脓毒症小鼠心肌组织和细胞中ANGPTL4的表达情况建立了脓毒症小鼠模型:腹腔注射LPS后,小鼠出现脓毒症症状,如寒战、无精打采、毛发竖立和腹泻;腹腔注射LPS 24 h后,分别收取两组小鼠的左心室,做了RNA-seq。结果显示,与对照组小鼠相比,脓毒症心肌病小鼠心室组织中ANGPTL4的表达明显上调(图 1A和1B)。收集了两组小鼠的心室组织,并且分离了小鼠乳鼠的心室肌细胞,用LPS刺激24 h,qRT-PCR和western blot的结果发现,与对照相比,脓毒症小鼠的动物模型及细胞模型中,ANGPTL4的mRNA和蛋白水平均显著增加(图 1C~F)。
|
| 注:A: RNA-Seq分析的对照组和脓毒症组小鼠心室组织中差异表达基因的热图;B: 对照组和脓毒症组心室组织中显著差异基因的火山图(红色图代表上调表达的基因,蓝色表示下调的基因);C-D: qRT-PCR验证动物模型和细胞模型中ANGPTL4的mRNA表达情况;E-F: Western blot验证动物模型和细胞模型中ANGPTL4的蛋白表达情况; aP < 0.05 图 1 脓毒症小鼠心肌组织和心室肌细胞中ANGPTL4的表达情况 Fig 1 The expression of ANGPTL4 in myocardial tissue and ventricular cardiomyocytes of sepsis mice. |
|
|
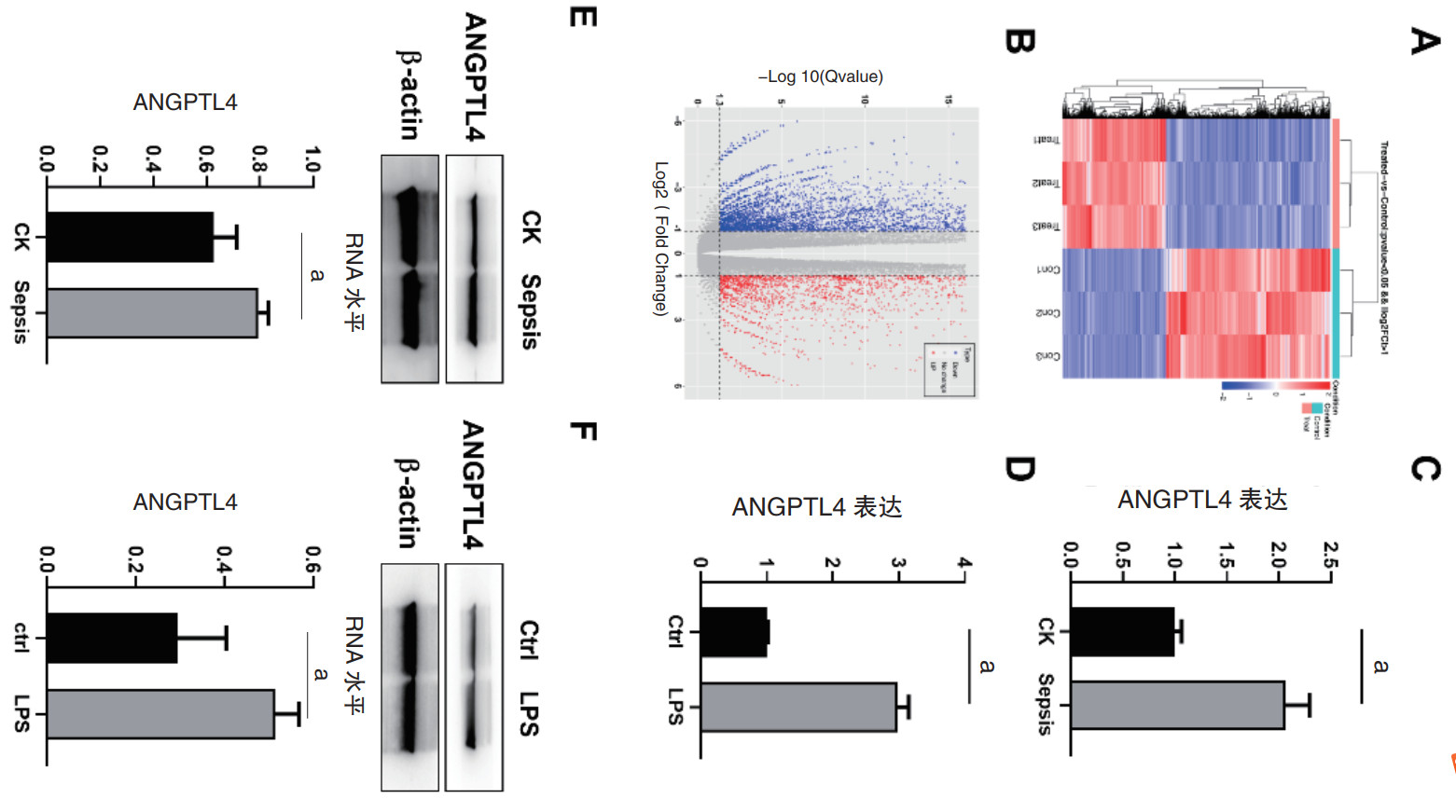
为了阐明ANGPTL4在脓毒症心肌损伤过程中发挥的作用,在小鼠乳鼠的心室肌细胞中构建了ANGPTL4的沉默和过表达载体,并通过qRT-PCR以及Western blot进行验证。结果显示心室肌细胞中转染ANGPTL4的siRNA之后,与NC相比,si-ANGPTL4组的ANGPTL4的mRNA及蛋白的表达量显著下降(图 2A和C);与之相反,将ANGPTL4-pcDNA3.1+质粒转染到心室肌细胞中中显著上调了ANGPTL4的水平(图 2B和D)。
|
| 注:A: qRT-PCR验证转染ANGPTL4的siRNA后心室肌细胞中ANGPTL4的mRNA表达情况;B: qRT-PCR验证转染ANGPTL4的过表达质粒后心室肌细胞中ANGPTL4的mRNA表达情况;C: Western blot验证转染ANGPTL4的siRNA后心室肌细胞中ANGPTL4的蛋白表达情况;D: Western blot验证转染ANGPTL4的过表达质粒后心室肌细胞中ANGPTL4的蛋白表达情况;aP<0.05 图 2 构建ANGPTL4的沉默和过表达载体 Fig 2 Construction of silencing and overexpression vectors of ANGPTL4. |
|
|
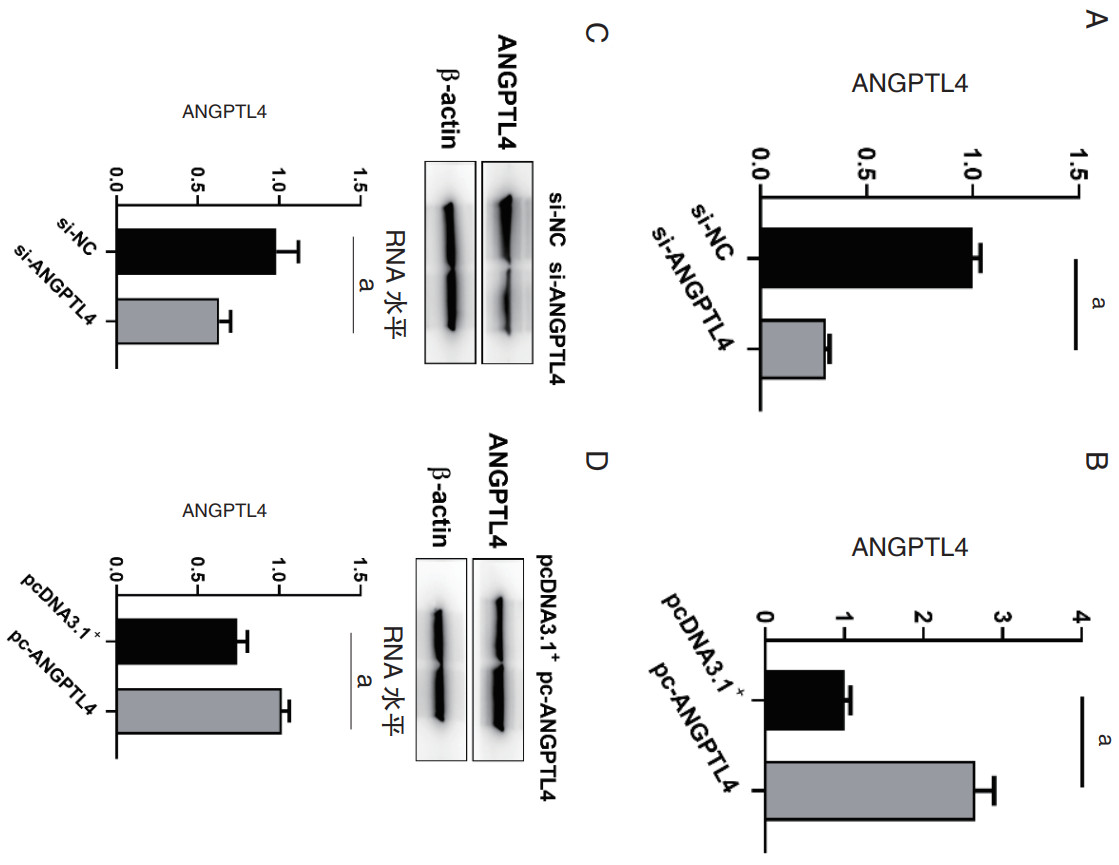
为了确定ANGPTL4对心室肌细胞增殖的影响,转染了ANGPTL4的沉默和过表达载体,用CCK8法测定心室肌细胞的增殖情况。结果显示,与对照组相比,si-ANGPTL4转染后心室肌细胞的增殖能力显著增强,ANGPTL4过表达的心室肌细胞增殖能力明显减弱(图 3A-3B)。CCK8的结果表明,ANGPTL4抑制了心室肌细胞的活性。
|
| 注:A: CCK8法检测转染ANGPTL4的siRNA后心室肌细胞的增殖情况;B: CCK8法检测转染ANGPTL4的过表达质粒后心室肌细胞的增殖情况;C: Western blot验证转染ANGPTL4的siRNA后心室肌细胞中凋亡因子的表达;D: Western blot验证转染ANGPTL4的过表达质粒后心室肌细胞中凋亡因子的表达;aP<0.05 图 3 ANGPTL4对心室肌细胞活力和凋亡的影响 Fig 3 The effect of ANGPTL4 on the viability and apoptosis of ventricular cardiomyocytes. |
|
|
心肌细胞的凋亡在SC中广泛存在,为了探究ANGPTL4对心室肌细胞凋亡的影响,转染了ANGPTL4的siRNA和过表达质粒,利用Western blot检测心室肌细胞中凋亡因子Bax、Bcl-2、Caspase 3的表达。结果显示,与对照组相比,转染si-ANGPTL4后心肌细胞中Bax和Caspase3的表达明显下调,Bcl-2的表达则明显上调(图 3C)。而转染pc-ANGPTL4后,Bax、Caspase3以及Bcl-2的表达呈相反趋势(图 3D)。
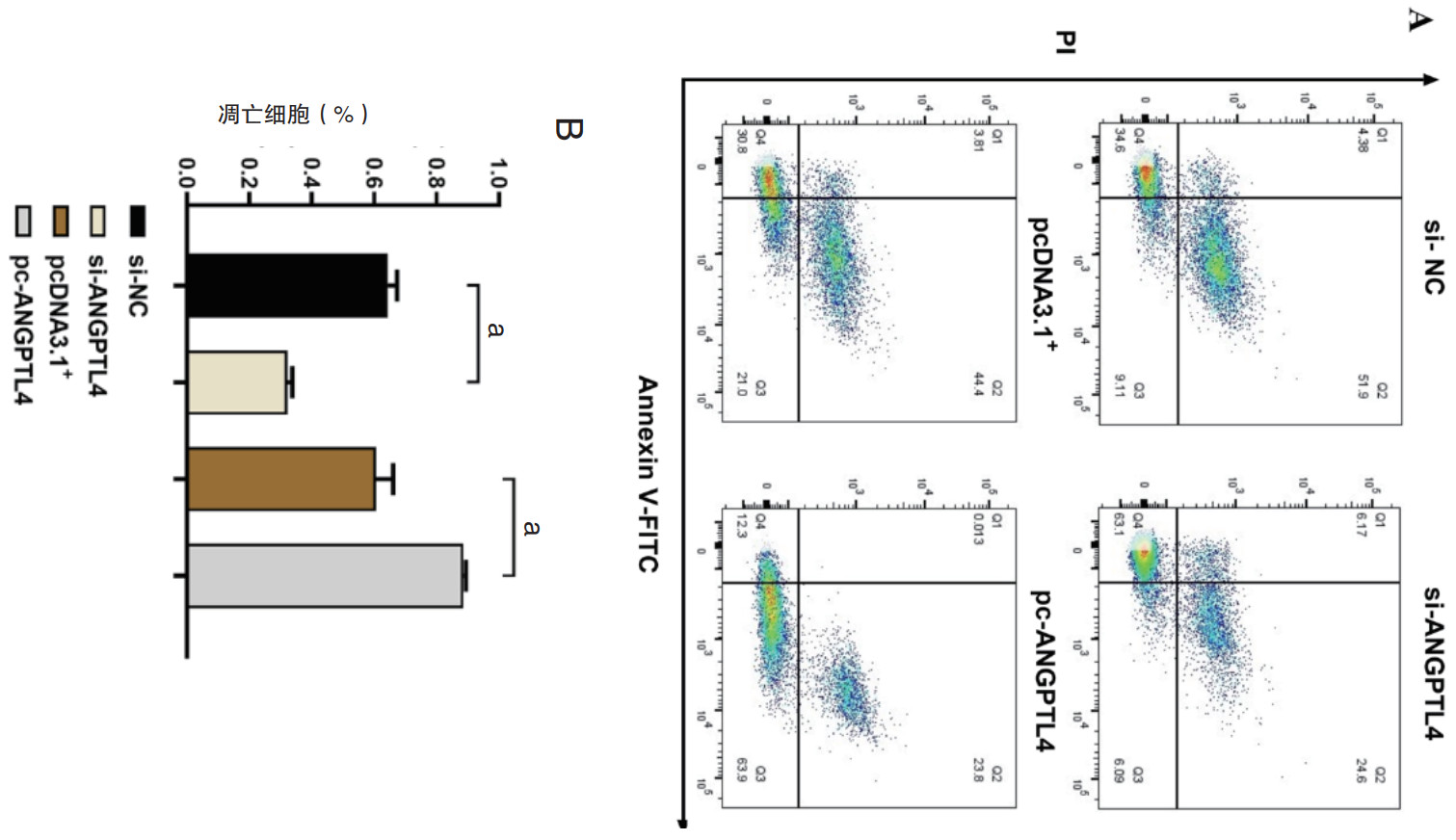
在心室肌细胞中转染了ANGPTL4的siRNA和过表达质粒,使用Annexin V/PI对心室肌细胞进行染色,流式细胞术检测心室肌细胞的凋亡。与对照组相比,si-ANGPTL4在Q2和Q3区域减少了凋亡细胞的数量;与之相反的是,ANGPTL4的过表达促使心室肌细胞凋亡的数量显著增加(图 4A-4B)。以上这些结果表明,ANGPTL4促进心室肌细胞的凋亡。
|
| 注:A: 流式细胞术检测心室肌细胞凋亡的代表性图片;B: 各组凋亡细胞的定量分析;aP<0.05 图 4 流式细胞术检测ANGPTL4对心室肌细胞凋亡的影响 Fig 4 Flow cytometry to detect the effect of ANGPTL4 on the apoptosis of ventricular cardiomyocytes |
|
|
SC是一种严重但可逆转的心肌损伤,这种疾病的诊断尚无明确的定义[9],随着被人们的日渐熟知,关于其发病机制出现了越来越多的争论。已有研究证实晚期免疫抑制是脓毒症患者死亡的主要原因[10],然而许多研究表明,细胞因子过度激活和SC也是脓毒症患者的重要死亡原因[11]。寻找抑制细胞因子的关键靶点,可以明显降低脓毒症患者的病死率,并改善患者预后。本研究结果表明,ANGPTL4在LPS诱导的脓毒症心肌损伤小鼠的心室组织和心肌细胞中均表达上调,并且ANGPTL4促进了心肌细胞的凋亡、降低了心肌细胞活力。所以探寻SC的发病机制,寻找潜在的治疗靶点是目前需要持续探索的。
ANGPTL4属于血管生成素样家族,在脂质代谢、血糖调节、血管再生、炎症反应等过程中均发挥重要作用。人类ANGPTL4的基因位于19号染色体,其氨基酸序列与小鼠的相似程度高达77%,因此,小鼠可以作为理想的动物模型来研究ANGPTL4的作用机制[12]。研究表明ANGPTL4能够调节脂糖代谢和炎症信号,并且可以通过环境或者组织依赖模式发挥促炎和抗炎作用。ANGPTL4在炎症反应中的双重作用,反映了ANGPTL4在不同组织和细胞类型中的功能和表达的复杂机制,包括翻译后修饰、切割和寡聚化、选择性剪接、亚细胞定位和DNA甲基化等[13]。有研究表明,ANGPTL4可以一定程度上抵消饱和脂肪酸在脂质代谢中的促炎作用,减少脂肪酸的脂溶性释放、泡沫细胞的形成、内质网应激以及炎症信号通路的激活[14]。Cho等[15]研究表明,在动脉粥样硬化小鼠体内注射ANGPTL4蛋白,可以下调KLF4的表达,抑制NOX1激活,抑制平滑肌细胞向泡沫样细胞的表型转化,使小鼠动脉斑块更加稳定,由此可见ANGPTL4可以通过抑制慢性病理性炎症反应发挥心脏保护作用。众多研究均证实ANGPTL4参与调节多种炎症反应,但其作用机制尚不明确。
在本研究中,通过RNA测序技术,分析脓毒症小鼠心肌组织中mRNA的表达情况,在后续的动物实验与细胞实验中,ANGPTL4在LPS诱导的脓毒症心肌损伤小鼠的心室组织和心肌细胞中均表达上调,这表明脓毒症机体损伤可能与ANGPTL4的表达增加存在相关性。而脓毒症可以诱导全身炎症反应和多脏器损伤,ANGPTL4在机体的心肌、肝脏、脂肪、肺脏等多组织都有分布表达[16]。既往研究表明在严重的脓毒症和并发SC患者中,心肌线粒体的超微结构和功能被严重破坏[17],包括线粒体肿胀、细胞质变性、蛋白积聚和溶酶体损伤等[18],并激活细胞凋亡途径[19]。为明确ANGPTL4参与脓毒症心肌损伤的作用机制,本研究构建了ANGPTL4的沉默和过表达载体,通过转染si-ANGPTL4和pc-ANGPTL4来调控ANGPTL4在心肌细胞中的表达,发现与对照组相比,si-ANGPTL4转染后心室肌细胞的增殖能力显著增强,并且心室肌细胞中Bax和Caspase3的表达明显下调,Bcl-2的表达则明显上调,心室肌细胞的凋亡率明显下降;而转染pc-ANGPTL4之后明显降低心室肌细胞的活力,促进心室肌细胞的凋亡。由此认为ANGPTL4有可能是SC的潜在治疗靶点之一,抑制ANGPTL4能够有效减轻脓毒症造成的急性心肌损伤。
本研究仍存在一定的局限性:未能检测临床患者的血清中ANGPTL4的表达情况,抑制ANGPTL4表达是否能减轻患者的病理损伤还需进一步实验验证。本实验表明ANGPTL4参与LPS诱导的心肌细胞凋亡,但涉及的相关诱导损伤因子、细胞凋亡具体机制和通路,以及ANGPTL4与氧化应激、线粒体作用的具体机制还需要进一步实验研究。
利益冲突 所有作者声明无利益冲突
作者贡献声明 梁雪、张伯阳:课题实施、论文撰写;王花玲李娇关思宇顾天舒:分子生物学实验、数据整理、统计学分析;李真玉:研究设计、实验指导、论文修改、经费支持
| [1] | Cecconi M, Evans L, Levy M, et al. Sepsis and septic shock[J]. Lancet, 2018, 392(10141): 75-87. DOI:10.1016/s0140-6736(18)30696-2 |
| [2] | Hollenberg SM, Singer M. Pathophysiology of sepsis-induced cardiomyopathy[J]. Nat Rev Cardiol, 2021, 18(6): 424-434. DOI:10.1038/s41569-020-00492-2 |
| [3] | Martin L, Derwall M, Al Zoubi S, et al. The septic heart: current understanding of molecular mechanisms and clinical implications[J]. Chest, 2019, 155(2): 427-437. DOI:10.1016/j.chest.2018.08.1037 |
| [4] | 袁睿, 陈凤英. 从信号传导通路方面减轻脓毒症心肌损伤的研究进展[J]. 中华急诊医学杂志, 2023, 32(7): 865-869. DOI:10.3760/cma.j.issn.1671-0282.2023.07.003 |
| [5] | 李真玉, 陈兵, 李广平. 脓毒症心肌抑制的诊治进展[J]. 中国循环杂志, 2015, 30(7): 705-707. DOI:10.3969/j.issn.1000-3614.2015.07.021 |
| [6] | Georgiadi A, Wang YN, Stienstra R, et al. Overexpression of angiopoietin-like protein 4 protects against atherosclerosis development[J]. Arterioscler Thromb Vasc Biol, 2013, 33(7): 1529-1537. DOI:10.1161/ATVBAHA.113.301698 |
| [7] | Jung KH, Son MK, Yan HH, et al. ANGPTL4 exacerbates pancreatitis by augmenting acinar cell injury through upregulation of C5a[J]. EMBO Mol Med, 2020, 12(8): e11222. DOI:10.15252/emmm.201911222 |
| [8] | Sun BS, Bai LN, Li QL, et al. Knockdown of angiopoietin-like 4 suppresses sepsis-induced acute lung injury by blocking the NF-κB pathway activation and hindering macrophage M1 polarization and pyroptosis[J]. Toxicol In Vitro, 2024, 94: 105709. DOI:10.1016/j.tiv.2023.105709 |
| [9] | Fu X, Lin X, Seery S, et al. Speckle-tracking echocardiography for detecting myocardial dysfunction in sepsis and septic shock patients: a single emergency department study[J]. World J Emerg Med, 2022, 13(3): 175-181. DOI:10.5847/wjem.j.1920-8642.2022.057 |
| [10] | Ren EF, Xiao HL, Wang GX, et al. Value of procalcitonin and presepsin in the diagnosis and severity stratification of sepsis and septic shock[J]. World J Emerg Med, 2024, 15(2): 135-138. DOI:10.5847/wjem.j.1920-8642.2024.028 |
| [11] | Hotchkiss RS, Monneret G, Payen D. Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy[J]. Nat Rev Immunol, 2013, 13(12): 862-874. DOI:10.1038/nri3552 |
| [12] | Yao QL, Shin MK, Jun JC, et al. Effect of chronic intermittent hypoxia on triglyceride uptake in different tissues[J]. J Lipid Res, 2013, 54(4): 1058-1065. DOI:10.1194/jlr.M034272 |
| [13] | Zuo YY, He Z, Chen Y, et al. Dual role of ANGPTL4 in inflammation[J]. Inflamm Res, 2023, 72(6): 1303-1313. DOI:10.1007/s00011-023-01753-9 |
| [14] | Lichtenstein L, Mattijssen F, de Wit NJ, et al. Angptl4 protects against severe proinflammatory effects of saturated fat by inhibiting fatty acid uptake into mesenteric lymph node macrophages[J]. Cell Metab, 2010, 12(6): 580-592. DOI:10.1016/j.cmet.2010.11.002 |
| [15] | Cho DI, Kang HJ, Jeon JH, et al. Antiinflammatory activity of ANGPTL4 facilitates macrophage polarization to induce cardiac repair[J]. JCI Insight, 2019, 4(16): e125437. DOI:10.1172/jci.insight.125437 |
| [16] | Gusarova V, O'Dushlaine C, Teslovich TM, et al. Genetic inactivation of ANGPTL4 improves glucose homeostasis and is associated with reduced risk of diabetes[J]. Nat Commun, 2018, 9(1): 2252. DOI:10.1038/s41467-018-04611-z |
| [17] | 伏春晓, 袁羞, 王晗, 等. Drp1介导的线粒体动力学平衡在脓毒症心肌细胞损伤的机制研究[J]. 中华急诊医学杂志, 2022, 31(6): 767-772. DOI:10.3760/cma.j.issn.1671-0282.2022.06.012 |
| [18] | Pinto BB, Dyson A, Umbrello M, et al. Improved survival in a long-term rat model of sepsis is associated with reduced mitochondrial calcium uptake despite increased energetic demand[J]. Crit Care Med, 2017, 45(8): e840-e848. DOI:10.1097/CCM.0000000000002448 |
| [19] | Kwong JQ, Molkentin JD. Physiological and pathological roles of the mitochondrial permeability transition pore in the heart[J]. Cell Metab, 2015, 21(2): 206-214. DOI:10.1016/j.cmet.2014.12.001 |
 2025, Vol. 34
2025, Vol. 34