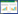2. 福建医科大学附属南平第一医院心血管内科,南平 353000;
3. 福建医科大学省立临床医学院重症医学四科,福建省立医院,福州大学附属省立医院,福建省急诊医学重点实验室,福州 350001;
4. 福建医科大学省立临床医学院急诊科,福建省立医院,福州大学附属省立医院,福建省急诊医学重点实验室,福州 350001
2. Department of Cardiology, Nanping First Hospital Affiliated to Fujian Medical University, Nanping 353000, Fujian, China;
3. Fourth Department of Critical Care Medicine, Shengli Clinical Medical College of Fujian Medical University, Fujian Provincial Hospital, Fuzhou University Affiliated Provincial Hospital, Fujian Provincial Key Laboratory of Emergency Medicine, Fuzhou 350001, Fujian, China;
4. Department of Emergency, Shengli Clinical Medical College of Fujian Medical University, Fujian Provincial Hospital, Fuzhou University Affiliated Provincial Hospital, Fujian Provincial Key Laboratory of Emergency Medicine, Fuzhou 350001, Fujian, China
急性病毒性心肌炎(acute viral myocarditis, AVMC)是由病毒感染引起的局灶性或弥漫性心肌炎性疾病,是导致年轻人心力衰竭和猝死的常见原因[1]。柯萨奇B3病毒(Coxsackievirus B3, CVB3)是AVMC的主要致病因子,通过直接侵犯心肌细胞及后续过度激活的免疫反应引起心肌损伤[2]。心肌细胞大量死亡是导致心功能恶化的重要原因,虽然抗病毒药物、免疫抑制剂和循环支持可以一定程度上挽救重症AVMC患者,但目前仍没有公认的特异性治疗方法[3-4]。因此,探索新的干预靶点至关重要。三基序蛋白72(tripartite motif-containing protein 72, Trim72, 也称为MG53)是Trim家族蛋白中的一员,具有特定的结构域,包括环状、B-box和盘状线圈分子以及羧基末端的SPRY片段[5]。作为一种细胞膜修复蛋白,它在骨骼肌和心肌中表达丰富,参与多种病理及生理过程,包括急性细胞膜修复、细胞内的囊泡转运和心脏缺血预适应等,是心肌损伤过程中的关键调节因子[6]。近年来的研究显示,Trim72基因缺失会增加心肌对缺血-再灌注损伤的易感性,而补充重组人Trim72对心肌缺血-再灌注损伤有保护作用[7-8]。本课题组前期通过高通量测序,发现它在AVMC小鼠心肌中显著低表达,然而其具体的作用尚不清楚[9]。本研究拟通过构建CVB3诱导的AVMC小鼠模型,探讨Trim72对AVMC小鼠的作用及可能的机制。
1 材料与方法 1.1 实验动物40只SPF级雄性6周龄BALB/c小鼠,体质量18~22 g,购自上海斯莱克实验动物有限责任公司,饲养在福建医科大学实验动物中心屏障环境中,并提供标准的饲料和水[许可证号:SYXK(闽)2020-0005]。实验前让小鼠适应环境3 d,自由进食饮水。
1.2 实验材料CVB3 Nancy株由广西医科大学实验中心惠赠,滴度为1.0×108 PFU/mL;PCR引物和重组9型腺相关病毒载体(adeno-associated virus serotype 9, AAV9)购自上海吉凯基因有限公司,滴度为5.0×1013 VG/mL;2%异氟烷购自深圳市瑞沃德生命科技有限公司;Trizol试剂、M-MLV逆转录试剂盒、荧光定量RT-qPCR试剂盒购自北京索莱宝科技有限公司;TUNEL试剂盒购自上海碧云天生物技术有限公司;ELISA试剂盒均购自武汉博士德生物技术有限公司;兔抗Trim72抗体、兔抗Bax抗体、兔抗Bcl-2抗体和兔抗GAPDH抗体均购自美国Abcam公司;兔抗Cleaved caspase-3抗体、兔抗Caspase-3抗体、兔抗TLR4抗体、兔抗NF-κB p65抗体和兔抗NF-κB p-p65抗体均购自美国CST公司;HRP标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司。LED正置显微镜DM2000、倒置荧光显微镜(德国Leica公司);Nanodrop分光光度计(美国Thermo Fisher Scientific公司);RT-qPCR仪(瑞士Roche公司);凝胶电泳成像分析系统、iMark酶标仪(美国Bio-Rad公司)。
1.3 分组及干预措施40只小鼠按照随机数字表法分为4组(n=10):阴性对照(negative control, NC)+磷酸缓冲盐溶液(phosphate-buffered saline, PBS)组(NC+PBS组)、过表达Trim72+PBS组(Trim72+PBS组)、NC+CVB3组和Trim72+CVB3组。造模前14 d,各组小鼠分别经尾静脉注射阴性对照或过表达Trim72的AAV9(5×1011 VG/只),后CVB3组经腹腔注射含CVB3(2.0×105 PFU/只)的PBS 200 μL构建AVMC小鼠模型,而PBS组小鼠经腹腔注射等量的PBS。观察各组小鼠的一般状况,7 d后2%异氟烷深度麻醉下行眼眶采血收集血液样本,后颈椎脱臼法处死小鼠,无菌留取心脏,并计算心脏重量/体重(heart weight/body weight, HW/BW)比值。本研究严格遵守《中华人民共和国实验动物管理条例》,实验方案由福建医科大学动物实验伦理委员会审核并批准(许可证号:IACUC FJMU 2022-0714)。
1.4 心肌病理学检查新鲜心肌组织于4%多聚甲醛固定24 h,常规脱水、石蜡包埋,制作成5 μm切片,行HE染色,中性树胶封片后光镜下观察心肌的病理改变,细胞质为红色,细胞核一般为蓝色,参考Grabie等[10]的标准,计算心肌病理积分。
1.5 TUNEL检测心肌细胞凋亡指数上述石蜡切片经烤片、脱蜡和水化后,滴加20 µg/mL的蛋白酶K工作液在37℃下孵育20 min,用PBS洗涤3次,将蛋白酶K洗涤干净。再滴加足量的TUNEL检测液,37℃下避光孵育1 h。DAPI染细胞核后,抗荧光猝灭剂封片,荧光显微镜下观察。计算凋亡指数,即TUNEL阳性细胞数占有核细胞总数的百分比。
1.6 RT-qPCR检测Trim72、TNF-α、IL-6和IL-1β的mRNA表达用Trizol试剂从心肌组织中提取总RNA,行RNA纯度鉴定,OD260/OD280比值均在1.8~2.0范围内。将RNA逆转录成cDNA,依据试剂盒说明书进行RT-qPCR检测,反应条件为:95℃预变性10 min循环1次,随后95℃变性10 s,58℃退火30 s,72℃延伸30 s,循环40次。以β-actin为内参,采用2-ΔΔCt法计算各基因的相对表达量。所用引物序列见表 1。
| 基因 | 引物序列(5′~3′) | 扩增长度(bp) |
| Trim72 | F: CCGGCAAGGCTAGATATCCA | 180 |
| R: CTTCTGGTCTGAGCACTCCA | ||
| TNF-α | F: AGTCCGGGCAGGTCTACTTT | 174 |
| R: TTGGACCCTGAGCCATAATC | ||
| IL-6 | F: ACAGAAGGAGTGGCTAAGGACC | 110 |
| R: TAGGCATAACGCACTAGGTTT | ||
| IL-1β | F: GAAATGCCACCTTTTGACAGTG | 117 |
| R: CTGGATGCTCTCATCAGGACA | ||
| β-actin | F: AGGGAAATCGTGCGTGAC | 192 |
| R: CATACCCAAGAAGGAAGGCT |
RIPA裂解缓冲液提取心肌组织总蛋白,BCA法测定蛋白浓度。变性后取等量蛋白样品于SDS-PAGE凝胶电泳,后移至PVDF膜,室温下5%脱脂牛奶封闭,加入一抗(以1:1 000稀释),4℃孵育过夜。TBST清洗3次后再加入HRP标记的二抗(以1:5 000稀释)并于室温下孵育1 h,TBST再次洗脱后,ECL曝光并采集图像,利用ImageJ分析,测定目的蛋白的相对表达量。
1.8 ELISA检测血清cTnI及促炎细胞因子的蛋白水平血液样本于4℃下3 000 r/min离心10 min,收集上层血清。按照试剂盒说明书进行ELISA检测,用酶标仪在450 nm波长处读取各孔OD值,后依据标准曲线计算血清中cTnI及促炎细胞因子TNF-α、IL-6和IL-1β的蛋白水平。
1.9 统计学方法数据使用GraphPad Prism 8.0.1软件进行统计分析,符合正态分布的计量资料以均数±标准差(x±s)表示,多组样本间比较采用单因素方差分析,组间两两比较采用LSD-t检验。心肌病理积分的比较采用Mann-Whitney U秩和检验。使用Kaplan-Meier法分析各组小鼠存活率。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠一般状况NC+PBS组和Trim72+PBS组的小鼠一般状况良好,饮食正常,无死亡。NC+CVB3组小鼠感染CVB3后2 d后逐步出现卷缩、毛发乱、反应差、食欲下降、易激惹、互相撕咬等症状,感染后7 d共有4只小鼠死亡(3 d死亡1只,5 d死亡2只,6 d死亡1只),生存率较NC+PBS组明显降低(P=0.029)。Trim72+CVB3组小鼠上述症状较NC+CVB3组有所减轻,感染后5 d有1只小鼠死亡,生存率与NC+CVB3组对比差异无统计学意义(P=0.128)。各组存活小鼠只数分别为:10、10、6、9只,纳入后续研究。
2.2 各组小鼠的HW/BW比值及心肌Trim72的表达感染CVB3后小鼠心肌出现炎症和水肿,与NC+PBS组相比,NC+CVB3组小鼠的HW/BW比值明显升高(P < 0.05,图 1A),而Trim72+CVB3组小鼠的HW/BW比值较NC+CVB3组明显降低(P < 0.05,图 1A)。此外,与NC+PBS组相比,心肌组织Trim72蛋白和mRNA的表达在Trim72+PBS组中明显上调,而在NC+CVB3组中则显著下调,差异有统计学意义(P < 0.05,图 1B~D);与NC+CVB3组相比,Trim72+CVB3组小鼠心肌组织中Trim72的表达显著上调,差异有统计学意义(P < 0.05,图 1B~D)。
|
| 注:A:各组小鼠HW/BW比值的对比分析,n=6~10/组;B和C:各组小鼠心肌组织中Trim72蛋白表达及相对表达量的对比分析,n=3/组;D:各组小鼠心肌组织中Trim72 mRNA相对表达量的对比分析,n=3/组。与NC+PBS组相比较,aP < 0.05;与NC+CVB3组相比较,bP < 0.05 图 1 各组小鼠的HW/BW比值及心肌Trim72的表达 Fig 1 HW/BW ratios and myocardial Trim72 expression of mice in each group |
|
|
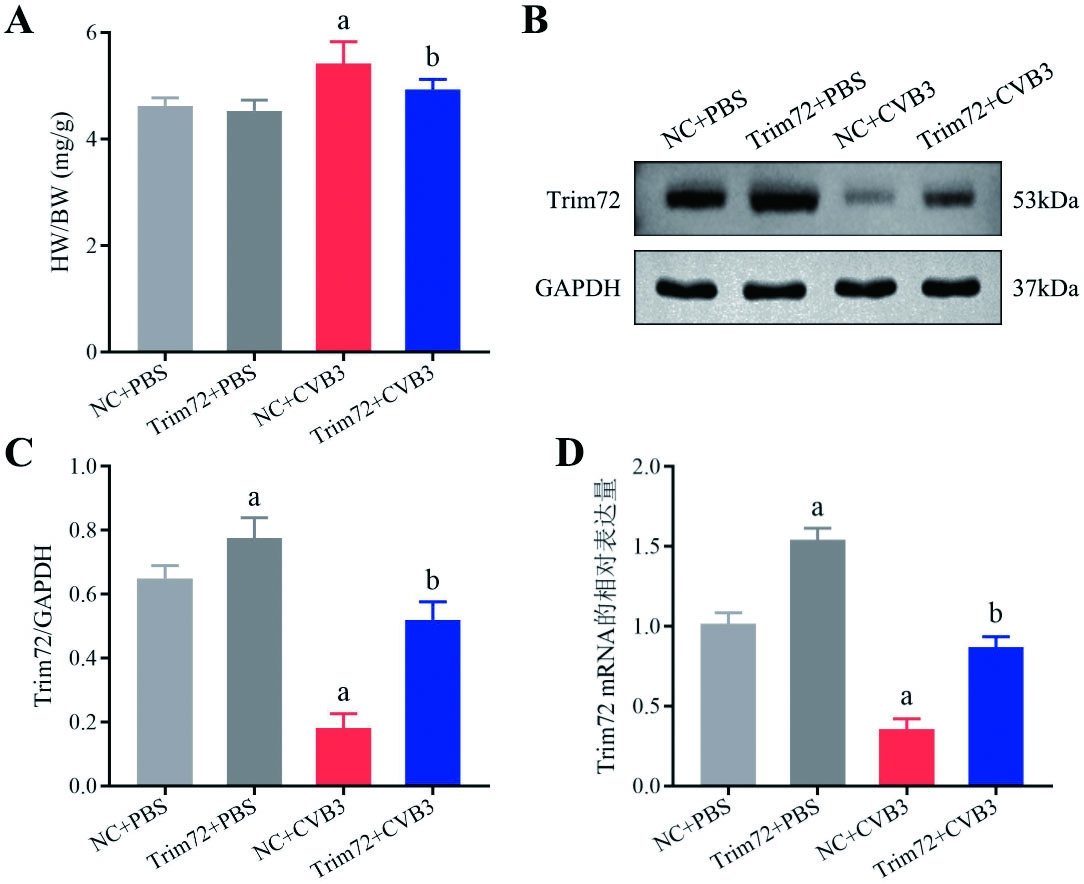
HE和TUNEL染色评估各组小鼠心肌病理改变及凋亡水平。如图 2A~C所示,NC+PBS组和Trim72+PBS组小鼠心肌结构完整,纤维排列整齐,心肌细胞无坏死,间隙无炎症细胞浸润;NC+CVB3组的小鼠心肌组织中可见心肌细胞水肿,大量炎症细胞浸润,并可见局灶性坏死,心肌病理积分及血清cTnI较NC+PBS组明显升高(P < 0.05);与NC+CVB3组相比,Trim72+CVB3组心肌炎症明显减轻,局灶性坏死有所减少,心肌病理积分及血清cTnI明显降低(P < 0.05)。如图 2A和D所示,NC+CVB3组小鼠心肌组织中的凋亡指数较NC+PBS组明显升高(P < 0.05),而过表达Trim72可以减轻CVB3感染导致的心肌细胞凋亡(P < 0.05)。NC+PBS组和Trim72+PBS组的心肌病理积分及凋亡指数差异均无统计学意义(P > 0.05)。
|
| 注:A:各组小鼠心肌组织HE及TUNEL染色(标尺100 μm);B:各组小鼠心肌病理积分的对比分析;C:各组小鼠血清cTnI水平的对比分析;D:各组小鼠心肌凋亡指数的对比分析。与NC+PBS组相比较,aP < 0.05;与NC+CVB3组相比较,bP < 0.05;n=6~10/组 图 2 各组小鼠心肌病理学改变及凋亡检测 Fig 2 Myocardial pathological changes and apoptosis detection in various groups of mice |
|
|
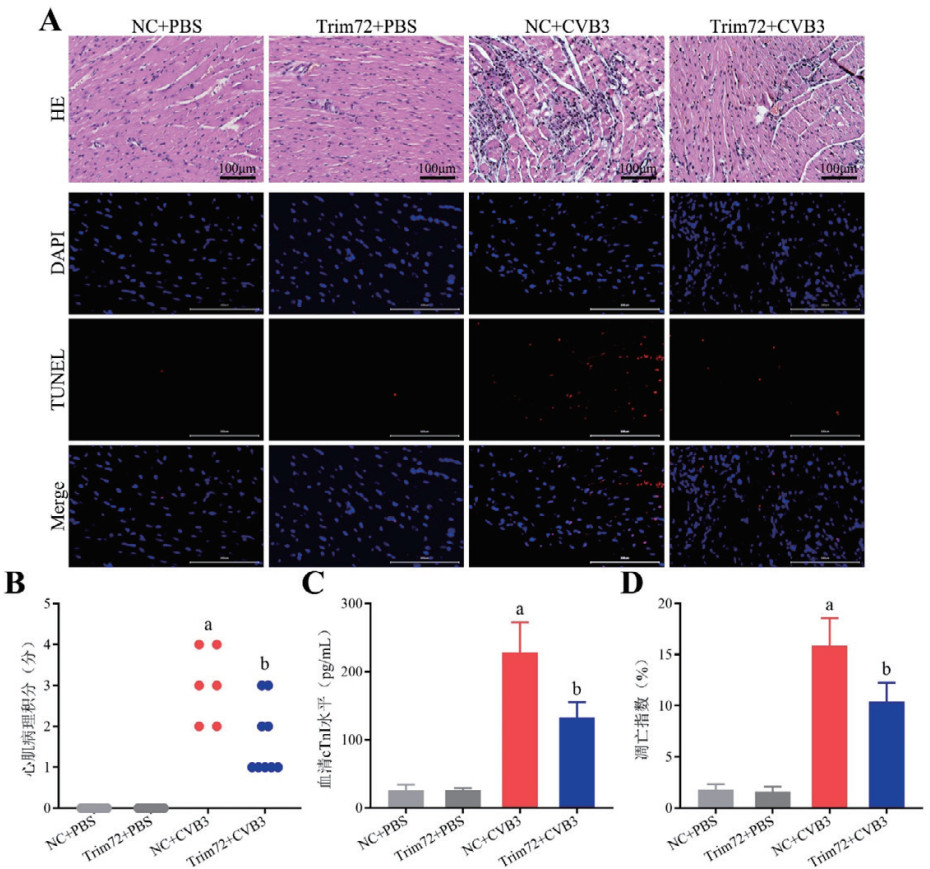
进一步评估过表达Trim72对体内促炎细胞因子表达的影响。如图 3A~C所示,与NC+PBS组相比,NC+CVB3组的心肌TNF-α、IL-6和IL-1β的mRNA相对表达量均明显升高(P < 0.05),而Trim72+CVB3组这些促炎细胞因子的表达量较NC+CVB3组显著降低(P < 0.05)。同样,NC+CVB3组血清TNF-α、IL-6和IL-1β的蛋白水平均显著高于NC+PBS组(P < 0.05),过表达Trim72可以减少血清中这些促炎细胞因子的蛋白水平(P < 0.05)。NC+PBS组和Trim72+PBS组中TNF-α、IL-6和IL-1β的表达差异均无统计学意义(P > 0.05,图 3D~F)。
|
| 注:A~C:各组小鼠心肌组织TNF-α、IL-6和IL-1β mRNA相对表达量的对比分析;D~F:各组小鼠血清TNF-α、IL-6和IL-1β蛋白水平的对比分析。与NC+PBS组相比较,aP < 0.05;与NC+CVB3组相比较,bP < 0.05;n=3/组 图 3 各组小鼠心肌及血清促炎细胞因子的表达 Fig 3 Expression of proinflammatory cytokines in the myocardium and serum of mice in each group |
|
|
如图 4A~D所示,NC+CVB3组的Bax和Cleaved caspase-3/Caspase-3的表达明显高于NC+PBS组,而Trim72+CVB3组这些蛋白的表达较NC+CVB3组明显降低(P < 0.05);相反,NC+CVB3组Bcl-2的表达明显低于NC+PBS组,而Trim72+CVB3组中Bcl-2的表达较NC+CVB3组明显升高(P < 0.05)。
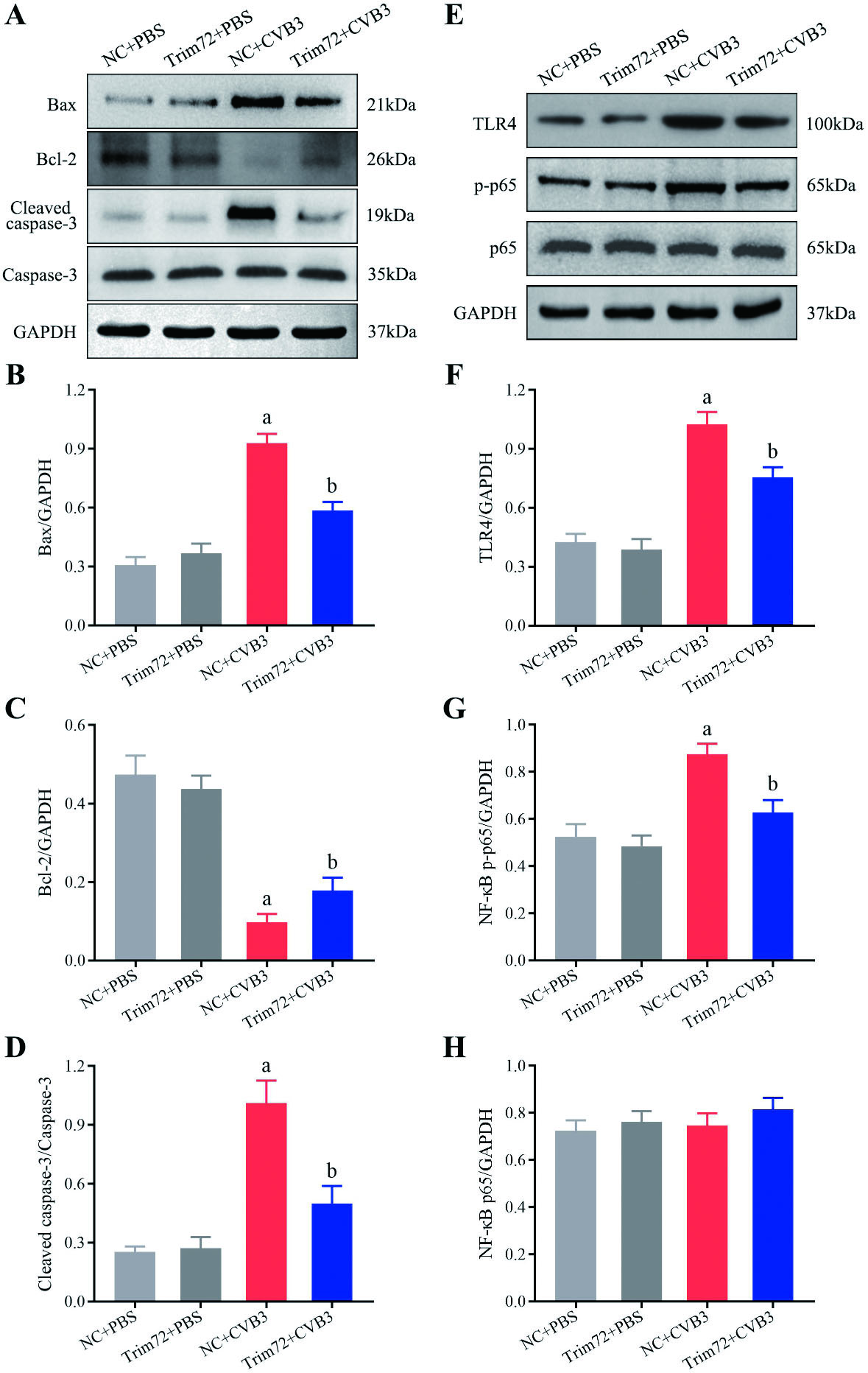
|
| 注:A~D:各组小鼠心肌凋亡相关蛋白,包括Bax、Bcl-2、Cleaved caspase-3/Caspase-3的表达及相对表达量对比分析;E~H:各组小鼠TLR4/NF-κB信号通路相关蛋白,包括TLR4、p-p65和p65的表达及相对表达量对比分析。与NC+PBS组相比较,aP < 0.05;与NC+CVB3组相比较,bP < 0.05;n=3/组 图 4 各组小鼠心肌凋亡及TLR4/NF-κB信号通路相关蛋白的表达 Fig 4 Expression levels of proteins related to myocardial apoptosis and TLR4/NF-κB signaling pathway in various groups of mice |
|
|
TLR4/NF-κB信号通路是AVMC中调控心肌炎症和细胞凋亡的关键通路。如图 4E~H所示,与NC+PBS组相比,NC+CVB3组心肌组织中TLR4和NF-κB p-p65的表达明显升高(P < 0.05),过表达Trim72可以明显减少TLR4和NF-κB p-p65的表达(P < 0.05)。NC+PBS组和Trim72+PBS组中心肌凋亡及TLR4/NF-κB信号通路相关蛋白的表达,差异均无统计学意义(P > 0.05)。
3 讨论本研究通过构建AVMC小鼠模型证实Trim72在AVMC小鼠心肌中明显低表达,利用AAV9过表达Trim72能够通过抑制心肌炎症损伤及凋亡失衡减轻小鼠AVMC。此外,过表达Trim72还能抑制AVMC小鼠心肌组织中TLR4/NF-κB信号通路的激活并减少体内促炎细胞因子的表达,提示Trim72对CVB3诱导的AVMC具有保护作用。
2009年首次报道Trim72的生物学特性[5],其在多种心脏疾病中的关键作用引起了人们的广泛兴趣。Trim72在心肌细胞的胞浆和胞核中均有表达,当细胞膜受损时,内源性Trim72可向损伤部位快速移动,将胞浆内的囊泡和质膜紧密结合,通过“补丁”作用修复缺口[11-12]。急性应激状态下,氧化介导的巯基-亚硝基化使得Trim72表达下调,降低其膜修复能力,促进心肌细胞死亡[13]。本研究先观察到AVMC小鼠心肌组织的Trim72表达量明显降低,提示CVB3感染可能对Trim72的表达下调有促进作用,这与Sermersheim等[14]的研究结果相似,他们发现流感病毒感染显著降低人类巨噬细胞中的Trim72表达。大多数研究表明Trim72有助于缓解心脏疾病,包括心肌缺血-再灌注[8, 15]、压力诱导的心肌肥厚[16]、脓毒性心肌病[17]及心力衰竭[18]等。然而,糖尿病相关研究发现Trim72可能通过E3-连接酶介导的IRS-1降解而导致胰岛素抵抗[19],Trim72可以上调PPARα及其目标基因,引起心脏脂质沉积和脂毒性,最终导致糖尿病性心肌病[20]。因此,Trim72在心脏疾病中的作用具有两面性,在AVMC中的功能机制需要进一步阐明。
炎症损伤和凋亡失衡是AVMC中的两个主要病理改变。CVB3感染导致心肌细胞变性死亡,进而激活免疫系统,招募大量炎症细胞浸润并释放促炎细胞因子,包括TNF-α、IL-6和IL-1β等加重周围心肌细胞损伤;同时,机体启动凋亡程序,通过牺牲感染细胞加速病毒清除,死亡的心肌细胞也会释放促炎细胞因子,放大炎症效应[21]。在本研究中,AAV9介导的Trim72过表达可以显著改善AVMC小鼠心肌的炎症损伤和凋亡失衡,这支持Trim72在AVMC中发挥保护性作用。由Bcl-2和caspase家族介导的线粒体途径在心肌细胞凋亡中占据核心地位,抗凋亡Bcl-2和促凋亡Bax之间的相互作用促进线粒体膜通透性升高,释放细胞色素C并引发caspase-3裂解,执行凋亡过程。因此,Bax、Bcl-2和Cleaved caspase-3是线粒体凋亡途径激活的重要指标。Gumpper-Fedus等[22]研究发现Trim72在氧化应激下可通过与心磷脂结合维持线粒体的完整性,本研究证实过表达Trim72可以改善线粒体凋亡途径相关蛋白的表达失衡,提示Trim72参与调节AVMC中的线粒体凋亡途径。
TLR4/NF-κB是经典的促炎信号通路,广泛分布于心肌细胞及各类炎症细胞中。TLR4识别CVB3诱导的心肌炎症,通过活化NF-κB的诱导激酶,促进NF-κB p65磷酸化并从胞质易位到胞核,与靶基因结合,调节促炎细胞因子TNF-α、IL-6和IL-1β的表达。这些细胞因子可以通过正反馈机制进一步激活TLR4/NF-κB信号通路,放大促炎信号,同时它们还能通过相应受体加重心肌细胞凋亡失衡。本项目的进一步研究结果显示,过表达Trim72可以抑制AVMC中TLR4/NF-κB的激活并减少促炎细胞因子的表达,提示Trim72是TLR4/NF-κB信号通路的负调控因子。Liu等[16]近期研究证实Trim72通过与通路上的关键蛋白TAK1和IκBα相互作用来抑制NF-κB的活性,这支持了本研究结论。此外,Trim72被证实可以通过抑制M1巨噬细胞极化来调节免疫微环境,减少促炎细胞因子的释放[14];在心脏应激状态下Trim72还具有保持T管完整性的重要作用。因此,Trim72在AVMC中可能具有多种功能效应,未来值得深入挖掘。
本研究还存在一些局限性。首先,体内研究存在许多潜在的干扰因素,Trim72在体外AVMC模型中能否发挥抗炎和抗凋亡作用尚不明确,完善体外实验有助于证实本研究结论;其次,有必要适当延长CVB3感染的实验周期,从而充分评估Trim72在病毒性心肌炎慢性期中的作用机制;再者,已有研究证实了Trim72在人类心脏中的表达[18],Trim72在人类AVMC中的治疗价值需要进一步验证。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王均祎、徐尚华、薛贻敏:研究设计、实验操作、论文撰写;柯俊:实验技术指导;章九云、谢辉、李珊:数据收集、整理及统计学分析;周晓芬:论文修改、支持性贡献
| [1] | Lampejo T, Durkin SM, Bhatt N, et al. Acute myocarditis: aetiology, diagnosis and management[J]. Clin Med (Lond), 2021, 21(5): e505-e510. DOI:10.7861/clinmed.2021-0121 |
| [2] | Olejniczak M, Schwartz M, Webber E, et al. Viral myocarditis-incidence, diagnosis and management[J]. J Cardiothorac Vasc Anesth, 2020, 34(6): 1591-1601. DOI:10.1053/j.jvca.2019.12.052 |
| [3] | Li S, Xu SY, Li CZ, et al. A life support-based comprehensive treatment regimen dramatically lowers the in-hospital mortality of patients with fulminant myocarditis: a multiple center study[J]. Sci China Life Sci, 2019, 62(3): 369-380. DOI:10.1007/s11427-018-9501-9 |
| [4] | 汪道文, 惠汝太. 推行暴发性心肌炎处理的中国方案, 挽救更多生命[J]. 中华心血管病杂志, 2022, 50(3): 212-218. DOI:10.3760/cma.j.cn112148-20210816-00702 |
| [5] | Cai CX, Masumiya H, Weisleder N, et al. MG53 nucleates assembly of cell membrane repair machinery[J]. Nat Cell Biol, 2009, 11(1): 56-64. DOI:10.1038/ncb1812 |
| [6] | Zhong WN, Benissan-Messan DZ, Ma JJ, et al. Cardiac effects and clinical applications of MG53[J]. Cell Biosci, 2021, 11(1): 115. DOI:10.1186/s13578-021-00629-x |
| [7] | Li ZY, Dai RL, Chen M, et al. p55γ degrades RIP3 via MG53 to suppress ischaemia-induced myocardial necroptosis and mediates cardioprotection of preconditioning[J]. Cardiovasc Res, 2023, 119(14): 2421-2440. DOI:10.1093/cvr/cvad123 |
| [8] | Shan D, Guo SL, Wu HK, et al. Cardiac ischemic preconditioning promotes MG53 secretion through H2O2-activated protein kinase C-δ signaling[J]. Circulation, 2020, 142(11): 1077-1091. DOI:10.1161/CIRCULATIONAHA.119.044998 |
| [9] | Xue YM, Ke J, Zhang JY, et al. Analysis of long noncoding RNAs and messenger RNAs expression profiles in the hearts of mice with acute viral myocarditis[J]. J Med Virol, 2023, 95(2): e28473. DOI:10.1002/jmv.28473 |
| [10] | Grabie N, Delfs MW, Westrich JR, et al. IL-12 is required for differentiation of pathogenic CD8+ T cell effectors that cause myocarditis[J]. J Clin Invest, 2003, 111(5): 671-680. DOI:10.1172/JCI16867 |
| [11] | Ma YM, Ding L, Li ZH, et al. Structural basis for TRIM72 oligomerization during membrane damage repair[J]. Nat Commun, 2023, 14(1): 1555. DOI:10.1038/s41467-023-37198-1 |
| [12] | Park SH, Han J, Jeong BC, et al. Structure and activation of the RING E3 ubiquitin ligase TRIM72 on the membrane[J]. Nat Struct Mol Biol, 2023, 30(11): 1695-1706. DOI:10.1038/s41594-023-01111-7 |
| [13] | Kohr MJ, Evangelista AM, Ferlito M, et al. S-nitrosylation of TRIM72 at cysteine 144 is critical for protection against oxidation-induced protein degradation and cell death[J]. J Mol Cell Cardiol, 2014, 69: 67-74. DOI:10.1016/j.yjmcc.2014.01.010 |
| [14] | Sermersheim M, Kenney AD, Lin PH, et al. MG53 suppresses interferon-β and inflammation via regulation of ryanodine receptor-mediated intracellular calcium signaling[J]. Nat Commun, 2020, 11(1): 3624. DOI:10.1038/s41467-020-17177-6 |
| [15] | Xu BW, Wang CX, Chen HP, et al. Protective role of MG53 against ischemia/reperfusion injury on multiple organs: a narrative review[J]. Front Physiol, 2022, 13: 1018971. DOI:10.3389/fphys.2022.1018971 |
| [16] | Liu WJ, Wang G, Zhang CC, et al. MG53, a novel regulator of KChIP2 and Ito, f, plays a critical role in electrophysiological remodeling in cardiac hypertrophy[J]. Circulation, 2019, 139(18): 2142-2156. DOI:10.1161/CIRCULATIONAHA.118.029413 |
| [17] | Han X, Chen DL, Liu FN, et al. MG53 protects against sepsis-induced myocardial dysfunction by upregulating peroxisome proliferator-activated receptor-α[J]. Oxid Med Cell Longev, 2020, 2020: 7413693. DOI:10.1155/2020/7413693 |
| [18] | Wang XL, Li XC, Ong H, et al. MG53 suppresses NF-κB activation to mitigate age-related heart failure[J]. JCI Insight, 2021, 6(17): e148375. DOI:10.1172/jci.insight.148375 |
| [19] | Song RS, Peng W, Zhang Y, et al. Central role of E3 ubiquitin ligase MG53 in insulin resistance and metabolic disorders[J]. Nature, 2013, 494(7437): 375-379. DOI:10.1038/nature11834 |
| [20] | Liu FH, Song RS, Feng YQ, et al. Upregulation of MG53 induces diabetic cardiomyopathy through transcriptional activation of peroxisome proliferation-activated receptor Α[J]. Circulation, 2015, 131(9): 795-804. DOI:10.1161/CIRCULATIONAHA.114.012285 |
| [21] | Zhang Y, Zhou XB, Chen SY, et al. Immune mechanisms of group B coxsackievirus induced viral myocarditis[J]. Virulence, 2023, 14(1): 2180951. DOI:10.1080/21505594.2023.2180951 |
| [22] | Gumpper-Fedus K, Park KH, Ma H, et al. MG53 preserves mitochondrial integrity of cardiomyocytes during ischemia reperfusion-induced oxidative stress[J]. Redox Biol, 2022, 54: 102357. DOI:10.1016/j.redox.2022.102357 |
 2025, Vol. 34
2025, Vol. 34