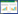创伤性颅脑损伤(traumatic brain injury, TBI)后出现的继发性脑损伤确切机制仍不清楚。其中,氧化应激和小胶质细胞异常活化导致的炎症反应被认为是继发性脑损伤的重要病理生理学特征,二者相互促进,进一步加剧细胞毒性、自由基释放、脑水肿和神经元死亡,造成永久性的神经细胞损伤[1]。然而,目前尚缺乏针对TBI后继发性脑损伤的有效干预策略。
转录因子核因子-E2相关因子2(nuclear factor erythroid2 related factor 2, Nrf2)是一种重要的抗氧化调节因子,可减少氧自由基的生成和减轻细胞内的炎症反应[2]。在炎症和氧化应激条件下,活性氧(reactive oxygen species, ROS)升高可促进肌动蛋白结合蛋白1(kelch-like ECH-associated protein 1, Keap)氧化,导致Nrf2释放[3]。转位到细胞核后,Nrf2激活一系列抗氧化性基因的表达,如血红素加氧酶-1(heme oxygenase-1, HO-1)、NADPH脱氢酶1(NAD(P)H: quinone oxidore-ductase-1, NQO1)等,以清除过量的ROS[4]。
甲基巴多索隆(methyl badosolone, CDDO-Me)是一类三萜类齐墩果酸衍生物,具有抗炎、抗氧化、抗癌和抗纤维化的作用[5-7]。研究显示CDDO-Me可通过抑制核因子-κB(toll-like receptors, NF-κB)和激活Nrf2/HO-1通路发挥抗炎和抗氧化应激的作用[8]。由于这种双重作用机制,CDDO-Me在氧化应激和炎症相关疾病中具有很大的治疗潜力。既往CDDO-Me主要研究方向为各类癌症相关的抗炎抗氧化作用以及慢性肾功能衰竭等疾病的肾保护功能[6, 9],目前CDDO-Me在一些中枢神经系统疾病如缺血性脑卒中、脑出血、糖尿病神经病的研究中也取得一定的进展[10-12],但CDDO-Me对TBI继发性损伤的影响目前尚不明确。本研究探讨CDDO-Me对TBI大鼠早期脑损伤的保护作用及其作用机制,以期为TBI的药物治疗提供新的理论依据及实践帮助。
1 材料与方法 1.1 实验动物及造模本研究经郑州大学附属郑州中心医院伦理委员会批准(批号:202262)。本实验实用仪器试剂如下:颅脑液压打击仪、脑立体定位仪(深圳沃瑞德生命科技公司),多功能酶标仪(瑞士TECAN公司),甲基巴多索隆(美国MCE公司),兔抗Nrf2抗体、兔抗NQO1抗体、兔抗BAX抗体、兔抗BCL-2抗体、小鼠抗β-actin抗体(武汉Proteintech公司),兔抗Iba-1单克隆抗体(美国CST公司),TUNEL检测试剂盒、IL-1β ELISA试剂盒、IL-18 ELISA试剂盒(北京索莱宝生物科技公司),TNF-α ELISA试剂盒(武汉云克隆科技股份公司),ROS、MDA检测试剂盒(上海碧云天生物技术公司)。
本实验使用SPF级健康雄性8周左右SD大鼠[体重(220±20)g]78只,购自郑州大学实验动物中心。根据实验需要随机(随机数字法)分为4组:假手术组(Sham组)、创伤性脑损伤模型组(TBI组)、溶媒对照组(TBI+Vehicle组)、CDDO-Me药物干预组(TBI+CDDO-Me组)。
其中60只使用标准化的手术方法和国际通用的液压打击仪,建立稳定的大鼠液压冲击颅脑损伤模型[13]。大鼠经4%的异氟烷诱导麻醉,用纵向正中切口切开大鼠头皮,暴露颅骨。以前囟右侧1.80 mm、后1.5 mm处为中心,电动骨钻凿出直径约为4 mm的骨窗,保证硬脑膜完好无破损。释放右侧打击重锤,使生理盐水冲击大鼠脑部。用骨蜡封闭骨窗,并缝合头皮,待麻醉苏醒放回笼中。24 h后由对实验分组不知情的研究人员对各组大鼠进行改良的神经功能评分(modified neurological severity score, mNSS)[14]。mNSS由运动、感觉、平衡和反射测试组成,总分为0~18分。1~6分为轻度损伤;7~12分为中度损伤;13~18分为重度损伤。将撞击死亡、mNSS平均分低于13分且差异较大的6只给予排除,以保持模型的稳定性。依据说明书,将CDDO-Me溶解在含1% DMSO的储备液中,其中18只TBI后立即腹膜内施用10 mg/kg的CDDO-Me,2次/d,共3 d。18只注射等剂量的DMSO作为对照。Sham组18只大鼠仅行头皮切开和骨窗钻孔,不进行打击,头皮切口常规消毒缝合。
1.2 观察指标 1.2.1 脑含水量测定参照文献[15]称量样品湿重并记录。随后将脑组织放于100 ℃烘箱,烘烤48 h,再次称量获得干重并记录。公式计算脑含水量:脑含水量百分比=[(湿重-干重)/湿重]×l00%。
1.2.2 脑组织中Nrf2、HO-1、NQO1、BAX和BCL-2蛋白的表达检测采用Western blot法检测。提取大鼠损伤灶周围皮质脑组织总蛋白和核蛋白,使用BCA蛋白定量试剂盒测定蛋白浓度。用聚丙烯酰胺凝胶电泳法分离出等量的蛋白质,转移到PVDF膜上,在室温下用5%脱脂牛奶封闭2 h。PVDF膜与一抗Nrf2(1:750)、HO-1(1:1000)、NQO1(1:750)、BAX(1:1000)、BCL-2(1:1000)、β-Actin(1:1000)在4 ℃孵育过夜。用增强化学发光法检测蛋白质条带。用Image J软件测量蛋白质条带的吸光度。
1.2.3 免疫荧光双染法检测Nrf2的表达和分布取大鼠损伤灶周围皮质脑组织,用4%多聚甲醛固定,石蜡包埋。组织块切成厚度4 µm的切片,二甲苯脱蜡,一系列梯度酒精溶液脱水后,用枸橼酸抗原修复液获得抗原。5% BSA室温封闭30 min,与一抗Nrf2(1:250)、NSE(1:100)孵育过夜。次日用PBS洗涤后,将它们与Cy3标记的二抗在室温下再孵育1 h。DAPI孵育3 min对细胞核进行染色,立即于倒置荧光显微镜拍照。使用Image J软件分析平均荧光强度。
1.2.4 免疫组织化学染色法检测Iba-1的表达石蜡切片经过抗原修复后,与一抗Iba-1(1:250)在4 ℃孵育过夜。次日用PBS洗涤后,与HRP标记的二抗在室温下再孵育30 min。然后,滴加适量DAB显色剂,孵育室温3 min后放入清水中以终止显色,然后用苏木精进行复染,中性树胶封片。每张切片均选取3个视野进行观察,使用Image J软件分析每个视野信号强度后计算平均值。
1.2.5 Tunel染色测定凋亡阳性细胞依据凋亡试剂盒说明书进行操作。石蜡切片经过抗原修复后,与Tunel反应混合物,在室温下孵育1 h。PBS洗涤后,DAPI对细胞核进行染色,立即于倒置荧光显微镜拍照。使用Image J软件分析平均荧光强度。
1.2.6 尼氏染色法观察损伤神经元采用尼氏染色法测定。石蜡切片经过脱蜡处理后使用尼氏染色溶液染色5 min。洗涤后,酒精脱水后二甲苯透明5 min,中性树胶封片。高倍显微镜下随机选取6个视野进行观察,计数每个视野损伤神经元的比例。
1.2.7 MDA和ROS检测取大鼠损伤灶周围皮质脑组织匀浆,依据MDA检测试剂盒、ROS检测试剂盒说明书进行操作,检测脑组织中MDA和ROS含量。
1.2.8 ELISA检测血清中炎性因子的表达采用ELISA测定。大鼠外伤后3 d进行深度麻醉,暴露腹腔及胸腔,经左心室插入针管留取全血于肝素抗凝管中,4 ℃冰箱静置6 h后离心,小心吸取血清后按照ELISA试剂盒说明进行操作,检测血清中炎症因子TNF-α、IL-1β和IL-18的水平。
1.3 统计学方法采用SPSS 24.0统计软件进行数据分析。正态分布的计量资料以均数±标准差(x±s)表示。单一时间点两组间比较采用成组t检验,多组间比较采用单因素方差分析,P < 0.05为差异具有统计学意义。
2 结果 2.1 mNSS评分及脑组织含水量比较通过液压冲击建立大鼠TBI模型,第3天小心剥离出完整的大脑并获得的实物图,可见TBI组大鼠撞击处大脑皮层组织缺损,周围淤血水肿形成,损伤严重。CDDO-Me给药后大脑皮层组织缺损及周围淤血水肿较为减轻。见图 1A~1C。
|
| 注:A~C:依次为Sham组、TBI组、TBI+CDDO-Me组大鼠大脑宏观实物图;D:各组大鼠mNSS评分比较;E:各组大鼠脑组织含水量比较。与Sham组比较,aP < 0.05;与TBI组比较,bP < 0.05 图 1 各组大鼠mNSS评分及脑组织含水量测定 Fig 1 mNSS scores and determination of brain tissue water content in each group of rats |
|
|
与Sham组比较,TBI组大鼠mNSS评分明显升高(P < 0.05)。与TBI组比较,TBI+Vehicle组差异无统计学意义(P > 0.05)。与TBI+Vehicle组比较,TBI+CDDO-Me组大鼠mNSS评分明显下降(P < 0.05)。见图 1D。
与Sham组比较,TBI组大鼠脑组织含水量明显升高(P < 0.05)。与TBI组比较,TBI+Vehicle组差异无统计学意义(P > 0.05)。与TBI+Vehicle组比较,TBI+CDDO-Me组大鼠脑组织含水量明显下降(P < 0.05)。见图 1E。
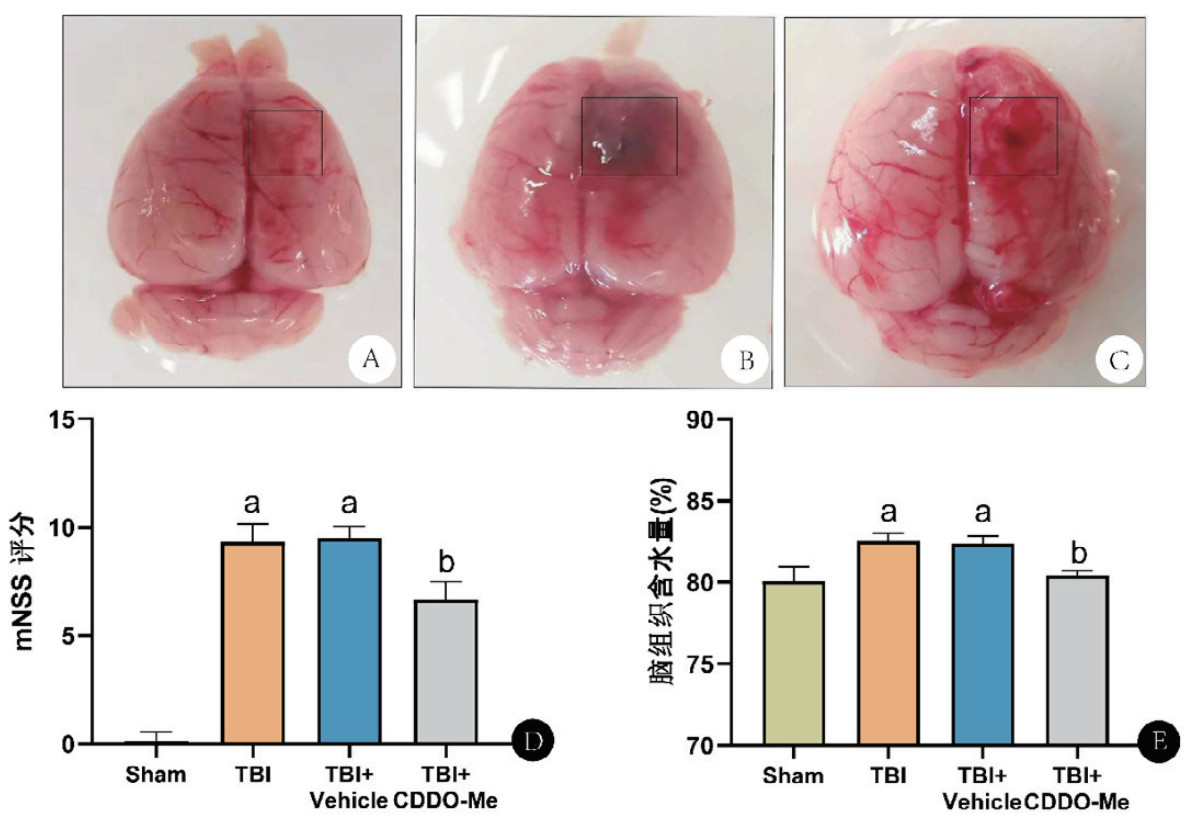
2.2 损伤神经元比例比较造模后第3天,尼氏染色结果显示Sham组大鼠大脑皮层神经元清晰完整,细胞核大,核仁明显,呈深蓝色的尼氏小体大且数量多。相比之下,TBI组神经元相对减少,损伤神经元比例明显升高(P < 0.05),受损神经元胞质内尼氏小体固缩坏死,溶解、液化后形成空泡样结构。CDDO-Me治疗后,神经元损伤程度明显减轻,损伤神经元比例明显下降(P < 0.05)。见图 2。
|
| 注:A~D:依次为Sham组、TBI组、TBI+ Vehicle组、TBI+CDDO-Me大鼠尼氏染色图片(×100);E:各组大鼠损伤神经元比例比较。与Sham组比较,aP < 0.05;与TBI组比较,bP < 0.05 图 2 各组大鼠尼氏染色结果 Fig 2 Nissl staining results of each group of rats |
|
|
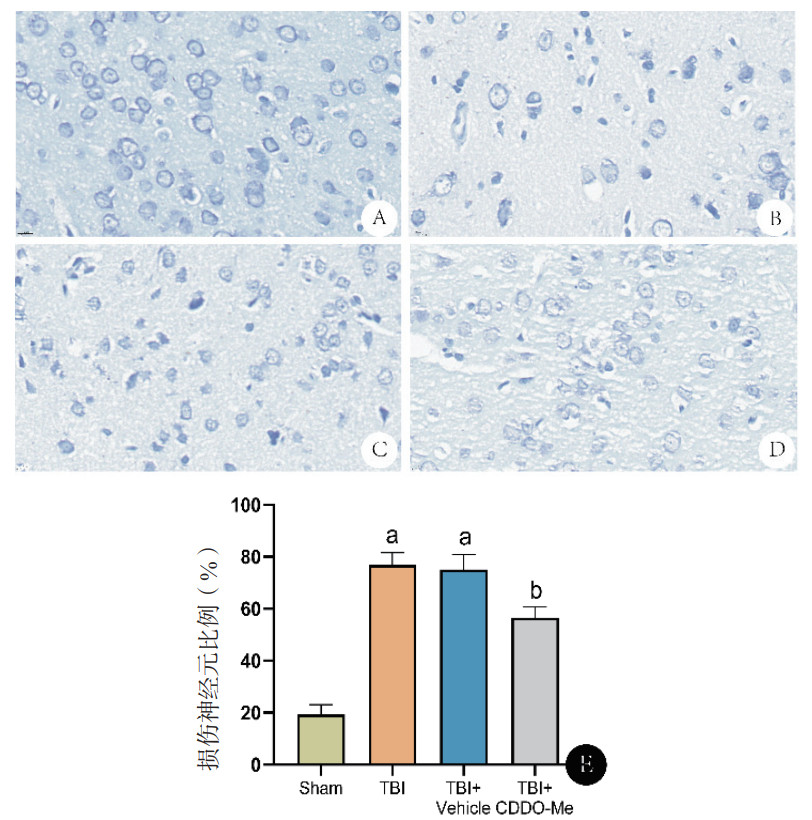
与Sham组比较,TBI组Tunel阳性细胞比例明显升高(P < 0.05)。与TBI组比较,TBI+Vehicle组差异无统计学意义(P > 0.05)。与TBI+Vehicle组比较,TBI+CDDO-Me组Tunel阳性细胞明显下降(P < 0.05)。见图 3A~3B。
|
| 注:A:各组大鼠损伤侧大脑皮层Tunel染色图(×100);B:细胞凋亡比例比较结果;C:各组大鼠BAX、BCL-2蛋白的Western blot检测条带;D:各组大鼠BAX、BCL-2蛋白相对表达量比较结果;与Sham组比较,aP < 0.05;与TBI组比较,bP < 0.05 图 3 各组大鼠损伤皮层Tunel染色和BCL-2、BAX蛋白表达情况 Fig 3 TUNEL staining and BCL-2, BAX protein expression in the injured cortex of each group of rats |
|
|
与Sham组比较,TBI组大鼠病变皮层BAX蛋白表达上调,BCL-2蛋白表达下降(P < 0.05)。与TBI组比较,TBI+Vehicle组差异无统计学意义(P > 0.05)。与TBI+Vehicle组比较,TBI+CDDO-Me组BAX蛋白表达下降,BCL-2蛋白表达上调(P < 0.05)。见图 3C~3D。
2.4 Nrf2/HO-1/NQO1信号通路活性改变及自由基水平变化与Sham组相比,TBI组Nrf2的红色荧光强度明显增强(P < 0.05),以细胞核中分布为主。与TBI组比较,TBI+Vehicle组差异无统计学意义(P > 0.05)。与TBI+Vehicle组相比,RGFP966处理后促进Nrf2易位到核中并且总红色荧光强度明显增强(P < 0.05)。见图 4A~4B。
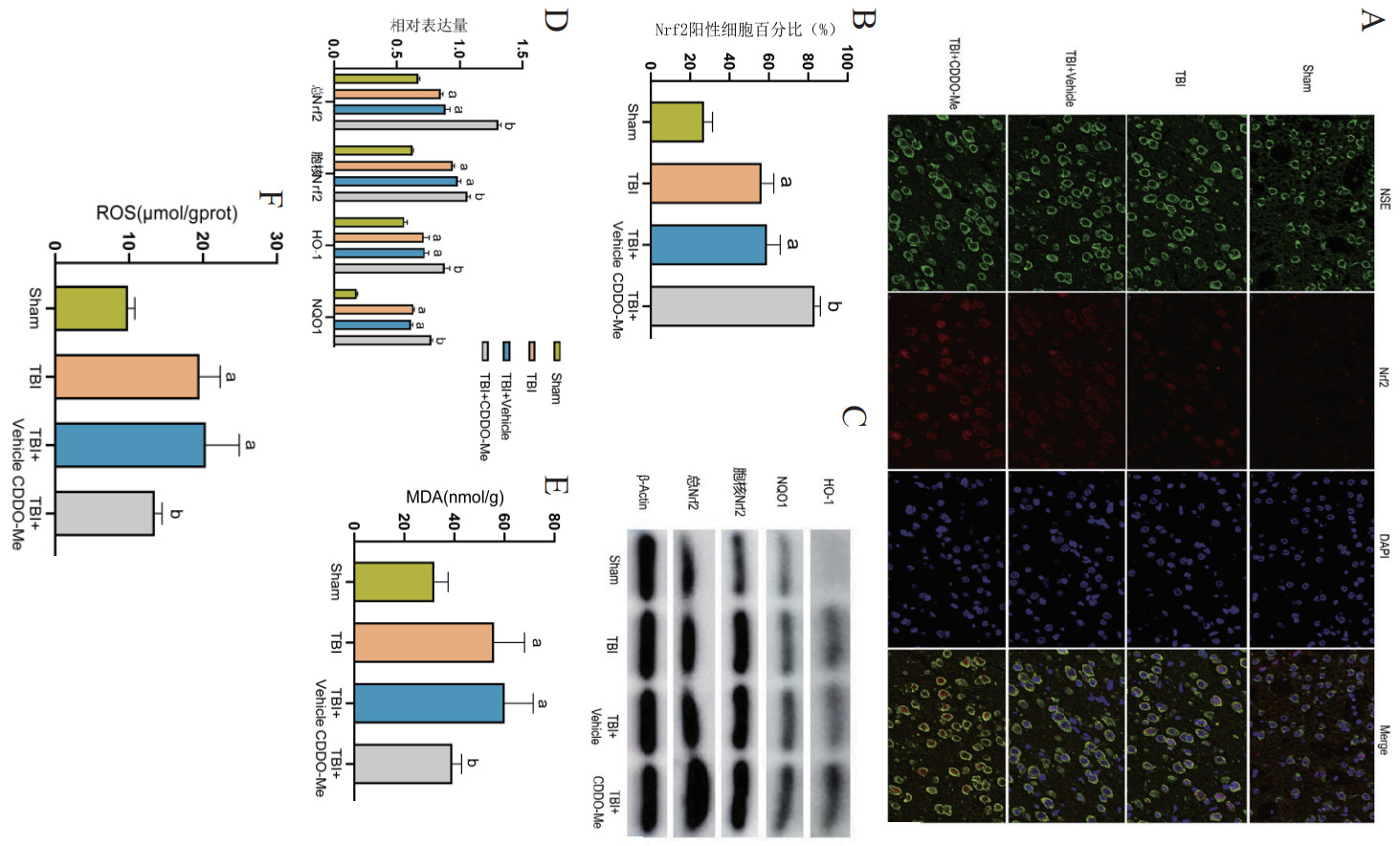
|
| 注:A:各组大鼠损伤侧大脑皮层Nrf2染色图(×100);B:Nrf2阳性细胞比例比较结果;C:各组大鼠总Nrf2、胞核Nrf2、HO-1、NQO1蛋白的Western blot检测条带;D:各组大鼠总Nrf2、胞核Nrf2、HO-1、NQO1蛋白相对表达量比较结果;与Sham组比较,aP < 0.05;与TBI组比较,bP < 0.05 图 4 各组大鼠损伤皮层Nrf2/HO-1/NQO1信号通路和MDA、ROS表达情况 Fig 4 Expression of the Nrf2/HO-1/NQO1 signaling pathway and MDA, ROS in the injured cortex of each group of rats |
|
|
与Sham组比较,TBI组大鼠病变皮层总Nrf2、胞核Nrf2、HO-1、NQO1蛋白表达上调(P < 0.05)。与TBI组比较,TBI+Vehicle组差异无统计学意义(P > 0.05)。与TBI+Vehicle组比较,TBI+CDDO-Me组总Nrf2、胞核Nrf2、HO-1、NQO1蛋白表达进一步升高(P < 0.05)。见图 4C~4D。
与Sham组比较,TBI组伤侧脑组织中MDA、ROS含量均明显增多(P < 0.05)。与TBI组比较,TBI+Vehicle组差异无统计学意义(P > 0.05)。与TBI+Vehicle组比较,TBI+CDDO-Me组MDA、ROS含量均明显下降(P < 0.05)。见图 4E~4F。
2.5 小胶质细胞标志物Iba-1及炎性因子含量水平变化免疫组织化学结果显示,与Sham组比较,TBI组伤侧脑组织中Iba-1含量明显增多(P < 0.05)。与TBI组比较,TBI+Vehicle组差异无统计学意义(P > 0.05)。与TBI+Vehicle组比较,TBI+CDDO-Me组Iba-1含量明显下降(P < 0.05)。见图 5A~5E。
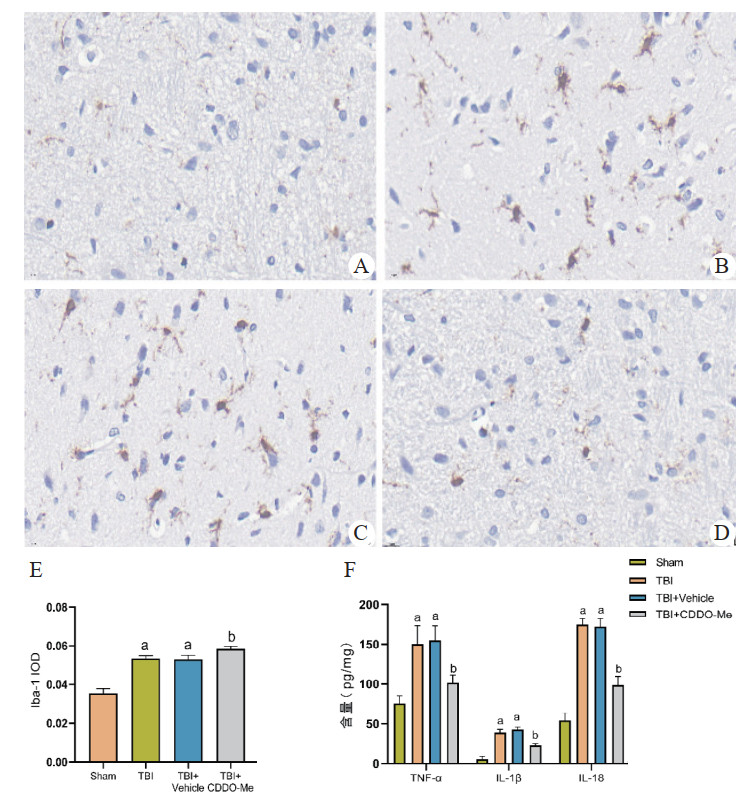
|
| 注:A~D:依次为Sham组、TBI组、TBI+Vehicle组、TBI+CDDO-Me大鼠Iba-1免疫组织化学染色图片(×100);E:Iba-1染色吸光度比较结果;与Sham组比较,aP < 0.05;与TBI组比较,bP < 0.05 图 5 各组大鼠损伤皮层Iba-1、炎性因子含量比较 Fig 5 Comparison of Iba-1 and inflammatory factor levels in the Injured cortex of each group of rats |
|
|
ELISA结果显示,与Sham组比较,TBI组血清中炎症因子TNF-α、IL-1β和IL-18的含量均明显增多(P < 0.05)。与TBI组比较,TBI+Vehicle组差异无统计学意义(P > 0.05)。与TBI+Vehicle组比较,TBI+CDDO-Me组TNF-α、IL-1β和IL-18的含量均明显下降(P < 0.05)。见图 5F。
3 讨论本研究通过液压打击仪致大鼠TBI模型,并通过mNSS评分进行神经功能缺损评分进一步验证TBI模型的损伤程度,最终得到稳定的大鼠中度创伤性颅脑损伤模型。脑组织含水量可反应脑水肿情况[16]。本研究结果显示CDDO-Me可以减轻TBI大鼠脑水肿,改善神经功能缺损,首次明确了CDDO-Me对TBI大鼠的神经保护作用。
氧化应激是导致TBI继发性损伤的主要机制,过量的ROS可导致DNA损伤、脂质过氧化和蛋白质功能障碍,最终导致细胞凋亡、坏死和炎症[17]。Nrf2是细胞氧化还原稳态的主要调节因子。Nrf2激活后易位至细胞核,反式激活HO-1、NQO1等抗氧化基因的表达来对抗氧化应激和有毒代谢物。HO-1可以抵抗氧化损伤,调节细胞凋亡,减轻炎症[18]。既往研究已经证明Nrf2/HO-1通路在多种中枢神经系统疾病中起保护作用[19-20]。缺乏Nrf2的神经元对氧化应激高度敏感。研究报告显示Nrf2主要在神经元细胞中表达,从大鼠实验性脑出血诱导后2 h开始显着增加,并在24 h达到峰值,直到10 d时逐渐减少[21]。Jin等[22]在自由落体颅脑损伤模型中发现Nrf2基因敲除的小鼠在伤后24 h出现更为严重的神经元凋亡和脑水肿,并且同时观察到NF-κB活力及其下游TNF-α、IL-1β、IL-6等炎症细胞因子表达均升高,而施加Nrf2信号通路的激活剂能减轻以上这些变化。在实验性TBI中,桃叶珊瑚苷通过增强Nrf2向细胞核的易位,激活抗氧化酶,抑制ROS的过度生成,并减少细胞凋亡[23]。CDDO-Me是通过上调Nrf2活性来对抗氧化应激的最重要药物之一[24]。在3期临床试验中,CDDO-Me被用于治疗糖尿病肾病[25]和Alport综合征[26]。CDDO-Me于2013年获准作为复发缓解型多发性硬化症患者的口服一线治疗药物,具有强大的神经保护和免疫调节作用,以及良好的效益风险特征[27]。并且一项临床前研究评估CDDO-Me通过激活Nrf2,可以有效治疗蛛网膜下腔出血介导的损伤[28]。然而,CDDO-Me对TBI继发性损伤的治疗果仍不清楚。在本研究中,TBI组ROS的产生和抗氧化因子HO-1、NQO1的表达显着增加。CDDO-Me处理可促进Nrf2核易位,激活了Nrf2介导的细胞内抗氧化系统,降低ROS的产生并增强抗氧化因子的表达。表明CDDO-Me可改善脑组织的抗氧化能力。这与CDDO-Me在软骨细胞中的抗氧化机制研究一致[29]。
炎症反应可以被氧化应激触发或增强。氧化应激过程中大量产生的ROS对于炎症反应的发生和激活至关重要[30]。小胶质细胞激活介导的神经炎性反应在继发性损伤中起重要作用,过量的促炎因子会刺激进一步氧化应激,加剧线粒体功能障碍,并促进神经元凋亡[31-32],两者形成恶性循环。研究表明,CDDO-Me能够通过酪蛋白激酶2和Nrf2信号通路改善脑出血后的炎症反应,降低血脑屏障通透性,改善神经功能[33]。本研究表明,TBI后小胶质细胞的活化和炎性因子(TNF-α,IL-1β和IL-18)的表达显著增强。CDDO-Me处理可抑制小胶质细胞活化,并减少TBI诱导的炎症因子增加。并且,相比于TBI组,CDDO-Me组大鼠损伤、凋亡神经元减少,下调了促凋亡因子BAX的表达。这些发现表明,CDDO-Me还可能通过发挥抗炎作用对TBI起神经保护作用。尽管CDDO-Me在脑损伤方面显示出治疗潜力,但既往研究表明CDDO-Me可能会因为因为容量超负荷增加患者心血管系统的负担,因此,CDDO-Me在治疗脑损伤方面的有效性和安全性仍需进一步研究和验证
然而,本实验也存在一些局限性,未设置Nrf2基因敲除组来验证是否减弱CDDO-Me效果。其次,未设置CDDO-Me的药物剂量梯度,无法探究CDDO-Me和TBI保护作用的量效关系。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李成建:实验设计、采集数据、分析数据、论文撰写;徐兰娟:行政支持、指导;安婷婷:实验设计、论文修改;刘静:采集数据、支持性贡献;吴琼:采集数据、论文修改;靳婕:采集数据、统计分析;丁慧慧:采集数据、统计分析;马轶凡:采集数据、统计分析;李向阳:采集数据、统计分析;贾宝辉:行政支持、对文章内容作批阅性审阅、支持性贡献
| [1] | Mira RG, Lira M, Cerpa W. Traumatic brain injury: mechanisms of glial response[J]. Front Physiol, 2021, 12: 740939. DOI:10.3389/fphys.2021.740939 |
| [2] | Sivandzade F, Prasad S, Bhalerao A, et al. NRF2 and NF-?B interplay in cerebrovascular and neurodegenerative disorders: Molecular mechanisms and possible therapeutic approaches[J]. Redox Biol, 2019, 21: 101059. DOI:10.1016/j.redox.2018.11.017 |
| [3] | Chen QM. Nrf2 for cardiac protection: pharmacological options against oxidative stress[J]. Trends Pharmacol Sci, 2021, 42(9): 729-744. DOI:10.1016/j.tips.2021.06.005 |
| [4] | You LT, Peng H, Liu J, et al. Catalpol protects ARPE-19 cells against oxidative stress via activation of the Keap1/Nrf2/ARE pathway[J]. Cells, 2021, 10(10): 2635. DOI:10.3390/cells10102635 |
| [5] | Song MK, Lee JH, Ryoo IG, et al. Bardoxolone ameliorates TGF-β1-associated renal fibrosis through Nrf2/Smad7 elevation[J]. Free Radic Biol Med, 2019, 138: 33-42. DOI:10.1016/j.freeradbiomed.2019.04.033 |
| [6] | Khurana N, Chandra PK, Kim H, et al. Bardoxolone-methyl (CDDO-me) suppresses androgen receptor and its splice-variant AR-V7 and enhances efficacy of enzalutamide in prostate cancer cells[J]. Antioxidants (Basel), 2020, 9(1): 68. DOI:10.3390/antiox9010068 |
| [7] | Pang ZY, Jiang ZX, Zhu RW, et al. Bardoxolone-methyl prevents oxidative stress-mediated apoptosis and extracellular matrix degradation in vitro and alleviates osteoarthritis in vivo[J]. Drug Des Devel Ther, 2021, 15: 3735-3747. DOI:10.2147/DDDT.S314767 |
| [8] | Kadıoğlu E, Tekşen Y, Koçak C, et al. Beneficial effects of bardoxolone methyl, an Nrf2 activator, on crush-related acute kidney injury in rats[J]. Eur J Trauma Emerg Surg, 2021, 47(1): 241-250. DOI:10.1007/s00068-019-01216-z |
| [9] | Kanda H, Yamawaki K. Bardoxolone methyl: drug development for diabetic kidney disease[J]. Clin Exp Nephrol, 2020, 24(10): 857-864. DOI:10.1007/s10157-020-01917-5 |
| [10] | Wang YY, Ma H, Huang JX, et al. Discovery of bardoxolone derivatives as novel orally active necroptosis inhibitors[J]. Eur J Med Chem, 2021, 212: 113030. DOI:10.1016/j.ejmech.2020.113030 |
| [11] | Loan JJM, Al-Shahi Salman R, McColl BW, et al. Activation of Nrf2 to optimise immune responses to intracerebral haemorrhage[J]. Biomolecules, 2022, 12(10): 1438. DOI:10.3390/biom12101438 |
| [12] | Kalvala AK, Kumar R, Sherkhane B, et al. Bardoxolone methyl ameliorates hyperglycemia induced mitochondrial dysfunction by activating the keap1-Nrf2-ARE pathway in experimental diabetic neuropathy[J]. Mol Neurobiol, 2020, 57(8): 3616-3631. DOI:10.1007/s12035-020-01989-0 |
| [13] | Knott MV, Ngwenya LB, Correll EA, et al. Lack of glutamate receptor subunit expression changes in hippocampal dentate gyrus after experimental traumatic brain injury in a rodent model of depression[J]. Int J Mol Sci, 2021, 22(15): 8086. DOI:10.3390/ijms22158086 |
| [14] | Zhao SS, Wang SQ, Cao LX, et al. Acupuncture promotes nerve repair through the benign regulation of mTOR-mediated neuronal autophagy in traumatic brain injury rats[J]. CNS Neurosci Ther, 2023, 29(1): 458-470. DOI:10.1111/cns.14018 |
| [15] | Huang LH, Kang JW, Chen GF, et al. Low-intensity focused ultrasound attenuates early traumatic brain injury by OX-A/NF-κB/NLRP3 signaling pathway[J]. Aging (Albany NY), 2022, 14(18): 7455-7469. DOI:10.18632/aging.204290 |
| [16] | Zheng YH, Li LY, Chen BW, et al. Chlorogenic acid exerts neuroprotective effect against hypoxia-ischemia brain injury in neonatal rats by activating Sirt1 to regulate the Nrf2-NF-κB signaling pathway[J]. Cell Commun Signal, 2022, 20(1): 84. DOI:10.1186/s12964-022-00860-0 |
| [17] | Khatri N, Thakur M, Pareek V, et al. Oxidative stress: major threat in traumatic brain injury[J]. CNS Neurol Disord Drug Targets, 2018, 17(9): 689-695. DOI:10.2174/1871527317666180627120501 |
| [18] | Chen QM. Nrf2 for cardiac protection: pharmacological options against oxidative stress[J]. Trends Pharmacol Sci, 2021, 42(9): 729-744. DOI:10.1016/j.tips.2021.06.005 |
| [19] | Sivandzade F, Prasad S, Bhalerao A, et al. NRF2 and NF-?B interplay in cerebrovascular and neurodegenerative disorders: Molecular mechanisms and possible therapeutic approaches[J]. Redox Biol, 2019, 21: 101059. DOI:10.1016/j.redox.2018.11.017 |
| [20] | 吴江林, 高明, 梁超伦, 等. 桔皮素调控Nrf2/NQO1通路减轻脊髓损伤大鼠炎症与氧化应激损伤[J]. 国际中医中药杂志, 2024, 46(11): 1462-1468. DOI:10.3760/cma.j.cn115398-20240124-00309 |
| [21] | Shang H, Yang D, Zhang W, et al. Time course of Keap1-Nrf2 pathway expression after experimental intracerebral haemorrhage: correlation with brain oedema and neurological deficit[J]. Free Radic Res, 2013, 47(5): 368-375. DOI:10.3109/10715762.2013.778403 |
| [22] | Jin W, Wang HD, Yan W, et al. Disruption of Nrf2 enhances upregulation of nuclear factor-kappaB activity, proinflammatory cytokines, and intercellular adhesion molecule-1 in the brain after traumatic brain injury[J]. Mediators Inflamm, 2008, 2008: 725174. DOI:10.1155/2008/725174 |
| [23] | Wang H, Zhou XM, Wu LY, et al. Aucubin alleviates oxidative stress and inflammation via Nrf2-mediated signaling activity in experimental traumatic brain injury[J]. J Neuroinflammation, 2020, 17(1): 188. DOI:10.1186/s12974-020-01863-9 |
| [24] | Cuadrado A, Rojo AI, Wells G, et al. Therapeutic targeting of the NRF2 and KEAP1 partnership in chronic diseases[J]. Nat Rev Drug Discov, 2019, 18(4): 295-317. DOI:10.1038/s41573-018-0008-x |
| [25] | Yamawaki K, Kanda H, Shimazaki R. Nrf2 activator for the treatment of kidney diseases[J]. Toxicol Appl Pharmacol, 2018, 360: 30-37. DOI:10.1016/j.taap.2018.09.030 |
| [26] | Chertow GM, Appel GB, Andreoli S, et al. Study design and baseline characteristics of the CARDINAL trial: a phase 3 study of bardoxolone methyl in patients with alport syndrome[J]. Am J Nephrol, 2021, 52(3): 180-189. DOI:10.1159/000513777 |
| [27] | Montes Diaz G, Hupperts R, Fraussen J, et al. Dimethyl fumarate treatment in multiple sclerosis: Recent advances in clinical and immunological studies[J]. Autoimmun Rev, 2018, 17(12): 1240-1250. DOI:10.1016/j.autrev.2018.07.001 |
| [28] | Zhao XR, Sun GH, Zhang J, et al. Dimethyl fumarate protects brain from damage produced by intracerebral hemorrhage by mechanism involving Nrf2[J]. Stroke, 2015, 46(7): 1923-1928. DOI:10.1161/STROKEAHA.115.009398 |
| [29] | Yang RJ, Guo YJ, Zong SJ, et al. Bardoxolone methyl ameliorates osteoarthritis by inhibiting osteoclastogenesis and protecting the extracellular matrix against degradation[J]. Heliyon, 2023, 9(2): e13080. DOI:10.1016/j.heliyon.2023.e13080 |
| [30] | Fischer R, Maier O. Interrelation of oxidative stress and inflammation in neurodegenerative disease: role of TNF[J]. Oxid Med Cell Longev, 2015, 2015: 610813. DOI:10.1155/2015/610813 |
| [31] | Ding K, Xu JG, Wang HD, et al. Melatonin protects the brain from apoptosis by enhancement of autophagy after traumatic brain injury in mice[J]. Neurochem Int, 2015, 91: 46-54. DOI:10.1016/j.neuint.2015.10.008 |
| [32] | 黄娟, 孙新刚. 小胶质细胞在蛛网膜下腔出血后早期脑损伤中的作用研究进展[J]. 实用心脑肺血管病杂志, 2024, 32(8). DOI:10.12114/j.issn.1008-5971.2024.00.157 |
| [33] | Iniaghe LO, Krafft PR, Klebe DW, et al. Dimethyl fumarate confers neuroprotection by casein kinase 2 phosphorylation of Nrf2 in murine intracerebral hemorrhage[J]. Neurobiol Dis, 2015, 82: 349-358. DOI:10.1016/j.nbd.2015.07.001 |
 2025, Vol. 34
2025, Vol. 34