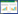急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是临床常见的危重症,但临床暂无有效治疗药物[1-2]。因此,探讨ALI/ARDS的发病机制及潜在治疗靶点具有重要的临床意义。铁死亡是一种新的铁依赖的细胞程序性死亡[3-4]。研究表明,铁死亡是ALI/ARDS发病的重要机制,抑制铁死亡可以缓解ALI/ARDS的进展[5-6]。沉默信息调节因子6(silent information regulator 6,SIRT6)参与调节端粒维持、DNA修复、肿瘤、心血管疾病、代谢性疾病及炎症等多种疾病[7-9]。但其在ALI/ARDS中的作用及相关机制未见相关报道。因此,在本研究旨在探讨SIRT6在ALI/ARDS中的作用及其对铁死亡的影响。
1 材料与方法 1.1 实验试剂GPX4活性检测试剂盒(伊莱瑞特,中国)。丙二醛(MDA)检测试剂盒、还原型谷胱甘肽(GSH)/氧化型谷胱甘肽(GSSG)含量检测试剂盒(碧云天,中国)。亚铁离子检测试剂盒(Abcam,英国)。TNF-ɑ、IL-1β、IL-6 ELISA试剂盒(达科为,中国)。C11 BODIPY581/591荧光探针,抗β-tubulin、SIRT6、Acetyl-H3K9、Acetyl-H3K56、H3抗体(ABclonal,中国)。SIRT6激动剂UBCS039 (UB)及MDL-800 (MDL)、SIRT6抑制剂OSS_128167 (OSS)(AbMole,美国)。铁死亡抑制剂Ferrostatin-1 (Fer-1)(MedChemExpress,美国);SIRT6过表达质粒(ThermoFisher Scientific,美国);SIRT6去乙酰化酶活性检测试剂盒(MBL,美国)。
1.2 动物模型与分组 1.2.1 动物模型SPF级,野生型C57BL/6小鼠,体重22~25 g,购于南方医科大学实验动物中心,湘南学院动物实验伦理审批号:2022DWLL010。参照以往文献[10-11]建立ALI模型,小鼠麻醉后钝性分离气管,向气管内滴注LPS(5 mg/kg)。假模型小鼠气管内滴注等体积生理盐水。
1.2.2 第一阶段小鼠随机分为5组(n=15):对照组建立假ALI模型;模型组建立ALI模型;低剂量组建立ALI后立即尾静脉注射UBCS039(15 mg/kg);中剂量组建立ALI后立即尾静脉注射UBCS039(30 mg/kg);大剂量组建立ALI后立即尾静脉注射UBCS039(45 mg/kg)。
1.2.3 第二阶段小鼠随机分为6组(n=6):对照组建立假ALI模型后予以溶剂处理;模型组建立ALI模型后予以溶剂处理;治疗1组建立ALI模型后立即予以UBCS039(30 mg/kg);治疗2组建立ALI模型后立即予以MDL(25 mg/kg)[12];抑制组建立ALI模型后立即予以OSS(50 mg/kg)[13];挽救组建立ALI模型后立即予以OSS(50 mg/kg)及Fer-1(5 mg/kg)[14]。在12 h后处死并检测相关指标。
1.3 细胞模型与分组以LPS(5 mg/L)刺激肺泡上皮细胞(MEL-12)12 h。细胞分为4组:空白组无干预;空白质粒组转染空质粒;实验组以LPS刺激;过表达组转染SIRT6质粒后以LPS刺激。
1.4 实验方法 1.4.1 HE染色肺组织HE染色后参照以往研究[15]评估肺损伤分数。
1.4.2 肺组织湿/干重比肺组织称肺湿重后置于80℃烤箱72 h。肺组织湿干重比(wet to dry ratio,W/D) =肺湿重/肺干重。
1.4.3 蛋白免疫印迹(Western blot)蛋白电泳及转膜后,一抗[SIRT6(1:1 000)、Acetyl-H3K9(1:1 000)、Acetyl-H3K56(1:1 000)、H3(1:2 000)、β-tubulin(1:5 000)] 4℃孵育过夜,二抗(1:5000)室温孵育2 h,曝光并进行灰度值分析。
1.4.4 丙二醛(MDA) 含量测定参照说明书配置工作液及处理,检测532 nm OD值。
1.4.5 GSH/GSSG比值检测参照说明书配置工作液及处理,检测412 nm OD值。
1.4.6 GPX4活性检测参照说明书配置工作液及处理,340 nm检测OD值。
1.4.7 血清炎症因子检测参照说明书方法,采用ELISA法检测TNF-ɑ、IL-1β、IL-6炎症因子水平。
1.4.8 SIRT6过表达将SIRT6过表达质粒与X-tremeGENE转染剂混合后室温孵育30 min。24 h后更换培养基,Western blot检测SIRT6过表达效果。
1.4.9 脂质过氧化检测细胞处理后加入C11 BODIPY 581/ 591(终浓度为10 μmol/L),在共聚焦荧光显微镜下观察。
1.4.10 亚铁离子检测参照说明书配置工作液及处理,检测592 nm OD值。
1.4.11 SIRT6活性检测参照说明书配置工作体系,激发波长490 nm,发射波长530 nm检测荧光强度。
1.5 统计学方法应用SPSS 20.0软件进行统计分析,计量资料以均数±标准差(x ± s)表示,组间比较使用单因素方差分析(one-way ANOVA)和LSD-t多重比较法,以P<0.05为差异有统计学意义。
2 结果 2.1 ALI中SIRT6表达的变化ALI小鼠肺组织中SIRT6表达逐渐下降,在12 h达最低值(P<0.05)。细胞水平,LPS刺激后SIRT6表达逐渐下降,在12 h达最低(P<0.05)。见图 1及表 1。
|
| 图 1 动物及细胞水平SIRT6表达 |
|
|
| 指标 | 0 h | 3 h | 6 h | 9 h | 12 h | 15 h |
| 动物SIRT6(%) | 100±10.5 | 106.7±11.6 | 103.3±12.9 | 69.7±6.1a | 54.7±4.6a | 68.7±3.5a |
| 细胞SIRT6(%) | 100±7.0 | 103±6.6 | 75.3±2.5 | 68.7±4.0a | 58±3.0a | 58.3±5.0a |
| 注:与0 h比较,aP<0.05 | ||||||
与模型组比较,小剂量组24 h及96 h生存率差异无统计学意义(P>0.05)。与模型组比较,中剂量组24 h及96 h生存率均显著增加(P<0.05)。中剂量组与大剂量组24 h及96 h生存率差异无统计学意义(P>0.05)。见表 2。
| 指标 | 对照组 | 模型组 | 小剂量组 | 中剂量组 | 大剂量组 |
| 24 h生存率(%) | 100(15/15) | 60.0(9/15) | 66.7(10/15) | 93.3(14/15)a | 93.3(14/15)ab |
| 96 h生存率(%) | 100(15/15) | 33.3(5/15) | 40(6/15) | 66.7(10/15)a | 73.3(11/15)ab |
| 注:与模型组比较,aP<0.05;与中剂量组比较,bP>0.05 | |||||
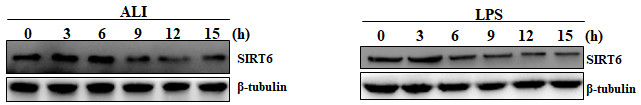
与模型组比较,治疗1组及治疗2组中肺组织H3K9及H3K56乙酰化显著下降,SIRT6活性显著增加(P<0.05);抑制组肺组织H3K9及H3K56乙酰化增加,SIRT6活性下降(P<0.05)。各组间SIRT6表达差异无统计学意义(P>0.05)。见图 2及表 3。
|
| 图 2 激动剂及抑制剂对SIRT6表达及活性的影响 |
|
|
| 指标 | 模型组 | 治疗1组 | 治疗2组 | 抑制组 |
| 乙酰化H3K9(%) | 100±5.6 | 43.3±10.6a | 42.3±6.7a | 241.7±37.8a |
| 乙酰化H3K56(%) | 100±7.8 | 54±5.7a | 44±4.6a | 186.3±13.3a |
| SIRT6表达(%) | 100±9.5 | 103±8.5b | 94.7±4.5 b | 97.3±5.9b |
| SIRT6活性(%) | 100±8.4 | 306.5±30.5a | 328±36.7a | 49.7±3.9a |
| 注:与模型组比较,aP<0.05,bP>0.05 | ||||
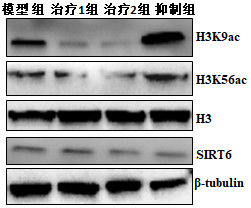
与实验组比较,过表达组细胞lipid-ROS、MDA及Fe2+水平均显著下降,GPX4活性、GSH/GSSG比值及细胞活力显著增加(P<0.05)。
与模型组比较,治疗1组及治疗2组肺组织MDA及Fe2+显著下降,GPX4活性及GSH/GSSG比值显著增加(P<0.05);抑制组MDA及Fe2+显著增加,GPX4活性及GSH/GSSG比值显著下降(P<0.05)。见图 3、表 4~5。
|
| 图 3 SIRT6对肺泡上皮细胞脂质活性氧(lipid ROS)的影响 |
|
|
| 指标 | 空白组 | 空白质粒组 | 实验组 | 过表达组 |
| Lipid ROS | 100±4.0 | 99.5±4.2 | 342.2±24.4 | 232.3±37.6a |
| MDA | 4.2±0.20 | 4.2±0.38 | 6.2±0.52 | 5.3±0.46a |
| GSH/GSSG | 17.8±0.93 | 17.7±0.46 | 6.9±0.92 | 8.9±0.57a |
| GPX4活性 | 4.6±0.69 | 4.6±0.58 | 2.8±0.52 | 3.7±0.43a |
| Fe2+ | 18.1±0.67 | 18.4±0.85 | 45.5±4.70 | 32.5±3.31a |
| 细胞活力 | 100±2.0 | 98.8±2.6 | 73.8±2.3 | 84.5±3.5a |
| 注:与实验组比较,aP<0.05 | ||||
| 指标 | 对照组 | 模型组 | 治疗1组 | 治疗2组 | 抑制组 |
| MDA | 2.2±0.52 | 5.8±0.88 | 4.5±0.61a | 4.3±0.66a | 6.8±0.63a |
| GSH/GSSG | 18.6±0.62 | 7.5±0.63 | 10.2±1.17a | 10.9±1.64a | 5.7±0.8a |
| GPX4活性 | 5.6±0.59 | 3.2±0.40 | 4.4±0.45a | 4±0.59a | 2.6±0.27a |
| Fe2+ | 20.8±7.1 | 58.2±7.8 | 44.5±6.6a | 41±7.7a | 69.2±6.6a |
| 注:与模型组比较,aP<0.05 | |||||
与模型组比较,治疗1组及治疗2组肺损伤评分,W/D,血清TNF-α、IL-1β及IL-6均显著下降(P<0.05);抑制组肺损伤评分,W/D,血清TNF-α、IL-1β及IL-6均显著增加(P<0.05)。与抑制组比较,挽救组肺损伤评分,W/D,血清TNF-α、IL-1β及IL-6均显著下降(P<0.05)。见图 4及表 6。
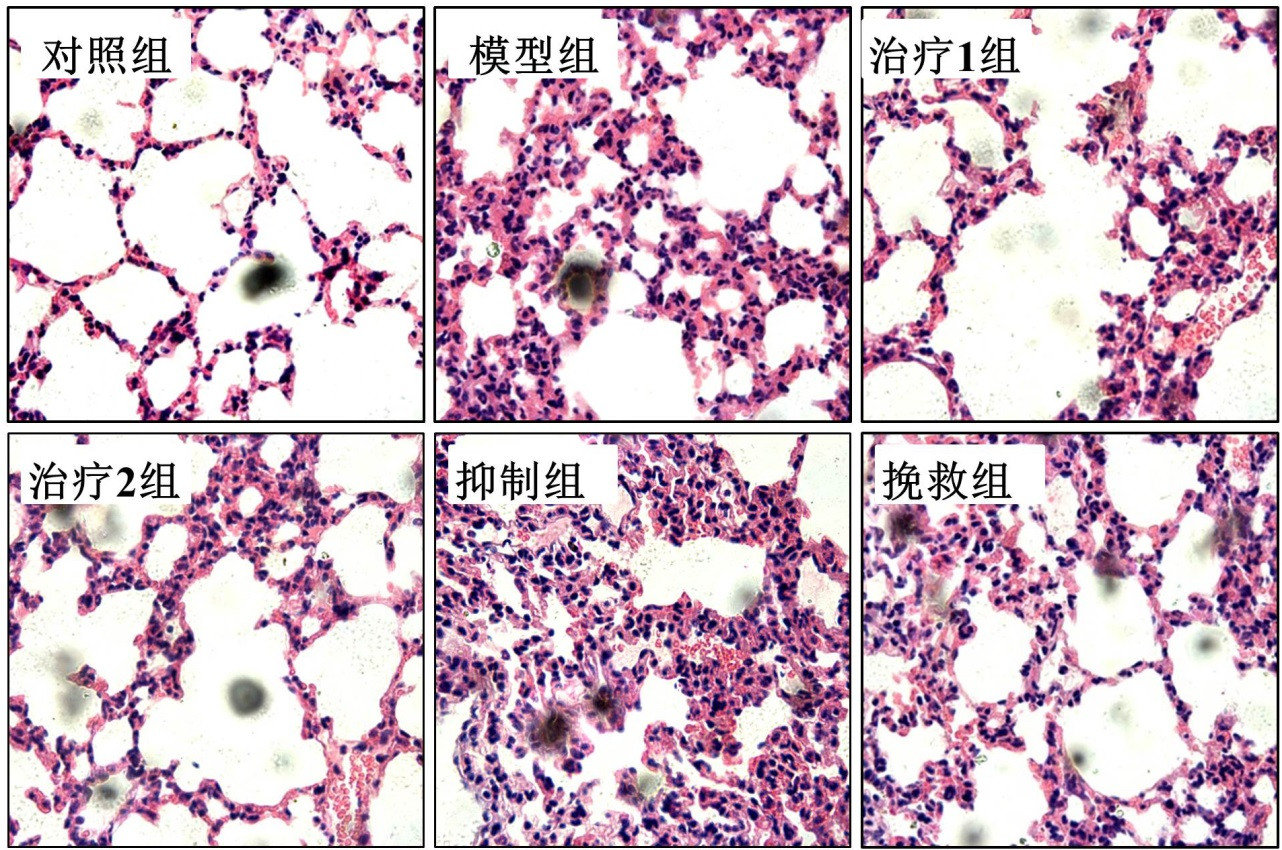
|
| 图 4 SIRT6对肺病理损伤的影响 |
|
|
| 指标 | 对照组 | 模型组 | 治疗1组 | 治疗2组 | 抑制组 | 挽救组 |
| 肺损伤评分 | 1.4±0.59 | 5.3±0.68 | 4.3±0.54a | 4.3±0.52a | 6.4±0.62a | 4.5±0.44b |
| 湿/干重比 | 4.2±0.20 | 6.2±0.52 | 5.3±0.46a | 5.1±0.5a | 6.8±0.26a | 4.8±0.34b |
| TNF-ɑ(pg/mL) | 25±8.8 | 279.3±30.9 | 187.7±24.6a | 184.3±47.7a | 383.7±47.6a | 201.7±19.4b |
| IL-1β(pg/mL) | 41.7±7.3 | 423.5±38.9 | 347.7±43.2a | 336.8±41a | 476.8±46.4a | 336.2±57.7b |
| IL-6(pg/mL) | 36±14.2 | 664.3±91.6 | 427.3±102.2a | 432.5±53.2a | 761.8±109.3a | 438.3±53.8b |
| 注:与模型组比较,aP<0.05;与抑制组比较,bP<0.05 | ||||||
SIRT6在肿瘤、衰老、炎症等疾病中发挥重要作用[9, 16]。但其在ALI/ARDS中的作用未知。本研究发现LPS刺激后SIRT6表达下降。为了探讨SIRT6在ALI/ARDS中的作用,本研究采用了一种可以变构激活SIRT6的特异性激动剂UBCS039[17]。通过比较3种不同剂量的UBCS039对小鼠的生存率的影响,确定了30 mg/kg作为ALI的治疗剂量。SIRT6具有去乙酰化酶活性,通常以组蛋白H3中的第9位及56位赖氨酸脱乙酰化水平反应其活性[18],本研究发现激活剂UBCS039及MDL-800都可以在不影响其表达的情况下提高SIRT6的活性,这与其他研究结果一致[12, 17, 19]。
研究证实,细胞铁死亡是导致ALI的重要机制,而针对铁死亡的调节机制可能作为治疗ALI的潜在策略。在铁死亡过程中,细胞内Fe2+的过载通过芬顿反应引起ROS堆积,导致组成生物膜的多不饱和脂肪酸发生脂质过氧化,继而引起细胞死亡。GPX4可以通过依赖GSH的方式清除脂质活性氧抑制铁死亡。本研究发现激活SIRT6可以显著抑制细胞铁死亡,而抑制SIRT6导致铁死亡增加。
在ALI中大量的炎症细胞浸润导致肺泡损伤,肺泡交换及屏障功能障碍,最终导致呼吸衰竭。本研究证实激活SIRT6可以减轻ALI中炎症反应及肺损伤。而抑制SIRT6导致ALI恶化,但是铁死亡抑制剂可以挽救SIRT6抑制剂引起的ALI恶化,提示SIRT6是通过抑制铁死亡在ALI发挥保护作用。在ALI中,SIRT6表达水平下降,而激活SIRT6可以显著减轻细胞铁死亡及肺损伤。因此,SIRT6可能作为治疗ALI/ARDS的潜在治疗靶点。
利益冲突 所有作者声明无利益冲突
作者贡献声明 彭甜、曹媛媛:实验操作、论文撰写;丁琼蕾、雷小保:数据收集及整理、统计学分析;李涛:经费获取、论文修改、实验指导;艾晨牧:研究设计、实验管理、经费获取
| [1] | 李林, 邢福席, 付全有, 等. 脓毒症急性肺损伤治疗的研究进展[J]. 中华医院感染学杂志, 2024, 34(1): 149-155. DOI:10.11816/cn.ni.2024-236123 |
| [2] | 哈雁翔, 黄坡, 张瑞, 等. 黄芪对脓毒症急性呼吸窘迫综合征小鼠治疗效果及机制[J]. 中华急诊医学杂志, 2024, 33(10): 1407-1412. DOI:10.3760/cma.j.issn.1671-0282.2024.10.010 |
| [3] | Yu Y, Yan Y, Niu FL, et al. Ferroptosis: a cell death connecting oxidative stress, inflammation and cardiovascular diseases[J]. Cell Death Discov, 2021, 7(1): 193. DOI:10.1038/s41420-021-00579-w |
| [4] | 薛皓月, 唐心怡, 丁锦秋, 等. 分子氢通过Nrf2信号分子抑制铁死亡减轻脓毒症相关急性肺损伤[J]. 中华急诊医学杂志, 2024, 33(10): 1413-1420. DOI:10.3760/cma.j.issn.1671-0282.2024.10.011 |
| [5] | Liu X, Zhang JQ, Xie W. The role of ferroptosis in acute lung injury[J]. Mol Cell Biochem, 2022, 477(5): 1453-1461. DOI:10.1007/s11010-021-04327-7 |
| [6] | Lv Y, Chen DM, Tian XY, et al. Protectin conjugates in tissue regeneration 1 alleviates sepsis-induced acute lung injury by inhibiting ferroptosis[J]. J Transl Med, 2023, 21(1): 293. DOI:10.1186/s12967-023-04111-9 |
| [7] | Guo ZY, Li P, Ge JB, et al. SIRT6 in aging, metabolism, inflammation and cardiovascular diseases[J]. Aging Dis, 2022, 13(6): 1787-1822. DOI:10.14336/AD.2022.0413 |
| [8] | Guo ZY, Li P, Ge JB, et al. SIRT6 in aging, metabolism, inflammation and cardiovascular diseases[J]. Aging Dis, 2022, 13(6): 1787-1822. DOI:10.14336/AD.2022.0413 |
| [9] | Li YJ, Jin J, Wang Y. SIRT6 widely regulates aging, immunity, and cancer[J]. Front Oncol, 2022, 12: 861334. DOI:10.3389/fonc.2022.861334 |
| [10] | Zhang ZJ, Wang X, Ma CZ, et al. Genipin protects rats against lipopolysaccharide-induced acute lung injury by reinforcing autophagy[J]. Int Immunopharmacol, 2019, 72: 21-30. DOI:10.1016/j.intimp.2019.03.052 |
| [11] | 段智, 邓加雄, 雷小保, 等. GLP-1受体在脂多糖诱导的大鼠急性肺损伤中的作用及其机制[J]. 中华老年多器官疾病杂志, 2020, 19(10): 773-777. DOI:10.11915/j.issn.1671-5403.2020.10.179 |
| [12] | Jiang XQ, Yao Z, Wang KY, et al. MDL-800, the SIRT6 activator, suppresses inflammation via the NF-κB pathway and promotes angiogenesis to accelerate cutaneous wound healing in mice[J]. Oxid Med Cell Longev, 2022, 2022: 1619651. DOI:10.1155/2022/1619651 |
| [13] | Cao YY, Peng T, Ai CM, et al. Inhibition of SIRT6 aggravates p53-mediated ferroptosis in acute lung injury in mice[J]. Heliyon, 2023, 9(11): e22272. DOI:10.1016/j.heliyon.2023.e22272 |
| [14] | Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [15] | Li T, Liu YT, Xu W, et al. Polydatin mediates Parkin-dependent mitophagy and protects against mitochondria-dependent apoptosis in acute respiratory distress syndrome[J]. Lab Invest, 2019, 99(6): 819-829. DOI:10.1038/s41374-019-0191-3 |
| [16] | Li YJ, Jin J, Wang Y. SIRT6 widely regulates aging, immunity, and cancer[J]. Front Oncol, 2022, 12: 861334. DOI:10.3389/fonc.2022.861334 |
| [17] | Iachettini S, Trisciuoglio D, Rotili D, et al. Pharmacological activation of SIRT6 triggers lethal autophagy in human cancer cells[J]. Cell Death Dis, 2018, 9(10): 996. DOI:10.1038/s41419-018-1065-0 |
| [18] | 王川, 祁星恺, 钱寒, 等. SIRT6的研究现状及展望[J]. 中国急救复苏与灾害医学杂志, 2018, 13(12): 1235-1237. |
| [19] | Huang ZM, Zhao JX, Deng W, et al. Identification of a cellularly active SIRT6 allosteric activator[J]. Nat Chem Biol, 2018, 14(12): 1118-1126. DOI:10.1038/s41589-018-0150-0 |
 2025, Vol. 34
2025, Vol. 34