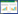2. 首都医科大学康复医学院,中国康复研究中心北京博爱医院心血管内科,北京 100068;
3. 首都医科大学附属北京朝阳医院急诊医学临床研究中心,心肺脑复苏北京市重点实验室,北京 100020
2. Capital Medical University School of Rehabilitation Medicine, Cardiovascular Department, Beijing Bo'ai Hospital, China Rehabilitation Research Center, Beijing 100068, China;
3. Emergency Medicine Clinical Research Center, Beijing Chao-Yang Hospital, Capital Medical University, Beijing Key Laboratory of Cardiopulmonary Cerebral Resuscitation, Beijing 100020, China
衰弱是一种与增龄相关的老年综合征,表现为生理储备下降、抗打击能力减退及应激后恢复能力下降[1],与跌倒、行动不便、失能、住院和死亡等多种不良结局有关[2]。研究发现,衰弱的患病率在65岁至69岁的老年人中约为8.2%,而在85岁以上的人群中高达29.8%[3]。随着人口老龄化进程的加剧,急诊老年患者的数量和比例在逐年增多,衰弱也成为急诊科面临的重要问题,严重影响了患者的临床预后[4-5]。早期识别衰弱患者并对其进行干预可以改善患者的临床结局,如给予营养补充和合适的运动锻炼等[6],另外,对急诊老年衰弱患者的早期识别也有利于评估患者的预后,影响临床决策[7]。但是,对于急诊老年患者来说,识别衰弱非常困难[8],这是因为目前衰弱的筛查与评估主要依赖于各种量表,其中包含许多主观感受信息及握力和步速测定等[6],而由于病情原因,这些信息对于大多数急诊患者都难以获得[9]。因此,本研究拟利用客观临床资料和生物标志物建立急诊老年患者发生衰弱的预测模型,并对此模型的性能进行评估和验证,以期优化医疗决策,改善患者预后。
1 资料与方法 1.1 研究对象本研究为横断面研究。连续收集2021年1月至2021年12月中国康复研究中心急诊科收治的老年患者作为研究对象。共纳入患者360例,剔除资料不全者12例后,最终纳入患者348例,其中男性181例(占52.01%),女性167例(占47.99%);年龄81.00(71.00, 87.00)岁;发生衰弱者187例,发生率为53.74%。
纳入标准:年龄60岁;留观时间24 h。排除标准:需要急诊手术干预者;生命体征不平稳,24 h内死亡的患者;无法完成衰弱评估者。本研究符合医学伦理学标准,经中国康复研究中心医学伦理委员会审查通过(审批号:2021-093-1)。所有受试者自愿参加本研究,签署临床研究知情同意书。
1.2 研究方法 1.2.1 临床资料收集记录患者的年龄、性别、身高、体重、受教育程度、是否与配偶同住、吸烟和饮酒史以及合并基础疾病等一般情况,计算身体质量指数(body mass index, BMI),根据BMI将研究对象分为体重正常(BMI:18.5~23.9 kg/m2)、体重过低(BMI < 18.5 kg/m2)、超重(BMI:24.0~27.9 kg/m2)和肥胖(BMI 28.0 kg/m2)[10]。记录入院24 h内白细胞计数(white blood cell, WBC)、血红蛋白(hemoglobin, HGB)、血小板计数(platelet, PLT)、C-反应蛋白(C-reactive protein, CRP)、丙氨酸氨基转移酶(alanine transaminase, ALT)、天门冬氨酸氨基转移酶(aspartate transaminase, AST)、白蛋白(albumin, ALB)、血尿素氮(blood urea nitrogen, BUN)、葡萄糖、尿酸、肌酐(creatinine, CRE)、纤维蛋白原(fibrinogen, FIB)、D-二聚体(D-dimer, DD)和N-末端脑钠肽前体(N-terminal pro-brain natriuretic peptide, NT-proBNP),根据中国康复研究中心检验参考范围,分别将ALT、AST和CRE分为降低、正常和升高,其中ALT参考范围为9.0~50.0 U/L,AST参考范围为15.0~40.0 U/L,CRE参考范围为57.0~111.0 μmol/L。
1.2.2 实验室指标测定采用迈瑞BC-5390全自动血细胞分析仪(广东省,中国)检测WBC、HGB、PLT和CRP,采用贝克曼AU-680全自动生化分析仪(加利福尼亚,美国)测定ALT、AST、ALB、BUN、葡萄糖、尿酸和CRE,采用Sysmex CA-7000全自动凝血仪(大阪,日本)测定FIB和DD,采用RADIOMETER AQT90 FLEX型分析仪(哥本哈根,丹麦)测定NT-proBNP。
1.2.3 衰弱评估采用Fried衰弱表型对患者进行衰弱评估,根据评估结果将患者分为衰弱组(0~2分)和非衰弱组(3~5分)[11]。
1.3 统计学方法采用SPSS 26.0和R语言4.2.1软件进行数据分析。符合正态分布的定量资料用均数±标准差(x ± s)表示,组间比较采用独立样本t检验;不符合正态分布的定量资料用中位数(四分位数)[M(QL, QU)]表示,组间比较采用Mann-Whitney U检验;无序分类资料用频数(百分比)表示,组间比较采用χ2检验。采用LASSO回归对单因素分析中有统计学意义的变量进行降维处理,避免过度拟合,选择最小l为最优值;将筛选出的变量进行多因素Logistic回归分析以建立预测模型,并绘制列线图将预测模型可视化。分别采用受试者工作特征(receiver operator characteristic, ROC)曲线的曲线下面积(area under the curve, AUC)、校准曲线和决策曲线评价预测模型的区分度、校准度和临床实用性。采用Bootstrap法进行内部验证。以P < 0.05为差异有统计学意义。
2 结果 2.1 衰弱组与非衰弱组临床资料比较一般资料方面,衰弱组与非衰弱组相比,年龄、性别、BMI、受教育程度、与配偶同住情况、合并冠心病(coronary heart disease, CHD)、合并慢性肾脏病(chronic kidney disease, CKD)及合并慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)差异有统计学意义(P均 < 0.05);实验室指标方面,两组HGB、CRP、ALT、ALB、BUN、CRE、FIB、DD和NT-proBNP差异有统计学意义(P均 < 0.05)。见表 1。
| 指标 | 衰弱组(n =187) | 非衰弱组(n =161) | Z/t/χ2值 | P值 |
| 年龄(岁)a | 83.00(78.00, 87.00) | 76.00(66.00, 85.00) | -4.179 | < 0.001 |
| 男性b | 86(45.99) | 95(59.01) | 5.873 | 0.015 |
| BMI | 33.745 | < 0.001 | ||
| 体重正常b | 82(43.85) | 72(44.72) | ||
| 体重过低b | 41(21.93) | 5(3.11) | ||
| 超重b | 33(17.65) | 57(35.40) | ||
| 肥胖b | 31(16.58) | 27(16.77) | ||
| 受教育程度 | -3.118 | 0.002 | ||
| 文盲b | 50(26.74) | 28(17.39) | ||
| 小学b | 60(32.09) | 34(21.12) | ||
| 初中b | 30(16.04) | 45(27.95) | ||
| 高中及以上b | 47(25.13) | 54(33.54) | ||
| 与配偶同住b | 86(46.00) | 102(63.35) | 10.503 | 0.001 |
| 吸烟b | 86(46.00) | 71(44.10) | 0.125 | 0.724 |
| 饮酒b | 47(25.13) | 53(32.92) | 2.561 | 0.110 |
| 合并疾病 | ||||
| 高血压b | 124(66.31) | 99(61.49) | 0.873 | 0.350 |
| 糖尿病b | 80(53.48) | 53(32.91) | 3.563 | 0.059 |
| CHDb | 100(30.50) | 48(29.81) | 19.818 | < 0.001 |
| CKDb | 22(11.76) | 9(5.59) | 4.065 | 0.044 |
| COPDb | 48(25.67) | 19(11.80) | 10.701 | 0.001 |
| 脑卒中b | 40(21.39) | 34(21.12) | 0.004 | 0.951 |
| 实验室指标 | ||||
| WBC(×109/L)a | 8.72(6.31, 11.19) | 8.01(5.88, 11.40) | -0.983 | 0.326 |
| HGB(g/L)a | 121.00(109.00, 136.00) | 134.00(121.00, 144.00) | -5.346 | < 0.001 |
| PLT(×109/L)a | 182.00(143.00, 242.00) | 176.00(140.50, 216.00) | -1.189 | 0.234 |
| CRP(mg/L)a | 37.66(7.24, 89.07) | 11.00(2.87, 67.86) | -3.791 | < 0.001 |
| ALT | 12.330 | 0.002 | ||
| 正常b | 127(67.91) | 134(83.23) | ||
| 降低b | 46(24.60) | 17(10.56) | ||
| 升高b | 14(7.49) | 10(6.21) | ||
| AST | 5.103 | 0.078 | ||
| 正常b | 84(44.92) | 88(54.66) | ||
| 降低b | 74(39.57) | 59(36.65) | ||
| 升高b | 29(15.51) | 14(8.70) | ||
| ALB(g/L)c | 33.76±5.56 | 37.40±4.14 | 6.974 | < 0.001 |
| BUN(mmol/L)a | 8.02(5.61, 12.45) | 6.14(4.99, 8.67) | -3.927 | < 0.001 |
| 葡萄糖(mmol/L)a | 6.58(5.47, 8.56) | 6.29(5.39, 8.42) | -0.829 | 0.407 |
| 尿酸(μmol/L)a | 336.00(246.00, 476.00) | 320.00(256.00, 413.00) | -1.181 | 0.237 |
| CRE | 16.492 | < 0.001 | ||
| 正常b | 94(50.27) | 115(71.43) | ||
| 降低b | 29(15.51) | 12(7.45) | ||
| 升高b | 64(34.22) | 34(21.12) | ||
| FIB(g/L)a | 3.57(2.59, 4.81) | 3.07(2.50, 3.98) | -2.586 | 0.010 |
| DD(mg/L)a | 1.40(0.67, 2.60) | 0.63(0.34, 1.58) | -4.890 | < 0.001 |
| NT-proBNP(μg/L)a | 3.24(1.08, 11.00) | 0.59(0.19, 1.83) | -8.309 | < 0.001 |
| 注:BMI为身体质量指数,CHD为冠心病,CKD为慢性肾脏病,COPD为慢性阻塞性肺疾病,WBC为白细胞计数,HGB为血红蛋白,PLT为血小板计数,CRP为C-反应蛋白,ALT为丙氨酸氨基转移酶,AST为天门冬氨酸氨基转移酶,ALB为白蛋白,BUN为血尿素氮,CRE为肌酐,FIB为纤维蛋白原,DD为D-二聚体,NT-proBNP为N-末端脑钠肽前体;a为M(Q1, Q3),b为例数(百分比),c为x ± s | ||||
将单因素分析中有统计学意义的变量进行LASSO回归,选择最小l为最优值,最终筛选出的预测因子为年龄、BMI、受教育程度、CHD、COPD、HGB、ALT、ALB、BUN、CRE、FIB、DD、NT-proBNP。见图 1。
|
| 图 1 LASSO回归筛选预测因子 Fig 1 Predictor selection using LASSO regression |
|
|
以患者是否存在衰弱(是=1,否=0)为因变量,以LASSO回归筛选出的预测因子为自变量,进行多因素Logistic回归分析,结果显示:受教育程度(OR=0.780,95%CI: 0.615~0.988)、CHD(OR=2.815,95%CI: 1.605~4.938)、COPD(OR=2.577,95%CI: 1.273~5.214)、ALB(OR=0.896,95%CI: 0.845~0.949)、FIB(OR=1.216,95%CI: 1.001~1.478)、NT-proBNP(OR=1.150,95%CI: 1.077~1.229)、CRE降低(OR=3.257,95%CI: 1.365~7.774)、体重过低(OR=7.028,95%CI: 2.316~21.323)是急诊老年患者存在衰弱的独立预测因子(P < 0.05)(见表 2)。基于多因素分析确定的预测因子构建急诊老年患者发生衰弱的列线图预测模型。见图 2。
| 变量 | β | SE | Waldχ2 | OR | 95%CI | P值 |
| 受教育程度 | -0.249 | 0.121 | 4.230 | 0.780 | 0.615~0.988 | 0.040 |
| CHD | 1.035 | 0.287 | 13.025 | 2.815 | 1.605~4.938 | < 0.001 |
| COPD | 0.946 | 0.360 | 6.926 | 2.577 | 1.273~5.214 | 0.008 |
| ALB | -0.110 | 0.030 | 13.833 | 0.896 | 0.845~0.949 | < 0.001 |
| FIB | 0.196 | 0.099 | 3.873 | 1.216 | 1.001~1.478 | 0.049 |
| NT-proBNP | 0.140 | 0.034 | 17.414 | 1.150 | 1.077~1.229 | < 0.001 |
| CRE | 7.245 | 0.027 | ||||
| 正常 | - | - | - | - | - | - |
| 降低 | 1.181 | 0.444 | 7.078 | 3.257 | 1.365~7.774 | 0.008 |
| 升高 | 0.299 | 0.331 | 0.819 | 1.349 | 0.706~2.579 | 0.365 |
| BMI | 14.748 | 0.002 | ||||
| 体重正常 | - | - | - | - | - | - |
| 体重过低 | 1.950 | 0.566 | 11.856 | 7.028 | 2.316~21.323 | 0.001 |
| 超重 | -0.322 | 0.332 | 0.940 | 0.725 | 0.378~1.389 | 0.332 |
| 肥胖 | 0.219 | 0.366 | 0.357 | 1.244 | 0.607~2.549 | 0.550 |
| 常数 | 2.535 | 1.193 | 4.511 | 12.615 | 0.034 | |
| 注:CHD为冠心病,COPD为慢性阻塞性肺疾病,ALB为白蛋白,FIB为纤维蛋白原,NT-proBNP为N-末端脑钠肽前体,CRE为肌酐,BMI为身体质量指数 | ||||||

|
| 注:Points:分数;Education:受教育程度(1为文盲;2为小学;3为初中;4为高中及以上);BMI:身体质量指数(NW为体重正常,UW为体重过低,OW为超重,OB为肥胖);CHD:冠心病;COPD:慢性阻塞性肺疾病;FIB:纤维蛋白原(g/L);ALB:白蛋白(g/L);NT-proBNP:N-末端脑钠肽前体(μg/L);CRE:肌酐;Total Points:总分;Predictive possibility:发生衰弱的概率 图 2 预测急诊老年患者发生衰弱的列线图 Fig 2 Nomogram in prediction for frailty in older emergency patients |
|
|
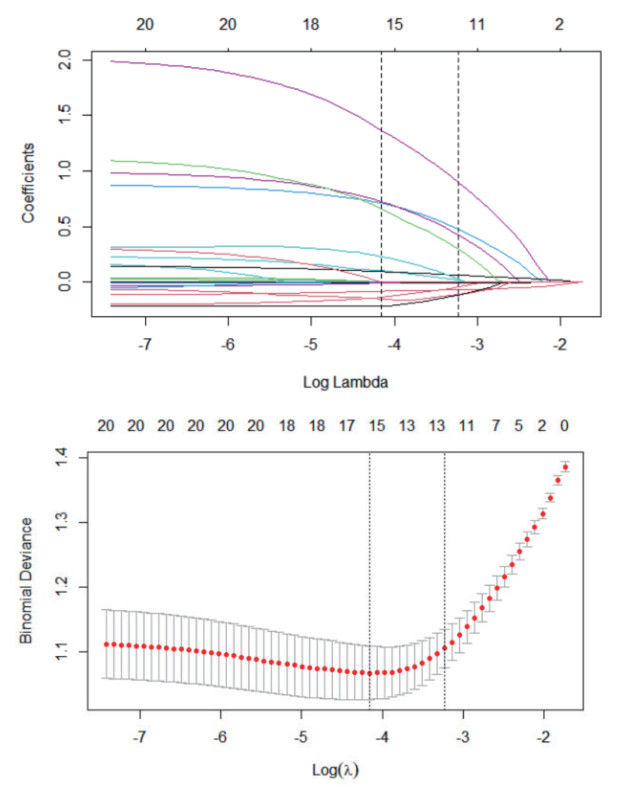
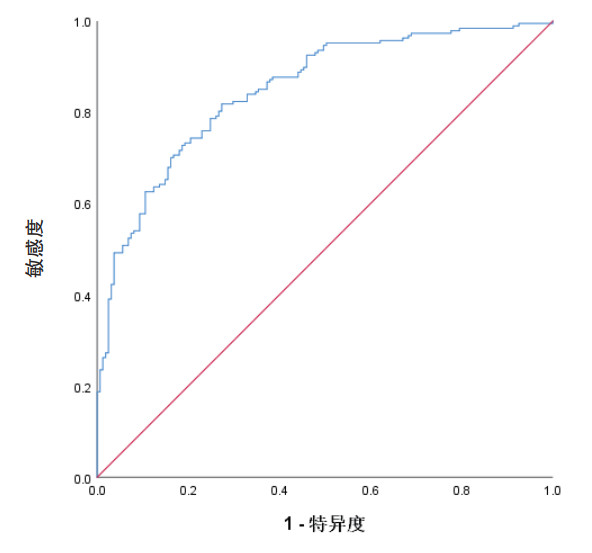
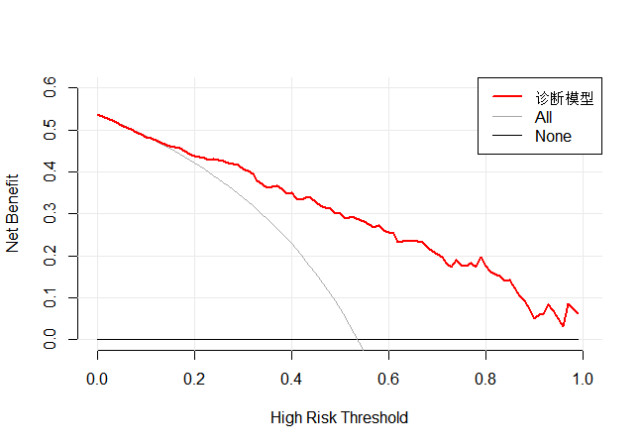
本预测模型预测急诊老年患者发生衰弱的AUC为0.849(95%CI: 0.809~0.889, P < 0.001),Bootstrap 500次后的AUC为0.861(95%CI: 0.799~0.876),表明预测模型具有良好的区分度(见图 3)。Hosmer-Lemeshow检验显示,本模型拟合效果良好(χ2= 1.472, P = 0.993),校准曲线显示本模型具有良好的校准度(见图 4)。决策曲线显示,阈概率值> 0.15时,使用该模型预测急诊老年患者发生衰弱的净获益较高(见图 5)。
|
| 图 3 预测模型预测急诊老年患者发生衰弱的ROC曲线 Fig 3 ROC curve of the prediction model for predicting frailty in older emergency patients |
|
|
|
| 图 4 预测模型预测急诊老年患者发生衰弱的校准曲线 Fig 4 Calibration curve of the prediction model for predicting frailty in older emergency patients |
|
|
|
| 图 5 预测模型的决策曲线 Fig 5 Decision curve analysis of the prediction model |
|
|
本研究采用客观临床资料和生物标志物建立了急诊老年患者发生衰弱的预测模型,并绘制了列线图将其可视化,该模型包含8个独立预测因子:受教育程度、CHD、COPD、ALB、FIB、NT-proBNP、CRE降低、体重过低。经模型评价及Bootstrap法内部验证显示,该预测模型具有良好的区分度、校准度和临床实用性,有利于早期方便快捷的识别急诊老年衰弱患者。
人口老龄化进程导致急诊老年患者的数量逐年上升,同时,衰弱这一问题逐渐凸显,成为急诊科不得不面对的一个重要挑战[4-5]。早期识别衰弱状态,有利于急诊老年患者的危险分层,指导进一步临床决策[7]。同时,早期进行干预,包括营养补充和合适的运动锻炼等[6],也能改善患者的临床预后。营养干预包括充足的能量供给、补充蛋白质和必要的营养制剂[12]。由于急诊老年患者卧床者较多,且合并急性疾病,适用的运动干预方式也有所不同,应根据患者的病情,采取循序渐进的原则,使患者取得最大获益,对于认知、关节活动度和肌肉力量较好的患者,可进行主动躯体运动或器具辅助运动,无法完成主动活动的患者可进行被动躯体运动、被动器具辅助运动和神经肌肉电刺激治疗[13]。另外,心理干预和睾酮等药物干预也可能会改善患者的衰弱状态[12, 14]。
目前临床上已经有多种衰弱筛查与评估工具,但大多并不适用于急诊患者。有Meta分析显示,在老年医学科中衰弱评估通常由专业医疗人员进行,而急诊科中的衰弱评估多是由研究人员完成的[7],说明在临床实践中,医务人员很少对急诊老年患者进行衰弱评估,这可能是因为急诊的工作更加繁忙,而大多数衰弱评估工具对于急诊环境来说过于复杂。目前最常用的衰弱评估工具为Fried衰弱表型、衰弱指数和临床衰弱量表(clinical frailty scale, CFS),相对而言,衰弱指数在急诊中的应用更多[7]。Fried衰弱表型包括体重减轻、自我感觉疲惫、身体活动量低、握力差和行走速度减慢5个评估指标[11],测量较为费时,且许多危重症患者并不能完成相关评估[15]。衰弱指数把个体健康缺陷的累计数量作为重点,评估指标较多,所需时间较长,也不适合在急诊中使用[16]。FRAIL量表、CFS、分诊风险筛查工具(triage risk screening tool, TRST)和高危老年患者识别(identification of seniors at risk, ISAR)工具等快速筛查工具可能更适用于繁忙的急诊工作环境[17]。但是,TRST和ISAR对急诊老年患者不良结局的预测效果较差[8],而急诊许多沟通受限的老年患者并不能提供FRAIL量表所需的主观感受信息,另外,虽然CFS在临床中广泛使用,但Shrier等[18]发现,急诊CFS与住院CFS评估一致性较差,且急诊CFS不能很好的预测患者的临床预后。因此,利用方便快捷的客观资料对患者进行衰弱评估应该更适用于急诊,本预测模型包含受教育程度、BMI、CHD和COPD病史、ALB、FIB、NT-proBNP和CRE,容易获得,且经过模型评估和内部验证显示性能较好。
研究表明受教育程度是老年患者合并衰弱的独立影响因素[19-20],可能因为受教育程度低的患者对外界知识的获取量较少,且健康保健意识薄弱,故而增大了并发衰弱的风险[19]。BMI受体重和身高的双重影响,而体重减轻是Fried衰弱表型评估内容的一部分,因此,不难理解BMI示体重过低可以作为衰弱的预测因子。而且,营养不良是衰弱发生的独立危险因素,体重过低与营养不良密切相关[21]。同样,ALB水平降低也与营养不良有关[22],另外,衰弱发生时往往合并慢性炎症反应,此时肝脏通常需要合成其他急性期蛋白而消耗氨基酸,相应的,ALB的合成会受到影响[23]。老年CHD患者常常合并衰弱,但是其机制尚不明确[24],其中一个原因为CHD患者的运动耐力下降,体力活动减少,导致衰弱的发生,此外,CHD和衰弱有着共同的危险因素,如吸烟、缺乏锻炼、不良饮食习惯等,使得二者常常并存[25]。COPD也与衰弱密切相关,研究发现,合并COPD的患者发生衰弱的风险是未合并COPD者的5.632倍[26],而COPD导致衰弱的机制涉及到多个方面,可能与炎症反应、自噬受损、氧化应激反应、内分泌功能紊乱等因素有关[27]。已有研究表明,FIB升高是衰弱发生的生物标志物之一,其水平随着年龄的增长而升高,导致血栓事件的发生增多,使躯体功能下降,进而促进衰弱发生发展[28]。NT-proBNP是诊断心衰的生物标志物,研究发现,衰弱在心衰患者中很常见,心衰患者合并衰弱的风险是无心衰患者的3.4倍[29-30]。CRE是体内肌酸和磷酸肌酸的代谢产物,其产生受骨骼肌的影响,因此,血清CRE水平降低与肌肉量减少和衰弱有关[31]。
本研究尚存在一定的局限性:(1)本研究为单中心研究,样本量较小,且根据指南推荐,采用了Fried衰弱表型对患者进行衰弱评估,而有的患者因无法完成相应评估未被纳入研究,可能存在选择偏倚;(2)本研究只对预测模型进行了内部验证,而没有进行外部验证,未来尚需进一步验证本预测模型对急诊老年患者发生衰弱的预测价值。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李俊玉:实验设计、采集数据、分析数据、文章撰写;王国栋:实验设计、分析数据、文章修改;商娜:采集数据、支持性贡献;王娜:文章修改、行政支持;郭树彬:文章修改、对文章内容作批评性审阅、行政支持、指导;刘慧珍:对文章内容作批评性审阅、支持性贡献
| [1] | 中华医学会老年医学分会, 《中华老年医学杂志》编辑委员会. 老年人衰弱预防中国专家共识(2022)[J]. 中华老年医学杂志, 2022, 41(5): 503-511. DOI:10.3760/cma.j.issn.0254-9026.2022.05.001 |
| [2] | 马丽娜, 陈彪. 老年人衰弱综合征的研究现状及发展趋势[J]. 中华老年医学杂志, 2020, 39(4): 369-372. DOI:10.3760/cma.j.issn.0254-9026.2020.04.001 |
| [3] | Siriwardhana DD, Hardoon S, Rait G, et al. Prevalence of frailty and prefrailty among community-dwelling older adults in low-income and middle-income countries: a systematic review and meta-analysis[J]. BMJ Open, 2018, 8(3): e018195. DOI:10.1136/bmjopen-2017-018195 |
| [4] | O'Caoimh R, Costello M, Small C, et al. Comparison of frailty screening instruments in the emergency department[J]. Int J Environ Res Public Health, 2019, 16(19): 3626. DOI:10.3390/ijerph16193626 |
| [5] | Lowthian J, Curtis A, Stoelwinder J, et al. Emergency demand and repeat attendances by older patients[J]. Intern Med J, 2013, 43(5): 554-560. DOI:10.1111/imj.12061 |
| [6] | Dent E, Morley JE, Cruz-Jentoft AJ, et al. Physical frailty: ICFSR international clinical practice guidelines for identification and management[J]. J Nutr Health Aging, 2019, 23(9): 771-787. DOI:10.1007/s12603-019-1273-z |
| [7] | Theou O, Squires E, Mallery K, et al. What do we know about frailty in the acute care setting? A scoping review[J]. BMC Geriatr, 2018, 18(1): 139. DOI:10.1186/s12877-018-0823-2 |
| [8] | Boreskie KF, Hay JL, Boreskie PE, et al. Frailty-aware care: giving value to frailty assessment across different healthcare settings[J]. BMC Geriatr, 2022, 22(1): 13. DOI:10.1186/s12877-021-02722-9 |
| [9] | Moloney E, Sezgin D, O'Donovan M, et al. The diagnostic accuracy and clinimetric properties of screening instruments to identify frail older adults attending emergency departments: a protocol for a mixed methods systematic review and meta-analysis[J]. Int J Environ Res Public Health, 2022, 19(3): 1380. DOI:10.3390/ijerph19031380 |
| [10] | 中国肥胖问题工作组. 中国成人超重与肥胖症预防与控制指南(节录)[J]. 营养学报, 2004, 26(1): 1-4. DOI:10.3321/j.issn:0512-7955.2004.01.001 |
| [11] | Fried LP, Tangen CM, Walston J, et al. Frailty in older adults: evidence for a phenotype[J]. J Gerontol A Biol Sci Med Sci, 2001, 56(3): M146-M156. DOI:10.1093/gerona/56.3.m146 |
| [12] | 谢诗瑶, 江帆, 徐扬, 等. 老年人衰弱干预的研究进展[J]. 中华全科医师杂志, 2023, 22(4): 429-434. DOI:10.3760/cma.j.cn114798-20220630-00715 |
| [13] | 刘金炜, 王芳, 张倪惠, 等. 卧床患者衰弱的运动干预[J]. 中华老年医学杂志, 2022, 41(4): 483-487. DOI:10.3760/cma.j.issn.0254-9026.2022.04.024 |
| [14] | Peng XC, Hou LS, Zhao YL, et al. Frailty and testosterone level in older adults: a systematic review and meta-analysis[J]. Eur Geriatr Med, 2022, 13(3): 663-673. DOI:10.1007/s41999-022-00614-8 |
| [15] | 王国栋, 刘慧珍, 商娜, 等. 老年急性冠脉综合征1年内主要不良心脑血管事件预测评分体系的构建及效能评估[J]. 中华急诊医学杂志, 2023, 32(7): 881-888. DOI:10.3760/cma.j.issn.1671-0282.2023.07.006 |
| [16] | Mitnitski AB, Mogilner AJ, Rockwood K. Accumulation of deficits as a proxy measure of aging[J]. Sci World J, 2001, 1: 323-336. DOI:10.1100/tsw.2001.58 |
| [17] | 李珂, 韩舒羽, 张梦杰, 等. 急诊老年综合评估的证据总结[J]. 中国护理管理, 2022, 22(4): 577-583. DOI:10.3969/j.issn.1672-1756.2022.04.019 |
| [18] | Shrier W, Dewar C, Parrella P, et al. Agreement and predictive value of the Rockwood Clinical Frailty Scale at emergency department triage[J]. Emerg Med J, 2021, 38(12): 868-873. DOI:10.1136/emermed-2019-208633 |
| [19] | 翟红丽, 林紫薇, 马威, 等. 老年冠心病患者合并衰弱的相关因素分析[J]. 实用临床医药杂志, 2021, 25(19): 74-77. DOI:10.7619/jcmp.20212588 |
| [20] | 乔慧娟, 张香芝. 老年脑梗死后遗症患者衰弱发生情况及其相关危险因素分析[J]. 航空航天医学杂志, 2023, 34(7): 791-794. DOI:10.3969/j.issn.2095-1434.2023.07.009 |
| [21] | Yuan LL, Chang ML, Wang J. Abdominal obesity, body mass index and the risk of frailty in community-dwelling older adults: a systematic review and meta-analysis[J]. Age Ageing, 2021, 50(4): 1118-1128. DOI:10.1093/ageing/afab039 |
| [22] | Mailliez A, Guilbaud A, Puisieux F, et al. Circulating biomarkers characterizing physical frailty: CRP, hemoglobin, albumin, 25OHD and free testosterone as best biomarkers. results of a meta-analysis[J]. Exp Gerontol, 2020, 139: 111014. DOI:10.1016/j.exger.2020.111014 |
| [23] | Picca A, Coelho-Junior HJ, Calvani R, et al. Biomarkers shared by frailty and sarcopenia in older adults: a systematic review and meta-analysis[J]. Ageing Res Rev, 2022, 73: 101530. DOI:10.1016/j.arr.2021.101530 |
| [24] | Liperoti R, Vetrano DL, Palmer K, et al. Association between frailty and ischemic heart disease: a systematic review and meta-analysis[J]. BMC Geriatr, 2021, 21(1): 357. DOI:10.1186/s12877-021-02304-9 |
| [25] | Stewart R. Cardiovascular disease and frailty: what are the mechanistic links?[J]. Clin Chem, 2019, 65(1): 80-86. DOI:10.1373/clinchem.2018.287318 |
| [26] | Hanlon P, Nicholl BI, Jani BD, et al. Frailty and pre-frailty in middle-aged and older adults and its association with multimorbidity and mortality: a prospective analysis of 493 737 UK biobank participants[J]. Lancet Public Health, 2018, 3(7): e323-e332. DOI:10.1016/S2468-2667(18)30091-4 |
| [27] | 程敏, 刘芹, 刘航呈, 等. 老年COPD相关性衰弱的发病机制及运动干预机制的研究进展[J]. 按摩与康复医学, 2023, 14(10) 100-103, 107. DOI:10.19787/j.issn.1008-1879.2023.10.027 |
| [28] | Xu L, Zhang J, Shen S, et al. Clinical frailty scale and biomarkers for assessing frailty in elder inpatients in China[J]. J Nutr Health Aging, 2021, 25(1): 77-83. DOI:10.1007/s12603-020-1455-8 |
| [29] | Marengoni A, Zucchelli A, Vetrano DL, et al. Heart failure, frailty, and pre-frailty: a systematic review and meta-analysis of observational studies[J]. Int J Cardiol, 2020, 316: 161-171. DOI:10.1016/j.ijcard.2020.04.043 |
| [30] | 王朋飞, 裴源源, 石芳娥, 等. 急诊急性心力衰竭单元收治患者出院后6个月内再入院率和病死率分析[J]. 中华急诊医学杂志, 2022, 31(7): 886-894. DOI:10.3760/cma.j.issn.1671-0282.2022.07.009 |
| [31] | Tang TJ, Xie LL, Hu S, et al. Serum creatinine and cystatin C-based diagnostic indices for sarcopenia in advanced non-small cell lung cancer[J]. J Cachexia Sarcopenia Muscle, 2022, 13(3): 1800-1810. DOI:10.1002/jcsm.12977 |
 2025, Vol. 34
2025, Vol. 34