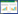根据2012年改善全球肾脏病预后组织(kidney disease improving global outcomes, KDIGO)指南对急性肾损伤(acute kidney injury, AKI)的定义,一项对全球近5千万患者的AKI流行病学荟萃分析显示,成人AKI合并发生率为21.6%,合并相关病死率为23.9%[1]。国内流行病学调查显示,在659 945位成人住院患者中,AKI总体发生率为11.6%,院内病死率为8.8%[2]。在重症监护病房(intensive care unit, ICU)内AKI发生率可高达50%,病死率也随着AKI严重程度的加重而增加[3]。
脓毒症、创伤、心脏大血管手术后、肾毒性药物、肾脏低灌注等是临床AKI发生的高危因素,AKI的高发病率和高相关病死率给患者带来沉重的疾病负担。
ICU内重症AKI患者常需肾替代治疗,而连续性肾脏替代治疗(continuous renal replacement therapy, CRRT)较间断RRT在血流动力学和内环境的稳定上更具有优势。行CRRT时,抗凝是其中重要一环。国际KDIGO指南推荐,对于没有枸橼酸使用禁忌的患者,CRRT抗凝首选局部枸橼酸抗凝(regional citrate anticoagulation, RCA)模式[4]。尽管目前国内市场上仍缺乏成品化的无钙透析液,但目前国内各级ICU内正逐步开展RCA-CRRT,尤其是对存有高出血风险因素的患者。
在进行CRRT治疗时,由于透析液与置换液成分的差异以及是否采用RCA治疗模式,患者体内的小分子能量物质如葡萄糖、乳酸、枸橼酸等会存在一定程度的增加或减少[5-6]。不同的医疗中心行CRRT时可能采用不同的透析液与置换液,如碳酸氢钠或乳酸缓冲液,成品液或手工配制溶液等。行RCA-CRRT时,不同的方案如前稀释与后稀释也会影响枸橼酸在体内的负荷。
葡萄糖(C6H12O6)、枸橼酸(C6H8O7)与乳酸(C3H6O3)作为体内代谢底物,经过机体细胞三羧酸循环或糖酵解途径代谢生成能量。同时,在CRRT治疗过程中,尽管CRRT机器有加热装置,常规会给予体外血液管路加热,但因为室温的影响及体外管路的散热,机体仍经常出现体温的降低[7-8]。因此,需要研究CRRT对机体能量代谢与生物热平衡的影响,以加强ICU内行CRRT支持的AKI患者的营养精准化评估与治疗,避免出现过度喂养或喂养不足。
1 资料与方法 1.1 研究对象本研究为前瞻观察性研究(注册号:ChiCTR2000032413),以2020年5月至2023年12月间在本中心行CRRT治疗的成人AKI患者为研究对象。纳入标准:①ICU内行CRRT治疗的AKI患者;②年龄≥18岁。排除标准:拒绝签署知情同意及无法纳入本研究的患者。本研究遵循《赫尔辛基世界医学会宣言》中涉及人类受试者的医学研究伦理原则[9],并得到了医院伦理委员会的批准(编号:20200423-32)。
1.2 研究方法 1.2.1 临床资料收集收集患者临床特征信息,包括性别、年龄、体重、疾病主要诊断、既往史、急性生理和慢性健康评分Ⅱ (acute physiology and chronic health evaluation Ⅱ, APACHE Ⅱ)、续贯器官衰竭评分(sequential organ failure assessment, SOFA)、ICU住院时间及总住院时间等。收集CRRT信息,包括治疗剂量、治疗时长与滤器寿命等。CRRT期间监测的血常规、电解质、血气分析、肝肾功能、凝血功能和体温等资料。
1.2.2 仪器设备及商品化溶液本研究中使用到的仪器包括床旁血气分析仪(GEM® premier 3000, 美国)、自动血液分析仪(Beckman,LH780,美国)、自动凝血分析仪(Sysmex Ca-7000,日本)、自动生化分析仪(Simens, Diedimension RxL Max HM,美国)、高效液相色谱系统(Waters Alliance 2695 Separations Module,美国),以及三款CRRT机器,即multiFiltrate®(德国),Aquarius®(德国)和Prismaflex®(意大利)。滤器有效期为72 h,除非体外管路或滤器提前凝血或跨膜压 > 300 mmHg。非机器原因如患者自动出院或死亡而提前下机的滤器数据视为截尾数据。行CRRT时使用商品化的溶液,包括4%枸橼酸钠溶液(四川南格尔生物科技有限公司)及置换液(成都青山利康药业股份有限公司)。置换液包括溶液A和溶液B(5%碳酸氢钠),标准配置后葡萄糖浓度为10.0 mmol/L。
1.2.3 CRRT的运行CRRT上机指征、时机和抗凝模式等有ICU主管医生决定。根据KDIGO指南,一般为2~3期的成人AKI患者才行CRRT治疗。CRRT采用3种抗凝模式,即全身肝素化(systemic heparinization, SH)、RCA与无抗凝(no anticoagulation, NA)。有高出血风险因素患者,首选RCA模式,包括心胸、腹部、脊柱或颅脑手术术后,各种原因的凝血功能紊乱如凝血酶原时间或活化部分凝血活酶时间 > 1.5倍于正常对照或血小板数量 < 50×109/L等。RCA模式滤器后血离子钙浓度目标为0.25~0.35 mmol/L。CRRT机的加热器一般设定为37.0℃,当机体核心温度 < 36.0℃时,设定温度调整为37.5℃~38.0℃。CRRT平均治疗剂量设定为20~25 mL/(kg·h),净脱水量由ICU医生决定,但一般不超过200 mL/h。CRRT治疗模式有连续性静脉-静脉血液透析滤过(continuous veno-venous hemodiafiltration, CVVHDF)、连续性静脉-静脉血液滤过(continuous veno-venous hemofiltration, CVVH),及连续性静脉-静脉血液透析(continuous veno-venous hemodialysis, CVVHD)。
1.2.4 枸橼酸浓度的检测参照作者既往研究中检测枸橼酸浓度的方法[10],在RCA-CRRT期间定期检测超滤液中的枸橼酸浓度。简述如下:将100 μL样品在高效液相色谱系统Atlantis®T3柱(150×4.6 mm, 3 μm)上进行分离,流动相为KH2PO4 (30 mmol/L, pH 2.8),流速为0.8 mL/min。枸橼酸测定波长为210 nm,计算色谱峰下面积来定量枸橼酸水平。该检测在浙江工业大学分析测试中心进行。
1.2.5 热卡与能量平衡的计算CRRT时代谢底物(如枸橼酸、葡萄糖及乳酸)进入机体血液循环中的量有如下公式计算。这些物质的生物能当量如下:枸橼酸0.59 kcal/mmol,葡萄糖0.73 kcal/mmol,乳酸0.33 kcal/mmol。代谢底物的每日热卡变化通过底物每日量的变化×相应底物的生物能当量计算。依据指南,ICU内危重患者血糖控制目标为6.0-10.0 mmol/L[11-12]。患者的营养处方亦根据最近的国内外营养指南进行[13-14]。
ΔM=Vin×Cin-Veff×Ceff
ΔM:代谢底物量的变化(mmol);Vin:CRRT中输入的液体量(L),即枸橼酸钠、透析液和置换液等的量;Cin:CRRT输入液中物质浓度(mmol/L);Veff:废液的体积(L);Ceff:废液中物质浓度(mmol/L)。
患者体温采用红外耳温计(PRO 6000, 伟伦,美国)测量,体核温度按耳温加0.5℃计算,如有血温、肛温或膀胱温度检测,体核温度则以上述温度直接记录。ICU环境温度和湿度分别设定为23℃~25℃和50%~60%。当患者核心温度 < 36.0℃,用毛毯或升温毯(CWS 4000,COCOON™,澳大利亚)对机体进行保温,行CRRT的患者,则将加热器温度设定为37.5℃~38.0℃。由于CRRT机器未配置血温探测模块,因此无法通过引血端与回血端血温测定以计算体外热能平衡[15]。基于CRRT过程中机体温度的动态变化,通过下述公式计算CRRT体外循环时热能的变化。
ΔE=ΔT×Qb×C×R
ΔE:CRRT时热能的变化(kcal/h);ΔT:CRRT前后体温的变化(℃);Qb:血流速(L/h);C:血比热[0.87 kcal/(kg·℃)];R:血液密度(1.052 kg/L)[16]。
1.3 统计学方法使用SPSS 19.0统计软件进行统计分析,用OriginPro 2021软件进行绘图。呈正态分布的连续变量值用以均数±标准差(x ± s)或均数(95%置信区间)进行统计描述,多组均数间的比较应用单因素方差分析,组间两两比较应用LSD和Scheffe法。呈偏态分布的连续变量值以中位数(95%置信区间)描述,采用非参数检验中的Krushkal-Wallis H检验。分类变量用率和百分比表示,统计采用χ2检验中的Pearson χ2及Fisher's精确概率法。如CRRT每日治疗时间不到24 h,计算葡萄糖、乳酸、枸橼酸等的日变量时则以时间24 h标化。滤器寿命用Kaplan-Meier生存分析中的Log-Rank test进行组间比较。以P < 0.05为差异有统计学意义。
2 结果 2.1 患者基本信息本研究中不同抗凝条件下行CRRT治疗患者的临床一般特征详见表 1,共有420例行CRRT的AKI患者纳入此前瞻观察性研究,男性患者为多,其中有约2/3的患者(288例)来源于大手术术后,近一半患者(200例)存在基础高血压病史,平均CRRT支持时间为4.83 d。抗凝模式选择中,约50%患者(215例)行SH模式,约30%患者(123例)行RCA模式,余下患者行NA模式。与SH组相比,NA组内患者年龄更大,平均年龄为61岁(P =0.026)。从三组患者的APACHE Ⅱ和SOFA评分比较看,NA组比SH组和RCA组患者病情更重(P < 0.001),ICU内存活率也相对更低,虽未到统计学差异(P =0.176)。
| 指标 | CRRT (n=420) | SH-CRRT(n=215) | RCA-CRRT(n=123) | NA-CRRT(n=82) | F/χ2值 | P值 |
| 年龄(y) | 55.5(53.6~57.5) | 54.1(51.4~56.9)a | 54.3(50.6~58.1) | 61.0(56.8~65.2)a | 3.664 | 0.026 |
| 性别-男性比(n, %) | (254/420)60.5 | (125/215)58.1 | (76/123)61.8 | (53/82)64.6 | 1.173 | 0.556 |
| 高血压(n, %) | (200/420)47.6 | (97/215)45.1 | (64/123)52.0 | (39/82)47.6 | 1.501 | 0.472 |
| 2型糖尿病(n, %) | (110/420)26.2 | (52/215)24.2 | (37/123)30.1 | (21/82)25.6 | 1.424 | 0.491 |
| 慢性肾功能不全(n, %) | (71/420)16.9 | (32/215)14.9 | (22/123)17.9 | (17/82)20.7 | 1.564 | 0.457 |
| 手术后(n, %) | (288/420)68.6 | (140/215)65.1 | (86/123)69.9 | (62/82)75.6 | 3.179 | 0.204 |
| APACHE Ⅱ | 21.5(20.8~22.2) | 20.3(19.4~21.3)a | 21.7(20.5~22.9)b | 24.3(22.9~25.7)ab | 16.911 | < 0.001 |
| SOFA | 13.3(12.8~13.7) | 12.0(11.4~12.6)a | 13.3(12.5~14.1)b | 16.5(15.7~17.3)ab | 52.145 | < 0.001 |
| CRRT支持时长(h) | 115.9(111.1~120.7) | 114.4(107.9~120.9) | 124.4(114.5~134.3)a | 107.2(97.5~116.8)a | 3.155 | 0.044 |
| 住ICU时间(d) | 9.8(9.4~10.3) | 10.1(9.4~10.8) | 9.6(8.8~10.4) | 9.5(8.6~10.4) | 0.423 | 0.809 |
| 住院时间(d) | 19.2(18.3~20.0) | 19.6(18.4~20.9)a | 20.0(18.3~21.7)b | 16.7(15.0~18.4)ab | 7.585 | 0.023 |
| ICU内存活率(n, %) | (288/420)68.6 | (144/215)67.0 | (92/123)74.8 | (52/82)63.4 | 3.477 | 0.176 |
| 注:CRRT为连续性肾脏替代治疗,SH为全身肝素化,RCA为局部枸橼酸抗凝,NA为无抗凝,APACHE Ⅱ为急性生理和慢性健康评分Ⅱ,SOFA为续贯器官衰竭评分。P值显示组间总体检验差异;组间差异以字母a, b表示。 | ||||||
本研究中CRRT置换液与透析液采用的是不含乳酸的碳酸氢钠缓冲液,乳酸作为小分子物质,在患者存在休克等高乳酸血症的情况下,能被CRRT一定程度清除。当血乳酸在14~18 mmol/L时,每日对应约有200~250 kcal能量的丢失;当血乳酸在6.5~11.5 mmol/L时,每日对应能量的丢失约为100~150 kcal。CRRT患者每日乳酸清除对应的热卡变化见图 1。CRRT第1天能平均清除约(771.4 ± 225.6) mmol乳酸,对应热卡为(254.6 ±74.5) kcal。随着血乳酸的降低,CRRT乳酸日清除量也相应降低。
|
| 图 1 CRRT患者每日乳酸对应的热卡变化(x ± s) Fig 1 Daily corresponding energy loss due to blood lactate clearance in patients undergoing CRRT(x ± s) |
|
|
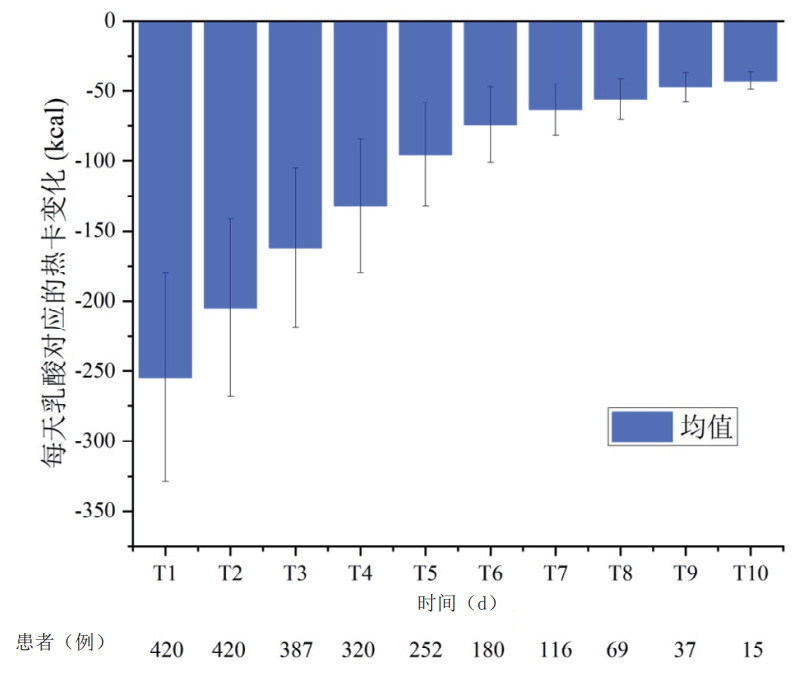
本研究中CRRT使用的置换液与透析液中葡萄糖的浓度为10.0 mmol/L,对患者血糖的影响取决于患者血糖水平。葡萄糖为小分子物质,机体血循环中葡萄糖可以通过弥散、对流等方式与透析液及置换液中葡萄糖实现交互平衡。CRRT患者每日葡萄糖对应的热卡变化以及亚组分析(糖尿病 vs. 非糖尿病,休克 vs. 非休克)见图 2。患者休克等应激早期,血糖均会相应升高,CRRT能清除部分血液中葡萄糖。糖尿病患者血糖一般都偏高,尤其是疾病早期,合并应激因素,升高的血糖能被CRRT一定程度平衡。糖尿病患者第1天CRRT中丢失葡萄糖约(116.3 ± 90.8)mmol,对应热卡为(84.9 ± 66.3)kcal。非糖尿病患者第1天CRRT治疗将会使机体血糖增加约(59.9 ± 81.6)mmol,对应热卡为(43.7 ± 59.6)kcal。休克患者早期多存在应激性高血糖,第1天CRRT中丢失葡萄糖约(24.5 ± 92.6)mmol,对应热卡为(17.9 ± 67.6)kcal。非休克患者亚组分析,第1天CRRT治疗将会使机体血糖增加约(36.4 ± 120)mmol,对应热卡为(26.6 ± 87.6)kcal。48 h后随着机体血糖逐渐控制在恰当水平(ICU内危重患者血糖目标值6.0~10.0 mmol/L),与CRRT逐步达到平衡。CRRT支持过程中机体平均每日约增加137~178 mmol葡萄糖,对应热卡为100~130 kcal。
|
| 图 2 CRRT患者每日葡萄糖对应的热卡变化(x ± s) Fig 2 Daily corresponding energy changes due to blood glucose balance in patients undergoing CRRT(x ± s) |
|
|
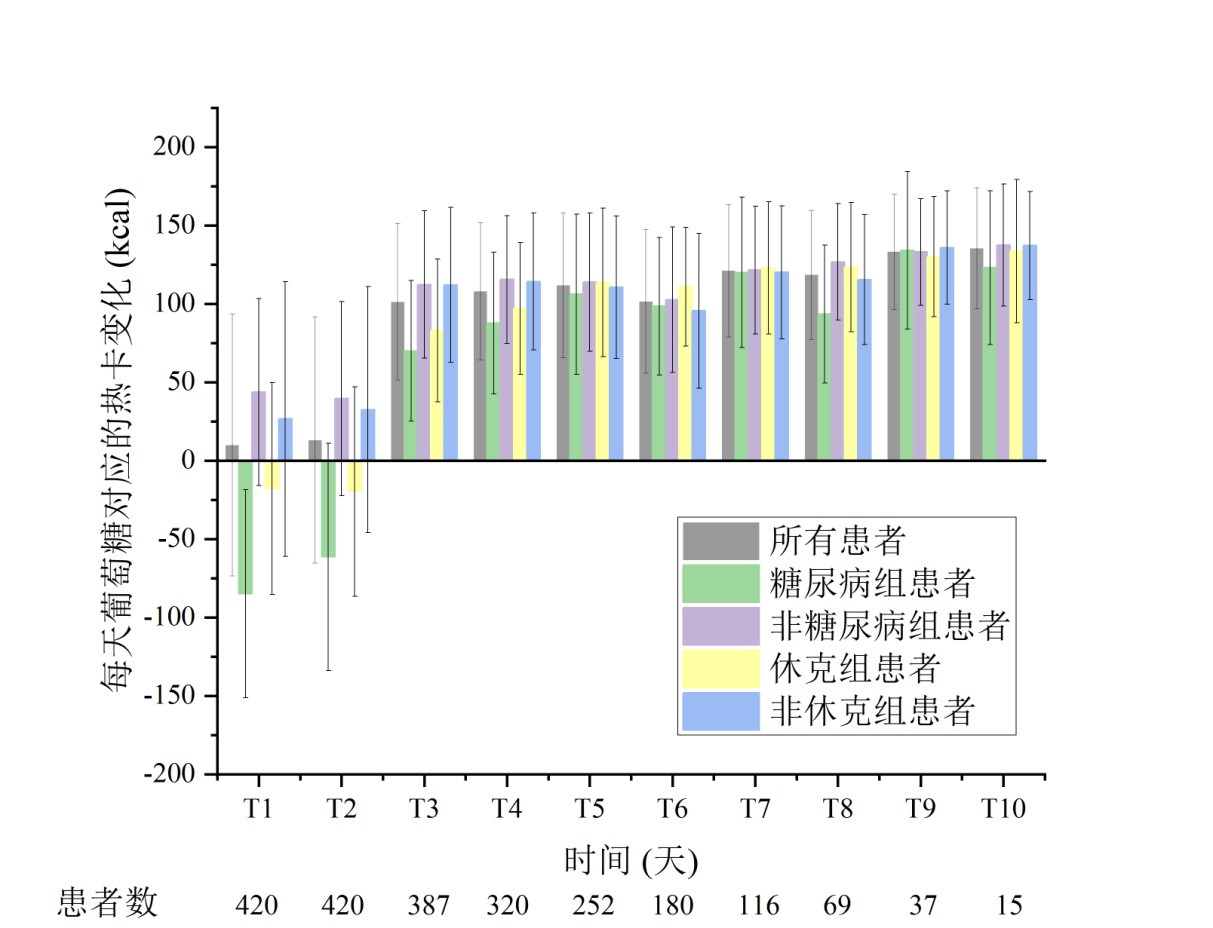
在RCA-CRRT治疗中,每日会有部分枸橼酸进入体内,经机体肝肾等代谢,通过细胞三羧酸循环产生ATP热能。RCA-CRRT患者每日枸橼酸对应的热卡变化见图 3。平均每日进入机体的枸橼酸量约为(561.2 ± 66.9)mmol,对应热卡为(331.1 ± 39.5)kcal。
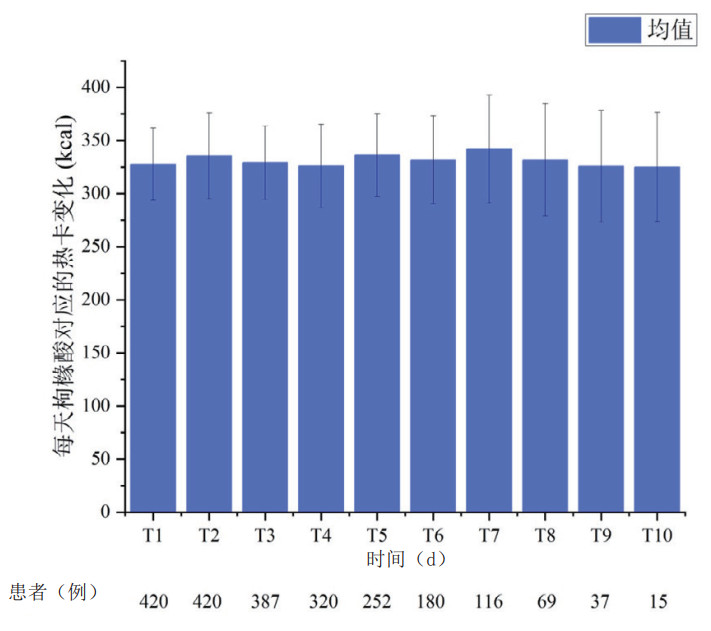
|
| 图 3 RCA-CRRT患者每日枸橼酸对应的热卡变化(x ± s) Fig 3 Daily corresponding energy changes due to citrate intake in patients undergoing RCA-CRRT(x ± s) |
|
|
CRRT期间患者每日体温的变化趋势见图 4。CRRT机器体外管路通过散热给机体起到降温的作用。伴存AKI的危重患者由于重症感染、大手术、创伤等引起的全身炎症反应,机体一般呈现发热状态,CRRT治疗下第1天能使机体温度平均降低约1.1℃,后面几天CRRT支持期间,体温相对趋于动态平衡,平均核心体温在36.9~37.1℃间波动,但个体间差异明显,每日体温变化的标准差在0.9~1.5℃间。CRRT患者每日体温变化所对应热能的变化趋势见图 5。CRRT第1天平均散失热能约为200.5 kcal,后面CRRT支持期间体温变化相对较小,对应热能的变化在±50 kcal之内,但因患者个体间差异较大,每日体温变化所对应的热能变化的标准差在177.9~296.5 kcal间。
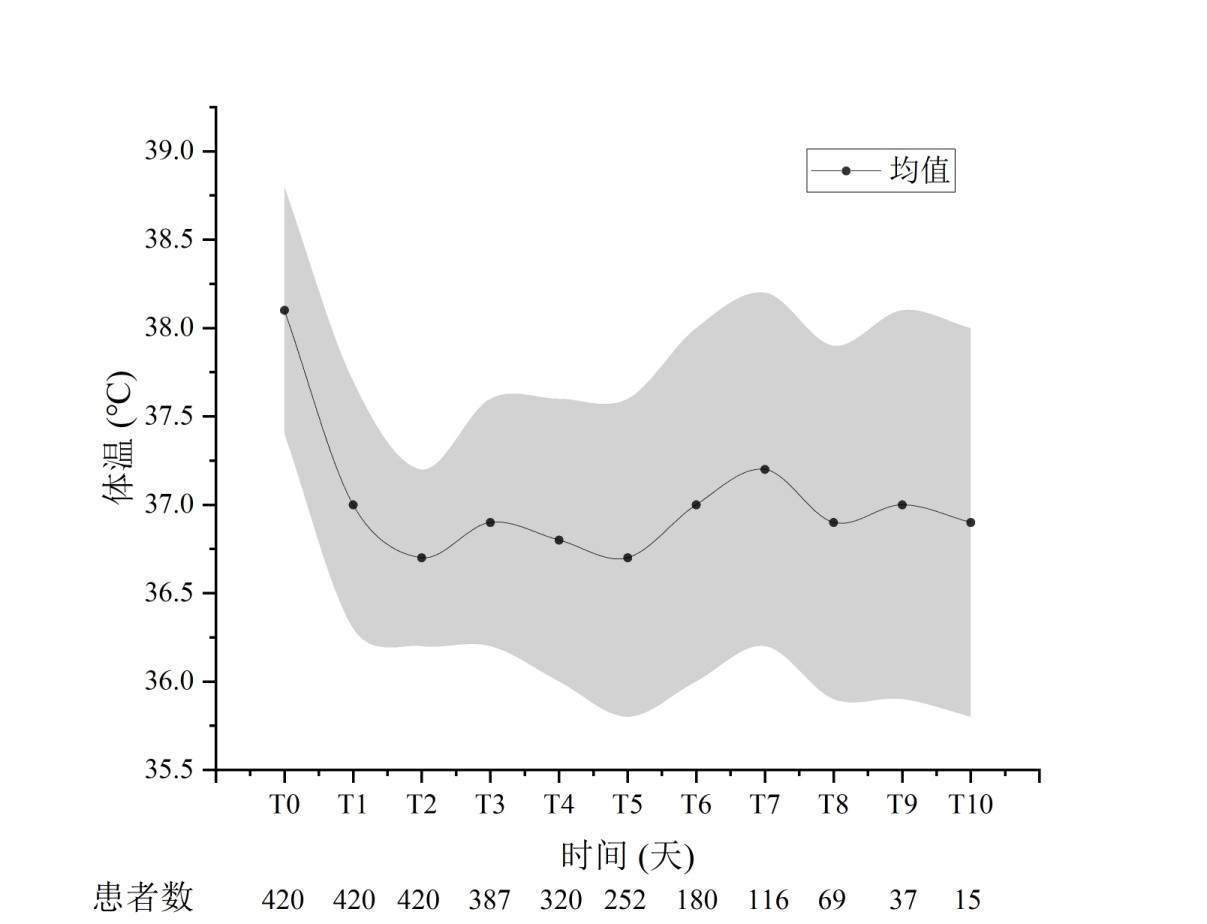
|
| 图 4 CRRT患者每日体温的变化趋势(x ± s) Fig 4 Trend of daily body temperature changes in CRRT patients (x ± s) |
|
|
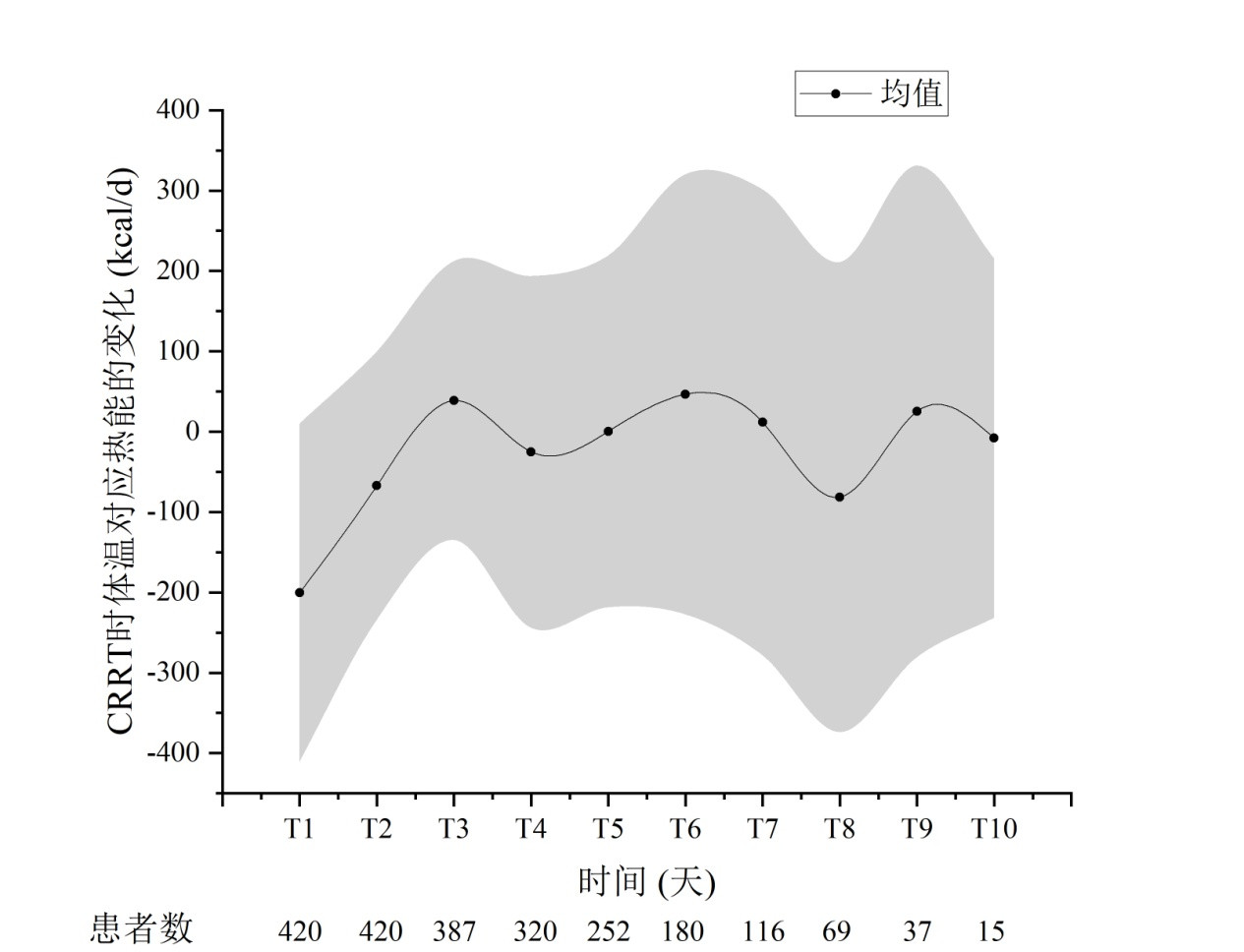
|
| 图 5 CRRT患者每日体温变化对应热能的变化趋势(x ± s) Fig 5 Daily corresponding energy changes due to body temperature balance in patients undergoing CRRT(x ± s) |
|
|
不同抗凝方式下CRRT的滤器寿命比较见图 6。各组滤器中位生存时间,SH组为46.0(44.6~47.4) h,RCA组为56.0(53.8~58.2) h,NA组为32.0(30.7~33.3) h。通过生存曲线组间比较,RCA组滤器寿命长于SH组,RCA组和SH组滤器寿命均长于NA组,差异有统计学意义(P < 0.001)。
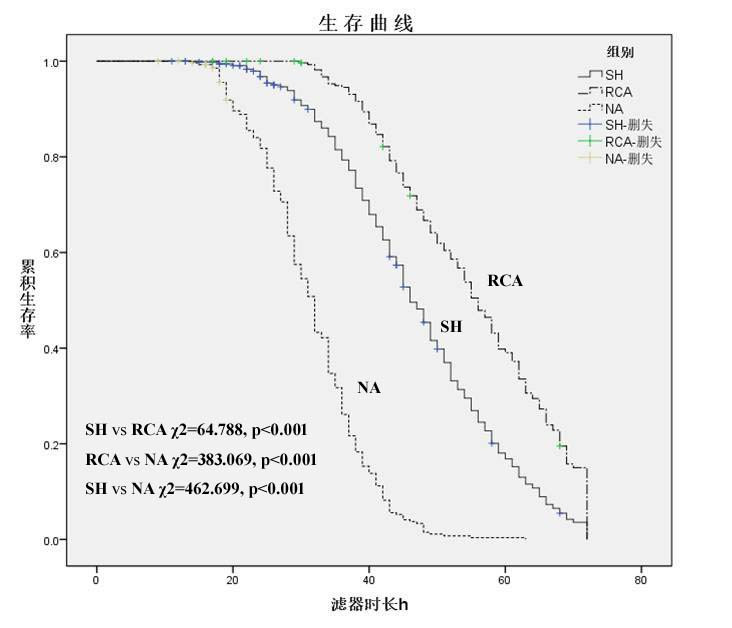
|
| 注:SH:全身肝素化抗凝;RCA:局部枸橼酸抗凝;NA:无抗凝 图 6 CRRT不同抗凝方式下滤器寿命的Kaplan-Meier生存曲线对比 Fig 6 Comparisons of Kaplan-Meier survival curves of filter lifespan under different anticoagulation modes during CRRT |
|
|
CRRT会对ICU内AKI患者的能量代谢与热量平衡产生影响。葡萄糖、乳酸、枸橼酸作为小分子物质,通过弥散、对流等机制与透析液及置换液内溶质进行交互平衡。同时,CRRT体外循环管路经常存在加热不足,通过辐射散热机制使得患者体温下降及对应热能的丢失。在给这些CRRT支持的ICU患者进行营养处方时,临床医师需要考虑到CRRT的这些影响因素,在疾病不同阶段给与精准化的营养供给。
本研究中以外科术后患者为多,行CRRT时选用了三种抗凝方式,SH模式为多,NA模式最少,但NA模式组中患者病情更重,可能是临床中当无法选择SH与RCA抗凝模式时,才次选了NA模式,这类患者多会存在严重高乳酸性休克、肝功能衰竭、高出血风险等严重情况。从ICU内存活率趋势上看,NA组患者也为最低,虽然未到统计学差异(P =0.176)。从滤器寿命角度分析,CRRT时NA模式滤器平均寿命最短,RCA模式优于SH和NA模式,因此对于存在高出血风险且没有枸橼酸使用禁忌的情况下,RCA模式应属于CRRT首选。同时,CRRT的SH模式在国内也在广泛应用,具有监测与操作方便的优势,对不存在高出血风险的AKI患者可以使用,弥补RCA模式下操作与监测相对复杂以及枸橼酸钠目前需要额外费用支出等缺点。
乳酸的清除能平衡机体内环境,纠正代谢性酸中毒,作为代谢物质,乳酸的清除也对应着相应热卡的丢失。在高乳酸血症期,当血乳酸在14~18 mmol/L时,每日对应约有200~250 kcal能量的丢失,而血乳酸在6.5~11.5 mmol/L时,每日对应能量的丢失约为100~150 kcal。在休克前期,血流动力学不稳定,肠外营养一般不给与,肠内营养也只给与少量滋养型营养。而在病情持续期,如果乳酸增高患者行CRRT治疗,需要考虑这部分能量的补充。
CRRT对患者血糖的影响取决于患者血糖的水平,入住ICU患者早期常常存在应激性血糖升高,CRRT期间置换液与透析液内的葡萄糖会与机体血糖达到动态平衡。在本研究亚组分析中,第1天行CRRT时糖尿病患者与休克患者都存在轻度的葡萄糖丢失,非糖尿病与非休克患者则存在轻度的葡萄糖增加。48 h后随着血糖的控制与达标,行CRRT的患者平均每日增加的葡萄糖对应的热卡约为100~130 kcal。因此,在进行早期(48 h内)营养处方时,因CRRT对患者血糖的影响相对较小,可常规禁食或仅给与肠内滋养型营养,而后期在营养处方时,需要考虑到CRRT对患者血糖升高的影响,及对应热卡的增加。同时,也要注意到研究中个体差异较大,临床上应注重个体化评估,达到营养的精准实施。
在进行RCA-CRRT时,枸橼酸平均每日进入机体的量约560 mmol,对应热卡约为330 kcal。在进行营养评估与处方时,需要充分考虑这部分摄入的能量。在休克与高乳酸血症的患者中,使用RCA-CRRT需要警惕枸橼酸蓄积的风险,但目前的研究认为,当血乳酸呈下降趋势并在严密监测下,RCA可以安全开展。此时,因为枸橼酸在机体内代谢减缓,RCA-CRRT时枸橼酸入量需相应调低,同时每日进入机体的枸橼酸量及对应热卡也会相对降低。研究中是以24 h标化后的平均进量,如果CRRT运行时间不到24 h,则进入机体的日摄入量也要相应减少。
Balik等教授[17]研究了后稀释-CVVHDF模式下,3种不同RCA及SH抗凝方案下的生物热能平衡,一种是抗凝剂使用枸橼酸-葡萄糖溶液(含枸橼酸113 mmol/L,葡萄糖138.9 mmol/L),透析液和后稀释的置换液使用含乳酸的缓冲液(含钙离子1.9 mmol/L,葡萄糖5.1 mmol/L,乳酸40.0 mmol/L),血流速为150 mL/min;第二种是抗凝剂使用4%枸橼酸三钠溶液(含枸橼酸136 mmol/L),透析液和置换液使用无钙低钠低碳酸氢盐溶液(钠离子133 mmol/L,葡萄糖5.6 mmol/L,碳酸氢根20 mmol/L),血流速为100 mL/min;第三种使用普通肝素全身抗凝,透析液和置换液使用含乳酸的缓冲液(葡萄糖5.1 mmol/L,乳酸40.0 mmol/L),血流速为150 mL/min。患者血糖控制目标是5.0~8.0 mmol/L。第一种方案能使机体平均增加约1 434 kcal/d,第二种方案生物热能平均增加约115 kcal/d,第三种方案平均约增加455 kcal/d。第一种方案中生物热能增加明显的原因在于葡萄糖机体摄入较多,以及因透析液与置换液使用了含钙溶液,枸橼酸使用量相应增加。New等[18]使用等剂量前后稀释的RCA-CVVH模式,计算患者生物热能的改变,抗凝剂使用枸橼酸-葡萄糖溶液(含枸橼酸113 mmol/L,葡萄糖138.9 mmol/L),机体平均日增加葡萄糖来源的能量295 kcal,枸橼酸来源的能量218 kcal。本研究中透析液与置换液中葡萄糖浓度为10.0 mmol/L,患者血糖控制目标在6.0~10.0 mmol/L,透析液与置换液为不含乳酸的碳酸氢盐作为缓冲液,血流速为150 mL/min,与上述研究的这些差异都会影响CRRT过程中营养物质生物热能的平衡。
CRRT治疗对机体有一定的降温作用,因不同的CRRT仪器加热设备差异,患者体温的变化个体差异性较明显。体温每变化1℃,CRRT引起的日平均热能变化约为200 kcal。因此,行CRRT治疗期间,需要关注患者体温的波动,尤其是发热的患者,在给日降温明显的患者营养处方时,需要考虑到这部分丢失热能的补充。在CRRT进行过程中,同时也要避免低体温的出现,尤其是室温较低的环境下,要注意置换液与透析液的充分加热,以及机体的保温。
本研究存在以下局限性:①未对氨基酸滤过作定量检测,蛋白的丢失也会影响机体热能的平衡。氨基酸作为蛋白合成原料,一定程度也参与机体三羧酸循环,产生热能。在疾病不同阶段,氨基酸所起的作用会有不同,疾病早期处于休克等应激状态,机体以分解代谢为主,后期以合成代谢为主,在评估CRRT时氨基酸丢失所对应的热能影响时,需要考虑该部分丢失的氨基酸在机体所起到的作用。实际上,本研究主要涉及非蛋白热卡的影响,而且临床实践中,CRRT患者临床医生在实施营养处方时,会加强一定程度的蛋白质供给。②本研究中SH抗凝方案以后稀释的CVVHDF模式为主,RCA抗凝方案中以后稀释的CVVH为主,NA抗凝方案以前后稀释的CVVH为主,不同的治疗模式对CRRT过程中生物热能平衡也有一定影响,需要后期更大样本量进行对照研究。
综上所述,在对ICU内CRRT支持的AKI患者行营养评估与处方时,需要充分考虑CRRT对患者能量代谢与热量平衡的影响,包括乳酸的清除、血糖的平衡、枸橼酸的摄入及体温的降低,同时要考虑到疾病类型与所处的阶段以及个体间的差异,达到营养的个体化评估及精准实施。
利益冲突 所有作者声明无利益冲突
作者贡献声明 高建平:实验设计、采集数据、分析数据、文章撰写、文章修改;王勇刚:实验设计、采集数据、文章修改;李丛丛:采集数据、支持性贡献;汤丽萍:采集数据、文章修改;金信浩:分析数据、文章撰写;潘孔寒:对文章内容作批评性审阅、行政支持、指导
| [1] | Susantitaphong P, Cruz DN, Cerda J, et al. World incidence of AKI: a meta-analysis[J]. Clin J Am Soc Nephrol, 2013, 8(9): 1482-1493. DOI:10.2215/CJN.00710113 |
| [2] | Xu X, Nie S, Liu Z, et al. Epidemiology and clinical correlates of AKI in Chinese hospitalized adults[J]. Clin J Am Soc Nephrol, 2015, 10(9): 1510-1518. DOI:10.2215/CJN.02140215 |
| [3] | Hoste EA, Bagshaw SM, Bellomo R, et al. Epidemiology of acute kidney injury in critically ill patients: the multinational AKI-EPI study[J]. Intensive Care Med, 2015, 41(8): 1411-1423. DOI:10.1007/s00134-015-3934-7 |
| [4] | Khwaja A. KDIGO clinical practice guidelines for acute kidney injury[J]. Nephron Clin Pract, 2012, 120(4): c179-c184. DOI:10.1159/000339789 |
| [5] | Ostermann M, Lumlertgul N, Mehta R. Nutritional assessment and support during continuous renal replacement therapy[J]. Semin Dial, 2021, 34(6): 449-456. DOI:10.1111/sdi.12973 |
| [6] | Jonckheer J, Spapen H, Malbrain MLNG, et al. Energy expenditure and caloric targets during continuous renal replacement therapy under regional citrate anticoagulation. A viewpoint[J]. Clin Nutr, 2020, 39(2): 353-357. DOI:10.1016/j.clnu.2019.02.034 |
| [7] | Bell M, Ronco C, Hansson F, et al. Hypothermia during CRRT, a comparative analysis[J]. Acta Anaesthesiol Scand, 2020, 64(8): 1162-1166. DOI:10.1111/aas.13616 |
| [8] | Jones S. Heat loss and continuous renal replacement therapy[J]. AACN Clin Issues, 2004, 15(2): 223-230. DOI:10.1097/00044067-200404000-00008 |
| [9] | World Medical Association. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects[J]. JAMA, 2013, 310(20): 2191-2194. DOI:10.1001/jama.2013.281053 |
| [10] | Gao J, Wang F, Wang Y, et al. A mode of CVVH with regional citrate anticoagulation compared to no anticoagulation for acute kidney injury patients at high risk of bleeding[J]. Sci Rep, 2019, 9(1): 6607. DOI:10.1038/s41598-019-42916-1 |
| [11] | Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021[J]. Intensive Care Med, 2021, 47(11): 1181-1247. DOI:10.1007/s00134-021-06506-y |
| [12] | Singer P, Blaser AR, Berger MM, et al. ESPEN guideline on clinical nutrition in the intensive care unit[J]. Clin Nutr, 2019, 38(1): 48-79. DOI:10.1016/j.clnu.2018.08.037 |
| [13] | Singer P, Blaser AR, Berger MM, et al. ESPEN practical and partially revised guideline: Clinical nutrition in the intensive care unit[J]. Clin Nutr, 2023, 42(9): 1671-1689. DOI:10.1016/j.clnu.2023.07.011 |
| [14] | 中国急诊危重症患者肠内营养治疗专家共识组. 中国急诊危重症患者肠内营养治疗专家共识[J]. 中华急诊医学杂志, 2022, 31(3): 281-290. DOI:10.3760/cma.j.issn.1671-0282.2022.03.004 |
| [15] | Rahmati S, Ronco F, Spittle M, et al. Validation of the blood temperature monitor for extracorporeal thermal energy balance during in vitro continuous hemodialysis[J]. Blood Purif, 2001, 19(2): 245-250. DOI:10.1159/000046949 |
| [16] | Blake AS, Petley GW, Deakin CD. Effects of changes in packed cell volume on the specific heat capacity of blood: implications for studies measuring heat exchange in extracorporeal circuits[J]. Br J Anaesth, 2000, 84(1): 28-32. DOI:10.1093/oxfordjournals.bja.a013376 |
| [17] | Balik M, Zakharchenko M, Leden P, et al. Bioenergetic gain of citrate anticoagulated continuous hemodiafiltration--a comparison between 2 citrate modalities and unfractionated heparin[J]. J Crit Care, 2013, 28(1): 87-95. DOI:10.1016/j.jcrc.2012.06.003 |
| [18] | New AM, Nystrom EM, Frazee E, et al. Continuous renal replacement therapy: a potential source of calories in the critically ill[J]. Am J Clin Nutr, 2017, 105(6): 1559-1563. DOI:10.3945/ajcn.116.139014 |
 2025, Vol. 34
2025, Vol. 34