2. 浙江大学医学院附属第二医院感染科,杭州 310009
鹦鹉热衣原体肺炎是由鹦鹉热衣原体引起的一种人畜共患疾病[1]。鹦鹉热属于衣原体科,可通过鸟类和家禽传播给人类[2]。与鸽子或家禽等鸟类接触是感染鹦鹉热的主要危险因素[3]。鹦鹉热肺炎的临床症状多种多样,缺乏特异性。鹦鹉热感染可导致严重肺炎、成人呼吸窘迫综合征,甚至多器官衰竭[4]。由于其非特异性症状和传统诊断方法的局限性,鹦鹉热容易诊断不足和误诊[5]。宏基因组二代测序(metagenomics next-generation sequencing, mNGS)正在成为一种准确快速识别潜在病原体的重要方法。本研究回顾性分析4例经mNGS确诊的鹦鹉热衣原体重症肺炎患者的临床资料,旨在阐明该病的临床特征,探讨mNGS在快速诊断鹦鹉热衣原体和提供早期合理治疗方面的潜在价值。
1 资料与方法 1.1 研究对象收集2020年1月至2022年1月浙江大学医学院附属第二医院收治4例鹦鹉热衣原体重症肺炎确诊患者。重症肺炎诊断标准参照2019年美国胸科学会和传染病学会制订的《成人社区获得性肺炎诊断和治疗指南》[6]。本研究已获得浙江大学医学院附属第二医院人体研究伦理委员会审查批准,审批号为:(2023)伦审研第(0359)号。
1.2 纳入标准(1) 符合上述重症肺炎诊断标准; (2)年龄大于18岁; (3)肺泡灌洗液的mNGS检测出鹦鹉热衣原体基因序列; ⑷在本院首诊,资料完整。
1.3 研究方法采用回顾性研究方法,收集符合纳入标准的4例患者一般资料、基础疾病、流行病史、临床表现、实验室检查、mNGS结果、影像学表现、治疗前后用药及28 d治疗转归进行分析。
2 结果 2.1 患者特征及临床表现4例患者发病前未使用过糖皮质激素、化疗或免疫抑制药物。在流行病学史方面,1例患者在家养鸭多年,1例患者曾在湖边喂养鸽子,其余2例患者去过活禽市场。4例患者均伴有肌痛、高热、寒战、头痛、咳嗽、乏力和呼吸困难,氧合指数均≤250 mmHg(1 mmHg=0.133 kPa)。3例患者使用气管插管接呼吸机辅助呼吸,使用呼吸机时间为7~12 d。其中1例患者因病情危重最终接受了ECOM治疗,另1例患者通过高流量加湿面罩给氧。从发病到入院的中位时间为5 d(3~7 d),从发病到确诊的时间为2~3 d(表 1)。
| 项目 | 患者人数(例) | 中位值(范围) |
| 男性/女性 | 2/2 | |
| 年龄(岁) | 64(55~75) | |
| 有禽类或家禽接触史 | 4/4 | |
| 潜在疾病 | ||
| 糖尿病 | 1/4 | |
| 心血管和脑血管疾病 | 1/4 | |
| 实体恶性肿瘤 | 1/4 | |
| 慢性肾病 | 2/4 | |
| 慢性阻塞性肺病 | 0/4 | |
| 慢性肝病 | 0/4 | |
| 临床表现 | ||
| 发烧 > 38.5℃ | 4/4 | |
| 咳嗽、乏力、呼吸困难 | 3/4 | |
| 头痛 | 4/4 | |
| 肌痛 | 4/4 | |
| 败血性休克 | 1/4 | |
| 呼吸机支持 | 3/4 | |
| 高流量面罩 | 1/4 | |
| PO2/FiO2 < 250(mmHg) | 4/4 | |
| 院外天数(d) | 5(3~7) | |
| 确认天数(d) | 2(2~3) | |
| 机械通气时间(d) | 9(7~12) | |
| 重症监护室时间(d) | 9(3~17) | |
| 注:PO2为动脉血氧分压,FiO2为吸入氧浓度,PO2/FiO2为氧合指数 | ||
在2例患者中观察到白细胞计数升高和降低。所有患者均表现出中性粒细胞计数、血红蛋白计数和血小板计数增加。此外,所有患者的C反应蛋白和降钙素原水平均升高(表 2)。
| 实验室检查项目 | 患者人数 | 中位值(范围) | 正常值范围 |
| 白细胞 | 1/4 | 6.9(3.2~11.4) | (4~10)×109/L |
| 中性粒细胞比例 | 4/4 | 95.5%(92%~97%) | 45%~75% |
| CRP | 4/4 | 239.8(216.3~269.8) | 0~10 mg/L |
| PCT | 4/4 | 8.0(5.39~11.63) | 0~0.5 ng/mL |
| 肌酸激酶 | 4/4 | 507.5(312~740) | 30~164 U/L |
| 乳酸脱氢酶 | 4/4 | 484.7(256~654) | 120~250 U/L |
| 低钾血症 | 1/4 | 3.7(3.1~4.2) | 3.5~5.0 mmol/L |
| D-二聚体 | 4/4 | 4.6(3.2~7.2) | 0.0~0.5 µg/mL |
| 丙氨酸氨基转移酶 | 2/4 | 44.3(22~61) | 10~50 U/L |
| 天冬氨酸氨基转移酶 | 4/4 | 81.7(52~107) | 15~40 U/L |
| 低蛋白血症 | 4/4 | 28.3(25.1~33.2) | 35.0~52.0 g/L |
| 肌酐 | 2/4 | 90.4(74~110) | 57.0~98.0 mmol/L |
| 血尿素氮 | 2/4 | 7.8(6.5~9.2) | 2.8~7.6 µmol/L |
| 注:CRP为C反应蛋白,PCT降钙素原 | |||
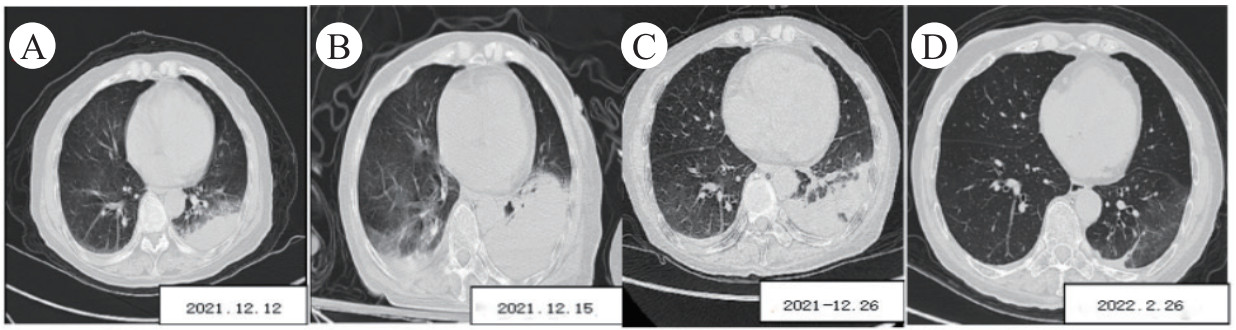
所有患者入院前都进行肺部CT检查。影像中4例重症鹦鹉热肺炎病例均出现肺部实变伴有支气管充气征,均观察到毛玻璃影,其中2例左肺受累、1例右肺受累、1例双肺受累,同时还发现1例伴有纵隔淋巴结/肺门淋巴结肿大,3例伴有少量胸腔积液。
|
| 注:A为入院时; B为入院第3天; C为入院第14天; D为入院第72天 图 1 75岁女性重症鹦鹉热肺炎的胸部CT影像(案例3) |
|
|
所有患者均接受支气管镜检查,收集支气管肺泡灌洗液(BALF),通过mNGS测试进行病原体检测。同时还采集了外周血样本进行mNGS检测(表 3)。
| 案例 | 标本类型 | 序列数 | 痰培养 | 血培养 |
| 案例1 | BALF/血液 | 15161/156 | 阴性 | 阴性 |
| 案例2 | BALF/血液 | 28603/0 | 阴性 | 阴性 |
| 案例3 | BALF/血液 | 2110/0 | 阴性 | 阴性 |
| 案例4 | BALF/血液 | 4302/66 | 阴性 | 阴性 |
所有患者入院时都接受了经验性治疗,包括碳青霉烯类、头孢菌素类或喹诺酮类抗生素。在mNGS确认病因后及时调整治疗方案。在本研究中,3例患者接受了多西环素和莫西沙星的联合治疗,1例患者(案例1)接受了米诺环素和莫西沙星的治疗。经过积极治疗,3例患者病情好转出院,而1例患者(案例1)因病情危重,拒绝服从医嘱而自动出院(表 4)。
| 案例 | 初始治疗方案 | 确诊后的调整治疗方案 | 预后 |
| 案例1 | 莫西沙星 | 莫西沙星+米诺环素 | 自动出院 |
| 案例2 | 哌拉西林他唑巴坦 | 莫西沙星+多西环素 | 好转后出院 |
| 案例3 | 美罗培南 | 莫西沙星+多西环素 | 好转后出院 |
| 案例4 | 亚胺培南西司他丁钠 | 莫西沙星+多西环素 | 好转后出院 |
鹦鹉热是一种由鹦鹉热衣原体在鸟类或家禽中引起的人畜共患疾病。一项Meta分析结果显示,鹦鹉热衣原体仅占每年社区获得性肺炎的1%~2%[7]。人们往往通过吸入被鹦鹉热衣原体污染的气溶胶而被感染[8]。在处理受感染的鸟类羽毛和组织以及清理笼子的密切接触也可能构成风险[9]。鹦鹉热衣原体不仅在鹦鹉和鸽子中发现,家禽中也有发现,包括鸭和鸡在内的活家禽是中国最常见的感染源[10-11]。
本研究中所有的患者都有接触史,其中1例患者接触过鸽子,1例患者饲养家禽,其余2例患者接触过活禽市场。对经mNGS确诊的鹦鹉热衣原体感染患者的回顾性分析显示,4例鹦鹉热衣原体重症肺炎病例都是通过mNGS诊断的。发烧、肌痛和头痛是最常见的症状,这与之前的报道不同[12-13]。实验室数据通常显示外周血白细胞正常或轻微升高,中性粒细胞、降钙素原和C反应蛋白水平较高。与其他衣原体属物种相比,鹦鹉热衣原体更具致病性,并引起更严重的炎症反应[14]。本研究中的胸部CT结果显示,炎症性病变始于肺下叶,同时伴有支气管充气征和实变,与其他研究中报道的模式不同[15]。
鹦鹉热衣原体肺炎的诊断具有挑战性,传统的病原体培养和血清学检测方法存在阳性率低、耗时长以及生物安全风险等问题。尤其是在重症肺炎患者中,快速、准确的病原体鉴定对于指导治疗至关重要[16]。本研究中的4例患者均通过mNGS技术从支气管肺泡灌洗液(BALF)中检测到鹦鹉热衣原体基因序列,且检测时间仅为2~3 d,显著缩短了诊断周期。mNGS的应用时机应结合患者的流行病学史、临床表现及常规实验室检查结果进行综合判断。对于有明确禽类接触史、临床表现符合鹦鹉热特征(如高热、肌痛、头痛等)且常规病原学检查阴性的患者,mNGS可作为早期诊断的有力工具。本研究中,所有患者均有禽类接触史,且常规痰培养和血培养均为阴性,mNGS的应用为快速确诊提供了关键依据。
与传统的病原体检测方法相比,mNGS具有更高的敏感性和特异性,能够同时检测多种病原体,尤其适用于难以培养或罕见的病原体[17-18]。在本研究中,mNGS不仅快速识别了鹦鹉热衣原体,还排除了其他可能的病原体感染,避免了经验性治疗的盲目性。若未进行mNGS检测,患者可能会继续接受广谱抗生素治疗,导致治疗延误和潜在的药物不良反应。
此外,mNGS的应用还为重症患者的治疗策略调整提供了依据。本研究中,3例患者在确诊后及时调整了治疗方案,采用了以四环素类和喹诺酮类为基础的联合治疗,最终病情好转出院。
鹦鹉热衣原体肺炎的治疗应基于病原体的敏感性和患者的病情严重程度进行个体化调整。四环素类、大环内酯类和喹诺酮类抗生素是治疗鹦鹉热的一线药物[19]。然而,由于四环素类和大环内酯类抗生素在中国存在较高的耐药性,氟喹诺酮类药物在临床应用已被证实治疗有效[20-21]。重症患者可能需要联合使用四环素类和喹诺酮类药物治疗。在本研究中,3例患者在确诊后接受了多西环素和莫西沙星的联合治疗,1例患者接受了米诺环素和莫西沙星的治疗。这种联合治疗方案不仅覆盖了鹦鹉热衣原体,还考虑到可能的混合感染和耐药性问题。通过mNGS的快速诊断,治疗策略得以在24 h内调整,显著缩短了治疗反应时间,降低了病死率[22]。
综上所述,鹦鹉热衣原体肺炎的临床表现与典型肺炎难以区分,导致临床实践中诊断延迟和初始治疗不当。mNGS作为一种高效的病原体检测技术,能够在短时间内提供准确的病原学诊断,为重症患者的治疗策略调整提供关键依据。通过结合流行病学史、临床表现及mNGS检测结果,临床医生可以更早地识别鹦鹉热衣原体感染,优化治疗方案,缩短住院时间并避免严重并发症。
利益冲突 所有作者声明无利益冲突
| [1] | Kalmar ID, Dicxk V, Dossche L, et al. Zoonotic infection with Chlamydia psittaci at an avian refuge centre[J]. Vet J, 2014, 199(2): 300-302. DOI:10.1016/j.tvjl.2013.10.034 |
| [2] | Balsamo G, Maxted AM, Midla JW, et al. Compendium of measures to control Chlamydia psittaci infection among humans (psittacosis) and pet birds (avian chlamydiosis), 2017[J]. J Avian Med Surg, 2017, 31(3): 262-282. DOI:10.1647/217-265 |
| [3] | Gough SL, Carrick J, Raidal SL, et al. Chlamydia psittaci infection as a cause of respiratory disease in neonatal foals[J]. Equine Vet J, 2020, 52(2): 244-249. DOI:10.1111/evj.13170 |
| [4] | Su SS, Su XQ, Zhou LP, et al. Severe Chlamydia psittaci pneumonia: clinical characteristics and risk factors[J]. Ann Palliat Med, 2021, 10(7): 8051-8060. DOI:10.21037/apm-21-1502 |
| [5] | 文文, 谷雷, 赵立维, 等. 鹦鹉热衣原体肺炎八例临床特征分析及其诊治[J]. 中华结核和呼吸杂志, 2021, 44(6): 531-536. DOI:10.3760/cma.j.cn112147-20210205-00097 |
| [6] | Jackson CD, Burroughs-Ray DC, Summers NA. Clinical guideline highlights for the hospitalist: 2019 American thoracic society/infectious diseases society of America update on community-acquired pneumonia[J]. J Hosp Med, 2020, 15(12): 743-745. DOI:10.12788/jhm.3444 |
| [7] | Hogerwerf L, DE Gier B, Baan B, et al. Chlamydia psittaci (psittacosis) as a cause of community-acquired pneumonia: a systematic review and meta-analysis[J]. Epidemiol Infect, 2017, 145(15): 3096-3105. DOI:10.1017/S0950268817002060 |
| [8] | Beeckman DSA, Vanrompay DCG. Zoonotic Chlamydophila psittaci infections from a clinical perspective[J]. Clin Microbiol Infect, 2009, 15(1): 11-17. DOI:10.1111/j.1469-0691.2008.02669.x |
| [9] | Mair-Jenkins J, Lamming T, Dziadosz A, et al. A psittacosis outbreak among English office workers with little or No contact with birds, August 2015[J]. PLoS Curr, 2018, 10: ecurrents.outbreaks.b646c3bb2b4f0e3397183f31823bbca6. DOI:10.1371/currents.outbreaks.b646c3bb2b4f0e3397183f31823bbca6 |
| [10] | Cong W, Huang SY, Zhang XY, et al. Seroprevalence of Chlamydia psittaci infection in market-sold adult chickens, ducks and pigeons in north-western China[J]. J Med Microbiol, 2013, 62(Pt 8): 1211-1214. DOI:10.1099/jmm.0.059287-0 |
| [11] | Chau S, Tso EYK, Leung WS, et al. Three cases of atypical pneumonia caused by Chlamydophila psittaci[J]. Hong Kong Med J, 2015, 21(3): 272-275. DOI:10.12809/hkmj144321 |
| [12] | de Gier B, Hogerwerf L, Dijkstra F, et al. Disease burden of psittacosis in the Netherlands[J]. Epidemiol Infect, 2018, 146(3): 303-305. DOI:10.1017/S0950268817003065 |
| [13] | Zhang AB, Xia XQ, Yuan XL, et al. Clinical characteristics of 14 cases of severe Chlamydia psittaci pneumonia diagnosed by metagenomic next-generation sequencing: a case series[J]. Medicine (Baltimore), 2022, 101(24): e29238. DOI:10.1097/MD.0000000000029238 |
| [14] | Knittler MR, Sachse K. Chlamydia psittaci: update on an underestimated zoonotic agent[J]. Pathog Dis, 2015, 73(1): 1-15. DOI:10.1093/femspd/ftu007 |
| [15] | Chen XC, Cao K, Wei Y, et al. Metagenomic next-generation sequencing in the diagnosis of severe pneumonias caused by Chlamydia psittaci[J]. Infection, 2020, 48(4): 535-542. DOI:10.1007/s15010-020-01429-0 |
| [16] | 徐秀丹, 焦鹏, 翟盈盈. 宏基因组二代测序技术在重症患者病原学诊断中的应用价值[J]. 中华急诊医学杂志, 2024, 33(3): 377-381. DOI:10.3760/cma.j.issn.1671-0282.2024.03.019 |
| [17] | Schlaberg R, Chiu CY, Miller S, et al. Validation of metagenomic next-generation sequencing tests for universal pathogen detection[J]. Arch Pathol Lab Med, 2017, 141(6): 776-786. DOI:10.5858/arpa.2016-0539-RA |
| [18] | Gu L, Liu W, Ru M, et al. The application of metagenomic next-generation sequencing in diagnosing Chlamydia psittaci pneumonia: a report of five cases[J]. BMC Pulm Med, 2020, 20(1): 65. DOI:10.1186/s12890-020-1098-x |
| [19] | Cillóniz C, Torres A, Niederman M, et al. Community-acquired pneumonia related to intracellular pathogens[J]. Intensive Care Med, 2016, 42(9): 1374-1386. DOI:10.1007/s00134-016-4394-4 |
| [20] | Gasparrini AJ, Markley JL, Kumar H, et al. Tetracycline-inactivating enzymes from environmental, human commensal, and pathogenic bacteria cause broad-spectrum tetracycline resistance[J]. Commun Biol, 2020, 3(1): 241. DOI:10.1038/s42003-020-0966-5 |
| [21] | DE Boeck C, Dehollogne C, Dumont A, et al. Managing a cluster outbreak of psittacosis in Belgium linked to a pet shop visit in The Netherlands[J]. Epidemiol Infect, 2016, 144(8): 1710-1716. DOI:10.1017/S0950268815003106 |
| [22] | Yang FX, Li JJ, Qi B, et al. Clinical symptoms and outcomes of severe pneumonia caused by Chlamydia psittaci in southwest China[J]. Front Cell Infect Microbiol, 2022, 11: 727594. DOI:10.3389/fcimb.2021.727594 |
 2025, Vol. 34
2025, Vol. 34