虫螨腈(chlorfenapyr,CHL),又称溴虫腈,是一种新型中度危险性广谱杀虫、杀螨剂,被广泛用于农作物虫害防治[1-2]。目前市面上虫螨腈有多种剂型和混合制剂,临床常见虫螨腈混合的农药包括甲维•虫螨腈、虫螨•茚虫威、虫螨腈•噻虫胺、虱脲•虫螨腈等。
目前尚无虫螨腈中毒大规模的流行病学资料,据不完全统计,急性虫螨腈中毒病死率高达60%~80%[3]。急性虫螨腈中毒早期临床表现无特异度,且无特效解毒药,国内目前缺乏统一的急性虫螨腈中毒救治方案或指南,各医疗机构诊疗实践差异明显。因此,中国医师协会急诊医师分会等成立共识筹划工作组,在现有文献基础和临床专家经验总结上,制订了现阶段急性虫螨腈中毒诊治中国专家共识(指南共识注册编号:PREPARE-2024CN916),旨在提高医护人员对急性虫螨腈中毒的认识和形成规范诊疗。
1 制定过程与推荐依据本共识是由来自全国急诊医学、毒理学等相关领域专家所组成的多学科团队共同讨论制定,结合国内外文献报道、最新研究进展,通过函审、线下/线上讨论会等方式,反复讨论、修改后最终定稿。专家成员对推荐意见逐一进行了表决,在最终轮投票进行表决时达成一致。文中推荐分级和循证证据等级见表 1、表 2。
| 推荐强度 | 等级释义及临床建议 |
| A强 | 循证证据肯定或者良好(Ⅰ~Ⅱ级);或循证证据一般(Ⅲ~Ⅳ级),但在国内外指南中明确推荐;能够改善健康结局,利大于弊 |
| B中 | 循证证据一般(Ⅲ~Ⅳ级),可以改善健康结局 |
| C弱 | 循证证据不足或矛盾;无法明确利弊,但可能改善健康结局 |
| 证据等级 | 分级释义 |
| Ⅰ | 基于多个随机对照试验的荟萃分析或系统评价;大宗随机试验 |
| Ⅱ | 基于至少1个质量较高的随机对照试验;设计规范、结果明确的观察性研究或横断面研究;前瞻性队列研究 |
| Ⅲ | 基于设计良好的非随机性病例对照研究;观察性研究;非前瞻性队列研究 |
| Ⅳ | 基于非随机性回顾性研究;病例报告;专家共识 |
虫螨腈是新型吡咯类化合物,被世界卫生组织界定为中度危险杀虫剂。原药性状为白色粉末状固体,具有低挥发性和亲脂性,有卤化物气味[4]。纯品为白色固体,能溶于丙酮、乙醚、乙腈、醇类等有机溶剂,难溶于水[5]。虫螨腈的理化性质见表 3。
| 参数 | 虫螨腈性质 |
| 化学名称 | 4-溴基-2-(4-氯苯基)-1-(乙氧基甲基)-5-(三氟甲基)吡咯-3-腈 |
| 化学式 | C15H11BrClF3N2O |
| 结构式 | 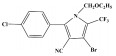 |
| CAS登记号 | 122453-73-0 |
| 相对分子质量 | 407.62 |
| 性状 | 白色粉末状固体 |
| 密度 | 0.543 g/mL |
| 稳定性 | 强碱或高温下分解释放出氢氯化物、氢氟化物和氮氧化物等有毒气体 |
| 溶解性 | 水中溶解度低,约0.11~0.14 mg/mL(pH5-9,20℃),能溶于丙酮、二甲基亚砜、二氯甲烷等有机溶剂 |
| pH | 7.16(24℃,1%水溶液) |
| 熔点 | 101.4~102.3℃ |
| WHO农药分类 | 中度危险,Ⅱ类 |
现有的研究对虫螨腈毒代动力学和毒理机制所知甚少,实验动物和暴露途径不同,大鼠急性经口半数致死量(LD50)有差异。世界粮农组织报道94.5%浓度的虫螨腈中毒雌性大鼠LD50为1 152 mg/kg,雄性大鼠LD50为441 mg/kg[6]。其他研究显示,95%质量分数的虫螨腈原药中毒雌性大鼠LD50为2 450~7 940 mg/kg,雄性大鼠LD50为223~619 mg/kg[7]。有报道人口服10%虫螨腈悬浮液5 mL可致死[8],口服10%虫螨腈10 mL可引起中枢神经系统损害[9]。
2.2.1 吸收虫螨腈可经消化道、呼吸道、皮肤及眼部吸收,其中消化道暴露途径最为常见。动物实验(大鼠,灌胃)显示虫螨腈给药后24 h吸收率约为30%,血浆达峰时间(Tmax)为8~12 h,雌性大鼠血液和组织中的浓度是雄性大鼠的2~3倍[10]。消化道途径还存在肠肝循环持续吸收[10]。
2.2.2 分布动物实验(大鼠,灌胃)显示给药7 d后检测虫螨腈浓度,90%以上的虫螨腈经循环逐渐分布于体内各组织,虫螨腈浓度由高到低依次为:脂肪 > 血液 > 肝脏 > 肾脏 > 肌肉 > 脑组织,在脂肪组织中有较高的积累[10]。中毒患者行血液灌流(hemoperfusion,HP)后可能出现组织中储存的虫螨腈再次释放入血的情况[11],临床上需警惕虫螨腈浓度的延迟升高和再分布现象。此外,虫螨腈可以穿过血脑屏障对中枢神经系统产生影响,这可能是造成后期中枢性呼吸循环衰竭的重要原因[12]。目前缺乏虫螨腈蛋白结合率和表观分布容积相关数据。
2.2.3 代谢虫螨腈主要在肝脏中代谢,主要通过N-脱烷基、脱卤、羟基化和共轭反应进行代谢,半衰期(t1/2)约为56 h(大鼠,灌胃)[10]。虫螨腈在多功能氧化酶作用后去除N-乙氧基甲基,形成溴代吡咯腈[13-14],目前认为溴代吡咯腈是直接致毒物质。国内报道了一例口服10%虫螨腈200 mL中毒患者,其血液中虫螨腈浓度在4 h、113 h、156 h分别为77.4 ng/mL、0 ng/mL、0 ng/mL,对应时段的溴代吡咯腈浓度分别为723.6 ng/mL、14 179 ng/mL、9 654.2 ng/mL[14],见表 4。
| 时点 | 血中虫螨腈浓度(ng/mL) | 血中溴代吡咯腈浓度(ng/mL) |
| 4 h | 77.4 | 723.6 |
| 113 h | 0 | 14 179 |
| 156 h | 0 | 9 654.2 |
虫螨腈在动物(大鼠,灌胃)体内24 h排泄量为70%(粪便66%,尿液4%)[10];在胆管插管动物染毒24 h后,尿液、胆汁的排泄量分别为4%~6%、17%~30%,以虫螨腈原型通过粪便排出的量为2%~19%。此外,虫螨腈还可通过乳汁排泄[15]。
推荐意见1:虫螨腈消化道暴露后吸收迅速,消化道摄入具有肠肝循环途径持续吸收。虫螨腈具有亲脂性,组织分布广泛,体内主要通过粪便、尿液、胆汁进行排泄。虫螨腈也可通过非消化道暴露吸收导致中毒。(证据等级Ⅳ,推荐强度B)
推荐意见2:临床应重视对血中虫螨腈及虫螨腈代谢产物(尤其是溴代吡咯腈)浓度的动态监测。(证据等级Ⅳ,推荐强度B)
2.3 虫螨腈中毒的毒理机制虫螨腈中毒的毒理机制尚不完全明确。虫螨腈属于弱酸质子型氧化磷酸化解偶联剂[16-17],目前认为虫螨腈进入人体后生成的活性代谢物溴代吡咯腈通过氧化磷酸化解偶联效应干扰细胞能量的产生是中毒的主要机制[17-18],其可能通过以下途径干扰细胞能量代谢:
① 阻断电子传递链:溴代吡咯腈干扰线粒体膜上的电子传递链,特别是细胞色素bc1复合物。这导致电子传递的中断,二磷酸腺苷(ADP)不能磷酸化生成三磷酸腺苷(ATP)。
② 破坏膜电位:电子传递链的中断会导致线粒体膜电位的丧失,进一步影响细胞内钙离子的平衡和能量代谢。
③ 诱导氧化应激:电子传递的中断会导致线粒体内活性氧(ROS)的增加,诱发氧化应激反应,造成细胞损伤和凋亡。
推荐意见3:急性虫螨腈中毒机制主要为氧化磷酸化解偶联,能量代谢障碍导致的多器官多系统损伤。(证据等级Ⅳ,推荐强度B)
3 虫螨腈中毒的诊断 3.1 虫螨腈接触史虫螨腈经消化道摄入、非消化道暴露(呼吸道、皮肤、眼部局部接触、腹膜及其他途径等)均可中毒,经消化道摄入中毒最为常见,自服是最主要的中毒原因,也有为数不少的呼吸道、皮肤等非消化道暴露吸收[16, 19-22],注射途径极为少见[23]。
3.2 虫螨腈中毒的临床表现急性虫螨腈中毒早期临床表现无特异度,容易被忽视。虫螨腈暴露后潜伏期为数分钟至2周,甚至更长,多数在6 h内出现症状[3, 12, 20, 22, 24-25]。经消化道摄入中毒患者,主要以恶心、呕吐、腹痛、腹泻等消化道症状为表现,并可伴有头晕等神经系统表现[26]。经皮肤、眼部或呼吸道途径中毒患者,可出现皮肤发红、眼部不适、视物模糊、咳嗽和咽部异物感等接触部位刺激的表现。虫螨腈导致的皮肤、黏膜损伤尚无循证医学证据支持,病例报道提示虫螨腈可能具有黏膜刺激性,但对皮肤无刺激性和致敏性[3, 16, 23]。
迟发性的毒性反应一般出现在中毒5~7 d后[12],主要表现为出汗或大汗、呼吸急促、高热、肌痛、肌麻痹、视力损害,甚至意识障碍、抽搐、呼吸衰竭,最终心率减慢、血压下降、心搏骤停[27-29]。
3.2.1 消化系统消化道摄入者恶心、呕吐、腹痛等症状多由初始症状持续数小时后逐渐缓解,肝功能可有丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)升高,少有严重表现。国外有虫螨腈与乙醇混合口服后发生急性胰腺炎的报道[26],可能与乙醇和虫螨腈相互作用有关。非消化道暴露者多无消化系统症状,虫螨腈注射中毒者罕见,文献报道的1例腹腔注射中毒的患者出现了腹痛、腹腔积液、小肠充血,持续数天发生肠缺血性损伤、脓毒症后,最终死亡[23]。
3.2.2 神经系统虫螨腈能通过人血-脑屏障损害神经系统,可能造成神经细胞能量耗竭和氧化损伤,具有迟发性毒性表现[20-21, 26-27, 30-33]。早期多数神志清楚,可有头晕表现,一般症状轻微,数天后演变为逐渐恶化的意识障碍、视力损害、肌肉僵硬、截瘫、癫痫等,深昏迷患者可能在数分钟至数天内死亡,出现肌肉僵硬者迅速死亡;当累及到脊髓时,存活患者还可遗留截瘫、视神经萎缩等长期损害[19, 31, 34]。影像学发现白质受累是本病例的影像学特征,多在5~7 d,主要为脑白质病变或脱髓鞘病变、脊髓弥漫性水肿及脱髓鞘病变[19, 25, 31]。核磁共振可表现为长T1长T2,液体衰减反转恢复序列(FLAIR)、弥散加权成像(DWI)高信号,表观弥散系数(ADC)低信号的双侧大脑半球白质对称性病变及全脊髓弥漫性肿胀。目前认为中枢神经系统损伤是患者死亡的主要原因之一。
3.2.3 循环系统心脏作为高耗能器官高度依赖ATP供能,虫螨腈中毒后可出现急性心肌损伤,肌钙蛋白升高[29, 35-36]。多数患者早期心血管症状并不突出,心率初始正常或增快,心电图异常指标为中毒后7~21 d出现广泛导联ST段压低,心血管系统呈进行性恶化表现,随着病程进展,在中后期可出现心动过缓、血压下降、循环衰竭最终进展为心搏停搏,且对血管活性药物治疗反应不佳。
3.2.4 呼吸系统早期无低氧血症或较轻,多数患者随病情进展呼吸速率增快,在数天后出现低氧血症,逐渐进展为呼吸频率过缓、呼吸衰竭和呼吸停止。非消化道暴露者出现低氧血症的时间可能更长,需引起重视。需有创机械通气的患者病死率极高。
3.2.5 泌尿系统多数患者病程中无明显肾损伤,一旦出现急性肾损伤[27, 32],则提示预后不良。非消化道暴露者肾功能损害较消化道暴露者似乎更轻微。
3.2.6 血液系统虫螨腈中毒患者白细胞计数多正常,部分患者可升高,尤其是中性粒细胞百分比升高[12, 37],凝血指标主要为凝血酶原时间(PT)延长[38]。
3.2.7 运动骨骼肌系统虫螨腈中毒可导致肌肉损伤,甚至横纹肌溶解[28]。肌酶指标尤以肌酸激酶(CK)升高明显[19],肌酸激酶同工酶(CK-MB)、肌红蛋白(MYO)等也可不同程度升高。消化道暴露患者由于短期内接触较大剂量虫螨腈,CK峰值可能更高。一些虫螨腈中毒患者死亡前出现肌肉僵硬[28, 37, 39-40],可能与中毒后ATP耗竭引起胞质中Ca2+释放及与神经损害共同作用有关。
3.2.8 能量代谢出汗与发热症状较为常见。初期多为出汗,而后出现发热,中毒患者可表现为出汗。数小时至数天后,无寒战前兆下体温进行性、延迟性升高达到高热或超高热。高热的患者多数在数分钟至数天内经历大汗和出汗量逐渐减少甚至不出汗后出现难以逆转心搏骤停。从病例报道和临床观察,体温超过38.5℃者,多预后不良[24, 37, 39]。动脉血乳酸早期通常无明显升高,在病程中后期阶段随着糖酵解增加、机体代谢功能障碍、能量逐渐衰竭而持续升高,内环境状态迅速恶化。
推荐意见4:虫螨腈消化道暴露潜伏期为数分钟至2周;多数在6 h内出现早期症状;后期危重的表现为以进行性高热、大汗、神经系统异常、骨骼肌及心肌损伤为主的中毒综合征;严重者最终因难以逆转的心搏骤停死亡。(证据等级Ⅳ,推荐强度A)
推荐意见5:中毒损伤具有延迟性,不良预后的表征为出现高热、意识障碍、肌肉僵硬、急性心力衰竭及循环衰竭。(证据等级Ⅳ,推荐强度A)
3.3 虫螨腈中毒的辅助检查 3.3.1 毒物检测对血液、尿液、胃内容物及残留毒物进行检测是虫螨腈中毒临床确诊的重要依据。毒检可明确诊断并帮助判断预后,但随着时间推移,毒物浓度可能会出现波动。因此应尽早检测,以评估患者的中毒剂量,有利于判断预后;并且在治疗中建议动态检测,以评价治疗效果。虫螨腈定量检测可采用气相色谱法、高效液相色谱法、气相色谱-质谱联用、液相色谱-质谱联用、高效液相色谱-质谱联用等方法[41-44]。由于溴代吡咯腈是虫螨腈的毒性代谢产物,建议与虫螨腈本体一起检测。
推荐意见6:对怀疑虫螨腈中毒患者,若有条件应立即对血、尿、胃内容物及残留毒物进行虫螨腈及代谢产物进行检测,之后酌情调整检测频次,指导诊治。(证据等级Ⅳ,推荐强度A)
3.3.2 常规检查入院后迅速完成相关检验进行急诊评估,包括动脉血气、血常规、尿常规、凝血功能、肌酶谱、心肌损伤标志物、脑钠肽、淀粉酶、脂肪酶、降钙素原、胆碱酯酶、血液肌酶指标等检验;动态监测体温、呼吸频率、指脉氧饱和度,完善心电图,结合心肌损伤标志物,评估有无心律失常及心肌损伤;监测ALT、AST、乳酸脱氢酶(LDH)和胆红素等肝功能指标;监测血清肌酐(Cr)、尿素氮(BUN)、血清胱抑素C(cystatin C)等肾功能指标;根据病情完善胸部、腹部CT检查。
若有意识障碍或其他神经系统相关的症状体征,则进行颅脑、脊髓CT或MRI等检查。头颅MRI提示脑白质受累是本病的影像学特征[25, 38, 45-47],主要异常指标为脑白质病变或脱髓鞘病变、脊髓弥漫性水肿及脱髓鞘病变[32, 48],见图 1。
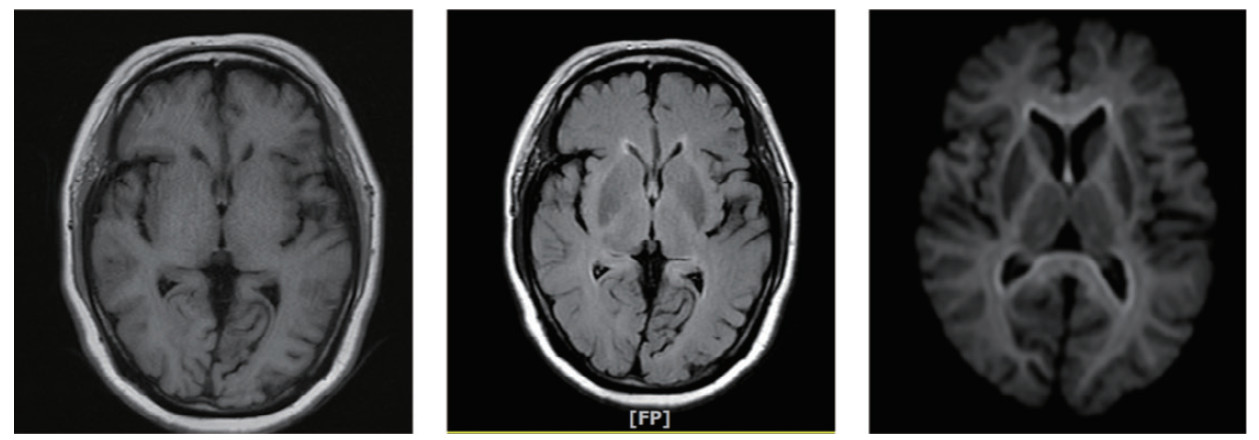
|
| 图 1 虫螨腈中毒患者中毒7 d后头颅MRI |
|
|
推荐意见7:入院迅速完成动脉血气、肌酶谱、心肌损伤标志物等急诊评估;并动态监测生命体征、实验室指标及必要的影像学检查。(证据等级Ⅳ,推荐强度A)
推荐意见8:出现神经系统症状体征者,及时行颅脑、脊髓CT或MRI检查,必要时复查;无神经系统症状者中毒后5~7d亦应完成上述检查。(证据等级Ⅳ,推荐强度A)
3.4 虫螨腈中毒的诊断急性虫螨腈中毒的诊断主要根据毒物接触史、临床表现、实验室毒物检测及辅助检查结果,急性虫螨腈中毒诊断时应考虑以下原则。
疑似诊断:具有急性虫螨腈中毒的相关临床表现,缺乏虫螨腈暴露史或不能明确暴露史及缺乏毒物检测证据,其他疾病难以解释的临床表现,可作为疑似诊断;具有虫螨腈急性暴露史,即使暂无相关临床表现,仍考虑疑似诊断。
临床诊断:虫螨腈急性暴露史明确伴有临床表现,并排除有相似临床表现的其他中毒或疾病,即可做出急性虫螨腈中毒的临床诊断。
临床确诊:在临床诊断的基础上有明确的虫螨腈毒物检测证据,即便缺乏虫螨腈毒物暴露史,诊断仍然成立;有虫螨腈毒物检测证据,而无明显临床表现,诊断也仍然成立。
急性虫螨腈中毒鉴别诊断确切依据是毒物检测,临床鉴别诊断应考虑以下两种情况:①影响能量代谢的其他氧化磷酸化解偶联毒物:如2-4二硝基苯酚(DNP)、硝氯酚、五氯酚(PCP)等;②引起高热和(或)出汗的其他疾病:如热射病、恶性高热、其他感染或非感染性疾病等。
推荐意见9:仅具有虫螨腈中毒相关临床表现,或仅虫螨腈消化道暴露但无症状者,均应考虑疑似诊断;有虫螨腈暴露及相应表现,考虑临床诊断;毒物检测阳性即临床确诊。(证据等级Ⅳ,推荐强度A)
3.5 虫螨腈中毒病情分型根据患者临床表现中毒可分为轻型、危重型、暴发型(见表 5)。
| 分型 | 临床表现 | 预后 |
| 轻型 | 病程中无明显症状,或仅有恶心、呕吐、腹痛等消化道症状。 | 大多数患者可痊愈不遗留后遗症。 |
| 危重型 | 在数小时至5 d后出现发热,表现为延迟性、进行性体温升高; 头晕、头痛、视物模糊等神经系统症状可在5~12 d后演变为逐渐恶化的意识障碍; 中毒7~21 d心电图出现ST压低、T波改变,后期出现心动过缓、循环衰竭; 中毒7 d后动脉血气分析可出现低氧血症,血氧饱和度降低。 |
多数患者在21 d内死亡,部分患者经治疗可存活,存活者少数可遗留视神经萎缩、截瘫、认知障碍等后遗症。 |
| 暴发型 | 中毒数小时至数天出现高热或超高热;意识状态快速进展为昏迷,查体可有腱反射消失;肌肉僵硬是濒死期表现,迅速死亡; 中毒数天内出现呼吸衰竭、循环衰竭,且难以纠正。 |
大多数患者于数小时至数天内死亡,很少存活。 |
推荐意见10:虫螨腈中毒依症状及体征分为轻型、危重型、暴发型,以指导治疗及评估预后。需动态监测与综合评估,警惕轻型向危重型转化。(证据等级Ⅳ,推荐强度A)
4 虫螨腈中毒的治疗虫螨腈中毒目前尚无特效解毒剂,治疗原则主要包括减少毒物吸收,促进毒物排出,以及改善能量代谢、抗氧化及对症支持等治疗,常需上述治疗措施联合应用。见图 2。
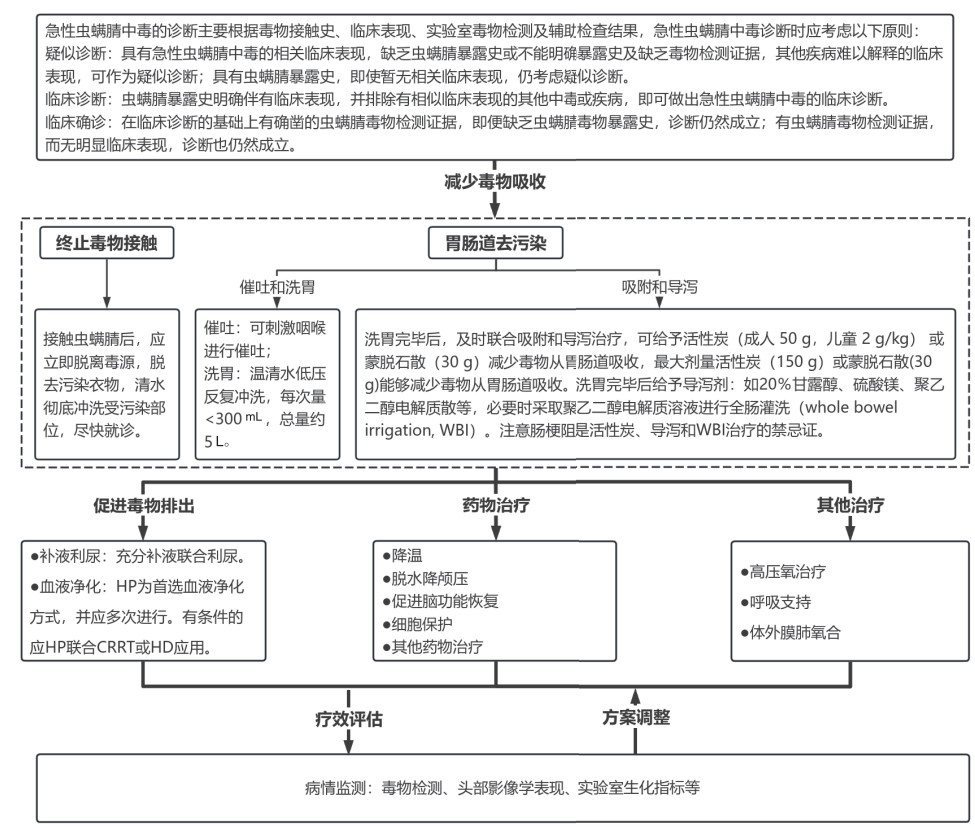
|
| 图 2 急性虫螨腈中毒诊疗流程 |
|
|
接触虫螨腈后,应立即脱离毒源,脱去污染衣物,清水彻底冲洗受污染部位,尽快就诊。
4.1.2 胃肠道去污染院前急救时可刺激咽喉进行催吐,入院后应尽快行洗胃、吸附和导泻。
口服中毒患者应积极行胃肠道毒物清除,主要措施包括:洗胃、吸附、导泻和全肠灌洗。建议尽早洗胃,可用温清水洗胃,建议采用低压力进行反复冲洗,每次洗胃液 < 300 mL,总量约5 L,1 h内对毒物清除的效果最佳,对有胃排空障碍或摄入量大的患者,6 h仍可考虑洗胃。洗胃完毕后,及时联合吸附和导泻治疗,可给予活性炭(成人50 g,儿童2 g/kg)或蒙脱石散(30 g)减少毒物从胃肠道吸收,最大剂量活性炭(150 g)或蒙脱石散(30 g)能够减少毒物从胃肠道吸收。洗胃完毕后给予导泻剂,如20%甘露醇、聚乙二醇电解质散等,必要时采取聚乙二醇电解质溶液进行全肠灌洗(whole bowel irrigation, WBI)。注意肠梗阻是活性炭、导泻和WBI治疗的禁忌证[49]。
推荐意见11:及时终止毒物接触,尽早催吐和洗胃,实施洗胃最好在服毒后1 h内进行,洗胃完毕后及时给予吸附和导泻药物。(证据等级Ⅳ,推荐强度A)
4.2 促进毒物排出清除循环中虫螨腈的主要措施为:强化利尿,血液净化。
4.2.1 补液利尿在患者机体条件允许的情况下,充分补液联合利尿有利于促进虫螨腈的排泄,利尿后应注意维持水和电解质平衡。
4.2.2 血液净化虫螨腈相对分子质量较小,脂溶性较高,理论上可以经血液灌流(hemoperfusion, HP)、血液透析(hemodialysis, HD)及血浆置换(plasma exchange, PE)清除。HP可有效吸附血液中的中、大分子毒素,有效清除虫螨腈中毒患者体内毒素,减少组织对毒物的摄取和蓄积[50-51],是治疗虫螨腈中毒的有效手段[52-53],也是国内最常用的血液净化方法,应在入院后尽早开展。
中毒早期应积极给予HP治疗并多次进行[12, 54],国外有学者认为应在中毒早期予以HD治疗[23, 55],也有认为HD对于中毒晚期可能有一定疗效[3]。根据病例报道资料及多个国内临床中毒救治中心的有限经验,认为早期行血液净化联合序贯式应用可能较单一模式更有益患者,尤其是HP联合其他血液净化方式是虫螨腈中毒救治成功的重要举措[52, 56-58]。当合并急性肾功能损伤或代谢性酸中毒时,应当联合肾脏替代治疗(continuous renal replacement therapy, CRRT)[16, 28]。血浆置换的治疗应用较少。血液净化实施过程中动态评估患者器官功能,有条件者监测血浆毒物浓度,指导病情评估及治疗。目前尚不清楚终止血液净化的虫螨腈及代谢产物的血液阈值,关于虫螨腈中毒的血液净化指征、方式方法、疗程等需进一步完善。由于虫螨腈及其代谢产物脂溶性强,可在血液净化前静脉使用脂肪乳,将脂肪组织中聚积的毒物萃取至血液中,以提高血液净化效率。
推荐意见12:消化道虫螨腈暴露患者推荐尽早行血液净化治疗,首选模式为血液灌流,有条件者可联合血液滤过、血液透析等,反复、多次进行效果更好。(证据等级Ⅳ,推荐强度A)
4.3 药物治疗目前常用药物治疗包括细胞保护、营养支持、促进脑功能恢复和对症支持治疗[59]。
4.3.1 细胞保护补充外源性ATP,巯基化合物等巯基类药物,抗氧化剂如乙酰半胱氨酸、还原性谷胱甘肽、辅酶Q等药物的应用理论上有益,可根据病情需要合理联合应用。
4.3.2 营养支持虫螨腈中毒患者能量产生效率降低,重症患者有高热、大汗,应加强营养支持,保证充分的能量供应,维持水电解质平衡。营养支持时应适时评估患者容量状态,警惕高热、大汗所致低容量发生,也应避免大量补液、心功能恶化所致的容量过负荷。
4.3.3 促进脑功能恢复虫螨腈可穿过血脑屏障对中枢系统造成损伤,也是中毒患者死亡的主要原因之一,存活患者中可遗留神经功能障碍。如果出现谵妄、嗜睡、意识改变等可能提示脑水肿,应积极脱水降颅压,根据患者肾功能情况合理应用甘露醇或呋塞米,应注意不要加重患者的低容量状态。可尝试使用有助于改善脑细胞代谢和促进神经功能恢复的药物。
4.4 其他对症支持治疗 4.4.1 物理降温虫螨腈中毒高热患者需迅速降温,首选物理降温,可予温水擦浴、冰毯、血管内热交换降温,CRRT也可作为一种降温措施。
4.4.2 高压氧治疗高压氧适用于脑及脊髓损伤、中毒导致的神经脱髓鞘疾病等的治疗[60-63],对虫螨腈中毒神经脱髓鞘病变可试用。
4.4.3 呼吸支持患者出现低氧血症时,可成为氧疗指征,必要时考虑人工气道、机械通气治疗。
推荐意见13:虫螨腈中毒患者可尝试予改善细胞能量代谢的药物,并进行综合对症支持治疗。(证据等级Ⅳ,推荐强度B)
推荐意见14:高热患者需迅速采取降温措施,首选物理降温。(证据等级Ⅳ,推荐强度A)
5 虫螨腈中毒的预后评估接触剂量是急性虫螨腈中毒预后最重要的影响因素,接触剂量越大,血、尿中虫螨腈及其代谢产物浓度越高,则临床分型越重,预后越差(表 5)。虫螨腈的中毒方式和治疗启动时间也是预后的影响因素。空腹服毒毒物吸收快,症状来势急骤;口含未吞咽服下者也可中毒,但较胃肠道摄入者起病缓。肌酸激酶亦是判断预后的重要指标,越早出现指标异常提示预后越不佳。出现体温 > 38.5℃及意识障碍者预后不良。毒物清除治疗的方法及其启动时间也可影响其预后,尤其是血液净化。早期进行包括HP在内的血液净化治疗可改善虫螨腈中毒的预后。
目前尚缺乏虫螨腈中毒预后的临床预测模型。中毒严重程度评分(poisoning severity score,PSS)、新中毒病死率评分系统(new-poisoning mortality scoring system,new-PMS)可能有助于临床决策,但实际预测效能仍有待临床实践验证。
上述各种预测结果对预后的判断仅供临床参考,不能仅以此作为放弃治疗的依据。
6 随访虫螨腈中毒存活者的随访要点在于神经系统监测,存活患者可能遗留截瘫、认知功能和神经系统改变,应进行至少半年的随访,关注有无四肢肌力和认知功能改变。定期头颅、脊髓MRI,肌电图,四肢肌力检查,视力检查,心肌酶、血乳酸、肾功能、肝功能等脏器指标评估,及早康复干预。
推荐意见15:存活患者至少进行半年随访,随访要点在于神经系统功能。(证据等级Ⅳ,推荐强度A)
7 预防开展宣传教育,加强农药管制,避免有自杀倾向人群接触虫螨腈。严格安全生产和更新设备工艺,减少虫螨腈生产中的接触,特别要加强农业作业中的防护,呼吸道、眼部、皮肤黏膜尤为重要,不慎接触后应立即进行充分擦拭、冲洗,并立即就医。
本共识主要基于文献复习及专家临床实践经验,由于虫螨腈中毒文献数量不多,相关实验研究及临床证据较少,本共识难免不足,有待更多的循证医学证据以期更新完善。
执笔人 陈潇荣(温州医科大学附属第一医院)王逸平(温州医科大学附属第一医院)宗良(北京协和医院)宫玉(河北医科大学第二医院)高艳霞(郑州大学第一附属医院)郑粉双(云南大学附属医院)程岳雷(山东第一医科大学附属中心医院)
参与共识制订专家:(按姓名汉语拼音为序):蔡洪流(浙江大学医学院附属第一医院)蔡文伟(浙江省人民医院)曹钰(四川大学华西医院)曾红科(广东省人民医院)柴艳芬(天津医科大学总医院)陈晨松(象山县第一人民医院医疗健康集团)陈大庆(温州医科大学附属第二医院)陈宏毅(福州大学附属省立医院)陈明泉(复旦大学附属华山医院)崇巍(中国医科大学附属第一医院)单仁飞(浙江省台州医院)邓颖(哈尔滨医科大学附属第二医院)杜力文(宁波市第二医院)樊毫军(天津大学卫生应学院)方邦江(上海中医药大学附属龙华医院)甘永雄(宁波大学附属第一医院)高洪(云南省曲靖市第一人民医院)高艳霞(郑州大学第一附属医院)郭树彬(北京朝阳医院)韩小彤(湖南省人民医院)何小军(中华急诊医学杂志编辑部)何许伟(丽水市人民医院)贺鹤群(宁波大学附属第一医院)黄亮(南昌大学第一附属医院)黄明伟(金华市中心医院)蒋龙元(中山大学孙逸仙纪念医院)兰超(郑州大学第一附属医院)兰频(温州医科大学附属第五医院)李波(昆明医科大学第一附属医院)李小刚(中南大学湘雅医院)李毅(北京协和医院)梁欢(西安交通大学第一附属医院)刘刚(重医附属大学城医院)刘明华(陆军军医大学西南医院)刘鹏(宁波市第二医院)刘雪兰(宁波市医疗中心李惠利医院)卢中秋(温州医科大学附属第一医院)吕传柱(四川省医学科学院·四川省人民医院)马岳峰(浙江大学医学院附属第二医院)毛恩强(上海交通大学医学院附属瑞金医院)牟雄能(台州市第一人民医院)聂时南(东部战区总医院)潘曙明(上海中医药大学附属普陀医院)钱传云(昆明医科大学第一附属医院)秦历杰(河南省人民医院)商德亚(山东省立医院)史继学(山东第一医科大学第二附属医院)宋维(海南省人民医院)田英平(河北医科大学第二医院)魏捷(武汉大学人民医院)吴斌(温州医科大学附属第一医院)吴冬(济宁市第一人民医院)邢吉红(吉林大学第一医院)徐峰(山东大学齐鲁医院)徐军(北京协和医院)杨建中(新疆医科大学第一附属医院)杨立山(宁夏医科大学总医院)杨梅(曲靖市第一人民医院)姚咏明(中国人民解放军总医院第四医学中心)于学忠(北京协和医院)张泓(安徽医科大学第一附属医院)张玮(昆明医科大学第一附属医院)张新超(北京医院)赵光举(温州医科大学附属第一医院)赵敏(中国医科大学附属盛京医院)赵晓东(中国人民解放军总医院第四医学中心)郑粉双(云南大学附属医院)郑悦亮(浙江省人民医院)郑贞苍(台州市中心医院)周荣斌(解放军总医院第七医学中心)朱保锋(南通市第一人民医院)朱华栋(北京协和医院)
利益冲突 所有作者声明无利益冲突
| [1] | Li H, Sun FS, Hu S, et al. Determination of market, field samples, and dietary risk assessment of chlorfenapyr and tralopyril in 16 crops[J]. Foods, 2022, 11(9): 1246. DOI:10.3390/foods11091246 |
| [2] | Raghavendra K, Barik TK, Sharma P, et al. Chlorfenapyr: a new insecticide with novel mode of action can control pyrethroid resistant malaria vectors[J]. Malar J, 2011, 10: 16. DOI:10.1186/1475-2875-10-16 |
| [3] | Chien SC, Chien SC, Su YJ. A fatal case of chlorfenapyr poisoning and a review of the literature[J]. J Int Med Res, 2022, 50(9): 3000605221121965. DOI:10.1177/03000605221121965 |
| [4] | Comstock GT, Nguyen H, Bronstein A, et al. Chlorfenapyr poisoning: a systematic review[J]. Clin Toxicol (Phila), 2024, 62(7): 412-424. DOI:10.1080/15563650.2024.2367658 |
| [5] | Huang P, Yan XY, Yu B, et al. A comprehensive review of the current knowledge of chlorfenapyr: synthesis, mode of action, resistance, and environmental toxicology[J]. Molecules, 2023, 28(22): 7673. DOI:10.3390/molecules28227673 |
| [6] | Lowe CA. (1993). Oral LD50 study in albino rats with AC 303, 630 technical. Unpublished report no. CK-411-001[R]. American Cyanamid Co., Princeton, NJ, USA. Submitted to WHO by BASF. |
| [7] | 殷霄, 陈晓燕, 刘莉莉, 等. 虫螨腈原药致畸毒性实验研究[J]. 中国职业医学, 2014, 41(3): 276-281. DOI:10.11763/j.issn.2095-2619.2014.03.007 |
| [8] | 宫玉, 孟庆冰, 刘亮, 等. 警惕高致死性杀虫剂虫螨腈中毒(附四例病例及文献复习)[J]. 中华劳动卫生职业病杂志, 2021, 39(9): 689-693. DOI:10.3760/cma.j.cn121094-20210513-00251 |
| [9] | Qiu C, Sun H, Xiao H, et al. Clinical and ct manifestations of delayed toxic encephalopathy caused by low-dose chlorfenapyr poisoning: a case report[J]. Longdom Publishing SL, 2021. |
| [10] | WHO. Inventory of evaluations performed by the Joint Meeting on Pesticide Residues (JMPR) (2012) [EB/OL]. [2023-08-03]. https://apps.who.int/pesticide-residues-jmpr-database/Document/53. |
| [11] | 黄钰, 刘焕皓, 车智浩. 虫螨腈中毒后迟发毒性反应致死一例[J]. 中华急诊医学杂志, 2020, 29(1): 131-132. DOI:10.3760/cma.j.issn.1671-0282.2020.01.021 |
| [12] | Zhang SJ, Wang X, Yang X, et al. Toxicokinetics, in vivo Metabolic profiling and tissue distribution of chlorfenapyr in mice[J]. Arch Toxicol, 2024, 98(11): 3763-3775. DOI:10.1007/s00204-024-03846-8 |
| [13] | Dalling T. Tranter v. food and agriculture organization of the united nations[J]. Int Law Rep, 1957, 21: 388-398. DOI:10.1017/cbo9781316151488.163 |
| [14] | Chung MJ, Mao YC, Hsu CT, et al. A fatal case of chlorfenapyr poisoning and the therapeutic implications of serum chlorfenapyr and tralopyril levels[J]. Medicina (Kaunas), 2022, 58(11): 1630. DOI:10.3390/medicina58111630 |
| [15] | Agency USEP. US EPA ARCHIVE DOCUMENT[EB/OL]. [2023-10-06]. https://archive.epa.gov/opprd001/chlorfenapyr/web/pdf/memohed2[J]. |
| [16] | Han SK, Yeom SR, Lee SH, et al. A fatal case of chlorfenapyr poisoning following dermal exposure[J]. HongKong J Emerg Med, 2019, 26(6): 375-378. DOI:10.1177/1024907918782065 |
| [17] | 张洪鑫, 宫玉, 孟娜, 等. 氧化磷酸化解偶联剂中毒临床诊治进展[J]. 中华急诊医学杂志, 2023, 32(3): 438-443. DOI:10.3760/cma.j.issn.1671-0282.2023.03.033 |
| [18] | Periasamy S, Deng JF, Liu MY. Who is the real killer?Chlorfenapyr or detergent micelle-chlorfenapyr complex?[J]. Xenobiotica, 2017, 47(9): 833-835. DOI:10.1080/00498254.2016.1236300 |
| [19] | Cheng YL, Zhao YL, Li H, et al. A clinical warning in the treatment of chlorfenapyr poisoning[J]. Toxicol Rep, 2024, 13: 101703. DOI:10.1016/j.toxrep.2024.101703 |
| [20] | Kang C, Kim DH, Kim SC, et al. A patient fatality following the ingestion of a small amount of chlorfenapyr[J]. J Emerg Trauma Shock, 2014, 7(3): 239-241. DOI:10.4103/0974-2700.136874 |
| [21] | Hoshiko M, Naito S, Koga M, et al. Case report of acute death on the 7th day due to exposure to the vapor of the insecticide chlorfenapyr[J]. Chudoku Kenkyu, 2007, 20(2): 131-136. |
| [22] | 安亚青, 苏建玲, 门奕娇, 等. 虫螨腈工作环境暴露中毒后死亡一例分析[J]. 中华危重症医学杂志(电子版), 2023, 16(3): 254-255. |
| [23] | Lee JN, Lee JH, Baek JM, et al. Toxicity from intra-abdominal injection of chlorfenapyr[J]. Case Rep Emerg Med, 2013, 2013: 425179. DOI:10.1155/2013/425179 |
| [24] | 宫玉, 孟庆冰, 刘亮, 等. 警惕高致死性杀虫剂虫螨腈中毒(附四例病例及文献复习)[J]. 中华劳动卫生职业病杂志, 2021, 39(9): 689-693. DOI:10.3760/cma.j.cn121094-20210513-00251 |
| [25] | Baek BH, Kim SK, Yoon W, et al. Chlorfenapyr-induced toxic leukoencephalopathy with radiologic reversibility: a case report and literature review[J]. Korean J Radiol, 2016, 17(2): 277-280. DOI:10.3348/kjr.2016.17.2.277 |
| [26] | Ku JE, Joo YS, You JS, et al. A case of survival after chlorfenapyr intoxication with acute pancreatitis[J]. Clin Exp Emerg Med, 2015, 2(1): 63-66. DOI:10.15441/ceem.15.004 |
| [27] | Choi UT, Kang GH, Jang YS, et al. Fatality from acute chlorfenapyr poisoning[J]. Clin Toxicol (Phila), 2010, 48(5): 458-459. DOI:10.3109/15563651003750074 |
| [28] | Zhang SY, Deng YX, Gao Y. Malignant hyperthermia-like syndrome in acute chlorfenapyr poisoning - A case report[J]. Heliyon, 2022, 8(8). DOI:10.1016/j.heliyon.2022.e10051 |
| [29] | 李田, 苗俊东, 张再伟. 虫螨腈中毒诱发急性心肌损伤合并窦性停搏一例[J]. 中国循环杂志, 2020, 35(2): 198-200. DOI:10.3969/j.issn.1000-3614.2020.02.017 |
| [30] | Lin, Chun-Chi, Yang, Chen-Chang. Delayed and fatal toxicity of chlorfenapyr. Clinical toxicology: the official journal of the American Academy of Clinical Toxicology and European Association of Poisons Centres and Clinical Toxicologists. 2017. |
| [31] | 朱珊, 艾明达, 许虹, 等. 虫螨-茚虫威中毒致迟发性中枢神经系统损害一例[J]. 中华神经科杂志, 2021, 54(10): 1055-1058. DOI:10.3760/cma.j.cn113694-20210412-00252 |
| [32] | Tharaknath VR, Prabhakar YS, Kumar KS, et al. Clinical and radiological findings in chlorfenapyr poisoning[J]. Ann Indian Acad Neurol, 2013, 16(2): 252-254. DOI:10.4103/0972-2327.112486 |
| [33] | Kim IS, Kim JH, Kim JB, et al. Chlorfenapyr intoxication manifested by extensive leukoencephalomyelopathy[J]. J Korean Neurol Assoc, 2018, 36(4): 390-392. DOI:10.17340/jkna.2018.4.28 |
| [34] | Park SJ, Jung JU, Kang YK, et al. Toxic optic neuropathy caused by chlorfenapyr poisoning[J]. J Korean Ophthalmol Soc, 2018, 59(11): 1097. DOI:10.3341/jkos.2018.59.11.1097 |
| [35] | 张维锋, 马艳梅, 张文军, 等. 急性甲维·虫螨腈杀虫剂中毒1例[J]. 中国乡村医药, 2018, 25(5): 45. DOI:10.19542/j.cnki.1006-5180.001385 |
| [36] | Ren YH, He X, Yan XY, et al. Unravelling the polytoxicology of chlorfenapyr on non-target HepG2 cells: the involvement of mitochondria-mediated programmed cell death and DNA damage[J]. Molecules, 2022, 27(17): 5722. DOI:10.3390/molecules27175722 |
| [37] | 蒲艳, 余成敏, 蒋星慧, 等. 虫螨腈中毒4例分析并文献回顾[J]. 中国中西医结合急救杂志, 2021, 28(5): 613-617. DOI:10.3969/j.issn.1008-9691.2021.05.022 |
| [38] | Yao DF. Brain damage caused by chlorfenapyr poisoning: a case report and literature review[J]. Signa Vitae, 2021. DOI:10.22514/sv.2021.092 |
| [39] | 廖国豪, 余红雨, 鲍立杰, 等. 急性虫螨腈中毒2例及文献复习[J]. 中华劳动卫生职业病杂志, 2022, 40(3): 212-216. DOI:10.3760/cma.j.cn121094-20210721-00366 |
| [40] | 李祥虎, 姚群梅, 起连珍. 口服虫螨腈中毒后"冰僵" 样死亡一例[J]. 中华急诊医学杂志, 2021, 30(7): 894-897. DOI:10.3760/cma.j.issn.1671-0282.2021.07.023 |
| [41] | 张云琛, 杨雪群, 胡艺英, 等. 虫螨腈中毒文献病例分析[J]. 中华卫生杀虫药械, 2021, 27(5): 400-403. DOI:10.19821/j.1671-2781.2021.05.003 |
| [42] | 刘晓鹏, 刘秋蕊, 马翠华. 气相色谱-质谱法测定辣椒中虫螨腈残留及消解动态[J]. 山东农业大学学报(自然科学版), 2022, 53(4): 543-547. DOI:10.3969/j.issn.1000-2324.2022.04.007 |
| [43] | 王坦, 孙强, 沈沁怡, 等. 超高压液相色谱法测定水果和蔬菜中虫螨腈及其代谢物以及在甘蓝中的残留评价应用[J]. 分析测试学报, 2021, 40(12): 1706-1712. DOI:10.19969/j.fxcsxb.21032403 |
| [44] | 高玉雪, 于晓龙, 冷金蔓, 等. 气相色谱-质谱法测定马铃薯中虫螨腈的残留量[J]. 农药, 2021, 60(6): 432-435. DOI:10.16820/j.cnki.1006-0413.2021.06.010 |
| [45] | Filley CM, McConnell BV, Anderson CA. The expanding prominence of toxic leukoencephalopathy[J]. J Neuropsychiatry Clin Neurosci, 2017, 29(4): 308-318. DOI:10.1176/appi.neuropsych.17010006 |
| [46] | Kim JH, Park NH, Park JY, et al. Magnetic resonance imaging and clinical features of chlorfenapyr-induced toxic leukoencephalopathy: a case report[J]. Taehan Yongsang Uihakhoe Chi, 2020, 81(4): 985-989. DOI:10.3348/jksr.2020.81.4.985 |
| [47] | Chen GZ, Luo S, Zhou CS, et al. Digital subtraction CT angiography for the detection of posterior inferior cerebellar artery aneurysms: comparison with digital subtraction angiography[J]. Eur Radiol, 2017, 27(9): 3744-3751. DOI:10.1007/s00330-017-4771-6 |
| [48] | Kodavanti PR. Neurotoxicity of persistent organic pollutants: possible mode(s) of action and further considerations[J]. Dose Response, 2006, 3(3): 273-305. DOI:10.2203/dose-response.003.03.002 |
| [49] | Magalhães N, Carvalho F, Dinis-Oliveira RJ. Human and experimental toxicology of diquat poisoning: Toxicokinetics, mechanisms of toxicity, clinical features, and treatment[J]. Hum Exp Toxicol, 2018, 37(11): 1131-1160. DOI:10.1177/0960327118765330 |
| [50] | Goodman JW, Goldfarb DS. The role of continuous renal replacement therapy in the treatment of poisoning[J]. Semin Dial, 2006, 19(5): 402-407. DOI:10.1111/j.1525-139X.2006.00194.x |
| [51] | 时育彤, 毛征生, 陈峰, 等. 血液净化对急性虫螨腈中毒的清除效果评价[J]. 中华急诊医学杂志, 2023, 32(2): 215-219. DOI:10.3760/cma.j.issn.1671-0282.2023.02.015 |
| [52] | 孟娜, 宫玉, 靳英利, 等. 血液净化对虫螨腈清除效果的研究(附1例分析)[J]. 中华劳动卫生职业病杂志, 2023, 41(11): 840-843. DOI:10.3760/cma.j.cn121094-20230328-00098 |
| [53] | 徐礼友, 骆佳艳, 季流, 等. 急性虫螨腈中毒早期持续血液灌流2例报道及文献回顾[J]. 临床急诊杂志, 2024, 25(7): 370-376. DOI:10.13201/j.issn.1009-5918.2024.07.009 |
| [54] | 吴敬芳, 谭清实, 李爽, 等. 儿童虫螨腈中毒致死一例并文献复习[J]. 中华急诊医学杂志, 2021, 30(7): 892-894. DOI:10.3760/cma.j.issn.1671-0282.2021.07.022 |
| [55] | Chomin J, Heuser W, Nogar J, et al. Delayed hyperthermia from chlorfenapyr overdose[J]. Am J Emerg Med, 2018, 36(11): 2129. DOI:10.1016/j.ajem.2018.05.035 |
| [56] | 赵波, 贺兰, 王金文, 等. 急性甲维虫螨腈中毒救治成功1例报告[J]. 中国工业医学杂志, 2021, 34(6): 515-516. DOI:10.13631/j.cnki.zggyyx.2021.06.012 |
| [57] | Cheng J, Chen YL, Wang WD, et al. Chlorfenapyr poisoning: mechanisms, clinical presentations, and treatment strategies[J]. World J Emerg Med, 2024, 15(3): 214-219. DOI:10.5847/wjem.j.1920-8642.2024.046 |
| [58] | 王逸平, 陈隆望, 赵光举, 等. 8例急性虫螨腈中毒的病例分析[J]. 中华劳动卫生职业病杂志, 2025, 43(1): 72-74. DOI:10.3760/cma.j.cn121094-20240306-00086 |
| [59] | 程岳雷, 赵云来, 李连祥, 等. 急性虫螨腈中毒基本救治通则及探讨[J]. 中国急救医学, 2023, 43(6): 497-504. DOI:10.3969/j.issn.1002-1949.2023.06.013 |
| [60] | 中国医师协会神经内科医师分会脑与脊髓损害专业委员会. CO中毒迟发性脑病诊断与治疗中国专家共识[J]. 中国神经免疫学和神经病学杂志, 2021, 28(3): 173-179. DOI:10.3969/j.issn.1006-2963.2021.03.001 |
| [61] | 中国康复医学会高压氧康复专业委员会, 解放军总医院第六医学中心. 颅脑创伤高压氧治疗的专家共识[J]. 中华航海医学与高气压医学杂志, 2021, 28(3): 271-275. DOI:10.3760/cma.j.cn311847-20190521-00123 |
| [62] | 中国人民解放军总医院第六医学中心. 中华医学会高压氧分会关于"高压氧治疗适应证与禁忌证" 的共识(2018版)[J]. 中华航海医学与高气压医学杂志, 2019, 26(1): 1-5. DOI:10.3760/cma.j.issn.1009-6906.2019.01.001 |
| [63] | 高压氧在脑复苏中的应用专家共识组. 高压氧在脑复苏中的应用专家共识[J]. 中华急诊医学杂志, 2019, 28(6): 682-690. DOI:10.3760/cma.j.issn.1671-0282.2019.06.006 |
 2025, Vol. 34
2025, Vol. 34