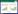2. 南京中医药大学附属无锡医院病理科,无锡 214071
2. Deportment of poothology, Wuxi Affiliated Hospital of Nanjing University of Chinese Medicine, Wuxi 214071, China
肺部感染是脓毒症的最常见原因,早期抗感染策略有助于降低病死率,但仍有接近40%的脓毒症患者出现不可控制的炎症反应、器官功能衰竭[1]。有研究表明,肠道在脓毒症发展过程中发挥了重要作用,肠道菌群紊乱、屏障功能破坏与脓毒症后续发展有着密切的关系[2-3]。中医认为“肺与大肠相表里”,提出了肺病治肠、肺肠同治的理论,在重症肺炎治疗上取的了一定的疗效[4],但其机制尚不清楚。
黄芩作为清泻肺火及上焦实热的常用中药,前期课题组观察到黄芩可能通过抑制炎症反应,保护内皮细胞,改善内毒素“二次打击”大鼠肺损伤严重程度[5],但对肠道菌群及黏膜屏障研究较少。本研究旨在基于“肺与大肠相表里”理论下,探讨内毒素“二次打击”脓毒症大鼠肠道菌群、D-乳酸及NF-κB的变化及黄芩的可能保护机制,为拓展黄芩临床应用提供理论基础。
1 材料与方法 1.1 实验动物SPF级雄性SD大鼠28只,8~9周龄,体重200~250 g,购自斯贝福(北京)生物技术有限公司提供[SCXK(京)2019-0010]。在江苏省血吸虫防治研究所实验动物中心,适应性饲养7 d,正常饮食饮水,保持昼夜节律。本实验动物伦理审查由无锡市中医医院实验动物伦理委员会批准(SSB2022110102)。
1.2 黄芩制剂制备无锡市中医医院中药房,取黄芩干制颗粒(江阴天江药业)100 g,用90℃水搅拌溶解,药液浓缩至浓度为0.4 g/mL。色谱图中具有相同保留时间色谱峰,且峰形与分离度良好。见图 1。
|
| 图 1 黄芩干制颗粒液相色谱图 Fig 1 biguid chromatography of dried Scutellaria baicalensis granules |
|
|
参照内毒素“二次打击”建立大鼠脓毒症急性肺损伤模型[6-7],具体如下:LPS按不同剂量溶于0.5 mL生理盐水中,取LPS溶液0.5 mL按1 mg/kg腹腔注射,建立脓毒症大鼠模型;16 h后用3%戊巴比妥钠40 mg/kg腹腔注射麻醉大鼠,仰位于平板上,一侧抬高60度。颈部正中手术暴露气管,“二次打击”采用LPS溶液0.5 mL,以5 mg/kg标准在无菌条件下气管内注入,将动物垂直放置30 s,以促进溶液均匀向肺部输送。假手术组予等量生理盐水。
将28只SPF级雄性SD大鼠按随机数字分为假手术组、模型组、黄芩正常剂量、高剂量组,每组7只。①黄芩正常剂量、高剂量组:术前6 h灌胃给药2 mL不同剂量(1 g/kg、4 g/kg)的黄芩煎剂,参照标准动物的体表面积等效剂量折算系数法计算给药剂量[8];②假手术组、模型组:术前经口灌胃等量生理盐水;不同分组每天给药1次,连续3 d。各组予术后第4天麻醉处死大鼠,留取组织标本。
1.4 实验试剂与仪器内毒素(lipopolysaccharide, LPS)L4268(Sigma公司);Fn试剂盒(Elabscience公司);D-乳酸试剂盒(Sigma公司);NF-κB抗体(Abcam公司);苏木精、伊红(Servicebio公司);凝胶成像仪、电泳仪、转膜仪(BioRad公司);荧光显微镜(美国莱卡公司)。
1.5 标本采集与检测 1.5.1 Fn、D-乳酸检测腹主动脉取血,低温离心收集血浆,酶联免疫吸附法检测血清Fn,D-乳酸含量。
1.5.2 肠组织HE染色取盲肠下端结肠部分,4%多聚甲醛固定,石蜡包埋、切片,苏木精和伊红染色,观察结肠组织形态学变化。
1.5.3 粪便标本检测固定大鼠,肛门周围刺激排便,放入10 mL无菌EP管中,-80℃冰箱里保存,在上海美吉生物公司完成16S rRNA基因序列分析。
1.5.4 肠组织NF-κB检测肠组织剪切成细小碎片,用PBS清洗,加入PMSF的RIPA裂解液,冰浴放置120 min,每15 min混匀一次,12 000 r/min 4℃离心20 min,提取上清液,用BCA法检测蛋白含量,参照试剂盒说明书步骤电泳、转膜、孵育,TBST洗涤、ECL发光,一体式化学发光仪拍摄照片。Image J软件系统对蛋白条带灰度值进行分析。
1.6 统计学方法应用Stata 11.0统计软件进行数据分析,正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析(LSD-t),采用Pearson相关分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 黄芩对大鼠肠道菌群的影响 2.1.1 质控分析各组的曲线平缓且相对集中,测序覆盖样本包含大部分菌种。Shannon指数越大,说明群落多样性越高,Simpson指数越大,说明群落多样性越低。
假手术组[Shannon指数(3.87±0.59)、Simpson指数(0.06±0.03)]、模型组[Shannon指数(3.79±0.21)、Simpson指数(0.06±0.01)]、黄芩正常剂量组[Shannon指数(4.33±0.31)、Simpson指数(0.11±0.1)]、高剂量组[Shannon指数(3.91±0.11)、Simpson指数(0.09±0.01)],各组均差异无统计学意义(P>0.05),表明不同剂量黄芩干预对大鼠肠道菌群多样性影响无统计学意义。
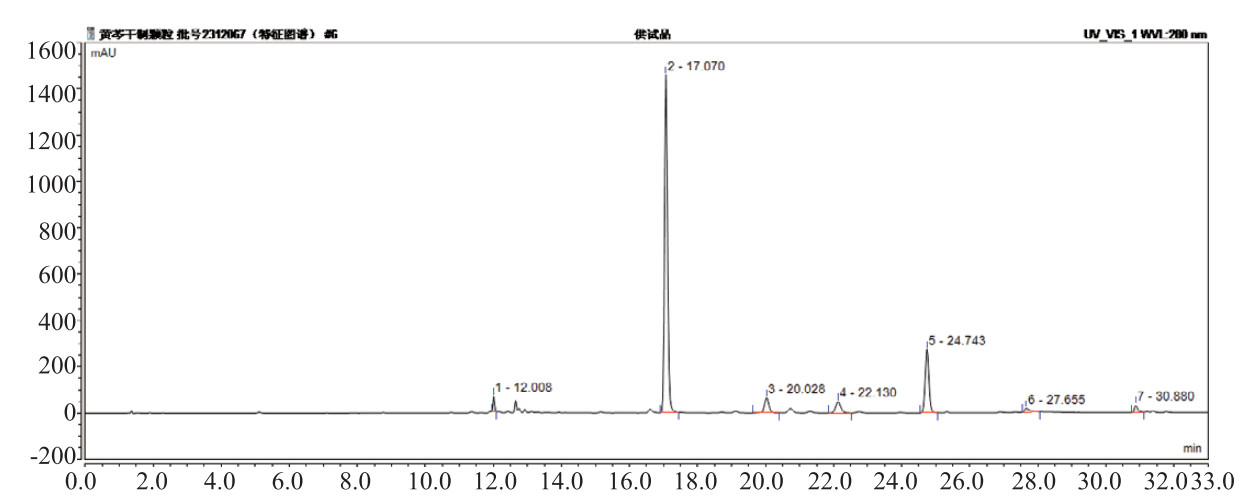
2.1.2 物种组成分析门分类水平方面,各组大鼠粪便中Firmicutes(厚壁菌门)、Bacteroidota(拟杆菌门)丰度较高,占全部微生物的90%以上;种水平上,Lactobacillus(鼠乳杆菌)丰度相对较高。
变化趋势如图所示,模型组较假手术组Firmicutes、Firmicutes/Bacteroidota、Lactobacillus下降明显(P < 0.01,P < 0.05);黄芩正常剂量、高剂量组干预后有回升明显(P < 0.01,P < 0.05);Bacteroidota模型组较假手术组上升(P < 0.01),黄芩干预后均明显下降(P < 0.01)。见表 1、图 2。
| 组别 | Firmicutes(%) | Bacteroidota(%) | Firmicutes/Bacteroidota | Lactobacillus(%) |
| 假手术组 | 88.1±3.22 | 8.63±1.65 | 10.49±1.75 | 6.02±0.89 |
| 模型组 | 68.2±2.01b | 28.6±2.11b | 2.38±0.16b | 3.49±0.51c |
| 正常剂量组 | 79.4±3.12ab | 19.5±2.86ab | 4.15±0.71cb | 17.86±2.01ab |
| 高剂量组 | 78.8±2.79ab | 19.3±2.85ab | 4.16±0.69cb | 26.41±2.14ab |
| F值 | 58.41 | 79.72 | 86.82 | 328.00 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 |
| 注:与模型组比较,aP<0.01;与假手术组比较,bP<0.01、cP<0.05 | ||||
|
| 图 2 各组大鼠肠道菌群Firmicutes、Bacteroidota趋势图 Fig 2 Trend Graphs of Intestinal Microbiota for Firmicutes and Bacteroidota in Each Group of Rats |
|
|
与假手术组相比,黄芩正常剂量组、高剂量组、模型组血浆Fn含量明显降低(P < 0.01),D-乳酸水平明显升高(P < 0.01);与模型组相比,黄芩正常剂量组、高剂量组血浆Fn显著高于模型组(P < 0.01),D-乳酸明显降低(P < 0.01);黄芩正常剂量组、高剂量组血浆Fn、D-乳酸含量差异无统计学意义(P > 0.05),见表 2。
| 组别 | D-乳酸(nmol/mL) | Fn(μg/L) |
| 假手术组 | 45.11±8.46 | 1498.96±217.49 |
| 模型组 | 169.68±15.61b | 387.69±82.69b |
| 正常剂量组 | 100.72±7.35ab | 1034.83±117.85ab |
| 高剂量组 | 101.60±8.21ab | 1170.89±154.88ab |
| F值 | 166.57 | 66.15 |
| P值 | <0.001 | <0.001 |
| 注:与模型组比较,aP<0.01;与假手术组比较,bP<0.01 | ||
与假手术组比较,黄芩正常剂量组、高剂量组、模型组肠组织NF-κB表达明显增加(P < 0.01);与模型组比较,黄芩正常剂量组NF-κB表达有降低(P < 0.05);黄芩正常剂量组与高剂量组肠组织NF-κB表达,差异无统计学意义(P > 0.05)。见表 3、图 3。
| 组别 | NF-κB |
| 假手术组 | 0.77±0.11 |
| 模型组 | 1.60±0.21b |
| 正常剂量组 | 1.32±0.13ba |
| 高剂量组 | 1.37±0.13b |
| F值 | 35.66 |
| P值 | <0.001 |
| 注:与模型组比较,aP<0.05;与假手术组比较,bP<0.01 | |

|
| 图 3 各组大鼠肠组织NF-κB蛋白条带 Fig 3 NF-κB protein bands in intestinal tissues of rats in each group of rats |
|
|
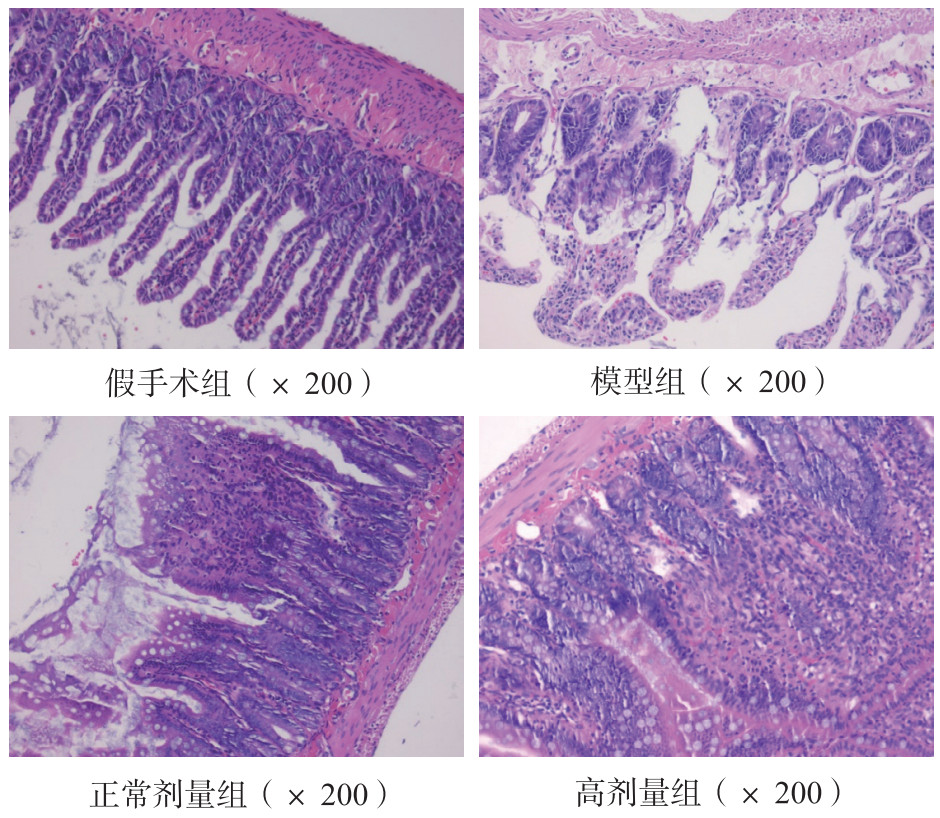
假手术组肠组织形态正常,黏膜完整,腺体结构完整,排列规整;模型组腺体组织肿胀、破坏、融合,黏膜结构破坏,大量中性粒细胞浸润,部分隐窝受损;黄芩正常剂量组、高剂量组肠组织黏膜结构破坏相对完整,部分腺体损伤,少至中等量炎性细胞浸润。见图 4。
|
| 图 4 各组大鼠肠组织病理学变化(HE × 200) Fig 4 Histopathological changes in intestinal tissues of rats in each group (HE × 200) |
|
|
经Pearson相关分析结果显示,Firmicutes丰度及Firmicutes /Bacteroidota丰度比与Fn呈正相关(r = 0.877、P < 0.01;r = 0.811、P < 0.01),与D-乳酸、NF-κB呈负相关(r = -0.829、P < 0.01,r= -0.841、P < 0.01;r= -0.764、P < 0.01,r = -0.745、P < 0.01);Bacteroidota丰度与Fn呈负相关(r = -0.812、P < 0.01),与D-乳酸、NF-κB呈正相关(r = 0.854、P < 0.01,r= 0.741、P < 0.01);但Lactobacillus丰度与Fn、D-乳酸、NF-κB相关性不明显(P > 0.05)。
3 讨论正常的微生物群是我们抵御病原体的第一道防线,肠道作为人体内最大细菌定居的器官,调节健康宿主的许多稳态机制,包括免疫功能和肠道屏障保护[9]。越来越多的研究表明,肠道微生物组可以影响远离肠道的肺部对病原体的抵抗力[2],而肺部作为脓毒症感染最常见部位[10],在早期应激状态期间,炎症反应、氧化应激平衡机制失调,引起的肠道微生物组的改变、肠道内皮细胞及屏障功能破坏,加剧了肺、肾和脑在内的多个组织的器官功能障碍,增加严重危及生命的感染不可控制的风险[11]。可见肺、肠功能在生理、病理状态下常常互相影响。黄芩味苦,性寒,归肺、大肠经,具有清热燥湿作用,临床常用于治疗肺系疾病。先前研究表明,黄芩提取物黄芩甘、黄芩素及单味黄芩煎剂能够抑制内毒素诱导的炎症反应,改善脓毒症大鼠靶器官肺损伤,与不同剂量黄连配伍使用,可抑制肠道有害菌,促进益生菌增值,改变肠道菌群结构[12];黄芩相关中药方剂黄芩汤、葛根芩连汤可以减轻炎症反应,改善肠道菌群失调,调节生物屏障,有助于恢复溃疡性结肠炎、2型糖尿病小鼠肠道微生态及黏膜屏障功能[13-14]。
Firmicute与Bacteroidota作为肠道微生物优势菌群[15],Firmicutes/Bacteroidota平衡性对维护肠道黏膜屏障极为关键,其相对丰度与肠道缺血-再灌注损伤程度密切相关[16];Lactobacillus是厚壁菌门乳酸杆菌科下的一类革兰氏阳性兼性厌氧或微需氧的棒状细菌,增加鼠乳杆菌丰度可发挥抗炎和抗菌作用,减少念珠菌二重感染的发生,是一种潜在的益生菌[17]。有研究表明Firmicutes、Lactobacillus比例下降,降低了巨噬细胞和自然杀伤(NK)细胞功能,不利于肺、肠道组织病理损伤的恢复,其机制可能与免疫细胞和血浆代谢产物相关[18]。本研究中也观察到,模型组、假手术组、黄芩组各组大鼠粪便菌群在门、种分类水平上,Firmicutes、Bacteroidota、Lactobacillus丰度相对较高;虽然总数占各组全部微生物的90%以上,但组间的肠道微生物群落丰度占比发生了明显的变化;与假手术组相比,模型组Firmicutes、Firmicutes/Bacteroidota、Lactobacillus丰度下降明显,Bacteroidota显著升高;正常剂量与高剂量黄芩干预组均较模型组Firmicutes、Firmicutes/Bacteroidota、Lactobacillus比例显著提高,Bacteroidota比例明显下降,肠道菌群结构明显改善,正常剂量与高剂量两组差异不大,可见在肺损伤病理进程中,肠道菌群发生了明显改变,灌胃给予黄芩制剂能够调节肠道菌群[15],促进肠道微生态的恢复。
D-乳酸是肠道内细菌的代谢产物,肠黏膜炎症、缺血缺氧,肠黏膜顶部上皮脱落,肠黏膜通透性增高,D-乳酸升高,反映肠黏膜屏障的重要指标,预测肠源性菌血症最特异度生物标志物[19]。Fn主要由内皮细胞生成,广泛存在于动物组织和组织液中的大分子糖蛋白,参与激活补体、增强单核巨噬细胞清除毒性物质、颗粒和免疫复合物的功能,与病情严重程度及预后相关[20]。NF-κB是细胞内炎症因子激活的关键核转录因子,NF-κB激活对炎症级联反应、线粒体自噬及降解发挥重要作用[21]。本研究中发现,模型组血浆D-乳酸升高明显、Fn下降明显,肠道组织NF-κB表达增加,肠道组织HE染色可见黏膜、腺体破坏,炎性细胞浸润;正常剂量与高剂量黄芩干预组均能降低D-乳酸水平及肠道组织NF-κB表达,升高Fn水平,肠道黏膜结构相对完整,炎症细胞浸润减轻。在内毒素“二次打击”肺损伤下,随着肠道组织炎症因子浸润,炎症反应的激活,肠道组织及血管内皮损伤,黏膜屏障破坏,黄芩在治疗原发病的同时,还可减轻肠道炎症反应,保护肠道黏膜屏障功能,降低菌群移位,减少后期肠源性内毒素释放。
在相关性研究中发现,Firmicutes丰度、Firmicutes /Bacteroidota丰度比与D-乳酸、NF-κB水平比例成负相关,与Fn水平成正相关;Bacteroidota丰度与Fn呈负相关,与D-乳酸、NF-κB呈正相关;可见肠道优势菌群Firmicutes、Bacteroidota结构的改变,对肠道炎症水平及屏障功能影响明显;但种水平上Lactobacillus丰度与Fn、D-乳酸、NF-κB相关性不明显,可能与Lactobacillu绝对丰度相对较少有关;在量效关系上,正常剂量组、高剂量组在肠道菌群丰度、控制炎症反应、肠道黏膜屏障方面差异无统计学意义,提示在临床工作中,增加剂量并不能一定增加疗效。
此外,中医认为“肺合大肠,大肠者,传导之腑”,大肠不仅是中医古籍和现代医学描述的形体结构范畴,更多是基于大肠脏器的功能单元,涵盖解剖器官与功能态器官[22]。本研究中采用大鼠粪便标本检测菌群,虽然能够反映整个肠道菌群变化的最终结果,但很大程度上与大肠菌群变化更为紧密;而脓毒症引起的肠道菌群变化,可能不仅仅局限于大肠,存在一定局限性,后期仍需更深入的研究。
利益冲突 所有作者声明无利益冲突
作者贡献声明 孙月雯:实验操作、论文撰写;吴锡平、董赟:数据分析整理、病理检测、统计学分析;吴海荣:研究设计、论文修改
| [1] | Kumar V. Pulmonary innate immune response determines the outcome of inflammation during pneumonia and sepsis-associated acute lung injury[J]. Front Immunol, 2020, 11: 1722. DOI:10.3389/fimmu.2020.01722 |
| [2] | 杨舸, 张瑞, 王晓红, 等. 脓毒症急性肺损伤小鼠肠肺菌群结构变化分析[J]. 中华急诊医学杂志, 2023, 32(3): 353-359. DOI:10.3760/cma.j.issn.1671-0282.2023.03.013 |
| [3] | 杨小娟, 杨晓军, 刘丹, 等. 脓毒症患者肠道菌群与肠屏障功能紊乱的相关性研究[J]. 中华急诊医学杂志, 2022, 31(2): 210-216. DOI:10.3760/cma.j.issn.1671-0282.2022.02.013 |
| [4] | 耿欢, 游丽娇, 杨小芳, 等. "肺与大肠相表里" 理论在重症肺炎治疗中的应用探析[J]. 中国中医急症, 2022, 31(1): 84-86. DOI:10.3969/j.issn.1004-745X.2022.01.020 |
| [5] | 吴海荣, 孙月雯, 吴锡平. 单味黄芩煎剂对内毒素"二次打击" 脓毒症大鼠体内Fn及肺组织EPCR、AMPK表达的影响[J]. 中国中医急症, 2023, 32(4): 581-585. DOI:10.3969/j.issn.1004-745X.2023.04.004 |
| [6] | 李言, 梁俊清, 张高峰, 等. 基于络病学探讨内毒素"二次打击" 急性肺损伤大鼠的Rho/ROCK机制及川芎嗪的保护作用[J]. 世界中医药, 2016, 11(1): 123-126. DOI:10.3969/j.issn.1673-7202.2016.01.033 |
| [7] | Zhou G, Xie D, Fan R, et al. Comparison of pulmonary and extrapulmonary models of sepsis-associated acute lung injury[J]. Physiol Res, 2023, 72(6): 741-752. DOI:10.33549/physiolres.935123 |
| [8] | 孙艳梅, 贾连群, 张妮, 等. 化瘀祛痰方对高脂血症大鼠肝脏mTOR介导自噬相关基因的影响[J]. 中华中医药学刊, 2017, 35(12): 3143-3146. DOI:10.13193/j.issn.1673-7717.2017.12.041 |
| [9] | Adelman MW, Woodworth MH, Langelier C, et al. The gut microbiome's role in the development, maintenance, and outcomes of sepsis[J]. Crit Care, 2020, 24(1): 278. DOI:10.1186/s13054-020-02989-1 |
| [10] | 冯玮, 王选锭. 重症感染抗菌治疗: 认知误区与改进策略[J]. 中华急诊医学杂志, 2024, 33(4): 455-459. DOI:10.3760/cma.j.issn.1671-0282.2024.04.001 |
| [11] | Miller WD, Keskey R, Alverdy JC. Sepsis and the microbiome: a vicious cycle[J]. J Infect Dis, 2021, 223(12 Suppl 2): S264-S269. DOI:10.1093/infdis/jiaa682 |
| [12] | 江文琳, 段志伟, 陈梦婕, 等. 黄连素和黄芩苷不同配伍对肠道细菌体外生长的影响[J]. 中国微生态学杂志, 2023, 35(3): 269-274. DOI:10.13381/j.cnki.cjm.202303004 |
| [13] | 姜洪宇, 陈萌, 关露春, 等. 从"肠道黏膜屏障完整性" 角度探讨黄芩汤治疗溃疡性结肠炎的机制[J]. 中华中医药学刊, 2024, 42(3): 113-118. DOI:10.13193/j.issn.1673-7717.2024.03.021 |
| [14] | 程瑞, 李力, 冯志海, 等. 基于肠道菌群探讨葛根芩连汤改善胰岛素抵抗的作用机制[J]. 中国微生态学杂志, 2024, 36(7): 847-854. DOI:10.13381/j.cnki.cjm.202407018 |
| [15] | 李心如, 盛先杰, 杨琰, 等. 4种常见清热燥湿类中药对肠道菌群及粪便胆汁酸和短链脂肪酸代谢的影响[J]. 南京中医药大学学报, 2023, 39(5): 442-451. DOI:10.14148/j.issn.1672-0482.2023.0442 |
| [16] | Hu JJ, Deng F, Zhao BC, et al. Lactobacillus murinus alleviate intestinal ischemia/reperfusion injury through promoting the release of interleukin-10 from M2 macrophages via Toll-like receptor 2 signaling[J]. Microbiome, 2022, 10(1): 38. DOI:10.1186/s40168-022-01227-w |
| [17] | Fan HX, Sheng S, Li DD, et al. Heat-killed Lactobacillus murinus confers neuroprotection against dopamine neuronal loss by targeting NLRP3 inflammasome[J]. Bioeng Transl Med, 2022, 8(2): e10455. DOI:10.1002/btm2.10455 |
| [18] | Chen QC, Liu MJ, Guo H, et al. Altered respiratory microbiomes, plasma Metabolites, and immune responses in influenza A virus and methicillin-resistant Staphylococcus aureus coinfection[J]. Microbiol Spectr, 2023, 11(4): e0524722. DOI:10.1128/spectrum.05247-22 |
| [19] | Lefèvre CR, Turban A, Luque Paz D, et al. Early detection of plasma d-lactate: toward a new highly-specific biomarker of bacteraemia?[J]. Heliyon, 2023, 9(6): e16466. DOI:10.1016/j.heliyon.2023.e16466 |
| [20] | 吴海荣, 吴锡平, 高树芹. 早期监测血浆纤维结合蛋白水平对重症肺炎患者病情严重程度及预后的影响[J]. 中国急救医学, 2018, 38(2): 149-151. DOI:10.3969/j.issn.1002-1949.2018.02.012 |
| [21] | Guilbaud E, Galluzzi L. A mitochondrial checkpoint to NF-κB signaling[J]. Cell Death Dis, 2024, 15(7): 477. DOI:10.1038/s41419-024-06868-3 |
| [22] | 李玉平, 翟海英, 杨长福. "肺与大肠相表里" 理论的研究[J]. 中国中医基础医学杂志, 2024, 30(2): 336-341. DOI:10.19945/j.cnki.issn.1006-3250.2024.02.032 |
 2025, Vol. 34
2025, Vol. 34