创伤性颅脑损伤(traumatic brain injury, TBI)是因暴力作用于头颅引起的损伤,包括头部软组织损伤、颅骨骨折及脑血管、脑组织和神经损伤。TBI无论是单独发生还是合并有其他部位的损伤,都是一种高病死率和高致残率的严重损伤[1]。国内的几项大规模调查显示,TBI每年的发生率为(55.4~64.0)/10万,相当于每年新增TBI患者(77.28~89.28)万,给家庭和社会造成了巨大负担[2]。重型TBI导致的死亡通常发生在受伤后的最初几小时内,而继发性脑损伤如颅内压(intracranial pressure, ICP)升高、脑组织灌注不足、缺血性梗死、代谢紊乱、体温异常等是加重TBI患者脑损伤严重程度,进而导致临床结局恶化和死亡的主要原因[3]。因此,院前和急诊急救阶段对继发性脑损伤的早期、有效处置是改善TBI尤其是重型TBI患者预后的关键。目前我国尚无关于成人急性TBI院前及急诊救治的专家共识。因此,根据已有的临床证据和指南,本共识写作组撰写了《成人创伤性颅脑损伤院前与急诊诊治中国专家共识》(以下简称共识)。
本共识检索数据库为PubMed、Web of Science、Cochrane Library、EMBASE、中国知网、中国生物医学文献数据库、万方数据知识服务平台和维普期刊网,检索关键词为“traumatic brain injury” “brain injury”“brain trauma”“craniocerebral trauma”“脑外伤”“脑损伤”“颅脑创伤”,纳入文献类型为系统评价、Meta分析、随机对照试验、队列研究、病例对照研究和病例报告等,检索时限为建库至2024年11月。经过筛选,最终引用文献58篇,其中英文文献54篇,中文文献4篇。考虑到在急性TBI院前和急诊救治领域缺乏高质量的研究,共识组采用改良德尔菲法向全国急诊、重症及神经外科领域专家征集意见,并对共识内容进行投票,超过70%的专家意见一致时被认为达成共识,形成共识推荐意见。推荐意见采用GRADE方法进行证据分级,证据级别分为高(A)、中(B)、低(C)和极低(D)四个等级,推荐强度分为强和弱两个等级(表 1)[4]。
| 项目 | 具体描述 |
| 证据质量分级 | |
| 高(A) | 非常有把握:观察值接近真实值 |
| 中(B) | 对观察值有中等把握:观察值有可能接近真实值,也有可能差别较大 |
| 低(C) | 对观察值把握有限:观察值与真实值可能有较大差别 |
| 极低(D) | 对观察值几乎没有把握:观察值与真实值可能有极大差别 |
| 推荐强度分级 | |
| 强推荐 | 明确显示干预措施利大于弊(或弊大于利)。临床医师、患者等人群在大多数情况下应该遵循该推荐意见 |
| 弱推荐 | 干预措施利弊不明确,或无论质量高低的证据均显示利弊相当。需要综合考虑患者价值观、偏好和具体的临床情况来做决策 |
本共识的主要目的是为以院前急救人员、急诊(急诊外科)医师和急诊重症监护医师为主体的医疗专业机构提供成人TBI患者急性期的规范化诊疗建议。对于伴有其他部位多发伤或创伤失血性休克的TBI患者的救治、TBI外科手术治疗,以及儿童TBI患者救治的相关内容,读者可参考国内外已发表的治疗指南和共识[5-9]。
1 院前诊治 1.1 院前伤情评估TBI患者在院前环境中可能会出现缺血、缺氧和低血压等情况。低血压可降低脑组织灌注压(cerebral perfusion pressure, CPP),缺氧也可对遭受创伤的大脑造成伤害,导致继发性脑损伤,对患者预后产生负面影响。因此,在院前维持有效的呼吸与循环至关重要。在确认创伤现场环境安全后,院前急救人员应评估TBI患者的气道、呼吸、循环等情况。现场评估应按照ABCDE的流程快速进行[9],包括:(1)气道评估(airway);(2)呼吸评估(breathing);(3)循环评估(circulation);(4)伤残评估(disability);(5)暴露后评估(exposure)。其中,暴露后评估应强调对体表可见的致命性出血进行快速、仔细识别。创伤患者经常存在难以早期识别的隐蔽伤情,在转运途中应重复ABCDE流程,及时发现可能出现的病情变化。
推荐意见1:建议在院前使用ABCDE流程对TBI患者的通气、氧合、循环、伤残情况和隐蔽伤情(尤其是体表可见的致命性出血)进行快速评估及处置,并在转运途中重复ABCDE流程。(强推荐,A级证据)
1.2 格拉斯哥昏迷评分和瞳孔检查院前急救阶段应对格拉斯哥昏迷评分(Glasgow coma scale, GCS)和瞳孔情况(大小、形状、对光反射)进行持续监测和动态评估,及时发现可能出现的早期神经系统功能变化[10]。运动反应是GCS中最客观且最容易评估的部分,尤其是在气管插管、面部受伤等难以评估言语和睁眼反应的情况下。瞳孔发生新的变化(如双侧瞳孔直径差异>1 mm、瞳孔散大、对光反射消失)提示ICP升高或颅内血肿导致脑疝形成,需要紧急启动降颅压治疗。
推荐意见2:建议对TBI患者进行格拉斯哥昏迷评分及瞳孔情况的动态评估,及时发现可能出现的神经功能恶化。(强推荐,A级证据)
1.3 通气与氧合中型-重型TBI患者常合并低氧血症,院前血氧饱和度(SpO2)<90%与患者病死率增高及神经系统功能恶化密切相关。对于重型TBI患者,在院前接受主动气道干预与入院及出院存活率的提高具有独立相关性[11]。因此,TBI患者应维持气道通畅,确保充分的通气和供氧,并动态监测SpO2。理想情况下,应至少每5 min记录一次并尽量将SpO2维持在95%以上。当SpO2<90%时应首先尝试面罩吸氧或经鼻高流量吸氧,如果仍无法改善低氧血症,应进行球囊面罩通气。在采取这些措施后,如SpO2仍持续<90%,则应在充分保护颈椎的基础上立即实施气管插管和(或)呼吸机辅助呼吸[3]。此外,当TBI患者的GCS≤8分、气道保护反射减弱或消失、出现脑疝临床征象时,应在充分氧合的基础上行气管插管[12]。常见的脑疝临床征象包括库欣三联征(血压升高、心动过缓、呼吸模式不规则)、去皮质或去大脑强直姿势、进行性神经功能恶化、单侧或双侧瞳孔散大固定。快速诱导插管后可能出现血流动力学不稳定,在到达急诊科之前应采取措施纠正低血压。低碳酸血症会诱发脑血管收缩,是脑缺血的危险因素。研究发现,与呼气末二氧化碳分压(PetCO2)<35 mmHg(1 mmHg=0.133 kPa)相比,PetCO2为35~45 mmHg的重型TBI患者30 d生存率更高[13]。因此,院前呼吸机应配置PetCO2监测模块,对机械通气的TBI患者进行PetCO2监测并将其控制在35~45 mmHg。
推荐意见3:建议持续进行经皮动脉SpO2监测,确保SpO2≥90%,最好维持在95%以上。当SpO2<90%时,应首先尝试鼻导管/面罩吸氧或球囊面罩通气;如果SpO2仍<90%,应实施气管插管和(或)机械通气;此外,当患者GCS≤8分、气道保护反射减弱或消失、出现脑疝体征时,应在充分氧合的基础上行气管插管和(或)机械通气。气管插管时应注意保护颈椎,机械通气时需监测并维持PetCO2在35~45 mmHg。(强推荐,B级证据)
1.4 止血与液体复苏院前低血压可明显增加TBI患者的死亡风险。一项观察性研究发现,院前收缩压<110 mmHg与院内死亡风险增加明显相关[14]。日本的一项研究也发现,定义重型TBI患者低血压的收缩压最佳阈值为110 mmHg,在此阈值下患者的院内死亡风险明显增加[15],提示应在院前急救中对动脉血压进行密切监测,并维持成人TBI患者的收缩压>110 mmHg[16]。
在进行液体复苏前,应重视致命性出血的快速识别与评估,这是稳定TBI患者血流动力学最优先的治疗措施。如果存在头皮活动性出血,应迅速通过局部压迫进行紧急止血;有条件时也可使用皮肤钉合器对合头皮进行止血。对血流动力学不稳定的TBI患者还应积极建立液体通路进行液体复苏,院前环境下首选外周静脉通路,当现场救治条件、患者自身血管情况等造成外周静脉通道建立困难时,健侧胫骨或肱骨近端骨髓腔穿刺置管是一种替代选择[9]。
在创伤性失血患者中使用晶体液作为初始复苏液体已被广泛接受,但使用晶体液的种类仍存在争议。大量输注0.9%氯化钠溶液可导致高氯性酸中毒或增加肾损伤风险,而平衡盐溶液(如醋酸钠林格液)包含接近生理浓度的氯化物,在液体复苏时可能具有优势[17]。TBI患者应避免使用低渗平衡盐溶液(如乳酸钠林格液),以减少液体向受损脑组织区域的细胞内转移。对于存在失血性休克的TBI患者应在晶体液复苏的基础上补充胶体液,可更有效地恢复血容量,目前临床上最常用的胶体液为白蛋白。羟乙基淀粉和明胶可能影响患者的凝血和血小板功能,应谨慎使用。
推荐意见4:建议持续监测并采取措施维持TBI患者的收缩压>110 mmHg。(强推荐,B级证据)
推荐意见5:建议对可见的活动性头皮出血进行紧急止血处理,同时尽快建立液体通路对合并低血压的TBI患者进行液体复苏。液体复苏首选等渗平衡盐溶液,避免使用低渗溶液。如果晶体液复苏无法维持组织灌注,可联合使用胶体溶液。(强推荐,B级证据)
1.5 ICP升高的院前处置甘露醇和高渗盐水(hypertonic saline, HS)是暂时降低ICP有效且常用的高渗制剂。然而,院前使用甘露醇和HS对TBI患者预后的改善效果尚存争议。Meta分析结果显示,接受HS或甘露醇治疗的颅内高压TBI患者的全因病死率率差异无统计学意义[18]。一项回顾性队列研究发现,与甘露醇相比,接受HS治疗可降低在院前出现瞳孔散大的TBI患者的ICU病死率[19]。因此,目前的证据不支持在院前环境中常规使用甘露醇或HS预防性降低ICP[16]。
推荐意见6:除非出现脑疝的临床征象,否则不建议院前使用高渗制剂(甘露醇和高渗盐水)预防ICP升高。(弱推荐,C级证据)
1.6 院前紧急医疗系统决策所有需要或可能需要神经外科手术[即颅内血肿清除和(或)ICP监测]挽救的重型TBI患者均应转运至具有神经外科救治能力的上级医院[20],不仅可及时进行外科手术,还能够为患者提供专业的神经创伤治疗和护理。近期研究发现,神经重症监护治疗可改善重型TBI成人患者的生存率和神经功能预后[21]。
推荐意见7:建议疑似中型-重型TBI患者应就近送往具有神经外科救治能力的医疗机构。(强推荐,B级证据)
2 急诊诊治 2.1 评估 2.1.1 急诊伤情评估急诊科应按照ABCDE流程对患者进行初次评估,以发现病情变化并排查危及生命的情况。此后,应当按照CRASH PLAN创伤评估方案对9大系统进行全面检查,以避免遗漏其他部位的损伤。CRASH PLAN包括:(1)心脏及循环系统(cardiac);(2)胸部及呼吸系统(respiration);(3)腹部(abdomen);(4)脊柱(spine);(5)头部(head);(6)骨盆(pelvis);(7)肢体(limbs);(8)动脉(arteries);(9)神经(nerves)。该评估方法强调检查的系统性、全面性,实际应用时可根据伤情灵活调整检查顺序。
TBI患者,尤其是GCS<13分的中型-重型TBI患者,在创伤后早期发生继发性神经功能恶化的风险很高。为及时发现可能发生的神经功能恶化,必须对患者的神经系统功能、GCS评分和瞳孔情况进行动态检查,检查的频率由接诊医师决定,但必须在入院后立即开始。英国指南推荐在伤后最初的2 h内每30 min检查一次,在随后的4 h内每小时检查一次[22]。
推荐意见8:建议急诊科首先按照ABCDE流程对TBI患者进行初次评估,随后使用CRASH PLAN流程对各部位伤情进行全面评估。(强推荐,B级证据)
推荐意见9:建议TBI患者入院后立刻开始对神经系统功能、GCS评分和瞳孔情况进行动态检查。(强推荐,B级证据)
2.1.2 影像学评估CT扫描是诊断原发性脑部病变的首选方法[23]。所有中型-重型TBI患者均应及时行颅脑及颈椎CT扫描[24]。轻型TBI患者除了动态监测意识和瞳孔情况外,如果符合以下条件也应进行颅脑CT扫描:(1)存在颅底骨折征兆(鼻出血、耳出血、耳后瘀斑、熊猫眼征);(2)颅骨骨折移位;(3)创伤后癫痫;(4)新发的局灶性神经功能异常;(5)凝血功能障碍;(6)正在接受抗凝、抗血小板治疗。患者在短时间内出现新发神经功能缺损或GCS评分下降≥2分时,应在条件允许的情况下立即复查头颅CT。当存在严重颅骨骨折时还应进行头颅CT三维重建。
主动脉弓和颈部动脉创伤性夹层的危险因素包括:(1)存在颈椎骨折;(2)CT平扫无法解释的局灶性神经功能缺损;(3)霍纳(Honer)综合征;(4)Lefort Ⅱ或Ⅲ型面部骨折;(5)颅底骨折;(6)颈部软组织损伤。当存在这些危险因素时应通过断层摄影血管造影(computed tomography angiography, CTA)检查主动脉弓、颈动脉和椎动脉。此外,当出现脑实质或原因不明的蛛网膜下腔出血或迟发性颅内出血时,也应进行CTA检查以了解是否存在创伤性假性动脉瘤。
推荐意见10:建议对TBI患者行颅脑CT检查,对于中型-重型TBI患者还应进行颈椎CT扫描。如存在主动脉弓和颈部动脉创伤性夹层的危险因素,或出现原因不明的脑实质/蛛网膜下腔出血,怀疑存在创伤性假性动脉瘤等情况时,应尽早行主动脉弓以上的颈部和颅内CTA。(强推荐,B级证据)
2.1.3 急诊多模态神经功能监测脑自动调节功能(cerebral autoregulation, CA)是大脑自我保护的重要机制。TBI发生后,大脑常不能维持正常CA,使其容易受到继发性损伤因素的影响。压力反应指数(pressure reactivity index, PRx)是由连续多个ICP和平均动脉压(mean arterial pressure, MAP)波形平均值计算得到的动态相关系数,通过PRx可确定TBI患者的最佳CA并计算出此时的优化CPP值,因而成为床旁连续评估CA的重要方法[25]。研究发现,20~22 mmHg的ICP临界值能够较好地预测患者预后,当ICP高于此阈值时,TBI患者的短期和长期病死率均明显增高[26-27]。第四版《严重创伤性颅脑损伤管理指南》推荐对ICP>22 mmHg的重型TBI患者进行降颅压干预,并维持CPP值在60~70 mmHg,以改善严重TBI患者的生存率和神经功能预后[28]。因此,应将ICP监测作为TBI治疗的核心环节,以便对CA和CPP实施精准的管理。推荐使用与外部压力计连接的脑室内置管作为监测手段,该方法不仅精确、可靠,还可通过引流脑脊液降低ICP。对于头颅CT扫描正常的重型TBI患者,如果入院时发现至少有以下2个特征,应进行ICP监测:(1)年龄>40岁;(2)去大脑或去皮质强直;(3)收缩压<90 mmHg[28]。ICP监测应持续至病情稳定,具体时间可依据颅脑损伤和脑水肿程度、临床病情变化、ICP值等决定,一般不超过14 d。
经颅多普勒(transcranial dopplers, TCD)是一种非侵入性的神经监测技术,常通过颞部和枕下入路,利用低频探头穿透颅骨,测量前循环和后循环的脑血流速度(cerebral blood flow velocity, CBFV),间接提供大脑基底动脉的脑血流情况。TCD对CA的评估作用越来越受到关注,通过连续60个时长5~10 s的脑血流监测结果,可计算出中位CPP慢波与中位CBFV之间的相关系数,被称为中位指数(mean index, Mx)。当Mx>0时,CPP与CBFV呈正相关,提示CA受损;而当Mx≤0时,CPP与CBFV无关或呈负相关,提示CA较好[29]。此外,Mx与ICP衍生的PRx指数之间具有较好的相关性[30]。因此,重型TBI患者抵达医院时应使用TCD进行初步评估,并纳入创伤超声评估的重点。
脑电图(electroencephalogram, EEG)可帮助判断脑功能和神经损伤程度。TBI后经常发生惊厥和非惊厥性癫痫,是导致TBI患者神经系统功能恶化的可治疗诱因,但经常被临床医师忽视。因此,使用连续或间歇EEG监测癫痫,并在癫痫发生时及时干预,可能会给TBI患者带来益处。此外,皮质播散性去极化(cortical spreading depolarization, CSD)在TBI患者中的发生率高达50%,且与不良预后相关[31]。EEG在识别CSD方面有一定作用,可对CSD进行实时监测并捕捉特征性电活动。
推荐意见11:在有条件的急诊科,建议对存在以下情况的TBI患者进行有创ICP监测,并将脑室内置管作为监测ICP的首选方法,控制ICP<22 mmHg,维持CPP在60~70 mmHg:(1)需要进行颅外手术的中型-重型TBI患者;(2)初始头颅CT扫描存在异常的重型TBI患者,包括颅内血肿、脑挫裂伤、脑肿胀、中线移位、环池受压等;(3)重型TBI患者初始头颅CT扫描正常,但入院时存在至少以下2个特征(①年龄>40岁,②去大脑或去皮质强直姿势,③收缩压<90 mmHg)。(强推荐,B级证据)
推荐意见12:在有条件的急诊科,建议使用TCD监测重型TBI患者的脑血流,指导和优化脑组织灌注治疗;使用EEG监测TBI后的脑功能状况及可能出现的惊厥/非惊厥性癫痫。(弱推荐,C级证据)
2.2 治疗 2.2.1 通气与氧合参考“院前诊治”部分的相关推荐意见。
2.2.2 液体复苏院内救治阶段制定液体管理的预期目标对于重型TBI患者至关重要。液体限制可能会对预后产生不利影响,而液体过负荷则可能导致肺水肿、脑水肿和ICP升高。一项前瞻性、多中心研究发现,液体正平衡可导致TBI重症患者6个月时的神经功能预后显著恶化,表明在血流动力学稳定的情况下应以液体出入量平衡为目标,避免液体过负荷[32]。第四版《严重创伤性颅脑损伤管理指南》建议将50~69岁重型TBI患者的收缩压维持在≥100 mmHg,或将15~49岁或>70岁重型TBI患者的收缩压维持在≥110 mmHg[28]。《欧洲外伤后大出血和凝血功能障碍治疗指南》建议将严重TBI患者的MAP维持在≥80 mmHg[5]。因此,除了院前诊治阶段的推荐意见外,在急诊科需要进一步细化TBI患者的液体复苏和容量管理目标。
推荐意见13:对于严重TBI患者(GCS≤8分),建议维持MAP≥80 mmHg,并维持50~69岁患者的收缩压≥100 mmHg,15~49岁或>70岁患者的收缩压≥110 mmHg。同时,严密监测液体出入量,维持液体平衡,避免液体不足或过负荷。(强推荐,B级证据)
2.2.3 ICP升高的急诊处置 2.2.3.1 体位早期识别和治疗ICP升高是最大限度改善TBI患者预后的基础。将重型TBI患者的头部保持在中轴位,避免颈部静脉受压,并将床头抬高30°~45°以促进脑静脉回流是神经重症监护的基本操作[33]。由于重型TBI患者可能存在脊柱创伤,因此在保持上述体位时应给予充分的脊柱保护措施。
推荐意见14:建议重型TBI患者在给予充分脊柱保护措施的基础上将头部保持中轴位,床头抬高30°~45°。(强推荐,B级证据)
2.2.3.2 镇痛、镇静TBI患者很可能出现疼痛和躁动,而躁动会导致ICP升高。实施镇静、镇痛管理策略可有效减少躁动的发作,缓解交感神经过度活跃的症状,可能改善TBI患者的预后[34]。西雅图重型颅脑创伤共识会议(Seattle Severe Traumatic Brain Injury Consensus Conference, SIBICC)建议将镇静、镇痛作为重型TBI患者的常规治疗方法以减轻疼痛、减少躁动,并在ICP升高时增加镇静、镇痛程度以控制ICP[33]。因此,重型TBI患者应给予镇静、镇痛治疗,以减少躁动、降低大脑和全身代谢,从而控制颅内高压[34]。但在使用镇静、镇痛药物期间,应密切监测动脉血压,避免发生低血压。
推荐意见15:建议对重型TBI患者进行镇静、镇痛治疗,但应密切监测并维持收缩压及MAP在目标范围内。(强推荐,B级证据)
2.2.3.3 脑室引流从脑室内引流脑脊液是控制ICP的一种治疗选择,但其有效性缺乏强有力的证据。第四版《严重创伤性颅脑损伤管理指南》建议在受伤后的最初12 h内,对于初始GCS<6分的TBI患者,可考虑使用脑脊液引流来降低ICP。此外,该指南还建议采用在中脑位置归零的脑室外引流系统,持续引流脑脊液以更有效地降低ICP[28]。
推荐意见16:建议有条件的急诊科可考虑对受伤12 h内且初始GCS<6分的TBI患者行侧脑室脑脊液持续引流以降低ICP。(弱推荐,C级证据)
2.2.3.4 高渗治疗甘露醇和HS是暂时降低ICP的有效且常用的高渗剂,但目前没有明确的证据证实二者在降低ICP及改善TBI患者预后方面的优劣[35-37]。虽然临床常用0.25~1.0 g/kg(2.5~10.0 mL/kg)20%甘露醇或2 mL/kg的3% HS,但最佳使用剂量及给药方式仍存在争议。建议肾功能正常的患者将血浆渗透压目标值维持在300~320 mmol/L,对于老年及肾功能容易损伤的患者,渗透压目标值可确定为290~300 mmol/L[38]。此外,使用时应考虑二者的不良反应:甘露醇会诱发渗透性利尿,可能导致低血压和低CPP,影响脑组织灌注和氧合;而HS可能导致高钠、高氯血症。因此,在使用过程中需注意监测并维持液体出入量及钠、氯离子平衡,避免血清钠浓度>155 mmol/L[33]。当血流动力学不稳定时,使用3% HS可能更加安全。
推荐意见17:建议间断静脉输注20%甘露醇(2.5~10.0 mL/kg)或3%高渗盐水(2 mL/kg),维持血浆渗透压在目标范围内(肾功能正常患者300~320 mmol/L,老年及肾功能易损伤患者290~300 mmol/L),避免血清钠离子浓度>155 mmol/L。(强推荐,B级证据)
2.2.3.5 过度通气过度通气诱导低碳酸血症是治疗颅内高压的一种临时性措施。通过提高呼吸频率可增加CO2的排出,降低PaCO2,导致脑血管收缩,减少大脑血容量,进而降低ICP。然而,低碳酸血症引起的脑血管收缩也是诱发脑缺血缺氧的重要危险因素。中度短暂过度通气(PaCO2 30~35 mmHg)可明显影响脑血流并伴有ICP降低,但不会引起脑代谢物和氧合的病理性改变[39]。在深度过度换气策略(PaCO2<30 mmHg)使用频率较高的医疗中心,TBI患者的6个月病死率和神经功能预后与该策略使用频率较低的医疗中心差异无统计学意义[40]。因此,SIBICC建议当ICP升高时,应首先尝试将PaCO2维持在35~38 mmHg(4.7~5.1 kPa)的正常范围下限,如ICP降低不明显,可实施过度通气使PaCO2维持在32~35 mmHg(4.2~4.5 kPa)[33]。
推荐意见18:建议在发生脑疝的紧急情况下可短暂使用过度通气策略来治疗颅内高压;过度通气时,应首先将PaCO2维持在35~38 mmHg(4.7~5.1 kPa);如果降低ICP效果不明显,可进一步将PaCO2维持在32~35 mmHg(4.2~4.5 kPa)。(弱推荐,C级证据)
2.2.3.6 亚低温治疗研究证实,入院时的自发性低体温和发热均与严重TBI患者的死亡风险增加和神经系统功能预后恶化明显相关[41-42]。因此,建议TBI患者应以正常体温(36~37 ℃)为目标。在初始ICP≥30 mmHg的TBI患者亚组中,持续5 d的长时程亚低温(34~35 ℃)治疗可明显改善患者的6个月神经功能预后且不增加并发症的发生率[43]。最近的一项Meta分析表明,在颅脑创伤后24 h内开始低温治疗可明显降低存在颅内高压的TBI患者的病死率[44]。当对其他药物治疗无反应时,建议在32~35 ℃目标范围下诱导低温治疗,以控制脑水肿和ICP,且治疗应维持数天,最好通过ICP监测进行缓慢复温[45]。
推荐意见19:建议维持TBI患者的核心温度在正常范围(36~37 ℃),但对于难治性ICP升高的患者可考虑长时程亚低温治疗,维持核心温度在32~35 ℃。(弱推荐,C级证据)
2.2.3.7 去骨瓣减压术两项高证据级别的随机对照试验均证实,与药物治疗相比,去骨瓣减压术可有效降低发生难治性颅内高压的弥漫性TBI患者的ICP并缩短ICU治疗时长,但对长期神经功能预后无明显改善作用[46-47]。因此,在《严重创伤性颅脑损伤管理指南》第四版及其2020年更新的建议中,均推荐采用大面积的额颞顶去骨瓣减压术(面积≥12 cm×15 cm或直径≥15 cm)以降低重型TBI患者的病死率,并改善其神经功能预后[28, 48]。SIBICC推荐将去骨瓣减压术作为第3级(并发症发生风险最高)的治疗方法,在其他降颅压措施效果不佳且生活质量可被接受的难治性ICP患者中使用[33]。《颅脑创伤去骨瓣减压术中国专家共识》进一步提出去骨瓣减压术的详细指征,但对于双侧瞳孔散大固定、对光反射消失、GCS 3分、呼吸停止和血压不稳定等晚期脑疝、预后极差的患者,不推荐行去骨瓣减压术[49]。
推荐意见20:建议有条件的急诊科将去骨瓣减压术(骨瓣面积≥12 cm×15 cm)作为预期生活质量可接受的难治性ICP升高的TBI患者的治疗手段,以降低ICP并缩短重症监护治疗时长。(强推荐,A级证据)
推荐意见21:对于TBI患者,去骨瓣减压术时机推荐如下:(1)已出现瞳孔散大的脑疝患者,若CT显示存在脑挫裂伤和出血、脑水肿、脑肿胀等状况,且导致明显的占位效应(中线移位、基底池受压等),建议及时行去骨瓣减压术;(2)若患者ICP进行性升高,且数值大于30 mmHg并持续超过30 min,建议及时行去骨瓣减压术;(3)当患者出现进行性意识障碍,同时CT显示存在脑挫裂伤和出血、脑水肿、脑肿胀等导致明显的占位效应(中线移位、基底池受压等),且经其他一线降颅压措施治疗后控制效果不佳时,建议及时行去骨瓣减压术;(4)若患者已呈现双侧瞳孔散大固定、对光反射消失、GCS 3分、呼吸停止和血压不稳定等晚期脑疝、预后极差的情况时,不建议施行去骨瓣减压术。(弱推荐,C级证据)
2.2.4 凝血功能支持氨甲环酸(tranexamic acid, TXA)已成为治疗有出血风险的创伤患者的主要方法之一[50]。创伤性脑损伤研究CRASH-3比较了TXA给药(1 g TXA静脉注射+8 h内1 g TXA静脉输注)组与匹配的安慰剂组的预后差异,结果显示,早期(伤后3 h内)给予TXA治疗可降低轻-中度TBI患者的病死率,但对重度TBI患者病死率无明显影响[51]。由于基线出血量较小,颅脑损伤较轻的患者可能从TXA治疗中获益更多[52]。
对于长期服用抗凝/抗血小板药物者,或存在原发性凝血功能障碍(如血友病)的患者,在TBI后发生创伤性凝血病的风险明显增加。因此,在急诊接诊时应尽快了解相关药物用药史或凝血功能障碍病史,并根据凝血功能检查结果决定是否给予相应的拮抗治疗。常用药物包括维生素K1或凝血酶原复合物(逆转华法林)、鱼精蛋白(拮抗肝素)、依达赛珠(Idarucizumab)单克隆抗体(逆转达比加群)、安得塞奈(Andexanet alfa)单克隆抗体(逆转沙班类药物)。对于服用抗血小板药物的TBI患者,如存在血小板功能障碍或需要行紧急神经外科手术,可补充浓缩血小板。对于血友病患者,如存在明显出血倾向或需要行神经外科手术,应补充相应的凝血因子[5]。
一项多中心、随机对照试验对常规凝血试验或血栓弹力图(thromboelastogram, TEG)指导的输血疗法进行了比较,发现在74例TBI患者的亚组分析中,TEG组的28 d病死率明显低于常规凝血试验组[53]。TBI具有独特的快速TEG(r-TEG)模式,其特点包括活化凝血时间延长(>128 s)、α角减小(<65°)、功能性纤维蛋白原水平降低(<365 mg/dL)、最大振幅正常且30 min裂解百分比无增加(Ly30 1.2%)[54]。此外,TEG可以很容易地检测出TBI患者存在的凝血病,且可根据TBI的严重程度描述出各种凝血病亚型[55]。
推荐意见22:建议尽快为TBI患者注射氨甲环酸,给药方式为受伤后3 h内给予负荷剂量1 g(>10 min缓慢注射),随后继续静脉滴注1 g(维持≥8 h)。(强推荐,B级证据)
推荐意见23:建议在急诊科详细询问TBI患者的抗凝、抗血小板药物用药史及基础凝血功能障碍病史,如存在相关出血,建议选择必要的药物拮抗或补充治疗。在有条件的医院,建议采用TEG对需要行紧急神经外科手术(包括ICP探头置入)的TBI患者的凝血功能进行早期、动态监测与优化管理。(强推荐,B级推荐)
2.2.5 癫痫的预防与处理创伤后癫痫发作(post-traumatic seizures, PTS)是TBI的严重并发症,可加重继发性脑损伤,可能导致患者的预后恶化。发生于TBI后7 d内的PTS为早期癫痫发作,发生于TBI 7 d后的PTS为晚期癫痫发作。由于目前的研究未发现抗癫痫药物在预防早期或晚期癫痫发作中有显著疗效[56-58],TBI后是否采用预防性抗癫痫药物治疗仍然存在较大争议。因此,基于现有证据,不建议常规使用抗癫痫药物预防PTS,但如果存在创伤后早期癫痫发作的危险因素时可考虑使用,其危险因素包括:GCS 3~8分、硬膜下血肿、蛛网膜下腔出血、Charlson共患病指数≥2、头颈部简明损伤评分为5或6分,以及坠落伤、额颞叶挫裂伤等[59]。
推荐意见24:存在早期颅脑PTS的危险因素时,建议使用7 d的抗癫痫药物来降低早期PTS的发生风险。对于确诊的PTS,建议进行及时、有效的规范化抗癫痫药物治疗或其他治疗。(弱推荐,C级证据)
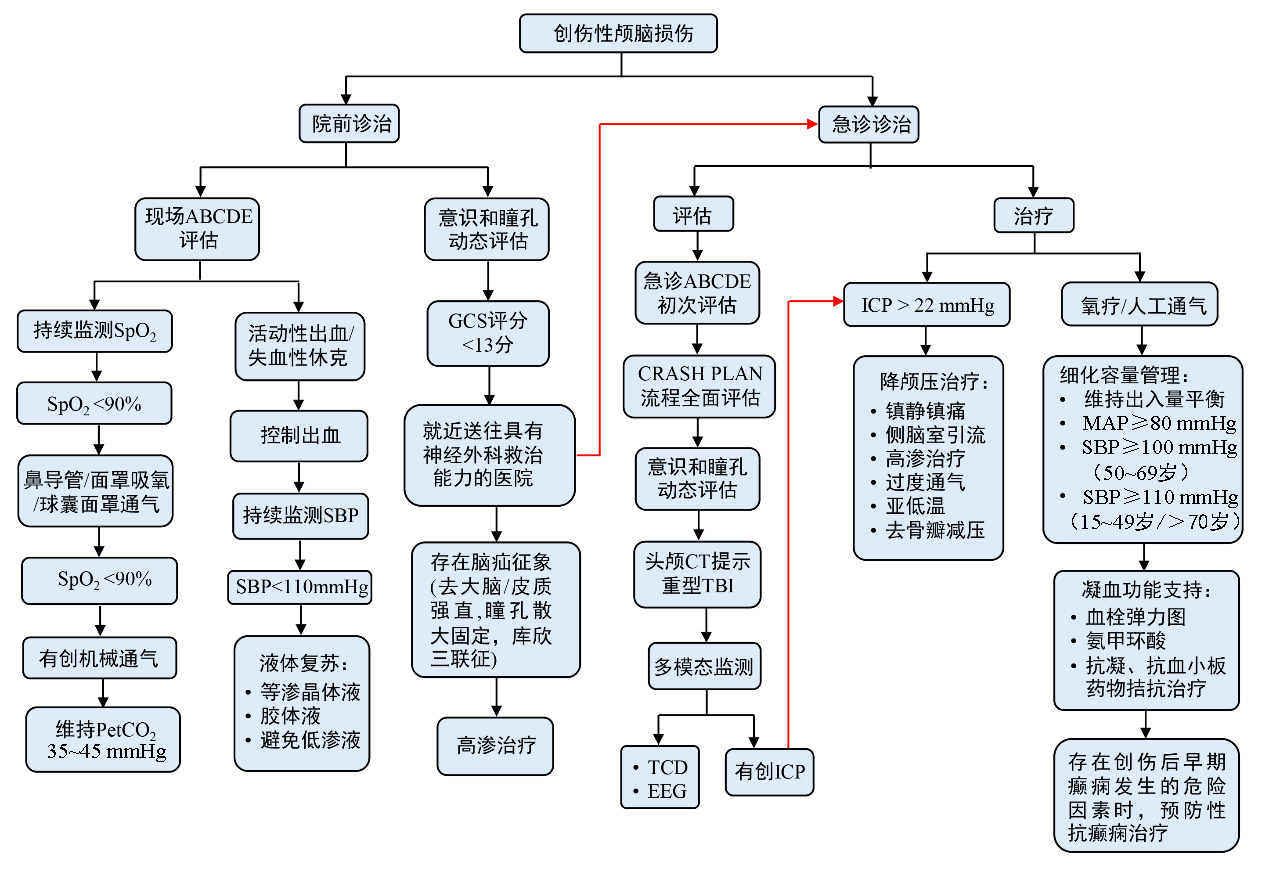
在TBI患者的救治中,尤其是重型TBI,早期精准识别病情的变化、及时干预危及生命的状况,并预防继发性脑损伤的诱因,是提高救治成功率及改善预后的关键(图 1)。院前急救时,医护人员需迅速依循ABCDE流程评估患者的伤情,重点关注通气、氧合、循环及全身体表等,动态监测意识及瞳孔变化,以便及时发现并处理活动性出血及脑疝等危及生命的紧急情况,疑似中型-重型TBI患者应优先转运至有神经外科救治能力的医疗机构。急诊急救阶段,要进行全面动态评估,包括CRASH PLAN创伤评估、意识和瞳孔评估、影像学评估及颅内压监测等,精准判断颅内及全身伤情,敏锐捕捉病情变化。治疗上,应维持有效通气及氧合,实施精细化液体复苏管理,对颅内压升高进行分级治疗,支持凝血功能,预防及处理癫痫发作。整个诊疗过程需遵循规范化原则,以降低病死率,改善功能预后。
|
| 注:SpO2为动脉血氧饱和度,PetCO2为呼气末二氧化碳分压,GCS为格拉斯哥昏迷评分,CT为计算机断层扫描,TBI为创伤性颅脑损伤,TCD为经颅多普勒超声,EEG为脑电图,ICP为颅内压,MAP为平均动脉压,SBP为收缩压,PTS为早期颅脑创伤后癫痫发作 图 1 成人创伤性颅脑损伤院前与急诊诊治决策流程图 |
|
|
由于TBI发生后最初几小时是颅内高压/脑疝发生的高峰期,具有极高的致残率和病死率。因此,院前和急诊救治对于降低患者的病死率,改善功能预后具有重要意义。通过对国内外相关指南、共识及近年来临床研究进展的全面回顾,本共识聚焦于院前和急诊急救,重点关注评估、监测和继发性颅脑损伤防治等方面,提出对TBI患者院前和急诊规范化诊治以及科学管理的推荐意见。由于TBI院前和急诊救治的临床研究较少,目前尚无专门针对该类创伤患者院前和急诊救治的管理指南,期待随着更多高质量临床研究的积累,未来会有更多的临床证据,以不断完善共识,最终改善TBI患者的预后。
共识执笔组成员:杨阳(空军军医大学唐都医院急诊医学科)、田小溪(空军军医大学唐都医院急诊医学科)、史正华(空军军医大学唐都医院急诊医学科)、王继鹏(空军军医大学唐都医院急诊医学科)
共识专家组成员(按姓名汉语拼音排序):白祥军(华中科技大学同济医学院附属同济医院急诊医学科)、曹阳(解放军总医院第四医学中心急诊医学科)、陈大庆(温州医科大学附属第二医院急诊医学科)、陈海鸣(南昌大学第一附属医院急诊医学科)、迟云飞(解放军总医院第四医学中心门诊部)、崇巍(中国医科大学附属第一医院急诊医学科)、党星波(陕西省人民医院急诊医学科)、邓永兵(重庆大学附属中心医院急诊医学科)、狄宝山(深圳市龙岗区中心医院急诊医学科)、杜工亮(陕西省人民医院急诊医学科)、窦清理(深圳市宝安区人民医院急诊医学科)、范晨芳(解放军医学杂志)、冯光(河南省人民医院急诊医学科)、冯军峰(上海交通大学医学院附属仁济医院神经外科)、甘涛(柳州市人民医院急诊医学科)、高峰(哈尔滨医科大学附属第二医院急诊医学科)、高亮(上海市第十人民医院神经外科)、高国一(首都医科大学附属北京天坛医院神经外科)、郭贯成(郑州大学第一附属医院急诊医学科)、何小军(《中华急诊医学杂志》编辑部)、黄齐兵(山东大学齐鲁医院急诊医学科)、冀兵(山西医科大学第一医院急诊医学科)、金红旭(北部战区总医院急诊医学科)、康新(南方医科大学第五附属医院急诊医学科)、李立宏(空军军医大学附属唐都医院急诊医学科)、李力卓(首都医科大学宣武医院急诊医学科)、李湘民(中南大学湘雅医院急诊医学科)、李小刚(中南大学附属湘雅医院急诊医学科)、李王安(惠州市第一人民医院急诊医学科)、李英男(联合参谋部警卫局卫生保健处)、梁永辉(航天中心医院急诊医学科)、蔺际龑(厦门大学第一附属医院急诊部)、刘爱军(解放军总医院神经外科学部)、刘劲芳(中南大学湘雅医院神经外科)、刘梅林(北京大学第一医院老年医学科)、刘明华(陆军军医大学第一附属医院急诊医学科)、刘双庆(解放军总医院第四医学中心急诊医学科)、刘斯(北京大学第一医院急诊医学科)、刘斯瑶(厦门大学附属第一医院急诊医学科)、刘亚巍(联合参谋部警卫局卫生保健处)、马可(复旦大学附属华山医院神经外科)、聂时南(东部战区总医院急诊医学科)、潘满冬(厦门大学附属第一医院急诊部)、彭鹏(新疆医科大学第一附属医院急救创伤中心)、单爱军(香港大学深圳医院急诊医学科)、邵玉静(联合参谋部警卫局卫生保健处)、沈俊(武汉大学中南医院急诊医学科)、孙玉发(联合参谋部警卫局卫生保健处)、唐柚青(广东省第二人民医院急诊医学科)、王海滨(济宁医学院附属医院创伤骨科)、王宁(首都医科大学北京宣武医院神经外科)、王培戈(青岛大学附属医院急诊医学科)、王威(广西医科大学第一附属医院急诊医学科)、王旭东(湖南航天医院急诊医学科)、王玉海(联勤保障部队第904医院神经外科)、王振杰(蚌埠医科大学第一附属医院急诊医学科)、魏智民(联合参谋部警卫局卫生保健处)、吴京兰(华中科技大学协和深圳医院急诊医学科)、吴利东(南昌大学第二附属医院急诊医学科)、吴巧艺(福建医科大学附属第一医院急诊医学科)、徐峰(苏州大学附属第一医院急诊医学科)、徐军(北京协和医院急诊医学科)、许硕贵(海军军医大学附属长海医院急诊医学科)、闫柏刚(重庆医科大学附属第三医院急诊医学科)、闫乐媛(解放军总医院第四医学中心门诊部)、闫伟(浙江大学医学院附属第二医院神经外科)、杨朝华(四川大学附属华西医院神经外科)、杨小峰(浙江大学医学院附属第一医院神经外科)、杨彦龙(陕西省人民医院急诊医学科)、姚爱明(徐州医科大学附属医院急诊医学科)、姚冬芳(解放军总医院第四医学中心护理部)、尹文(空军军医大学附属西京医院急诊医学科)、张国斌(天津市环湖医院颅脑创伤与重症医学科)、张磊冰(贵州省人民医院急诊外科)、张立春(中国医科大学附属盛京医院急诊医学科)、张茂(浙江大学医学院附属第二医院急诊医学科)、赵迪(河北医科大学第四医院神经外科)、赵刚(华中科技大学同济医学院附属协和医院急诊医学科)、赵晓东(解放军总医院第四医学中心门诊部)、周敏(中国科学技术大学附属第一医院重症医学科)、朱长举(郑州大学第一附属医院急诊医学部)、朱海燕(解放军总医院第一医学中心急诊医学科)、朱华栋(北京协和医院急诊医学科)、朱建军(苏州大学附属第二医院重症医学科)、朱延安(浙江省台州医院急诊医学科)、左永波(北京市海淀医院急诊医学科)
利益冲突 所有作者声明无利益冲突
| [1] | GBD 2016 Traumatic Brain Injury and Spinal Cord Injury Collaborators. Global, regional, and national burden of traumatic brain injury and spinal cord injury, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet Neurol, 2019, 18(1): 56-87. DOI:10.1016/S1474-4422(18)30415-0 |
| [2] | Jiang JY, Gao GY, Feng JF, et al. Traumatic brain injury in China[J]. Lancet Neurol, 2019, 18(3): 286-295. DOI:10.1016/S1474-4422(18)30469-1 |
| [3] | Lulla A, Lumba-Brown A, Totten AM, et al. Prehospital guidelines for the management of traumatic brain injury - 3rd edition[J]. Prehosp Emerg Care, 2023, 27(5): 507-538. DOI:10.1080/10903127.2023.2187905 |
| [4] | Balshem H, Helfand M, Schünemann HJ, et al. GRADE guidelines: 3. Rating the quality of evidence[J]. J Clin Epidemiol, 2011, 64(4): 401-406. DOI:10.1016/j.jclinepi.2010.07.015 |
| [5] | Rossaint R, Bouillon B, Cerny V, et al. The European guideline on management of major bleeding and coagulopathy following trauma: fourth edition[J]. Crit Care, 2016, 20: 100. DOI:10.1186/s13054-016-1265-x |
| [6] | Picetti E, Rossi S, Abu-Zidan FM, et al. WSES consensus conference guidelines: monitoring and management of severe adult traumatic brain injury patients with polytrauma in the first 24 hours[J]. World J Emerg Surg, 2019, 14: 53. DOI:10.1186/s13017-019-0270-1 |
| [7] | Kochanek PM, Tasker RC, Carney N, et al. Guidelines for the management of pediatric severe traumatic brain injury, third edition: update of the brain trauma foundation guidelines, executive summary[J]. Neurosurgery, 2019, 84(6): 1169-1178. DOI:10.1093/neuros/nyz051 |
| [8] | 中国医师协会神经外科医师分会, 中国神经创伤专家委员会. 中国颅脑创伤外科手术指南[J]. 中华神经外科杂志, 2009, 25(2): 100-101. DOI:10.3760/cma.j.issn.1001-2346.2009.02.003 |
| [9] | 中国人民解放军急救医学专业委员会, 中国医师协会急诊医师分会, 北京急诊医学学会, 等. 创伤失血性休克中国急诊专家共识(2023)[J]. 中国急救医学, 2023, 43(11): 841-854. DOI:10.3969/j.issn.1002-1949.2023.11.001 |
| [10] | Stocchetti N, Carbonara M, Citerio G, et al. Severe traumatic brain injury: targeted management in the intensive care unit[J]. Lancet Neurol, 2017, 16(6): 452-464. DOI:10.1016/S1474-4422(17)30118-7 |
| [11] | Gaither JB, Spaite DW, Bobrow BJ, et al. EMS treatment guidelines in major traumatic brain injury with positive pressure ventilation[J]. JAMA Surg, 2024, 159(4): 363-372. DOI:10.1001/jamasurg.2023.7155 |
| [12] | Robba C, Poole D, McNett M, et al. Mechanical ventilation in patients with acute brain injury: recommendations of the European Society of Intensive Care Medicine consensus[J]. Intensive Care Med, 2020, 46(12): 2397-2410. DOI:10.1007/s00134-020-06283-0 |
| [13] | Bossers SM, Mansvelder F, Loer SA, et al. Association between prehospital end-tidal carbon dioxide levels and mortality in patients with suspected severe traumatic brain injury[J]. Intensive Care Med, 2023, 49(5): 491-504. DOI:10.1007/s00134-023-07012-z |
| [14] | Shibahashi K, Hoda H, Okura Y, et al. Acceptable blood pressure levels in the prehospital setting for patients with traumatic brain injury: a multicenter observational study[J]. World Neurosurg, 2021, 149: e504-e511. DOI:10.1016/j.wneu.2021.01.145 |
| [15] | Shibahashi K, Sugiyama K, Okura Y, et al. Defining hypotension in patients with severe traumatic brain injury[J]. World Neurosurg, 2018, 120: e667-e674. DOI:10.1016/j.wneu.2018.08.142 |
| [16] | Hawryluk GWJ, Lulla A, Bell R, et al. Guidelines for prehospital management of traumatic brain injury 3rd edition: executive summary[J]. Neurosurgery, 2023, 93(6): e159-e169. DOI:10.1227/neu.0000000000002672 |
| [17] | Semler MW, Self WH, Wanderer JP, et al. Balanced crystalloids versus saline in critically ill adults[J]. N Engl J Med, 2018, 378(9): 829-839. DOI:10.1056/NEJMoa1711584 |
| [18] | Miyoshi Y, Kondo Y, Suzuki H, et al. Effects of hypertonic saline versus mannitol in patients with traumatic brain injury in prehospital, emergency department, and intensive care unit settings: a systematic review and meta-analysis[J]. J Intensive Care, 2020, 8: 61. DOI:10.1186/s40560-020-00476-x |
| [19] | Codorniu A, Charbit E, Werner M, et al. Comparison of mannitol and hypertonic saline solution for the treatment of suspected brain herniation during prehospital management of traumatic brain injury patients[J]. Eur J Emerg Med, 2024, 31(4): 287-293. DOI:10.1097/MEJ.0000000000001138 |
| [20] | Meyfroidt G, Bouzat P, Casaer MP, et al. Management of moderate to severe traumatic brain injury: an update for the intensivist[J]. Intensive Care Med, 2022, 48(6): 649-666. DOI:10.1007/s00134-022-06702-4 |
| [21] | Pham X, Ray J, Neto AS, et al. Association of neurocritical care services with mortality and functional outcomes for adults with brain injury: a systematic review and meta-analysis[J]. JAMA Neurol, 2022, 79(10): 1049-1058. DOI:10.1001/jamaneurol.2022.2456 |
| [22] | Rajesh S, Wonderling D, Bernstein I, et al. Head injury: assessment and early management-summary of updated NICE guidance[J]. BMJ, 2023, 381: 1130. DOI:10.1136/bmj.p1130 |
| [23] | Currie S, Saleem N, Straiton JA, et al. Imaging assessment of traumatic brain injury[J]. Postgrad Med J, 2016, 92(1083): 41-50. DOI:10.1136/postgradmedj-2014-133211 |
| [24] | Geeraerts T, Velly L, Abdennour L, et al. Management of severe traumatic brain injury (first 24hours)[J]. Anaesth Crit Care Pain Med, 2018, 37(2): 171-186. DOI:10.1016/j.accpm.2017.12.001 |
| [25] | Zeiler FA, Aries M, Czosnyka M, et al. Cerebral autoregulation monitoring in traumatic brain injury: an overview of recent advances in personalized medicine[J]. J Neurotrauma, 2022, 39(21/22): 1477-1494. DOI:10.1089/neu.2022.0217 |
| [26] | Gritti P, Bonfanti M, Zangari R, et al. Cerebral autoregulation in traumatic brain injury: ultra-low-frequency pressure reactivity index and intracranial pressure across age groups[J]. Crit Care, 2024, 28(1): 33. DOI:10.1186/s13054-024-04814-5 |
| [27] | Zeiler FA, Ercole A, Cabeleira M, et al. Descriptive analysis of low versus elevated intracranial pressure on cerebral physiology in adult traumatic brain injury: a CENTER-TBI exploratory study[J]. Acta Neurochir, 2020, 162(11): 2695-2706. DOI:10.1007/s00701-020-04485-5 |
| [28] | Carney N, Totten AM, O'Reilly C, et al. Guidelines for the management of severe traumatic brain injury, fourth edition[J]. Neurosurgery, 2017, 80(1): 6-15. DOI:10.1227/NEU.0000000000001432 |
| [29] | Vitt JR, Loper NE, Mainali S. Multimodal and autoregulation monitoring in the neurointensive care unit[J]. Front Neurol, 2023, 14: 1155986. DOI:10.3389/fneur.2023.1155986 |
| [30] | Zeiler FA, Cardim D, Donnelly J, et al. Transcranial Doppler systolic flow index and ICP-derived cerebrovascular reactivity indices in traumatic brain injury[J]. J Neurotrauma, 2018, 35(2): 314-322. DOI:10.1089/neu.2017.5364 |
| [31] | Dreier JP, Fabricius M, Ayata C, et al. Recording, analysis, and interpretation of spreading depolarizations in neurointensive care: Review and recommendations of the COSBID research group[J]. J Cereb Blood Flow Metab, 2017, 37(5): 1595-1625. DOI:10.1177/0271678X16654496 |
| [32] | Wiegers EJA, Lingsma HF, Huijben JA, et al. Fluid balance and outcome in critically ill patients with traumatic brain injury (CENTER-TBI and OzENTER-TBI): a prospective, multicentre, comparative effectiveness study[J]. Lancet Neurol, 2021, 20(8): 627-638. DOI:10.1016/S1474-4422(21)00162-9 |
| [33] | Hawryluk GWJ, Aguilera S, Buki A, et al. A management algorithm for patients with intracranial pressure monitoring: the Seattle International Severe Traumatic Brain Injury Consensus Conference (SIBICC)[J]. Intensive Care Med, 2019, 45(12): 1783-1794. DOI:10.1007/s00134-019-05805-9 |
| [34] | 中华医学会急诊医学分会危重症学组, 中国急诊成人镇痛、镇静与谵妄管理专家共识组. 中国急诊成人镇痛、镇静与谵妄管理专家共识[J]. 中华急诊医学杂志, 2023, 32(12): 1594-1609. DOI:10.3760/cma.j.issn.1671-0282.2023.12.004 |
| [35] | Mangat HS, Wu X, Gerber LM, et al. Hypertonic saline is superior to mannitol for the combined effect on intracranial pressure and cerebral perfusion pressure burdens in patients with severe traumatic brain injury[J]. Neurosurgery, 2020, 86(2): 221-230. DOI:10.1093/neuros/nyz046 |
| [36] | Schwimmbeck F, Voellger B, Chappell D, et al. Hypertonic saline versus mannitol for traumatic brain injury: a systematic review and meta-analysis with trial sequential analysis[J]. J Neurosurg Anesthesiol, 2021, 33(1): 10-20. DOI:10.1097/ANA.0000000000000644 |
| [37] | van Veen E, Nieboer D, Kompanje EJO, et al. Comparative effectiveness of mannitol versus hypertonic saline in patients with traumatic brain injury: a CENTER-TBI study[J]. J Neurotrauma, 2023, 40(13/14): 1352-1365. DOI:10.1089/neu.2022.0465 |
| [38] | 中华医学会神经外科学分会, 中国神经外科重症管理协作组. 中国神经外科重症管理专家共识(2020版)[J]. 中华医学杂志, 2020, 100(19): 1443-1458. DOI:10.3760/cma.j.cn112137-20200318-00818 |
| [39] | Brandi G, Stocchetti N, Pagnamenta A, et al. Cerebral metabolism is not affected by moderate hyperventilation in patients with traumatic brain injury[J]. Crit Care, 2019, 23(1): 45. DOI:10.1186/s13054-018-2304-6 |
| [40] | Citerio G, Robba C, Rebora P, et al. Management of arterial partial pressure of carbon dioxide in the first week after traumatic brain injury: results from the CENTER-TBI study[J]. Intensive Care Med, 2021, 47(9): 961-973. DOI:10.1007/s00134-021-06470-7 |
| [41] | Gouvêa Bogossian E, Salvagno M, Fiore M, et al. Impact of fever on the outcome non-anoxic acute brain injury patients: a systematic review and meta-analysis[J]. Crit Care, 2024, 28(1): 367. DOI:10.1186/s13054-024-05132-6 |
| [42] | Rubiano AM, Sanchez AI, Estebanez G, et al. The effect of admission spontaneous hypothermia on patients with severe traumatic brain injury[J]. Injury, 2013, 44(9): 1219-1225. DOI:10.1016/j.injury.2012.11.026 |
| [43] | Hui JY, Feng JF, Tu Y, et al. Safety and efficacy of long-term mild hypothermia for severe traumatic brain injury with refractory intracranial hypertension (LTH-1): a multicenter randomized controlled trial[J]. EClinicalMedicine, 2021, 32: 100732. DOI:10.1016/j.eclinm.2021.100732 |
| [44] | Chen HB, Wu F, Yang PL, et al. A meta-analysis of the effects of therapeutic hypothermia in adult patients with traumatic brain injury[J]. Crit Care, 2019, 23(1): 396. DOI:10.1186/s13054-019-2667-3 |
| [45] | Jo KW. Target temperature management in traumatic brain injury with a focus on adverse events, recognition, and prevention[J]. Acute Crit Care, 2022, 37(4): 483-490. DOI:10.4266/acc.2022.01291 |
| [46] | Hutchinson PJ, Kolias AG, Timofeev IS, et al. Trial of decompressive craniectomy for traumatic intracranial hypertension[J]. N Engl J Med, 2016, 375(12): 1119-1130. DOI:10.1056/NEJMoa1605215 |
| [47] | James Cooper D, Rosenfeld JV, Murray L, et al. Patient outcomes at twelve months after early decompressive craniectomy for diffuse traumatic brain injury in the randomized DECRA clinical trial[J]. J Neurotrauma, 2020, 37(5): 810-816. DOI:10.1089/neu.2019.6869 |
| [48] | Hawryluk GWJ, Rubiano AM, Totten AM, et al. Guidelines for the management of severe traumatic brain injury: 2020 update of the decompressive craniectomy recommendations[J]. Neurosurgery, 2020, 87(3): 427-434. DOI:10.1093/neuros/nyaa278 |
| [49] | 中华神经外科学会神经创伤专业组. 颅脑创伤去骨瓣减压术中国专家共识[J]. 中华神经创伤外科电子杂志, 2015(2): 6-8. DOI:10.3877/cma.j.issn.2095-9141.2015.02.003 |
| [50] | 王飒, 闫丹萍, 武作家, 等. 急诊成人创伤活动性出血患者止血措施的证据等级总结[J]. 中华急诊医学杂志, 2024, 33(12): 1781-1787. DOI:10.3760/cma.j.issn.1671-0282.2024.12.022 |
| [51] | Roberts I, Shakur-Still H, Aeron-Thomas A, et al. Tranexamic acid to reduce head injury death in people with traumatic brain injury: the CRASH-3 international RCT[J]. Health Technol Assess, 2021, 25(26): 1-76. DOI:10.3310/hta25260 |
| [52] | CRASH-3 Intracranial Bleeding Mechanistic Study Collaborators. Tranexamic acid in traumatic brain injury: an explanatory study nested within the CRASH-3 trial[J]. Eur J Trauma Emerg Surg, 2021, 47(1): 261-268. DOI:10.1007/s00068-020-01316-1 |
| [53] | Baksaas-Aasen K, Gall LS, Stensballe J, et al. Viscoelastic haemostatic assay augmented protocols for major trauma haemorrhage (ITACTIC): a randomized, controlled trial[J]. Intensive Care Med, 2021, 47(1): 49-59. DOI:10.1007/s00134-020-06266-1 |
| [54] | Samuels JM, Moore EE, Silliman CC, et al. Severe traumatic brain injury is associated with a unique coagulopathy phenotype[J]. J Trauma Acute Care Surg, 2019, 86(4): 686-693. DOI:10.1097/TA.0000000000002173 |
| [55] | Cannon JW, Dias JD, Kumar MA, et al. Use of thromboelastography in the evaluation and management of patients with traumatic brain injury: a systematic review and meta-analysis[J]. Crit Care Explor, 2021, 3(9): e0526. DOI:10.1097/CCE.0000000000000526 |
| [56] | Fang TL, Valdes E, Frontera JA. Levetiracetam for seizure prophylaxis in neurocritical care: a systematic review and meta-analysis[J]. Neurocrit Care, 2022, 36(1): 248-258. DOI:10.1007/s12028-021-01296-z |
| [57] | Karamian A, Farzaneh H, Taheri M, et al. Effectiveness of Levetiracetam versus phenytoin in preventing seizure in traumatic brain injury patients: a systematic review and meta-analysis[J]. Clin Neurol Neurosurg, 2024, 240: 108251. DOI:10.1016/j.clineuro.2024.108251 |
| [58] | Fiani B, Andraos C, Mabry I, et al. A comparison of seizure prophylaxis: phenytoin versus levetiracetam[J]. Cureus, 2021, 13(5): e14956. DOI:10.7759/cureus.14956 |
| [59] | Laing J, Gabbe B, Chen ZB, et al. Risk factors and prognosis of early posttraumatic seizures in moderate to severe traumatic brain injury[J]. JAMA Neurol, 2022, 79(4): 334-341. DOI:10.1001/jamaneurol.2021.5420 |
 2025, Vol. 34
2025, Vol. 34