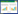2. 上海交通大学医学院附属新华医院泌尿外科,上海 200092
2. Department of Urology, Xinhua Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200092, China
严重烧伤患者救治难度大,预后不良且死亡率高[1]。由于皮肤缺损和机体应激状态,创面感染、高代谢状态、免疫功能紊乱、肠黏膜屏障破坏等因素协同诱导烧伤患者脓毒症和多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)的发生发展[2–5]。尤其是大面积烧伤患者在住院期间可能发生多次脓毒症,因此,早期识别可能发展为脓毒症的体征和症状并加以干预,对于延长患者的无脓毒症生存期至关重要。研究表明超过60%的烧伤患者死于感染并发症如脓毒症,几乎所有患者至少存在一个器官功能衰竭[4]。国内研究亦显示,成人特重度烧伤合并脓毒症患者病死率高达48.3%,其早期预后受血钠、降钙素原及血红蛋白等指标影响[6]。
肝脏作为调节代谢、凝血及免疫功能的重要器官,其功能障碍常在脓毒症早期出现,并与患者死亡直接相关[7]。烧伤后,急性肝衰竭(acute liver failure, ALF)的发生可能归因于肝脏灌注不足、肝毒性物质产生、肝内胆汁淤积、肝细胞程序性死亡增加等潜在机制[8]。ALF的发生伴随着全身炎症与抗炎反应,在后续的临床过程中,全身炎症反应失调与感染症状相似。同时,ALF会影响其他重要器官系统,最终导致脓毒症及MODS的不可避免的发生[9]。尽管既往已有针对烧伤患者脓毒症独立影响因素的研究,但大多集中于常见的临床指标,对ALF报道较少。此外,传统研究常以生存与否作为主要临床结局指标,未能充分揭示脓毒症发生的动态过程。无脓毒症生存(sepsis-free survival, SFS)作为一个更敏感的中间结局指标,有助于捕捉炎症失控与感染蔓延的关键节点,体现对高危人群的早期识别价值[10]。本研究收集中国昆山工厂铝粉尘爆炸中成功送医的烧伤患者的详细临床资料,通过回顾性队列研究评估ALF对于烧伤患者脓毒症的预测价值。此研究对于完善烧伤脓毒症早期特异性诊断体系、提高烧伤患者生存率有着重要临床意义。
1 资料与方法 1.1 研究对象本研究采用多中心回顾性研究方法,纳入2014年8月2日至2015年4月13日就诊于江苏及上海地区20家医疗单位的全部烧伤患者。上述患者均来自2014年8月2日江苏昆山工厂铝粉尘爆炸事故现场。
纳入标准:2014年8月2日江苏昆山工厂铝粉尘爆炸事件中,所有成功送达医院并接受救治的烧伤患者,年龄、性别不限。排除标准:当场或送医途中死亡的患者,以及入院后24 h内死亡者,确保所有纳入病例均有明确随访观察窗口,最短生存时间为1 d。
随访截止时间为2015年4月13日。本研究符合STROBE声明,已获海军军医大学第一附属医院伦理委员会批准(批号:CHEC2023-274)。
1.2 临床资料收集患者性别、年龄、烧伤总面积、从送医到脓毒症发生所经天数及是否发生器官功能障碍、感染性休克、吸入性损伤、ALF、是否输血等临床变量信息。
其中,脓毒症的诊断基于2007年美国烧伤烧伤协会在全身炎症反应综合征标准上制定的烧伤脓毒症诊断标准[11]:成人明确感染且符合以下6条标准中的3条:(1)体温>39℃或<36.5℃;(2)心率>110次/min;(3)呼吸>25次/min或机械通气>12 L/min;(4)血小板计数<10 000/mm3;(5)高血糖状态:无糖尿病基础上,血糖>11.1 mmol/L或出现胰岛素抵抗;(6)肠内营养不耐受超过24 h,包括腹胀、腹泻、胃潴留。ALF的诊断基于2005年美国肝病研究学会所发布的ALF处理共识[12]及本中心多年的烧伤诊治临床经验:急性起病,2周内迅速发展并加重的肝功能障碍,患者无既往慢性肝病史,出现以下核心表现:(1)凝血功能障碍:国际标准化比值≥1.5或血浆凝血酶原活动度≤40%;(2)伴或不伴肝性脑病:表现为精神状态改变;(3)其他临床表现包括:极度乏力伴严重消化道症状,短期内黄疸迅速加深并出现酶胆分离,以及肝脏体积进行性缩小。根据随访期内是否诊断为合并ALF将纳入患者分为ALF组和非ALF组。
1.3 入院后管理所有患者入院后均接受早期复苏、烧伤创面覆盖、重症监护和(或)支持性护理以及康复四个阶段综合对症治疗,病程中包括但不限于液体复苏、血浆及白蛋白输注、营养支持、并发症及相应器官功能保护、局部抗生素或敷料预防感染、手术清创、自体移植或临时皮肤替代物覆盖、机械通气、深静脉置管等。多学科团队协作,包括烧伤专科医生、重症监护专家、营养师和康复治疗师,共同制定个体化治疗方案,在患者生命体征初步稳定的前提下实施早期清创术、切削痂术、分期植皮术、皮瓣移植术以及后期整形修复手术,提高患者的生存率和生活质量。
1.4 统计学分析使用R 4.2.2软件进行数据分析。组间计量资料比较时,正态分布者采用独立样本t检验,数据以均数±标准差(x±s)表示;非正态分布者采用Wilcoxon秩和检验,结果以中位数(四分位数)[M(Q1,Q3)]表示;组间计数资料比较时,采用χ2检验,以频数表示。首先,在单因素分析中,采用Kaplan-Meier生存分析评估两组的临床结局及研究结局差异。随后,通过卡方检验开展亚组分析,探讨ALF与多种临床变量的相关性。最后,多因素Cox回归模型用于筛选脓毒症的独立危险因素。在混杂因素分析中,剔除相关变量缺失的患者数据,以保证统计分析的准确性与结果的稳健性;在多因素Cox回归分析中,进一步排除关键临床信息缺失者。为全面评价模型性能,进一步进行残差分析、决策曲线分析(decision curve analysis, DCA)、校准曲线、受试者工作特征(receiver operating characteristic, ROC)曲线分析,并计算一致性指数(C-index)与赤池信息量准则(AIC)。结果通过森林图和列线图可视化。以P<0.05为差异具有统计学意义。
2 结果 2.1 患者基线资料比较该事件共造成260人伤亡,其中75人于现场或转运途中死亡,本研究共纳入185例成功送医并接受系统救治的烧伤患者,其中ALF组21例(11.35%),非ALF组164例(88.65%)。表 1为两组患者在年龄、性别、烧伤总面积、临床结局及是否实现SFS等方面的详细基线信息。ALF组患者年龄偏高(P=0.005),41~60岁患者15例(71.43%),而非ALF组19~40岁患者占比为60.98%。
| 指标 | ALF组(n=21) | 非ALF组(n=164) | 统计值 | P值 |
| 年龄(岁) | 7.989 | 0.005 | ||
| 19~40 | 6 (28.57) | 100 (60.98) | ||
| 41~60 | 15 (71.43) | 64 (39.02) | ||
| 性别 | 0.073 | 0.788 | ||
| 男性 | 11 (52.38) | 91 (55.49) | ||
| 女性 | 10 (47.62) | 73 (44.51) | ||
| 烧伤总面积占体表总面积百分比(%) | -2.547 | 0.011 | ||
| <70 | 0 (0.00) | 26 (15.85) | ||
| 70~79 | 0 (0.00) | 9 (5.49) | ||
| 80~89 | 1 (4.76) | 16 (9.76) | ||
| 90~95 | 8 (38.10) | 54 (32.93) | ||
| 96~100 | 12 (57.14) | 59 (35.98) | ||
| 三度和四度烧伤面积占烧伤总面积百分比(%) | -1.688 | 0.091 | ||
| >20 | 21 (100.00) | 144 (87.80) | ||
| ≤20 | 0 (0.00) | 14 (8.54) | ||
| 未知 | 0 (0.00) | 6 (3.66) | ||
| 合并吸入性损伤 | 21 (100.00) | 153 (93.29) | 0.538 | 0.463 |
| 并发症 | ||||
| 脓毒症 | 21 (100.00) | 97 (59.15) | 13.451 | <0.001 |
| 感染性休克 | 19 (90.48) | 58 (35.37) | 23.269 | <0.001 |
| DIC | 11 (52.38) | 9 (5.49) | 37.732 | <0.001 |
| MODS | 19 (90.48) | 60 (36.59) | 22.097 | <0.001 |
| 临床结局 | 20.627 | <0.001 | ||
| 存活 | 3 (14.29) | 108 (65.85) | ||
| 死亡 | 18 (85.71) | 56 (34.15) | ||
| 研究结局 | 12.233 | <0.001 | ||
| 无脓毒症生存(是) | 0 (0.00) | 63 (38.41) | ||
| 无脓毒症生存(否) | 21 (100.00) | 101 (61.59) | ||
| 注:DIC为弥散性血管内凝血,MODS为多器官功能障碍综合征 | ||||
所有接受治疗的烧伤患者的病因均为火焰烧伤,ALF组烧伤总面积占体表总面积超过90%的患者比例为95.24%,远高于非ALF组的68.90%。根据1970年上海全国烧伤会议确立的烧伤严重程度分类,烧伤总面积达50%以上或三度烧伤面积达20%以上称为特重度烧伤。三度及以上烧伤面积>20%的比例在ALF组为100%,非ALF组为87.80%。ALF组住院期间并发症的发生率高于非ALF组(均P<0.001)。
临床结局方面,ALF组死亡18例(85.71%),无一例实现SFS;非ALF组死亡56例(34.15%),实现SFS 63例(38.41%)(均P<0.001)。在全部185例患者中,共有63例(34.05%)实现SFS,其比例与非ALF组(38.41%)基本接近;相比之下,ALF组无一例实现SFS,其SFS结局区别于非ALF组和整体患者队列。
2.2 烧伤患者ALF的发生与总体生存及无脓毒症生存的关系应用Kaplan-Meier生存曲线对ALF组和非ALF组患者进行单因素分析,评估ALF的发生对烧伤患者预后的影响。分析结果显示,ALF组的总体生存(overall survival, OS)和SFS时间均短于非ALF组(P<0.001)(图 1A~B)。在不同的年龄亚组中,ALF组患者的SFS时间均长于非ALF组(P<0.05)(图 1C~D)。此外,这种差异在男性和女性患者中也一致(图 1E~F),说明ALF的发生导致烧伤患者的不良预后与年龄和性别无关。
|
| 注:A为总体生存情况;B为无脓毒症生存情况:C为年龄亚组(19~40岁);D为年龄亚组(41~60岁);E为性别亚组(男性);F为性别亚组(女性) 图 1 Kaplan-Meier生存法分析ALF组和非ALF组烧伤患者生存情况 Fig 1 Kaplan-Meier survival analysis of severe burn patients with ALF and non-ALF groups |
|
|
采用卡方检验进行亚组分析,探究烧伤患者ALF的发生与多种临床特征的相关性。如表 2所示,ALF组与非ALF组在器官功能障碍的发生率方面差异有统计学意义(均P<0.001),ALF的出现常常伴随多器官功能障碍,可能构成MODS链条中的核心触发环节。非ALF组的血液透析使用(P<0.001)和送医前深静脉置管(P=0.017)比例较低。
| 指标 | ALF组(n=21) | 非ALF组(n=164) | 统计值 | P值 |
| 器官功能障碍 | ||||
| AKI | 20 (95.24) | 36 (21.95) | 47.371 | <0.001 |
| AHF | 19 (90.48) | 61 (37.20) | 21.533 | <0.001 |
| ARDS | 19 (90.48) | 54 (32.93) | 25.809 | <0.001 |
| 侵入性治疗操作 | ||||
| 气管切开术 | 21 (100) | 133 (81.10) | 1.809 | 0.179 |
| 呼吸机辅助通气 | 21 (100) | 139 (84.76) | 3.701 | 0.050 |
| 送医前深静脉置管 | 15 (71.43) | 72 (43.90) | 5.662 | 0.017 |
| 血液透析 | 19 (90.48) | 55 (33.54) | 25.148 | <0.001 |
| 早期切削痂术 | 7 (33.33) | 74 (45.12) | 1.051 | 0.305 |
| 减压切削痂术 | 17 (80.95) | 99 (60.37) | 3.374 | 0.066 |
| 注:AKI为急性肾衰竭,AHF为急性心力衰竭,ARDS为急性呼吸窘迫综合征 | ||||
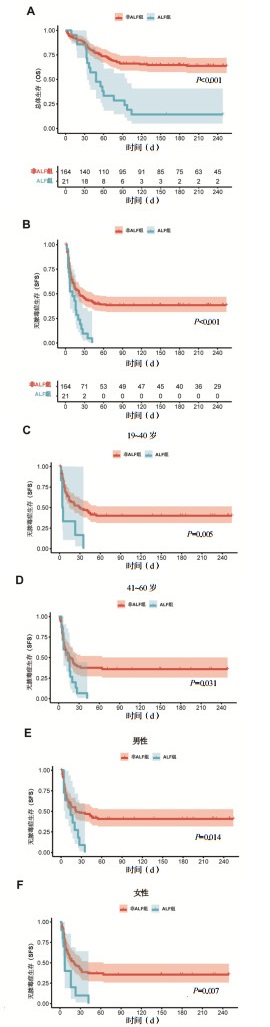
为进一步明确影响烧伤合并ALF患者短期生存的独立危险因素,基于多因素Cox回归分析构建了预后评估模型。最终纳入模型的变量包括年龄、性别、是否发生ALF及三/四度烧伤面积比例(图 2A)。模型具有统计学意义(全局log-rank检验P=0.001),其AIC值为979.87,C-index为0.612,提示模型具有中等判别能力。模型显示,ALF组脓毒症不良预后结局的风险显著高于非ALF组(HR=1.68, 95%CI: 1.00~2.80, P<0.05),提示其为SFS失败的独立预测因子。
|
| 注:A为多因素Cox回归分析森林图;B为Schoenfeld残差检验图;C为不同时间点对烧伤患者SFS预测的ROC曲线;D为预测模型校准曲线;E为预测模型决策曲线 图 2 多因素Cox回归分析及模型诊断 Fig 2 Multivariate Cox regression analysis and model diagnostics |
|
|
为进一步验证模型的稳定性与预测准确性,从以下几方面进行了系统诊断:(1)残差分析:偏差残差图(图 2B)中大部分残差位于-2至+2之间,且未见明显系统性偏离,提示模型拟合良好,无严重离群值或误差积聚现象;(2)判别能力:ROC曲线分析(图 2C)显示,模型在2、4、8及12周时点的SFS预测中,AUC分别为0.626、0.714、0.703和0.706,其中4至12周的AUC均超过0.7,提示模型在中后期具有较好的判别效能;(3)校准能力:基于1 000次重抽样的校准曲线(图 2D)显示,模型在各时间点预测值与实际观察值间具有良好一致性,尤其在4周与8周SFS预测中校准表现最佳,曲线接近理想线,表明模型具有良好的稳定性与可靠性;(4)临床净效益:DCA(图 2E)显示,在大部分临床相关阈值概率范围内(0.2~0.6),使用本模型预测SFS优于“对所有患者预测事件”或“对所有患者预测非事件”的策略,具有更高的净收益,证明模型在临床决策中具有一定实用价值。
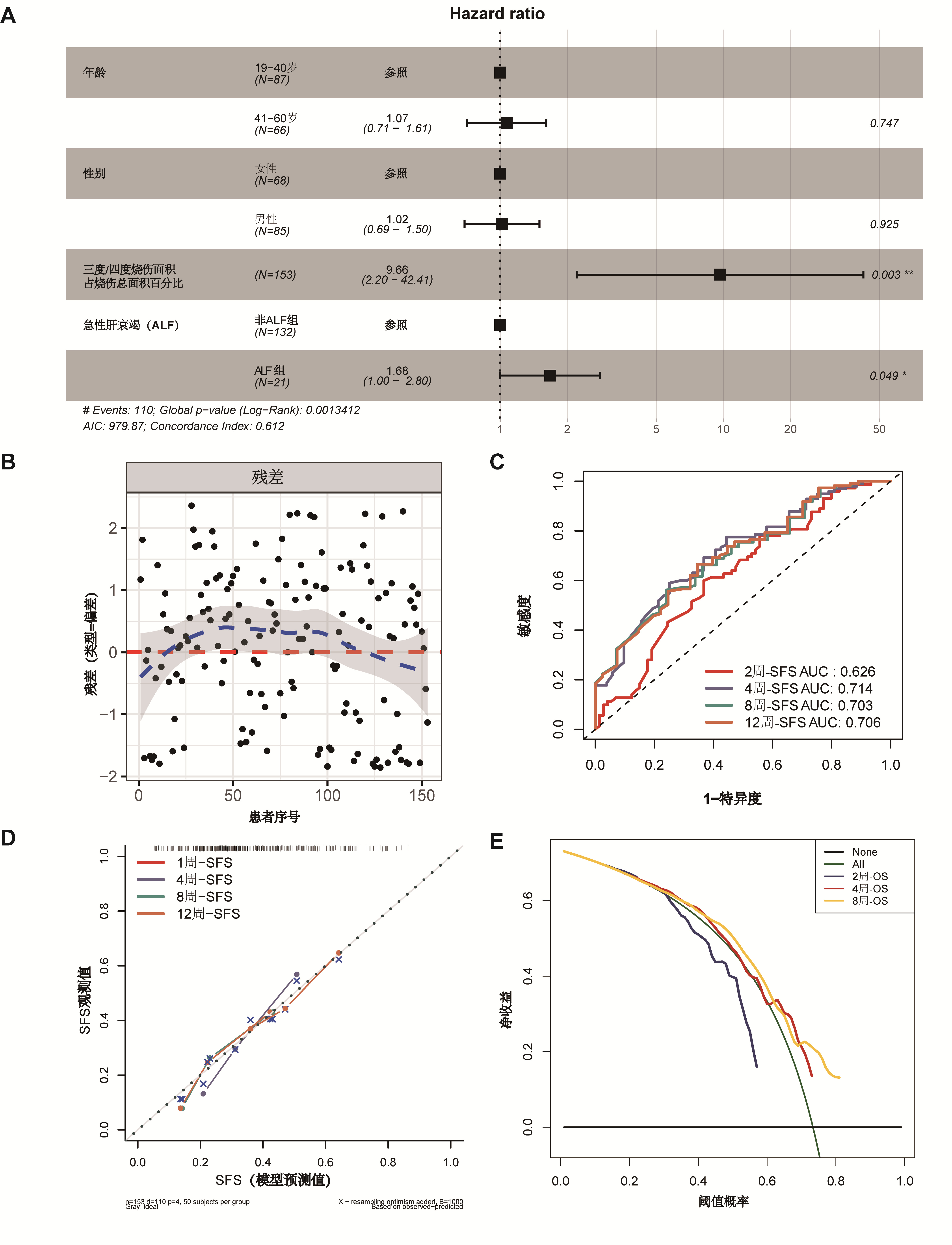
为进一步提升模型的临床可操作性,在多因素Cox回归的基础上构建了列线图预测工具(图 3),实现对烧伤患者2~12周脓毒症发生风险的可视化评估。该列线图集成了各项独立预测变量(包括ALF)所赋权重,便于临床医生根据个体特征快速计算脓毒症发生概率,实现更精准的风险分层管理与个体化干预决策。
|
| 图 3 预测烧伤患者2~12周脓毒症发生的列线图 Fig 3 Nomogram for predicting sepsis occurrence in severe burn patients from week 2 to week 12 |
|
|
多样性和异质性是烧伤脓毒症临床表现的显著特征。尽管同一起重大事故中的烧伤患者致伤因素一致,烧伤面积和深度相似,并在相同医疗条件下救治,院内脓毒症程度和症状体征仍可能存在差异。Zhang等[13]根据临床表现将脓毒症分为基本型、呼吸功能障碍型、多器官功能障碍型和神经功能障碍型,其中多器官功能障碍型脓毒症患者病死率最高。因此,保护烧伤患者重要器官功能尤为重要。本研究表明,尽管ALF患者仅占11.35%,但其结局表现高度一致:21例ALF患者中脓毒症发生率为100%,病死率达85.71%,且无一例实现SFS。相比之下,非ALF组SFS比例为38.41%,与整体患者的SFS实现率(34.05%)接近。这一差异提示,ALF虽非唯一致死机制,但一旦出现,往往提示病情快速恶化,具有明确的预警价值。多因素Cox回归分析进一步证实,ALF可作为脓毒症发生的独立预测因素(HR=1.68, 95%CI: 1.00~2.80, P<0.05),在预测本研究所关注的结局—SFS失败方面具有独立指示意义。因此,早期防治ALF对于改善烧伤患者的预后至关重要。
烧伤后肝功能受损与脓毒症的发生密切相关[14]。广泛的血管渗漏是严重烧伤后组织损伤引起的全身病理生理改变的始动环节。明显的毛细血管渗漏可归因于以一氧化氮和炎症介质水平升高为标志的氧化应激反应,这在大面积深度烧伤患者中尤为严重[15-16]。此外,烧伤后液体复苏治疗会加重组织间隙水肿,进一步导致微循环障碍及肝脏等多器官的缺血缺氧[17]。免疫失调和高代谢反应是烧伤后的另外两个关键病理过程。烧伤后数小时内,损伤产生的各种内源性因子被单核细胞、巨噬细胞和中性粒细胞等免疫细胞识别,它们作为Toll样受体和NOD样受体的特异性配体激活炎症级联反应,导致炎症介质释放进入循环,诱发全身炎症反应综合征[18]。研究表明,烧伤面积超过体表面积的三分之一即可诱导机体发生以高分解代谢为主的全身代谢变化[19]。肝脏是一个极其重要的代谢和免疫器官,参与蛋白质合成、脂肪代谢、血糖平衡和免疫调节[9, 20-21]。研究表明,烧伤后高代谢状态导致大量脂肪分解,产生如甘油三酯、游离脂肪酸和二酰甘油等脂肪毒性中间产物。这些物质转移到肝脏,灌注不足功能受损的肝脏无法代谢所有累积物质,从而进一步加重肝功能损伤[22]。更重要的是,ALF可激活神经-内分泌轴和炎症通路,导致高能量消耗和高代谢状态,同时伴随胰岛素代谢障碍及血糖调节紊乱,从而导致脓毒症及多器官功能衰竭的临床结局[23]。
器官串扰是重症患者发生MODS的关键机制之一。其本质是多个器官之间通过炎症因子、代谢产物、激素、外泌体及神经调节等介质实现的远程信号交换与协同调节。在脓毒症及ALF等高炎症状态下,器官串扰会表现为免疫激活、代谢重编程与自主神经失衡等现象,形成一类“炎症-代谢-神经”高度耦合的正反馈环路,进而加速多器官功能障碍的发生与进展[24]。例如,AKI可通过尿毒素和IL-6影响心肺功能,肺部炎症亦可反向加重肾损伤;肝脏通过分泌肝脏因子影响免疫代谢,外泌体在器官间炎症放大中也发挥重要作用[25-26]。这些机制共同构成脓毒症中多器官失调的病理基础。亚组分析结果提示,ALF组烧伤患者更易发生合并症和器官功能障碍,尤以DIC、AKI为甚。这也印证了既往研究:任何器官的突然或慢性功能障碍都会导致另一器官的调节异常,由信号传导因子介导的远处器官之间的复杂相互串扰对全身病理生理反应有着深远影响[27]。尽管烧伤本身可通过炎症和免疫功能紊乱等多条机制直接引起脓毒症,ALF的发生也可介导其他器官的功能障碍,协同促进烧伤脓毒症的发生。既往研究显示,高达80%的ALF患者会并发AKI[28],这在本次烧伤患者队列中得到了验证。肝细胞中损伤相关的分子模式的释放、肝功能急剧下降引起的血流动力学紊乱等,诱导了以肾前性氮质血症、急性肾小管坏死和肝肾综合征为主要标志的AKI[29-30]。此外,肝脏解毒功能受损与AKI共同减少肾氨的排泄,直接导致神经元功能障碍和脑水肿,即肝性脑病,也是ALF的重要临床表现。肠道和肝脏之间的串扰被广泛认可,因为它们通过胆道、门静脉和体循环进行双向交流。由于肠肝轴的相互作用,严重烧伤患者体内炎症因子和氧自由基水平的升高,损害了肝脏的清除能力并破坏肠道菌群,或直接损伤肝实质并引起炎症风暴。肝功能障碍、细菌清除率降低和代谢紊乱会导致肠道菌群失调增加和肠道屏障进一步破坏,从而引发脓毒症和MODS[31-32]。由此可知,ALF的发生影响烧伤后整体预后和转归。密切监护烧伤后肝功能的变化,并对远隔器官加以综合性预防治疗,对促进烧伤患者SFS有重要意义。
更重要的是,本研究发现,血液透析、深静脉置管和辅助通气等侵入性治疗与烧伤患者ALF的发生相关。在烧伤后全身炎症反应综合征以外,巨噬细胞的抗原呈递或中性粒细胞对入侵病原体的杀伤、T细胞增殖和IL-2的产生也受到抑制,这些事件共同导致适应性免疫反应受损,从而增加感染的易感性[4]。各项侵入性操作增加了患者发生导管相关血流感染和机械通气相关下呼吸道感染的可能性。由于肝脏是补体合成的主要场所,ALF发生后血清补体水平降低,中性粒细胞的趋化能力随之下调,增加了机体因侵入性操作导致的定殖生物体感染的风险[33]。肝脏制造的血浆纤连蛋白减少,影响Kupffer细胞清除循环中微生物的能力,从而导致免疫细胞的吞噬功能障碍[23]。因此,ALF的发生使机体易受病原体入侵。侵入性因素造成的感染可进一步加重肝功能障碍,形成诱导脓毒症发生的恶性循环。
本研究表明,对于烧伤患者这一特殊临床人群,ALF与脓毒症在预后方面相关,ALF可作为烧伤后脓毒症发生的独立预测因素,辅助脓毒症的早期预防。尽管本研究为烧伤脓毒症的早期防治提供了有价值的临床信息,但仍存在一些局限。首先,本研究属于回顾性队列研究,论证强度有待提升。其次,本研究的人群来自特定灾难事件,研究结论应用于不同地区、种族和因素所致烧伤时需谨慎考量。此外,需要指出的是,并非所有死亡患者均发生ALF,提示烧伤致死机制复杂,可能涉及感染性休克、AKI、急性心力衰竭、急性呼吸窘迫综合征等多因素共同作用。ALF虽非唯一死亡机制,但其一旦出现,常代表病情进入更严重的免疫和器官失衡阶段。
综上,ALF不仅是烧伤后脓毒症发生的早期指征,也可能是器官串扰放大的中枢环节。其识别有助于脓毒症的早期干预与精准预警。后续研究将结合SOFA评分、炎症代谢指标、分子分型等多维参数,扩展至不同事件的烧伤患者队列,深入评估患者的异质性,探索ALF在烧伤后免疫失衡进程中的作用机制与预测模型优化价值。
作者贡献声明丁欣然:研究的构思与设计,实施研究,分析/解释数据,撰写论文;张伟:研究的构思与设计,分析/解释数据;刘逸凡、徐达圆:数据的收集与整理;佟希睿、姚蕴韬:统计分析及图表绘制工作;黄润之、纪世召:参与结果的解读并对文章进行了重要的修改意见反馈;夏照帆:对整个研究进行统筹与指导,并对最终稿件进行审批
利益冲突 所有作者声明无利益冲突
作者贡献声明 丁欣然:研究的构思与设计,实施研究,分析/解释数据,撰写论文;张伟:研究的构思与设计,分析/解释数据;刘逸凡、徐达圆:数据的收集与整理;佟希睿、姚蕴韬:统计分析及图表绘制工作;黄润之、纪世召:参与结果的解读并对文章进行了重要的修改意见反馈;夏照帆:对整个研究进行统筹与指导,并对最终稿件进行审批
| [1] | Song HP, Yuan ZQ, Peng YZ, et al. Extracorporeal membrane oxygenation combined with continuous renal replacement therapy for the treatment of severe burns: current status and challenges[J]. Burns Trauma, 2021, 9: tkab017. DOI:10.1093/burnst/tkab017 |
| [2] | Yoon J, Kym D, Hur J, et al. The clinical differentiation of blood culture-positive and-negative sepsis in burn patients: a retrospective cohort study[J]. Burns Trauma, 2023, 11: tkad031. DOI:10.1093/burnst/tkad031 |
| [3] | Osborne T, Wall B, Edgar DW, et al. Current understanding of the chronic stress response to burn injury from human studies[J]. Burns Trauma, 2023, 11: tkad007. DOI:10.1093/burnst/tkad007 |
| [4] | Jeschke MG, van Baar ME, Choudhry MA, et al. Burn injury[J]. Nat Rev Dis Primers, 2020, 6: 11. DOI:10.1038/s41572-020-0145-5 |
| [5] | Munley JA, Park G, Kelly LS, et al. Persistence and sexual dimorphism of gut dysbiosis and pathobiome after sepsis and trauma[J]. Ann Surg, 2024, 280(3): 491-503. DOI:10.1097/SLA.0000000000006385 |
| [6] | 潘选良, 朱志康, 沈涛, 等. 成人特重度烧伤患者脓毒症预后预测指标分析[J]. 中华急诊医学杂志, 2023, 32(9): 1235-1240. DOI:10.3760/cma.j.issn.1671-0282.2023.09.015 |
| [7] | Gong Y, Long XM, Xu H, et al. The changes and prognostic value of liver function in young adults with severe burn: a retrospective observational study[J]. Medicine (Baltimore), 2018, 97(51): e13721. DOI:10.1097/MD.0000000000013721 |
| [8] | Anand AC, Nandi B, Acharya SK, et al. Indian national association for the study of the liver consensus statement on acute liver failure (part 1): epidemiology, pathogenesis, presentation and prognosis[J]. J Clin Exp Hepatol, 2020, 10(4): 339-376. DOI:10.1016/j.jceh.2020.04.012 |
| [9] | Sehrawat SS, Premkumar M. Critical care management of acute liver failure[J]. Indian J Gastroenterol, 2024, 43(2): 361-376. DOI:10.1007/s12664-024-01556-8 |
| [10] | Hotchkiss RS, Moldawer LL, Opal SM, et al. Sepsis and septic shock[J]. Nat Rev Dis Primers, 2016, 2: 16045. DOI:10.1038/nrdp.2016.45 |
| [11] | Greenhalgh DG, Saffle JR, Holmes JH, et al. American Burn Association consensus conference to define sepsis and infection in burns[J]. J Burn Care Res, 2007, 28(6): 776-790. DOI:10.1097/bcr.0b013e3181599bc9 |
| [12] | J P, WM L. AASLD position paper: the management of acute liver failure[J]. Hepatology (Baltimore, Md.), 2005, 41(5): 1179-1197. DOI:10.1002/hep.20703 |
| [13] | Zhang ZH, Zhang GS, Goyal H, et al. Identification of subclasses of sepsis that showed different clinical outcomes and responses to amount of fluid resuscitation: a latent profile analysis[J]. Crit Care, 2018, 22(1): 347. DOI:10.1186/s13054-018-2279-3 |
| [14] | Yang YJ, Chen Q, Fan SJ, et al. Glutamine sustains energy metabolism and alleviates liver injury in burn sepsis by promoting the assembly of mitochondrial HSP60-HSP10 complex via SIRT4 dependent protein deacetylation[J]. Redox Rep, 2024, 29(1): 2312320. DOI:10.1080/13510002.2024.2312320 |
| [15] | Rae L, Fidler P, Gibran N. The physiologic basis of burn shock and the need for aggressive fluid resuscitation[J]. Crit Care Clin, 2016, 32(4): 491-505. DOI:10.1016/j.ccc.2016.06.001 |
| [16] | Guillory AN, Clayton RP, Herndon DN, et al. Cardiovascular dysfunction following burn injury: what we have learned from rat and mouse models[J]. Int J Mol Sci, 2016, 17(1): 53. DOI:10.3390/ijms17010053 |
| [17] | Saffle JR. Fluid creep and over-resuscitation[J]. Crit Care Clin, 2016, 32(4): 587-598. DOI:10.1016/j.ccc.2016.06.007 |
| [18] | Sikora JP, Karawani J, Sobczak J. Neutrophils and the systemic inflammatory response syndrome (SIRS)[J]. Int J Mol Sci, 2023, 24(17): 13469. DOI:10.3390/ijms241713469 |
| [19] | Liu Y, Wang JZ. Stress response induced by burn injury and its regulation strategy[J]. Zhonghua Shaoshang Zazhi, 2021, 37(2): 126-130. DOI:10.3760/cma.j.cn501120-20201125-00499 |
| [20] | Sasaki T, Kakisaka K, Kuroda H, et al. Nutritional management for acute liver failure[J]. Hepatol Res, 2024, 54(8): 736-744. DOI:10.1111/hepr.14090 |
| [21] | Guillot A, Tacke F. Liver macrophages revisited: The expanding universe of versatile responses in a spatiotemporal context[J]. Hepatol Commun, 2024, 8(7): e0491. DOI:10.1097/HC9.0000000000000491 |
| [22] | Barayan D, Abdullahi A, Vinaik R, et al. Interleukin-6 blockade, a potential adjunct therapy for post-burn hypermetabolism[J]. FASEB J, 2021, 35(5): e21596. DOI:10.1096/fj.202100388r |
| [23] | Dong V, Nanchal R, Karvellas CJ. Pathophysiology of acute liver failure[J]. Nut Clin Prac, 2020, 35(1): 24-29. DOI:10.1002/ncp.10459 |
| [24] | Borges A, Bento L. Organ crosstalk and dysfunction in sepsis[J]. Ann Intensive Care, 2024, 14(1): 147. DOI:10.1186/s13613-024-01377-0 |
| [25] | Matsuura R, Doi K, Rabb H. Acute kidney injury and distant organ dysfunction-network system analysis[J]. Kidney Int, 2023, 103(6): 1041-1055. DOI:10.1016/j.kint.2023.03.025 |
| [26] | 白松杰, 李佳辉, 杨洁, 等. 细胞外囊泡在脓毒症中的研究进展[J]. 中华急诊医学杂志, 2022, 31(3): 422-425. DOI:10.3760/cma.j.issn.1671-0282.2022.03.032 |
| [27] | Armutcu F. Organ crosstalk: the potent roles of inflammation and fibrotic changes in the course of organ interactions[J]. Inflamm Res, 2019, 68(10): 825-839. DOI:10.1007/s00011-019-01271-7 |
| [28] | Tujios SR, Hynan LS, Vazquez MA, et al. Risk factors and outcomes of acute kidney injury in patients with acute liver failure[J]. Clin Gastroenterol Hepatol, 2015, 13(2): 352-359. DOI:10.1016/j.cgh.2014.07.011 |
| [29] | Bonavia A, Stiles N. Renohepatic crosstalk: a review of the effects of acute kidney injury on the liver[J]. Nephrol Dial Transplant, 2022, 37(7): 1218-1228. DOI:10.1093/ndt/gfaa297 |
| [30] | Hadem J, Kielstein JT, Manns MP, et al. Outcomes of renal dysfunction in patients with acute liver failure[J]. United European Gastroenterol J, 2019, 7(3): 388-396. DOI:10.1177/2050640618817061 |
| [31] | Zhang X, Liu H, Hashimoto K, et al. The gut-liver axis in sepsis: interaction mechanisms and therapeutic potential[J]. Crit Care, 2022, 26(1): 213. DOI:10.1186/s13054-022-04090-1 |
| [32] | Ji Y, Yin Y, Li ZR, et al. Gut microbiota-derived components and metabolites in the progression of non-alcoholic fatty liver disease (NAFLD)[J]. Nutrients, 2019, 11(8): 1712. DOI:10.3390/nu11081712 |
| [33] | Mannes M, Schmidt CQ, Nilsson B, et al. Complement as driver of systemic inflammation and organ failure in trauma, burn, and sepsis[J]. Semin Immunopathol, 2021, 43(6): 773-788. DOI:10.1007/s00281-021-00872-x |
 2025, Vol. 34
2025, Vol. 34