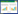2. 河北省泛血管疾病重点实验室,承德 067000;
3. 河北省神经损伤与修复重点实验室,承德 067000
2. Hebei Key Laboratory of Panvascular Diseases, Chengde 067000, China;
3. Hebei Key Laboratory of Nerve Injury and Repair, Chengde 067000, China
脊髓损伤(spinal cord injury, SCI)是中枢神经系统的严重创伤性疾病,如何有效的促进SCI后神经功能恢复仍是世界性难题[1-2]。现有治疗手段(包括手术减压、炎症调控及康复训练等)在促进神经再生与修复方面仍存在局限性[3-5]。从病理生理机制角度分析,神经功能缺损与轴突脱髓鞘过程密切相关[6]。而少突胶质细胞作为髓鞘形成与修复的关键细胞,其损伤或死亡将直接影响脊髓神经功能[7]。因此,如何维持损伤后少突胶质细胞存活已成为促进轴突重塑和抑制脱髓鞘的关键。近年来,在中枢神经系统中,脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)和神经营养因子3(neurotrophin-3, NT-3)已被证实可促进SCI后少突胶质细胞的存活、分化及髓鞘再生[8-10]。相较于BDNF的研究进展,NT-3对少突胶质细胞的作用机制仍存在诸多未知领域。现有研究表明,NT-3能够促进少突胶质细胞分化与存活[11-12],但其潜在的分子机制尚不明确。
随着对程序性死亡机制的深入研究,自噬作为新型细胞死亡方式逐渐成为SCI领域的研究热点[13]。过度激活的自噬可能会通过诱导神经元和少突胶质细胞死亡而加剧神经损伤[14-15],这提示自噬调控将成为神经保护的新策略。尽管已有研究证实BDNF可通过TrkB受体促进神经元自噬[16],但目前NT-3与自噬的相关报道仍较少。
从分子机制层面分析,NT-3主要通过TrkC受体发挥作用,其下游PI3K/AKT信号通路已被证实参与多种细胞存活调控过程[17-19]。而PI3K/AKT通路恰是抑制自噬的关键通路[20]。此外,TrkA、TrkB受体泛素化作为信号转导的重要调控方式,在TRAF6/p62系统中已被证实可影响细胞凋亡或自噬的相关信号通路表达[21],但TrkC受体泛素化在自噬调控中的作用尚未见报道。
本研究将通过动物和细胞实验,进一步探讨NT-3-自噬-少突胶质细胞三者的关系,为SCI治疗提供新的分子靶点和理论依据。
1 材料与方法 1.1 实验动物8周雌性SD大鼠15只,体重(250±10)g,由北京华傅康生物科技股份有限公司提供,许可证号:SCXK(京)2019-0008。乳鼠(24 h)由承德医学院附属医院实验中心动物房提供,许可证号:SYXK(冀)2021-004。本研究经承德医学院附属医院伦理委员会批准(批准号:LL2021013)。
1.2 实验分组动物实验中将15只大鼠造模后(随机数字法)分为Sham组、SCI组、SCI+NT-3组,每组5只,用于Basso-Beattie-Bresnahan(BBB)评分及相应目的蛋白提取。细胞实验中取乳鼠脑组织分离培养少突胶质细胞,等密度接种于培养皿中。造模后分为OGD组、OGD+NT-3组、OGD+NT-3+泛素化抑制剂(UCHL1)组、OGD+NT-3+泛素化激动剂(MG132)组。用于细胞形态观察、免疫荧光、蛋白提取等实验。
1.3 实验主要试剂实验主要试剂包括NT-3(武汉华美生物工程有限公司),兔抗LC3B单克隆抗体(杭州华安生物技术有限公司),兔抗Olig1单克隆抗体、兔抗MBP单克隆抗体(英国abcam公司),Goat Anti-Rabbit IgG H & L Alexa Fluor® 594(英国abcam公司),Goat Anti-RABBIT lgG (H & L) Antibody Dylight488 Conjugated(石家庄瑞帕特生物有限公司),兔抗HA多克隆抗体、小鼠DDK单克隆抗体、pCMV6-Myc-DDK-TrkC质粒[安诺伦(北京)生物科技有限公司],UCHL1、MG132(美国MCE公司),GenElute™质粒小量制备试剂盒(北京默克有限公司),少突胶质细胞专用培养基(武汉普诺赛生命科技有限公司),Lipofectamine3000(美国Thermo Fisher公司)。
1.4 实验方法 1.4.1 少突胶质细胞提取乳鼠麻醉后,取脑组织并用TBST清洗,移除脑膜和血管。加入少突胶质细胞专用培养基。将脑皮质匀浆制作细胞悬液,依次通过230 μm和100 μm滤网。细胞经1 000 r/min 10 min离心,重悬细胞。以5×104/培养皿(10 cm)的密度接种于含有5 mL少突胶质细胞专用培养基的培养皿中,将培养皿放置在37 ℃,5%CO2温箱中。每48 h更换一次少突胶质细胞专用培养基。少突胶质细胞生长在星形胶质细胞层的上面,运用旋转摇床以260 r/min 18 h摇荡分离,通过30 μm滤网,然后将细胞悬液等密度接种培养皿中。成功培养的少突胶质细胞呈梭形或多角形或圆形带有突触。
1.4.2 SCI模型异氟烷麻醉后,逐层切开大鼠的皮肤、皮下、椎旁肌肉,暴露T10椎板,将椎板小心咬除,暴露脊髓,应用同一型号且挤压力度相同的医用无菌止血夹夹闭脊髓10 s,可见大鼠后肢不自主剧烈抽搐伴鼠尾摇摆,此时松开止血夹,肉眼可见损伤区域充血明显。术后大鼠恒温环境下单笼饲养,给予小腿三头肌肌注青霉素钠20万U/d,连续3 d,预防感染。按摩腹部及膀胱促进排尿、排便。造模成功后各组应用BBB评分来评估神经功能恢复情况。该评分分数范围为0~21分,0分表示后肢无功能,21分表示后肢活动正常。
1.4.3 糖氧剥夺模型应用OGD模型来模拟SCI后少突胶质细胞微环境改变对少突胶质细胞的影响。本实验应用一种简便的方法来制备该模型,即将培养基换成1640无糖培养基,创造类似缺血环境,然后用石蜡封闭培养皿并用密封胶带密封创造缺氧环境。
1.4.4 给药方式蛛网膜下腔置管:大鼠麻醉后暴露L3/4棘突间隙,使用医用留置针穿刺硬脊膜、蛛网膜,拔出针芯,将软管置入蛛网膜下腔,见少量脑脊液溢于软管中,证明置管成功,导管内口约位于L1椎体,缝合固定。鞘内置管后注入20 µL 2%盐酸利多卡因注射液,注射后大鼠双后肢出现瘫痪,半小时内恢复正常,表明导管在位通畅。体内实验中NT-3(20 μg/kg)经微量泵泵入蛛网膜下腔,每日一次,连续给药7 d。体外实验中NT-3(1 μg/mL)、UCHL1(2 μg/mL)和MG132(2 μg/mL)均于细胞造模前24 h加入培养基中。
1.4.5 细胞质粒扩增与转染首先将1 µL的DDK-TrkC质粒或HA-Ub质粒DNA工作液与感受态大肠杆菌200 µL混匀接种于琼脂糖青霉素培养基上,37 ℃过夜。取大肠杆菌菌落置入LB培养基。37℃过夜完成质粒的扩增,应用GenElute™质粒小量制备试剂盒,进行质粒DNA的提取。按照Lipo3000说明书配置相应质粒工作液,进行转染。由于体外分离纯化的少突胶质细胞存活周期短,无法按照常规转染方法进行稳定转染细胞株筛选,本实验在转染48 h后应用免疫荧光及Western Blot检测HA-Ub、DDK-TrkC蛋白的表达情况,以此评估转染是否成功。
1.4.6 Western Blot检测将各组样品溶解于RIPA裂解液中,应用离心机以12 000 r/min离心,提取总蛋白。应用BCA试剂盒检测蛋白浓度,将各组及各组不同时间点蛋白浓度调至同一水平。应用凝胶电泳分离蛋白样品并转移至PVDF膜上。应用BSA封闭液封闭非特异性抗原。在4℃条件下孵育相应目的蛋白一抗12 h,在室温条件下孵育二抗2 h,抗体浓度按照说明书配置。将含有目的蛋白的PVDF膜浸泡在ECL化学发光溶液中5 min,使用BACKMAN显影仪进行显影并采集图像。最后使用ImageJ软件检测目的蛋白的灰度值。应用目的蛋白灰度值与内参蛋白灰度值的比值来评价蛋白相对表达水平。自噬蛋白LC3B的相对表达水平用LC3BII灰度值与LC3BI灰度值的比值表示。本实验中Western Blot用于检测LC3B、Olig1、MBP、TRAF6、TrkC、Ub-TrkC、HA-Ub、DDK-TrkC蛋白表达。
1.4.7 免疫荧光将各组少突胶质细胞PBS清洗3遍。应用4%多聚甲醛固定20 min后PBS清洗3遍。应用0.2%Triton-100通透10 min,清洗后孵育相应目的蛋白一抗(抗体浓度按说明书配置)并4℃过夜。清除一抗后孵育荧光二抗,室温避光2 h。PBS清洗三遍,DAPI核染后荧光显微镜下拍照。本实验中免疫荧光用于验证转染是否成功以及观察自噬蛋白LC3B聚集现象,并在显微镜明场下观察细胞形态。
1.5 统计学方法采用SPSS 28.0软件进行数据分析。符合正态分布的计量资料以均数±标准差(x±s)表示。多组间比较采用单因素方差分析,进一步两两比较使用最小显著性差异法(least significance difference, LSD)。采用GraphPad Prism 7软件绘制直方图,以P<0.05为差异具有统计学意义。
2 结果 2.1 NT-3促进大鼠SCI后神经功能恢复通过检测各组各个时间点脊髓组织中NT-3的表达变化,以及对应用外源性NT-3的大鼠进行BBB功能评分,发现SCI后NT-3的表达逐渐增多,并且应用外源性NT-3治疗的大鼠神经功能恢复较快。
在造模后第1、3、5、7天,SCI组比Sham组脊髓组织中NT-3的表达量明显上升[(0.22±0.02) vs.(0.12±0.01), (0.29±0.01) vs. (0.13±0.03), (0.39±0.03) vs. (0.12±0.01), (0.39±0.01) vs. (0.13±0.01), 均P<0.001]。见图 1A~B。
|
| 注:A为NT-3蛋白Western Blot检测条带;B为各组NT-3相对表达量统计图;C为各组BBB评分统计图;与Sham组相比较,aP<0.05;与SCI组相比较,bP<0.05 图 1 大鼠脊髓损伤后NT-3蛋白表达及NT-3对神经功能恢复的影响 Fig 1 The expression of NT-3 protein and the impact of NT-3 on the recovery of nerve function after spinal cord injury in rats. |
|
|
在造模后第3、5、7天与SCI组相比较,SCI+NT-3组大鼠BBB评分明显升高[(4.00±0.84) vs. (2.00±0.98), (8.00±0.88) vs. (6.00±0.89), (12.00±0.96) vs. (8.00±0.95), 均P<0.05],见图 1C。
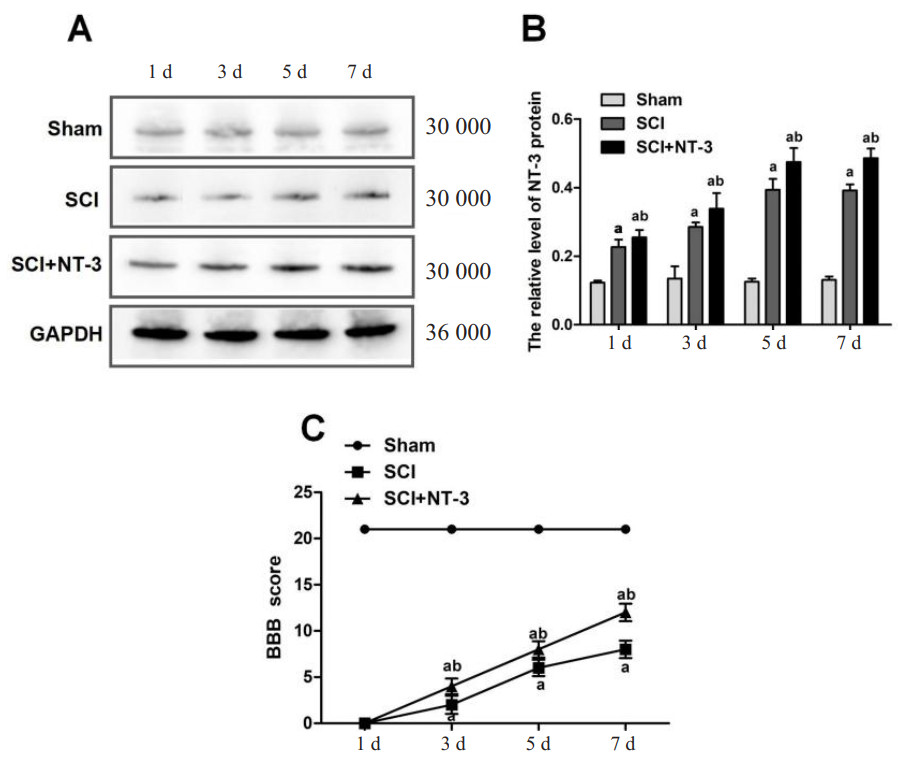
2.2 NT-3抑制SCI大鼠脊髓组织中自噬水平在造模后第3、5、7天,SCI+NT-3组比Sham组在自噬水平降低[(0.82±0.02) vs. (0.87±0.02), (0.78±0.02) vs. (0.93±0.04), (0.69±0.03) vs. (0.87±0.04), 均P<0.001]。见图 2。应用外源性NT-3的大鼠,在SCI后3~7 d,脊髓组织中自噬水平明显降低,说明NT-3具有抑制自噬的作用。
|
| 注:A为LC3B蛋白的Western Blot检测条带;B为各组LC3B相对表达量统计图;与Sham组相比较,aP<0.05;与SCI组相比较,bP<0.05 图 2 大鼠脊髓损伤后NT-3对脊髓组织中自噬蛋白LC3B表达的影响 Fig 2 The effect of NT-3 on the expression of autophagy protein LC3B in spinal cord tissue after spinal cord injury in rats |
|
|
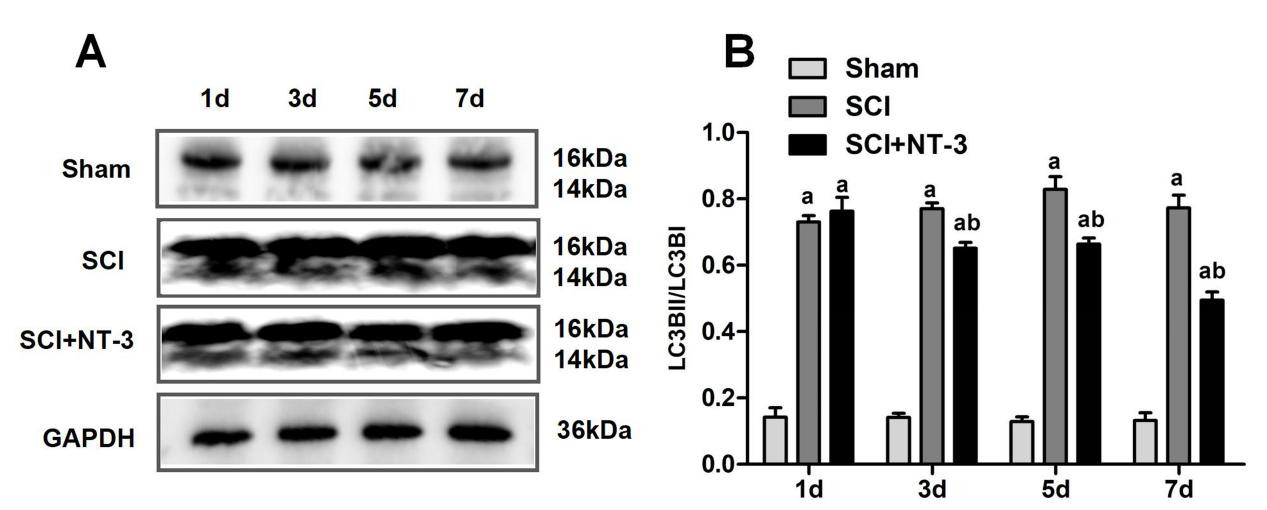
在应用NT-3的脊髓组织中,两种与少突胶质细胞增殖、分化密切相关的蛋白Olig1、MBP均增多明显。在造模后第1、3、5、7天,与Sham组相比较,SCI组Olig1表达升高(均P<0.001);与SCI组相比较,SCI+NT-3组Olig1表达升高(均P<0.01)。见图 3A~B。在造模后第3、5、7天与Sham组相比较SCI组MBP表达升高(均P<0.01)。与SCI组相比较,SCI+NT-3组MBP表达升高(均P<0.001)。见图 3C~D。
|
| 注:A为Olig1蛋白的Western Blot检测条带;B为各组Olig1相对表达量统计图;C为MBP蛋白的Western Blot检测条带;D为各组MBP相对表达量统计图;与Sham组相比较,aP<0.05;与SCI组相比较,bP<0.05 图 3 大鼠脊髓损伤后NT-3对脊髓组织中Olig1、MBP蛋白表达的影响 Fig 3 The influence of NT-3 on the expression of Olig1 and MBP proteins in spinal cord tissue after spinal cord injury in rats |
|
|
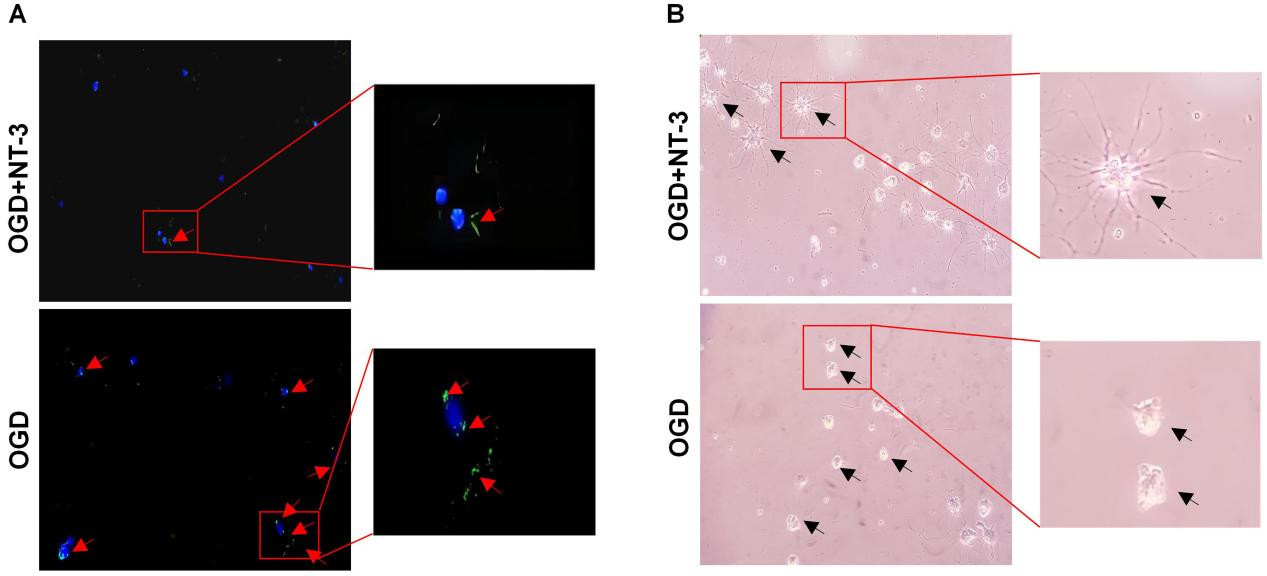
LC3B参与构成自噬小体的双层膜结构,免疫荧光下会呈现聚集现象。在少突胶质细胞的OGD模型中应用NT-3,并在第5小时应用观察各组少突胶质细胞的形态以及LC3B蛋白表达情况。相比OGD+NT-3组,OGD组绿色荧光聚集明显(见图 4A红色箭头)。在光镜下观察细胞形态,相比较OGD+NT-3组,OGD组少突胶质细胞出现突触回缩的现象(见图 4B黑色箭头)。上述现象表明NT-3维持少突胶质细胞存活的原因与抑制自噬有关。
|
| 注:A为各组少突胶质细胞LC3B免疫荧光图像(×100);B为各组少突胶质细胞形态改变(×100) 图 4 NT-3对少突胶质细胞自噬及细胞形态的影响 Fig 4 The impact of NT-3 on autophagy and cell morphology of oligodendrocytes |
|
|
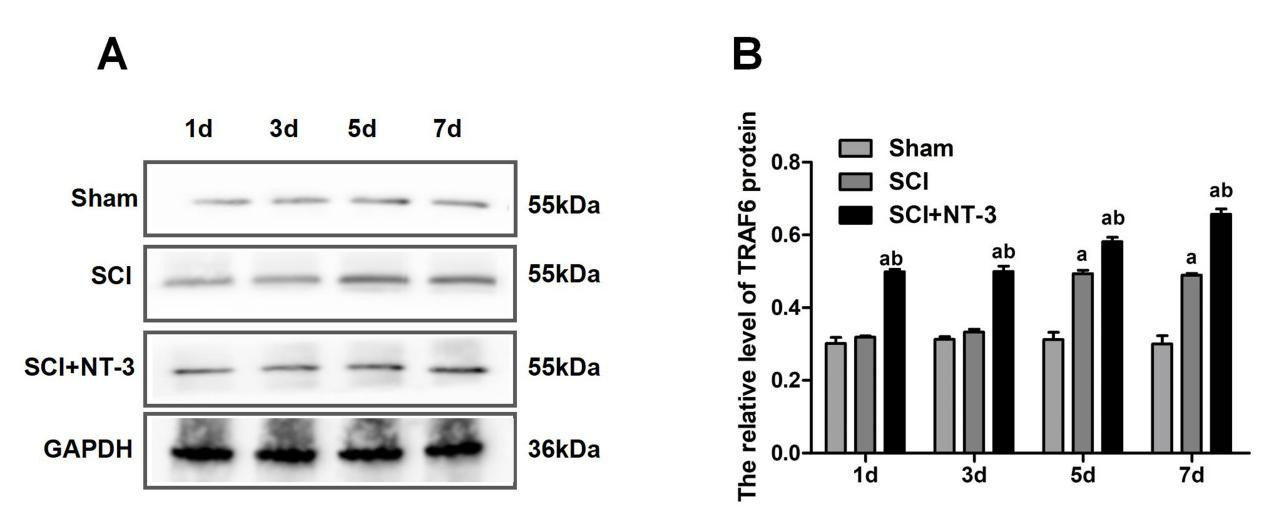
在造模后第5、7天与Sham组相比较,SCI组TRAF6蛋白表达升高(均P<0.001)。在造模后第1、3、5、7天,与Sham组相比较,SCI+NT-3组TRAF6蛋白在表达升高(均P<0.001)。SCI+NT-3组比SCI组TRAF6蛋白表达升高[(0.49±0.01) vs. (0.32±0.004), (0.49±0.01) vs. (0.33±0.01), (0.58±0.01) vs. (0.49±0.01), (0.66±0.02) vs. (0.49±0.005), 均P<0.001]。见图 5。
|
| 注:A为TRAF6蛋白的Western Blot检测条带;B为各组TRAF6相对表达量统计图;与Sham组相比较,aP<0.05;与SCI组相比较,bP<0.05 图 5 大鼠脊髓损伤后NT-3对脊髓组织中TRAF6蛋白表达的影响 Fig 5 The influence of NT-3 on the expression of TRAF6 protein in spinal cord tissue after spinal cord injury in rats |
|
|
TRAF6作为一种泛素连接酶是靶蛋白泛素化的标志性蛋白,实验发现当应用NT-3后,脊髓组织中TRAF6蛋白表达增加,说明NT-3促进SCI后神经功能恢复的过程中存在泛素化现象。
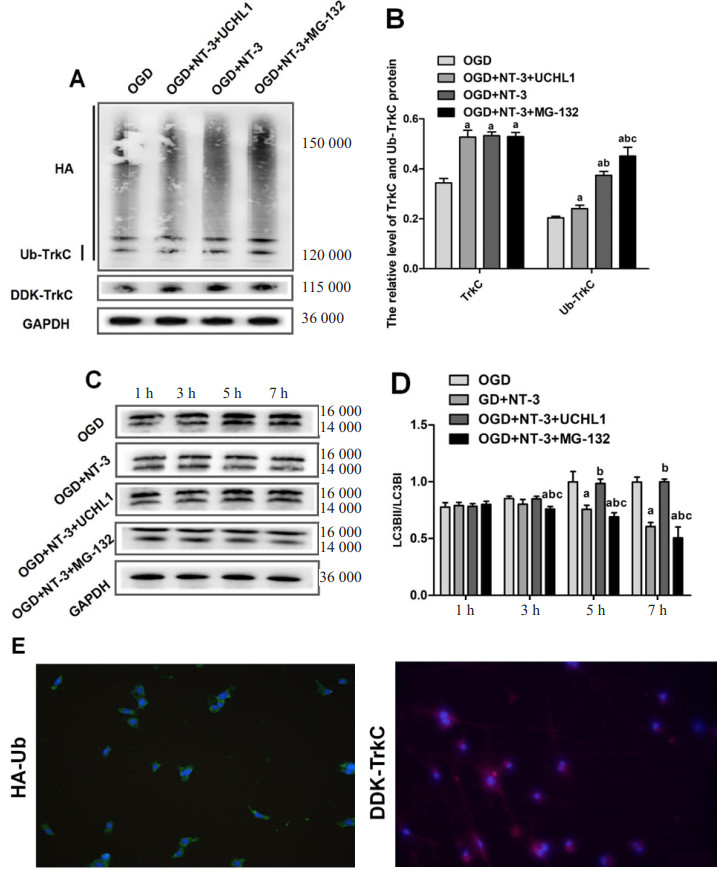
2.6 NT-3经TrkC受体泛素化抑制少突胶质细胞自噬与OGD组相比较,OGD+NT-3组、OGD+NT-3+MG132组、OGD+NT-3+UCHL1组Ub-TrkC蛋白和TrkC蛋白表达上升(均P<0.01)。与OGD+NT-3+UCHL1组相比较,OGD+NT-3组、OGD+NT-3+MG132组Ub-TrkC蛋白表达升高(均P<0.001)。与OGD+NT-3组相比较,OGD+NT-3+MG132组Ub-TrkC蛋白表达升高(P<0.001)。见图 6A~B。
|
| 注:A为TrkC蛋白及Ub-TrkC蛋白的Western Blot检测条带;B为各组TrkC及Ub-TrkC相对表达量统计图;C为LC3B蛋白的Western Blot检测条带;D为各组LC3B相对表达量统计图;E为转染HA-Ub质粒及DDK-TrkC质粒后的免疫荧光图像(×100);与OGD组相比较,aP<0.05;与OGD+NT-3组相比较,bP<0.05;与OGD+NT-3+UCHL1组相比较,CP<0.05 图 6 TrkC泛素化对少突胶质细胞自噬的影响 Fig 6 The impact of TrkC ubiquitination on autophagy in oligodendrocytes |
|
|
造模后第5、7小时,OGD+NT-3+MG132组比OGD+NT-3组自噬水平下降[(0.69±0.04) vs. (0.98±0.04), (0.51±0.10) vs. (0.99±0.02), 均P<0.001],OGD+NT-3+UCHL1组自噬水平上升[(0.98±0.04) vs. (0.76±0.04), (0.99±0.02) vs. (0.61±0.04), 均P<0.001]。见图 6C~D。
对体外培养的少突胶质细胞进行HA-Ub质粒及DDK-TrkC质粒的共转染,通过免疫荧光可以观察到HA-Ub质粒(绿色荧光)及DDK-TrkC质粒(红色荧光)成功转染(见图 6E)。以上结果证明了TrkC受体泛素化可以激活NT-3抑制自噬的信号通路。
3 讨论SCI是一种严重的中枢神经损伤,致残率高。给社会及个人造成了沉重的经济负担。但目前治疗SCI的方法及效果有限,因此如何促进神经修复是SCI临床治疗上亟待解决的问题[22]。无论是手术治疗还是保守治疗,最终面临的问题是如何促进受损细胞存活和轴突修复与再生。既往研究表明NTF不仅对神经元发育、成熟具有重要作用[23],还能够促进SCI后轴突重塑和功能恢复[24]。许多改善受损脊髓功能的实验都使用了神经营养因子[25],特别是BDNF和NT-3[26],这些实验也证实了神经营养因子在治疗SCI中的有效性[27]。相比较BDNF,NT-3主要在脊髓组织中表达[28]。实验发现受损脊髓组织中NT-3的表达量增多,说明神经细胞可以通过自分泌NT-3的方式进行自我修复[29]。进一步探索NT-3促进SCI恢复作用机制,将为NT-3的临床应用提供有力的理论支持。
少突胶质细胞在SCI神经功能恢复中发挥着关键作用[30]。它是神经髓鞘构成的主要参与者,其损伤或死亡将造成脱髓鞘改变[31]。所以如何维持少突胶质细胞的存活或髓鞘化会直接影响神经功能恢复。诱导少突胶质细胞髓鞘化,是NT-3促进SCI恢复的重要方式之一[32]。另外NT-3还可以促进少突胶质细胞前体细胞有丝分裂[33-34],并通过TrkC受体维持少突胶质细胞存活[35]。由此可见NT-3促进SCI恢复的原因与促进少突胶质细胞存活、分化、髓鞘化密切相关。但目前NT-3在少突胶质细胞中具体的信号传导机制仍不完善。本实验发现了一种目前尚未明确报道的维持少突胶质细胞存活的机制,即NT-3对少突胶质细胞自噬的调节作用。
在明确大鼠体内应用NT-3具有促进少突胶质细胞分化及髓鞘化的作用后,即大鼠脊髓组织中Olig1、MBP蛋白表达增多。本实验在少突胶质细胞的OGD模型中也应用了NT-3,并发现NT-3能够最大限度的维持少突胶质细胞存活。通过检测自噬蛋白表达,发现无论是动物实验还是细胞实验,NT-3均表现出抑制自噬的作用,且自噬水平较弱的少突胶质细胞在OGD模型建立后能够长时间维持细胞形态。由此可见,NT-3抑制自噬的过度表达能够维持少突胶质细胞存活。
NT-3的主要受体是TrkC,泛素化是激活受体功能的重要方式,神经营养因子可通过受体泛素化来激活不同的通路[36]。TRAF6是一种泛素连接酶,反应泛素化水平,也可作为信号通路开关,影响下游信号通路磷酸化情况[37]。动物实验中发现TRAF6表达增多,说明SCI后存在泛素化增强的现象。但是否TrkC受体发生了泛素化并且激活了抑制自噬的信号通路需实验验证。由于TrkC与TrkB同源,既往有UCHL1抑制TrkB受体泛素化[38]的报道,所以本实验选用了泛素抑制剂UCHL1来破环泛素化过程。MG132是一种蛋白酶体抑制剂能够增强靶蛋白泛素化水平。在少突胶质细胞OGD中应用NT-3并共转染DDK-TrkC质粒和HA-Ub质粒。发现应用NT-3后TrkC受体表达增多且能检测到较多的泛素化TrkC,这说明NT-3不仅有诱导TrkC蛋白表达的作用,还增加了TrkC受体的泛素化水平。通过对比OGD+NT-3+UCHL1组及OGD+NT-3+MG132组中TrkC受体泛素化水平及自噬蛋白表达水平,发现TrkC受体泛素化越强,自噬蛋白表达越弱,这说明TrkC受体泛素化激活了抑制自噬的信号通路。
在具备一定实验基础的前提下,NT-3如何应用于临床中SCI患者也是一项亟待解决的问题。相比较纳米载体或细胞移植[39],类似于本实验中的给药方式,采用微量泵髓鞘内注射将是一种简便有效的方法。
综上所述,根据实验结果可得到NT-3经TrkC受体泛素化抑制自噬,促进少突胶质细胞存活,从而有利于SCI后神经功能恢复的结论。但本实验目前仍存在不足,目前只能得到TrkC受体泛素化抑制自噬的结果,但抑制自噬的具体信号通路,以及是否能够通过结合其他能力弱的受体抑制自噬仍需进一步研究。深入的研究NT-3的作用机制及临床应用,将为SCI的治疗提供新思路、新方法,为SCI患者带来康复希望。
利益冲突 所有作者声明无利益冲突
作者贡献声明 丛岩:实验设计、论文撰写;孙志德:实验实施、论文修改;王艳飞:数据和论文的校对;于健:实验数据分析处理
| [1] | 汪靖宇, 刘天健, 王琳琳, 等. 急性脊髓损伤临床治疗进展[J]. 中华急诊医学杂志, 2017, 26(4): 470-472. DOI:10.3760/cma.j.issn.1671-0282.2017.04.026 |
| [2] | Eli I, Lerner DP, Ghogawala Z. Acute traumatic spinal cord injury[J]. Neurol Clin, 2021, 39(2): 471-488. DOI:10.1016/j.ncl.2021.02.004 |
| [3] | Ahuja CS, Nori S, Tetreault L, et al. Traumatic spinal cord injury-repair and regeneration[J]. Neurosurgery, 2017, 80(3S): S9-S22. DOI:10.1093/neuros/nyw080 |
| [4] | 郭鹏超, 张茂. 脊髓损伤或有脊髓损伤风险患者处理的法国指南[J]. 中华急诊医学杂志, 2020, 29(9): 1165-1166. DOI:10.3760/cma.j.issn.1671-0282.2020.09.005 |
| [5] | Karsy M, Hawryluk G. Modern medical management of spinal cord injury[J]. Curr Neurol Neurosci Rep, 2019, 19(9): 65. DOI:10.1007/s11910-019-0984-1 |
| [6] | Hassannejad Z, Yousefifard M, Azizi Y, et al. Axonal degeneration and demyelination following traumatic spinal cord injury: a systematic review and meta-analysis[J]. J Chem Neuroanat, 2019, 97: 9-22. DOI:10.1016/j.jchemneu.2019.01.009 |
| [7] | Zirngibl M, Assinck P, Sizov A, et al. Oligodendrocyte death and myelin loss in the cuprizone model: an updated overview of the intrinsic and extrinsic causes of cuprizone demyelination[J]. Mol Neurodegener, 2022, 17(1): 34. DOI:10.1186/s13024-022-00538-8 |
| [8] | Kumar S, Kahn MA, Dinh L, et al. NT-3-mediated TrkC receptor activation promotes proliferation and cell survival of rodent progenitor oligodendrocyte cells in vitro and in vivo[J]. J Neurosci Res, 1998, 54(6): 754-765. DOI:10.1002/(SICI)1097-4547(19981215)54:6754::AID-JNR3>3.0.CO;2-K |
| [9] | Langhnoja J, Buch L, Pillai P. Potential role of NGF, BDNF, and their receptors in oligodendrocytes differentiation from neural stem cell: an in vitro study[J]. Cell Biol Int, 2021, 45(2): 432-446. DOI:10.1002/cbin.11500 |
| [10] | Zhao H, Gao XY, Wu XJ, et al. The Shh/Gli1 signaling pathway regulates regeneration via transcription factor Olig1 expression after focal cerebral ischemia in rats[J]. Neurol Res, 2022, 44(4): 318-330. DOI:10.1080/01616412.2021.1981106 |
| [11] | Fressinaud C, Thomas O, Umerska AM, et al. Lipid nanoparticles vectorized with NFL-TBS.40-63 peptide target oligodendrocytes and promote neurotrophin-3 effects after demyelination in vitro[J]. Neurochem Res, 2020, 45(11): 2732-2748. DOI:10.1007/s11064-020-03122-y |
| [12] | Heinrich M, Gorath M, Richter-Landsberg C. Neurotrophin-3 (NT-3) modulates early differentiation of oligodendrocytes in rat brain cortical cultures[J]. Glia, 1999, 28(3): 244-255. |
| [13] | Fan SJ, Yue LY, Wan W, et al. Inhibition of autophagy by a small molecule through covalent modification of the LC3 protein[J]. Angew Chem Int Ed, 2021, 60(50): 26105-26114. DOI:10.1002/anie.202109464 |
| [14] | Yin J, Yin ZY, Wang B, et al. Angiopoietin-1 protects spinal cord ischemia and reperfusion injury by inhibiting autophagy in rats[J]. Neurochem Res, 2019, 44(12): 2746-2754. DOI:10.1007/s11064-019-02893-3 |
| [15] | Kanno H, Ozawa H, Sekiguchi A, et al. Induction of autophagy and autophagic cell death in damaged neural tissue after acute spinal cord injury in mice[J]. Spine (Phila Pa 1976), 2011, 36(22): E1427-E1434. DOI:10.1097/BRS.0b013e3182028c3a |
| [16] | Geng X, Zou YH, Li JH, et al. BDNF alleviates Parkinson's disease by promoting STAT3 phosphorylation and regulating neuronal autophagy[J]. Cell Tissue Res, 2023, 393(3): 455-470. DOI:10.1007/s00441-023-03806-1 |
| [17] | Jawhari S, Bessette B, Hombourger S, et al. Autophagy and TrkC/NT-3 signaling joined forces boost the hypoxic glioblastoma cell survival[J]. Carcinogenesis, 2017, 38(6): 592-603. DOI:10.1093/carcin/bgx029 |
| [18] | Skaper SD. Neurotrophic factors: an overview[J]. Methods Mol Biol, 2018, 1727: 1-17. DOI:10.1007/978-1-4939-7571-6_1 |
| [19] | Zhu ZW, Li G, Wu GG, et al. Transplantation of peripheral nerve tissueoid based on a decellularized optic nerve scaffold to restore rat hindlimb sensory and movement functions[J]. Biomaterials, 2025, 315: 122949. DOI:10.1016/j.biomaterials.2024.122949 |
| [20] | Kma L, Baruah TJ. The interplay of ROS and the PI3K/Akt pathway in autophagy regulation[J]. Biotechnol Appl Biochem, 2022, 69(1): 248-264. DOI:10.1002/bab.2104 |
| [21] | Jadhav T, Geetha T, Jiang JX, et al. Identification of a consensus site for TRAF6/p62 polyubiquitination[J]. Biochem Biophys Res Commun, 2008, 371(3): 521-524. DOI:10.1016/j.bbrc.2008.04.138 |
| [22] | Anjum A, Yazid MD, Fauzi Daud M, et al. Spinal cord injury: pathophysiology, multimolecular interactions, and underlying recovery mechanisms[J]. Int J Mol Sci, 2020, 21(20): 7533. DOI:10.3390/ijms21207533 |
| [23] | Pandey S, Mudgal J. A review on the role of endogenous neurotrophins and schwann cells in axonal regeneration[J]. J Neuroimmune Pharmacol, 2022, 17(3/4): 398-408. DOI:10.1007/s11481-021-10034-3 |
| [24] | Novikova LN, Novikov LN, Kellerth JO. BDNF abolishes the survival effect of NT-3 in axotomized Clarke neurons of adult rats[J]. J Comp Neurol, 2000, 428(4): 671-680. DOI:10.1002/1096-9861(20001225)428:4<671::aid-cne7>3.0.co;2-h |
| [25] | Li X, Zhang Y, Yan YP, et al. RETRACTED: neural stem cells engineered to express three therapeutic factors mediate recovery from chronic stage CNS autoimmunity[J]. Mol Ther, 2016, 24(8): 1456-1469. DOI:10.1038/mt.2016.104 |
| [26] | 徐委, 程黎明. 神经营养因子修复脊髓损伤的研究与应用[J]. 中国组织工程研究, 2013, 17(2): 369-374. DOI:10.3969/j.issn.2095-4344.2013.02.033 |
| [27] | Muheremu A, Shu L, Liang J, et al. Sustained delivery of neurotrophic factors to treat spinal cord injury[J]. Transl Neurosci, 2021, 12(1): 494-511. DOI:10.1515/tnsci-2020-0200 |
| [28] | Dravid A, Parittotokkaporn S, Aqrawe Z, et al. Determining neurotrophin gradients in vitro to direct axonal outgrowth following spinal cord injury[J]. ACS Chem Neurosci, 2020, 11(2): 121-132. DOI:10.1021/acschemneuro.9b00565 |
| [29] | Keefe KM, Sheikh IS, Smith GM. Targeting neurotrophins to specific populations of neurons: NGF, BDNF, and NT-3 and their relevance for treatment of spinal cord injury[J]. Int J Mol Sci, 2017, 18(3): 548. DOI:10.3390/ijms18030548 |
| [30] | Faw TD, Lakhani B, Schmalbrock P, et al. Eccentric rehabilitation induces white matter plasticity and sensorimotor recovery in chronic spinal cord injury[J]. Exp Neurol, 2021, 346: 113853. DOI:10.1016/j.expneurol.2021.113853 |
| [31] | Cheli VT, Correale J, Paez PM, et al. Iron metabolism in oligodendrocytes and astrocytes, implications for myelination and remyelination[J]. ASN Neuro, 2020, 12: 1759091420962681. DOI:10.1177/1759091420962681 |
| [32] | Smith DR, Dumont CM, Park J, et al. Polycistronic delivery of IL-10 and NT-3 promotes oligodendrocyte myelination and functional recovery in a mouse spinal cord injury model[J]. Tissue Eng Part A, 2020, 26(11/12): 672-682. DOI:10.1089/ten.TEA.2019.0321 |
| [33] | Barres BA, Raff MC, Gaese F, et al. A crucial role for neurotrophin-3 in oligodendrocyte development[J]. Nature, 1994, 367: 371-375. DOI:10.1038/367371a0 |
| [34] | Yan H, Wood PM. NT-3 weakly stimulates proliferation of adult rat O1 (-) O4(+) oligodendrocyte-lineage cells and increases oligodendrocyte myelination in vitro[J]. J Neurosci Res, 2000, 62(3): 329-335. DOI:10.1002/1097-4547(20001101)62:3329::AID-JNR2>3.0.CO;2-C |
| [35] | Kahn MA, Kumar S, Liebl D, et al. Mice lacking NT-3, and its receptor TrkC, exhibit profound deficiencies in CNS glial cells[J]. Glia, 1999, 26(2): 153-165. |
| [36] | Sánchez-Sánchez J, Arévalo JC. A review on ubiquitination of neurotrophin receptors: facts and perspectives[J]. Int J Mol Sci, 2017, 18(3): 630. DOI:10.3390/ijms18030630 |
| [37] | Deng TJ, Hu BL, Wang XB, et al. TRAF6 autophagic degradation by avibirnavirus VP3 inhibits antiviral innate immunity via blocking NFKB/NF-κB activation[J]. Autophagy, 2022, 18(12): 2781-2798. DOI:10.1080/15548627.2022.2047384 |
| [38] | Guo YY, Lu Y, Zheng Y, et al. Ubiquitin C-terminal hydrolase L1 (UCH-L1) promotes hippocampus-dependent memory via its deubiquitinating effect on TrkB[J]. J Neurosci, 2017, 37(25): 5978-5995. DOI:10.1523/JNEUROSCI.3148-16.2017 |
| [39] | Marchionne F, Krupka AJ, Smith GM, et al. Intrathecal delivery of BDNF into the lumbar cistern re-engages locomotor stepping after spinal cord injury[J]. IEEE Trans Neural Syst Rehabil Eng, 2020, 28(11): 2459-2467. DOI:10.1109/TNSRE.2020.3027393 |
 2025, Vol. 34
2025, Vol. 34