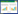2. 锦州医科大学附属第一医院耳鼻咽喉头颈外科,锦州 121000;
3. 锦州医科大学附属第一医院重症医学科,锦州 121000;
4. 锦州医科大学附属第一医院肾内科,锦州 121000
2. Department of Otolaryngology Head and Neck Surgery, the First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, China;
3. Department of Intensive Care Unit, the First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, China;
4. Nephrology department, the First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, China
急性呼吸窘迫综合症(acute respiratory distress syndrome, ARDS)是一种在临床上十分严重并且常见的疾病,其病死率相对较高,尤其在老年患者中表现尤为明显。这是因为老年人的器官功能减弱,同时患有多种基础疾病,这使得老年ARDS患者在进行有创机械通气时,在脱机过程中面临更大的挑战。因此,在治疗过程中,脱机阶段可被视为一个至关重要的决策时点。在这一关键环节,医疗团队必须全面评估患者的呼吸状态及肺部病变等相关因素,以确定是否能够安全地完成呼吸机的撤离。准确预测撤机结果对于制定治疗方案以及改善患者预后具有重要意义。超声技术在评估肺部病变方面展现出了敏感、灵活且便捷的特点。有研究指出,肺部超声评分(lung ultrasound score, LUS)能有效评估ARDS的严重程度[1]。膈肌作为主要的呼吸肌肉,在呼吸衰竭的病理生理过程中扮演着关键角色[2]。以往的评估方法通常依赖于浅快呼吸指数等参数,然而缺乏对肌肉运动功能的详细数据。近年来,随着先进超声技术的应用,对膈肌功能的评估引起了广泛关注。其中,膈肌增厚分数(diaphragmatic thickening fraction, DTF)在预测需要机械通气患者的脱机结果方面显示出一定的潜力[3]。因此,本研究旨在探讨DTF和LUS在老年ARDS患者脱机结局预测中的应用,分析二者之间的关联,为临床实践提供更为可靠的指导和决策支持。
1 资料与方法 1.1 研究对象回顾性收集2020年1月至2023年12月锦州医科大学附属第一医院ICU收治的老年ARDS患者的临床资料。
纳入标准:(1)气管插管;(2)年龄>60岁;(3)机械通气时间>24 h;(4)基于柏林定义诊断为ARDS。排除标准:(1)神经肌肉疾病;(2)脊髓损伤;(3)胸腹部术后;(4)胸廓、气管畸形;(5)中途转为气管切开。
本研究符合医学伦理学标准,经锦州医科大学附属第一医院医学研究伦理委员会批准(审批号:KYLL2024147)。
1.2 资料收集收集患者的撤机结局,分为成功组和失败组,拔管成功的标准为患者在拔管后超过48 h未再进行气管插管,反之则视为失败,即在48 h以内重新插管。在此基础上,收集并整理了两组换着的基本信息,包括性别、年龄、急性生理学与慢性健康状况评分 Ⅱ(acute physiological and chronic health evaluation Ⅱ, APACHE Ⅱ)、序贯器官衰竭估计评分(sequential organ failure assessment, SOFA)、体重指数(body mass index, BMI)、吸烟史、原发疾病、入ICU时氧合指数(oxygenation index, OI),此外,还记录了拔管前测得的DTF、LUS、OI、浅快呼吸指数、机械通气时间。
1.2.1 LUS评分标准(1) 分区方法:通常采用12分区法,将每侧胸壁分为前、侧、后三区,再以上下界(左右乳头水平)为界,将每侧胸壁分为6个区域,左右两侧共12个区域。(2)评分标准:0分,正常通气,表现为A线或不超过2条B线;1分,中度通气损失,表现为3条或更多间隔良好的B线;2分,通气严重丧失,表现为融合B线,3分,完全失去通气,表现为肺实变(组织样模式),可能伴或不伴支气管充气征。(3)总分计算与意义:将12个区域的评分相加,得到总分,范围为0~36分;分值越高,表示肺部通气损失越严重,病情越重。
1.2.2 DTF测量标准(1) 测量方法:患者取仰卧位,使用高频探头,置于腋前线或腋中线,7~8肋间或8~9肋间,肋隔角下方0.5~2 cm处,探测深度为3~4 cm,静态图像显示两条平行的高回声线(分别为壁层胸膜和腹膜),中间的低回声区域为膈肌,分别测量平静呼气末和最大吸气末的膈肌厚度。(2)计算公式:膈DTF =(吸气末膈肌厚度-呼气末膈肌厚度)/呼气末膈肌厚度×100%。
1.3 统计学方法本研究采用SPSS 25.0软件对所收集的数据进行分析和处理。计量资料以均值±标准差(x±s)形式呈现,并应用独立样本t检验进行统计分析。分类变量以例(百分比)表示,组间比较根据理论频数采用χ2检验。使用二元Logistic回归模型分析DTF和LUS对老年ARDS患者撤机风险的影响。通过受试者工作特征曲线(receiver operator characteristic curve, ROC)分析DTF和LUS对老年ARDS患者撤机结果的预测价值,通过Pearson相关性分析考察DTF与LUS之间的关系。以P<0.05为差异有统计学意义。
2 结果 2.1 两组患者临床资料比较共纳入317例老年ARDS患者,其中撤机成功212例,失败105例。两组患者的性别、年龄、APACHE Ⅱ评分、SOFA评分、BMI、吸烟史、原发疾病、入ICU时OI,差异均无统计学意义(均P>0.05);撤机前的OI、机械通气时间、LUS、DTF差异具有统计学意义(均P<0.05)。见表 1。
| 指标 | 成功组(n=212) | 失败组(n=105) | 统计值 | P值 |
| 一般情况 | ||||
| 男性a | 124(58.5) | 67(63.8) | 0.018 | 0.894 |
| 年龄(岁)b | 67.59±4.76 | 66.84±4.78 | 1.330 | 0.184 |
| 吸烟史a | 108(50.9) | 65(61.9) | 3.403 | 0.065 |
| BMIb | 24.47±3.01 | 25.10±2.80 | -1.797 | 0.073 |
| 原发病a | 5.126 | 0.077 | ||
| 肺内诱因 | 148(69.8) | 63(60.0) | ||
| 肺外诱因 | 53(25.0) | 30(28.6) | ||
| 其他因素 | 11(5.2) | 12(11.4) | ||
| 入院时b | ||||
| APACHE- Ⅱ评分 | 17.45±3.39 | 18.14±3.35 | -1.724 | 0.086 |
| SOFA评分 | 12.99±2.37 | 13.10±2.44 | -0.376 | 0.714 |
| OI(mmHg) | 167.83±24.04 | 171.78±24.43 | -1.370 | 0.175 |
| 撤机前b | ||||
| LUS评分 | 13.69±4.06 | 17.26±3.04 | -7.964 | <0.001 |
| DTF(%) | 40.15±6.49 | 27.83±6.37 | 17.560 | <0.001 |
| OI(mmHg) | 288.35±17.24 | 280.53±18.18 | 3.730 | <0.001 |
| RSBI[次/(min·L)] b | 42.91±14.98 | 46.10±14.16 | -1.856 | 0.064 |
| 机械通气时间(d)b | 6.98±3.18 | 7.77±3.11 | -2.112 | 0.036 |
| 注:BMI为体重指数,APACHE Ⅱ评分为急性生理学与慢性健康状况评分 Ⅱ,SOFA评分为序贯器官衰竭估计评分,OI为氧合指数,LUS评分为肺部超声评分,DTF为膈肌增厚分数,RSBI为浅快呼吸指数;a为(例,%),b为x±s | ||||
二元Logistic回归分析显示,LUS和DTF均为影响老年ARDS患者撤机的独立危险因素(均P<0.05)。见表 2。
| 指标 | B | SE | Wald | P值 | OR(95%CI) |
| LUS | 0.163 | 0.051 | 10.211 | 0.001 | 1.177(1.065~1.301) |
| DTF | -0.345 | 0.042 | 68.018 | <0.001 | 0.708(0.653~0.769) |
| 注:LUS评分为肺部超声评分,DTF为膈肌增厚分数 | |||||
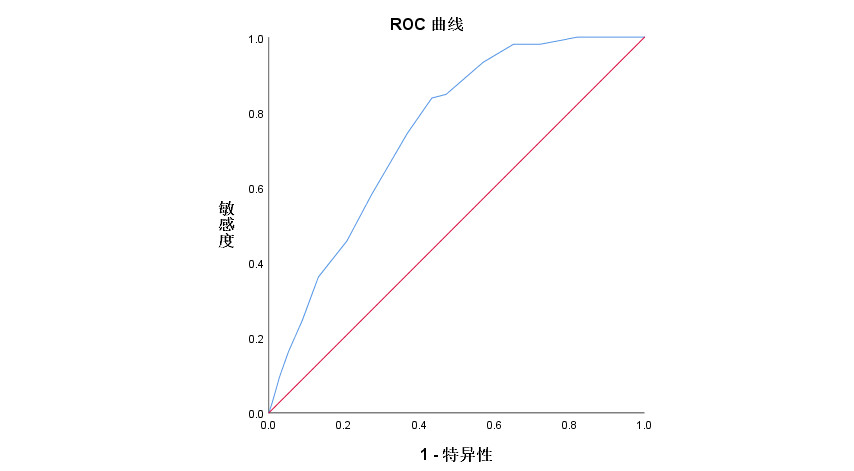
LUS预测老年ARDS患者撤机失败的曲线下面积(area under the curve, AUC)>0.7,DTF预测老年ARDS患者撤机成功的AUC>0.7,二者均可以对患者的撤机结果进行预测。见图 1~2、表 3。
|
| 图 1 LUS预测老年ARDS患者撤机结果的ROC曲线 Fig 1 ROC curve for predicting weaning outcomes in elderly ARDS patients using LUS |
|
|
|
| 图 2 DTF预测老年ARDS患者撤机结果的ROC曲线 Fig 2 ROC curve for predicting weaning outcomes in Elderly ARDS patients using DTF |
|
|
| 指标 | AUC | 95%CI | P值 | 敏感度(%) | 特异度(%) | 临界值 | 阳性预测值(%) | 阴性预测值(%) |
| LUS | 0.748 | 0.695~0.801 | <0.001 | 83.81 | 56.60 | 14.5 | 48.89 | 87.59 |
| DTF | 0.935 | 0.909~0.961 | <0.001 | 83.02 | 89.52 | 33.5 | 94.12 | 72.31 |
| 注:LUS评分为肺部超声评分,DTF为膈肌增厚分数 | ||||||||
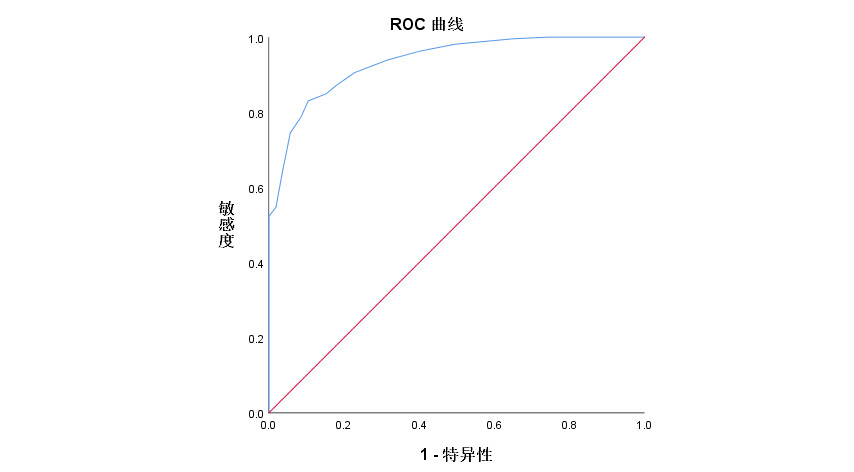
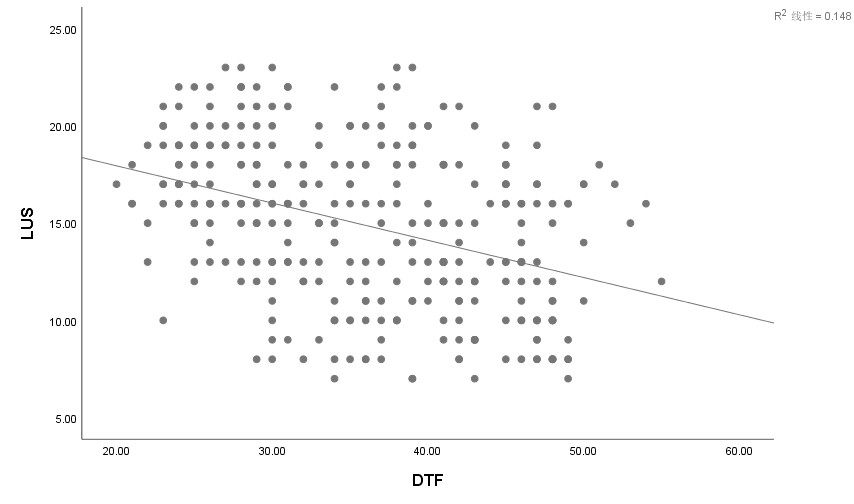
老年ARDS患者撤机前LUS和DTF呈负相关性(r=-0.385,P<0.001)。
|
| 图 3 老年ARDS患者撤机前LUS和DTF的相关性分析 Fig 3 Correlation analysis of LUS and DTF before weaning in elderly ARDS patients |
|
|
ICU患者中10%以上存在ARDS,而机械通气患者中约23.4%为ARDS[4]。而在这些患者中,老年患者往往是治疗的难点。随着国内老龄化问题的加剧,患者的数量也将逐渐增加。老年ARDS患者在疾病特点上与非老年患者可能存在一些差异。首先,老年人群具有高发病率的特点,老年人群由于免疫系统功能下降、慢性疾病累积等因素,患ARDS的风险相对较高。其次,容易出现多器官受累的情况,老年ARDS患者通常会伴随多脏器功能不全,特别是心脏、肾脏和脑部等器官的损伤;且原发病因复杂,老年ARDS患者常常合并有其他慢性疾病,如慢性阻塞性肺疾病、心衰等,这些基础疾病可能影响ARDS的发病和治疗。再次,组织修复能力差,由于老年人体质较弱,组织修复和免疫反应能力相对较差,因此其康复过程可能相对缓慢和困难。最后,预后较差,相对于非老年ARDS患者,老年ARDS患者的预后往往较差,包括较高的病死率和长期功能障碍风险。也正是由于老年患者的这些特点,机械通气的时间往往较长,时间越长,发生呼吸机相关性并发症的风险也越高,这会进一步导致病死率增加。
老年患者在患ARDS后,治疗与护理应更全面和个性化,旨在提高其生存率和生活质量。在实际临床操作中,医护团队需特别关注老年ARDS患者的独特特征,并根据这些特征量身定制治疗方案。ARDS是急性低氧性呼吸衰竭的极端类型,尽管在其定义和病理生理学方面取得了显著进展,有多种讨论和建议,胸部CT仍然被认为是ARDS诊断和评估的“金标准”,能够为诊疗过程提供重要的循证依据[5]。相比之下,床边胸部X光检查的影像分辨率较低,病情反应滞后,无法完全准确地反映肺部病变的变化[6]。肺部超声技术已经在ICU和急诊中得到了广泛应用,成为一种成熟的诊断工具,并发展出系统化的学科体系。在ARDS的临床应用上,肺部超声显示了其显著优势。研究表明,该技术在诊断肺水肿、肺实变、肺不张、气胸及胸腔积液等疾病时,其敏感性和特异性均明显高于床边进行的胸部X光检查[7]。此外,有研究指出,肺部超声的敏感度与特异度与传统的胸部CT相当,同时可以评估ARDS患者体内的肺水含量[8]。因此,肺部超声能够在某种程度上替代CT用于ARDS的诊断,这对预测患者预后具有重要意义。在重症阶段,胸部异常区域可能在48 h内扩大达到50%,影像学检查通常会揭示出双肺的广泛病变,以实性改变为主,同时伴有磨玻璃样密度影,在这些影像中,可以观察到充气支气管征和多发条索影,此外,还可能存在双侧胸腔的轻度积液[9]。近年来,对于肺不张与实变的超声诊断初步研究显示出较高的敏感性与准确性[10]。相关研究发现,ARDS患者的肺部超声与同一时期进行的胸部CT结果之间有着密切联系,这表明超声评估可以作为ARDS患者病情监测的一种有效替代方法[11]。
超声检查具有很高的重复性,而且实用、简单,最重要的是无创,能够有效评估膈肌的功能,并让患者受益。在患者平卧位时,膈肌两侧的运动幅度几乎是一致的。超声检查不仅能提供详尽的信息来评估膈肌的运动和收缩功能,还能反映膈肌运动幅度的变化,对于膈肌麻痹等收缩功能障碍的评估效果也非常良好[12]。一些学者指出,在危重症患者中,膈肌运动的变化对于改善呼吸功能具有重要意义,与肋间肌和呼吸肌相比,膈肌的运动更为稳定、持久,对于肺部的呼吸功能显得更为重要[13]。ARDS患者常出现膈肌功能减退,膈肌无力可能导致拔管困难和机械通气时间延长[14]。研究指出,利用超声技术评估膈肌功能,可以预测机械通气患者的撤机潜力,确定脱机失败的原因,并评估早期治疗的效果[15]。膈肌作为主要的呼吸肌肉,其功能对撤机具有重大影响。早在20世纪初期,人们就发现使用呼吸机可能导致膈肌功能异常,近年来,ARDS相关的膈肌功能异常也引起了广泛关注。膈肌功能的评估可以通过吸气压力、肺容积、胸壁结构位移的测量来实现,但监测每次呼吸都会变化的解剖结构则面临挑战。
ICU床边超声技术为评估膈肌功能提供了新的途径。ARDS由多种因素引起,其表现和症状复杂,膈肌周围可能存在结缔组织变化、炎症反应、脂肪堆积及肌肉水肿等情况,单纯依据膈肌厚度难以准确反映其形态和功能的变化[16]。研究显示,膈肌功能障碍的发生率是上肢肌无力的两倍,因此利用代表膈肌活力的DTF能更精确地预测患者撤机的成功率[17]。膈肌在呼吸运动中起着关键地作用,不但是人体主要的驱动肌肉之一,还可以反映患者的咳嗽、咳痰能力。长时间的机械通气,尤其是在采用被动通气的情况下,可能导致膈肌无力和萎缩。研究表明,当患者接受机械通气18~69 h后,膈肌会出现萎缩,并引发相关蛋白酶的活化现象[18]。此外,使用镇痛镇静药、疾病导致的营养损耗、全身炎症反应以及过度使用糖皮质激素等因素,都可能增加ICU中老年患者膈肌无力的风险。研究显示,首次进入ICU并接受有创机械通气的患者中,大约有64%存在膈肌功能障碍;而经过5~6 d的机械通气后,膈肌收缩力平均可减少约三分之一[19]。膈肌无力的发生会使患者更加依赖于机械通气,而且对于老年患者来说,如果不打断这个恶性循环,可能会进一步降低咳嗽能力,随着气道分泌物的增加还会增加感染的风险。
机械通气为老年ARDS患者提供了强大的通气支持,但强大的通气支持并不能解决的病因,而且机械通气的最终目标是撤机。DTF可以反映患者的膈肌功能,而LUS可以评估患者肺部病变的严重程度,DTF与LUS可以互相补充。具体来说,DTF增高可能意味着膈肌功能减弱,导致撤机困难;而LUS增高则表示肺部病变更严重,使得患者撤机的风险增加。因此,综合考虑这两个指标可以更全面地评估患者的撤机情况,指导医生制定更合适的治疗方案。需要注意的是,每位患者的情况都有所不同,而且撤机结局受到多种因素影响,因此在临床实践中,医生还需要结合患者的全面情况进行综合评估,而不仅仅依赖于单一的指标。最终的决策应该是基于多个指标的综合判断,以及医生的临床经验和专业判断。
利益冲突 所有作者声明无利益冲突
作者贡献声明 郭闯:论文撰写、统计学分析;储蕴:研究设计、论文修改;张凤香:数据收集及整理;崔向飞:指导、支持性贡献
| [1] | 吕茂华, 曹励琪, 李香祥, 等. 肺部超声评分评估急性呼吸窘迫综合征严重程度的Meta分析[J]. 中国超声医学杂志, 2022, 38(10): 1191-1194. |
| [2] | Santana PV, Cardenas LZ, Albuquerque ALP, et al. Diaphragmatic ultrasound: a review of its methodological aspects and clinical uses[J]. J Bras Pneumol, 2020, 46(6): e20200064. DOI:10.36416/1806-3756/e20200064 |
| [3] | Le Neindre A, Philippart F, Luperto M, et al. Diagnostic accuracy of diaphragm ultrasound to predict weaning outcome: a systematic review and meta-analysis[J]. Int J Nurs Stud, 2021, 117: 103890. DOI:10.1016/j.ijnurstu.2021.103890 |
| [4] | Bellani G, Laffey JG, Pham T, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries[J]. JAMA, 2016, 315(8): 788-800. DOI:10.1001/jama.2016.0291 |
| [5] | 储蕴, 郭闯, 付海燕. 老年机械通气患者膈肌浅快呼吸指数与肺部超声评分的相关性及其对撤机结局的预测价值[J]. 中华危重病急救医学, 2024, 36(2): 152-155. DOI:10.3760/cma.j.cn121430-20230626-00466 |
| [6] | 胡泊, 李晓东, 李甜, 等. 功能残气量与肺部超声评分的相关性及其对急性呼吸窘迫综合征俯卧位通气治疗的预测价值[J]. 中国急救医学, 2021, 41(1): 46-51. DOI:10.3969/j.issn.1002-1949.2021.01.009 |
| [7] | 金永浩, 李晓东, 李甜, 等. 功能残气量与肺部超声评分在ARDS俯卧位通气患者中的应用效果评价[J]. 中国中西医结合急救杂志, 2021, 28(3): 329-333. DOI:10.3969/j.issn.1008-9691.2021.03.017 |
| [8] | Lei JQ, Li JF, Li X, et al. CT imaging of 2019 novel coronavirus (2019-nCoV) pneumonia[J]. Radiology, 295(1): 18. DOI:10.1148/radiol.2020200236 |
| [9] | 窦志敏, 李鸿杰, 吴晓霞, 等. 超声膈肌功能评估对急性呼吸窘迫综合征患者无创机械通气结果的预测价值[J]. 中国医学影像学杂志, 2023, 31(5): 492-496. |
| [10] | Nazerian P, Volpicelli G, Vanni S, et al. Accuracy of lung ultrasound for the diagnosis of consolidations when compared to chest computed tomography[J]. Am J Emerg Med, 2015, 33(5): 620-625. DOI:10.1016/j.ajem.2015.01.035 |
| [11] | 郭闯, 储蕴, 付海燕. 急性呼吸窘迫综合征患者死腔分数与肺部超声评分的相关性及其对预后的评估作用[J]. 中华危重病急救医学, 2022, 34(5): 514-518. DOI:10.3760/cma.j.cn121430-20211012-01466 |
| [12] | Yalçın B, Sekmenli N, Baktık B, et al. Evaluation of diaphragm thickness and function with ultrasound technique and comparison with spirometry in stable chronic obstructive pulmonary disease[J]. Tuberk Toraks, 2022, 70(1): 76-84. DOI:10.5578/tt.20229909 |
| [13] | 黄晓丽, 李颖川, 封凯旋, 等. 床旁超声膈肌功能监测对机械通气患者撤机的指导价值[J]. 中国超声医学杂志, 2022, 38(6): 657-661. |
| [14] | 雷佳羲, 王璐, 张静, 等. 膈肌超声评估在急性呼吸窘迫综合征机械通气患者预后预测中的价值[J]. 武汉大学学报(医学版), 2023, 44(11): 1320-1324. DOI:10.14188/j.1671-8852.2023.0064 |
| [15] | 胡泊, 李晓东, 刘敬禹, 等. 膈肌超声评估与跨膈压对慢性阻塞性肺疾病急性加重期患者接受无创通气结局的预测价值研究[J]. 中国实用内科杂志, 2022, 42(9): 756-760. DOI:10.19538/j.nk2022090112 |
| [16] | 邸兴伟, 李晓东, 李甜, 等. 膈肌增厚分数与腹内压导向的风险预测模型对重症急性胰腺炎患者撤机失败的预测价值[J]. 中华危重病急救医学, 2023, 35(2): 177-181. DOI:10.3760/cma.j.cn121430-20220930-00873 |
| [17] | Dot I, Pérez-Terán P, Francés A, et al. Association between histological diaphragm atrophy and ultrasound diaphragm expiratory thickness in ventilated patients[J]. J Intensive Care, 2022, 10(1): 40. DOI:10.1186/s40560-022-00632-5 |
| [18] | Dres M, Dubé BP, Mayaux J, et al. Coexistence and impact of limb muscle and diaphragm weakness at time of liberation from mechanical ventilation in medical intensive care unit patients[J]. Am J Respir Crit Care Med, 2017, 195(1): 57-66. DOI:10.1164/rccm.201602-0367OC |
| [19] | Marin-Corral J, Dot I, Boguña M, et al. Structural differences in the diaphragm of patients following controlled vs assisted and spontaneous mechanical ventilation[J]. Intensive Care Med, 2019, 45(4): 488-500. DOI:10.1007/s00134-019-05566-5 |
 2025, Vol. 34
2025, Vol. 34